黑果腺肋花楸果制剂中有效成分测定及体外活性研究
陈 浩,王晓林,钟方丽,刘君宇,刘 波,孟 澳
(吉林化工学院,吉林吉林 132022)
黑果腺肋花楸Aronia melanocarpa属蔷薇科腺肋花楸属灌木,又称野樱莓[1],果实具有多种活性成分[2],文中简称黑果.2018年国家卫健委将黑果列为新食品原料[3].黑果具抗氧化、控制血糖、改善血脂、抗炎、抗肿瘤等功效[4-5].刺玫果Rosa davuricaPAII.系蔷薇科蔷薇属植物山刺玫的成熟果实[6],富含黄酮、多糖、鞣质等成分,具有抗衰老、抗疲劳、保护心血管等药理作用[7],并且毒副作用小.黑果和刺玫果在食品、药品和保健品领域皆被广泛研究与应用.
颗粒剂指原料药物与适宜的辅料混合制成具有一定粒度的干燥颗粒状制剂[8].为确保黑果腺肋花楸果制剂稳定性好、运输、携带和贮藏方便[9],我们对其颗粒剂进行了研究.黑果颗粒剂是以黑果为单一原料,与适宜的添加剂制成的颗粒状功能性食品,而双果颗粒剂是将黑果与刺玫果两种原料合用,与适宜的添加剂制成的一种全新的颗粒状功能性食品.
本实验组在前期工作的基础上,建立了制剂中总黄酮、原花青素、花色苷和多糖的含量测定方法,并进行了方法学验证,以制定该制剂的质量标准.另外对其体外清除亚硝酸盐能力,抑制脲酶、α-葡萄糖苷酶和抑制胰脂肪酶的活性进行考察,为黑果腺肋花楸果制剂在食品方面的研究及开发提供实验依据.
1 实验材料、试剂与仪器
本实验所用材料黑果购自吉林省黑果花楸科技有限公司,刺玫果购自安徽亳州医药总公司.
实验所用试剂有原花青素、芦丁、矢车菊素-3-O-葡萄糖苷标准品(成都曼思特生物科技有限公司),尿素酶、α-葡萄糖苷酶、胰脂肪酶、对硝基苯磷酸二钠盐(p-Nitrophenyl phosphate,p-NPP)(生化级,上海宝曼生物科技有限公司),4-硝基酚-α-D-吡喃葡萄糖苷(4-nitrobenzophenone-α-D-glucopyr anoside,PNPG)(生化级,北京梦怡美生物科技有限公司),其他试剂均为国产分析纯.
实验仪器主要有H1850型台式高速离心机(湖南湘仪实验室仪器开发有限公司),TU-1810型紫外可见分光光度计、TU-1950 型紫外可见分光光度计(北京普析通用仪器有限责任公司)和PL-9602型酶标仪(北京普朗新技术有限公司)等.
2 实验方法
2.1 有效成分的质量测定
2.1.1总黄酮的质量测定
采用硝酸铝比色法[10]绘制芦丁标准曲线,线性方程y=0.013 72x-0.025 93(R2=0.999 2).测定样品溶液的吸光度值并计算质量浓度,按式(1)计算总黄酮的质量.
式中:X1为样品中总黄酮的质量,mg;C1为样液中总黄酮质量浓度,µg/mL;V1为样液体积,mL;N1为稀释倍数;10-3为将µg换算成mg.
2.1.2原花青素的质量测定
采用铁盐催化比色法[11]绘制原花青素标准曲线,线性方程y=2.020 95x-0.013 46(R2=0.999 3).测定样品溶液的吸光度值并计算质量浓度,按式(2)计算原花青素的质量.
式中:X2为样品中原花青素的质量,mg;C2为样液中原花青素质量浓度,mg/mL;V2为样液体积,mL;N2为稀释倍数.
2.1.3花色苷的质量测定
采用亚硫酸钠漂白法[12]绘制矢车菊素-3-O-葡萄糖苷标准曲线,线性方程y=0.032 23x+0.002 86(R2=0.999 5).测定样品溶液的吸光度值并计算质量浓度,按式(3)计算花色苷的质量.
式中:X3为样品中花色苷的质量,mg;C3为样液中花色苷质量浓度,µg/mL;V3为样液体积,mL;N3为稀释倍数;10-3为将µg换算成mg.
2.1.4多糖的质量测定
采用苯酚-硫酸法[13]绘制葡萄糖标准曲线,线性方程为y=12.769 54x-0.038 86(R2=0.999 4).测定样品溶液的吸光度值并计算质量浓度,按式(4)计算多糖的质量.
式中:X4为样品中多糖的质量,mg;C4为样液中多糖质量浓度,mg/mL;V4为样液体积,mL;N4为稀释倍数.
2.2 黑果颗粒剂和双果颗粒剂的制备
2.2.1黑果颗粒剂的制备
根据参考文献[14],将干燥后的黑果浸膏研磨成粉末,加入适量的乳糖、可溶性淀粉和蔗糖混合、制粒、干燥、整粒,制得3批黑果颗粒剂,备用.
2.2.2双果颗粒剂的制备
根据参考文献[15],将干燥后的双果浸膏研磨成粉末,加入适量的羧甲纤维素钠、甘露醇混合、制粒、干燥、整粒,制得3批双果颗粒剂,备用.
2.3 样品有效成分的含量测定
各取两种颗粒剂研磨为细粉后,分别称取样品1.0 g于容量瓶中,加入适量甲醇(或水),超声使其溶解,加入相应溶剂至刻度,离心,将上清液作为样品溶液,测定,分别计算两种颗粒剂中总黄酮、原花青素、花色苷和多糖的含量.
2.4 方法学验证
2.4.1稳定性实验
显色前稳定性:取样品溶液适量,分别于配制后0、30、60、120、180、240、300、360 min 进行测定,同“2.1”方法测定不同有效成分吸光度并计算RSD.
显色后稳定性:取样品溶液适量,分别同“2.1”方法显色后0、10、20、30、40、50、60 min 进行测定,测定不同有效成分吸光度并计算RSD.
2.4.2重复性实验
分别精密吸取样品溶液适量,同“2.1”方法后测定不同有效成分,连续6 次,记录吸光度并计算RSD.
2.4.3精密度实验
分别精密吸取样品溶液适量6 份,同“2.1”方法后经2 人在不同仪器上分别测定不同有效成分吸光度,记录吸光度并计算RSD.
2.4.4加样回收率实验
称取已知含量的样品6 份,每份样品中加入相应的对照品适量,同“2.3”操作,制备6 份样品溶液,按照“2.1”方法测定不同有效成分的吸光度,计算总黄酮、原花青素、花色苷和多糖的平均回收率及RSD.
2.5 黑果颗粒剂和双果颗粒剂的含量测定
取3批黑果颗粒剂和双果颗粒剂,同“2.3”操作,测定不同有效成分吸光度,计算总黄酮、原花青素、花色苷和多糖的含量平均值.
3 制剂的体外活性研究
3.1 清除亚硝酸盐能力的测定
根据参考文献[16]的方法,略加改动,分别吸取不同质量浓度样品溶液1 mL 进行试验,分别在538 nm处测定A0、Ai、Aj.按式(5)计算样品对亚硝酸盐清除率.
式中:A0为未加样品溶液吸光度值,Ai为加入样品吸光度值,Aj为对照吸光度值.
3.2 脲酶活性抑制率的测定
参考文献[17]的方法,略加改动,分别每个孔加入25µL脲酶溶液,再加入25µL不同质量浓度的样品溶液或加入25µL磷酸缓冲溶液.分别在630 nm处测定A样品、A空白、A对照.按式(6)计算样品对脲酶活性抑制率.
式中:A样品为加入样品溶液吸光度值,A空白为不加样品和尿素溶液吸光度值,A对照为不加样品溶液吸光度值.
3.3 α-葡萄糖苷酶活性抑制率的测定
参考文献[18]的方法,略加改动,按各反应液组成进行试验,分别在405 nm测定A样品、A背景和A空白.按式(7)计算样品α-葡萄糖苷酶活性抑制率.
式中:A空白为不加待测样品的吸光度,A样品为加入样品溶液的吸光度,A背景为酶溶液用缓冲溶液代替的吸光度,保持其他条件不变.
3.4 胰脂肪酶活性抑制率的测定
参考文献[19]的方法,略加改动,在微孔板中每个孔加入20µL 磷酸盐缓冲液(pH6.8)或20µL 不同质量浓度的样品溶液进行试验,分别在405 nm 测定Ai1、A1、Ai0和A0.按式(8)计算样品胰脂肪酶抑制率.
式中:Ai1为加样品溶液实验组吸光度值,A1为不加胰脂肪酶溶液实验空白组吸光度值,Ai0为不加样品溶液对照组吸光度值,A0为不加样品溶液和胰脂肪酶溶液空白组吸光度值.
4 结果与分析
4.1 方法学验证的实验结果
4.1.1样品有效成分含量测定的实验结果
黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷和多糖的含量分别为7.29、14.11、1.65、486.92 mg/g和12.34、3.46、0.81、706.11 mg/g.
4.1.2稳定性的实验结果
如表1、表2所示,数据得出黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷、多糖均在显色前360 min 内和显色后60 min 内有良好的稳定性,且RSD<3.0%,可满足含量测定的要求.

表1 显色前稳定性的实验结果
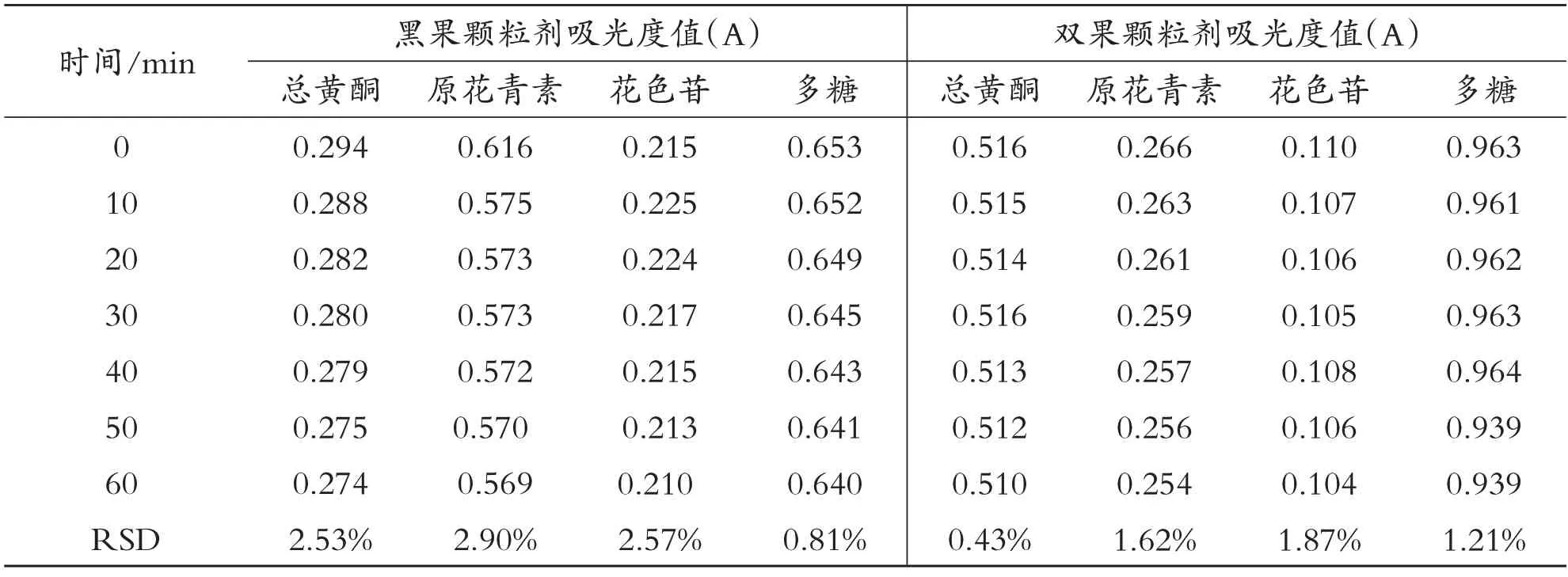
表2 显色后稳定性的实验结果
4.1.3重复性的实验结果
如表3所示,黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷、多糖的吸光度值RSD≤1.0%,说明此测定方法重复性好.
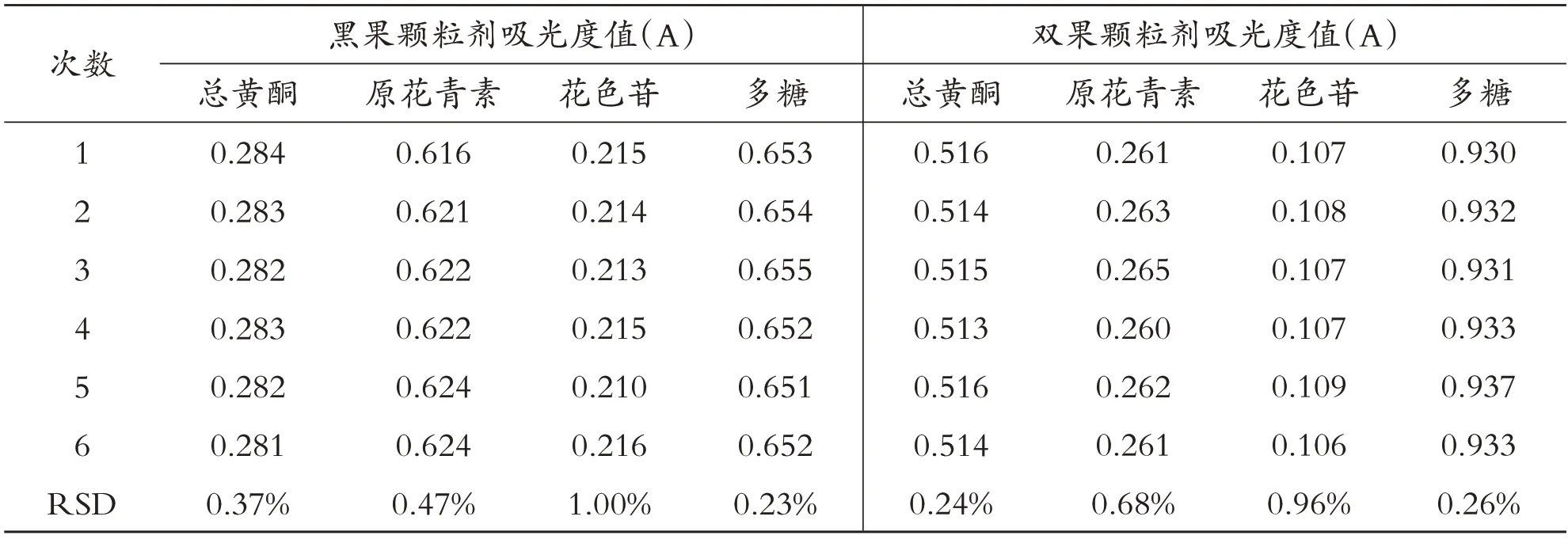
表3 重复性的实验结果
4.1.4精密度的实验结果
如表4所示,黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷、多糖吸光度值RSD<2.0%,表明此测定方法精密度良好,可以满足含量测定要求.
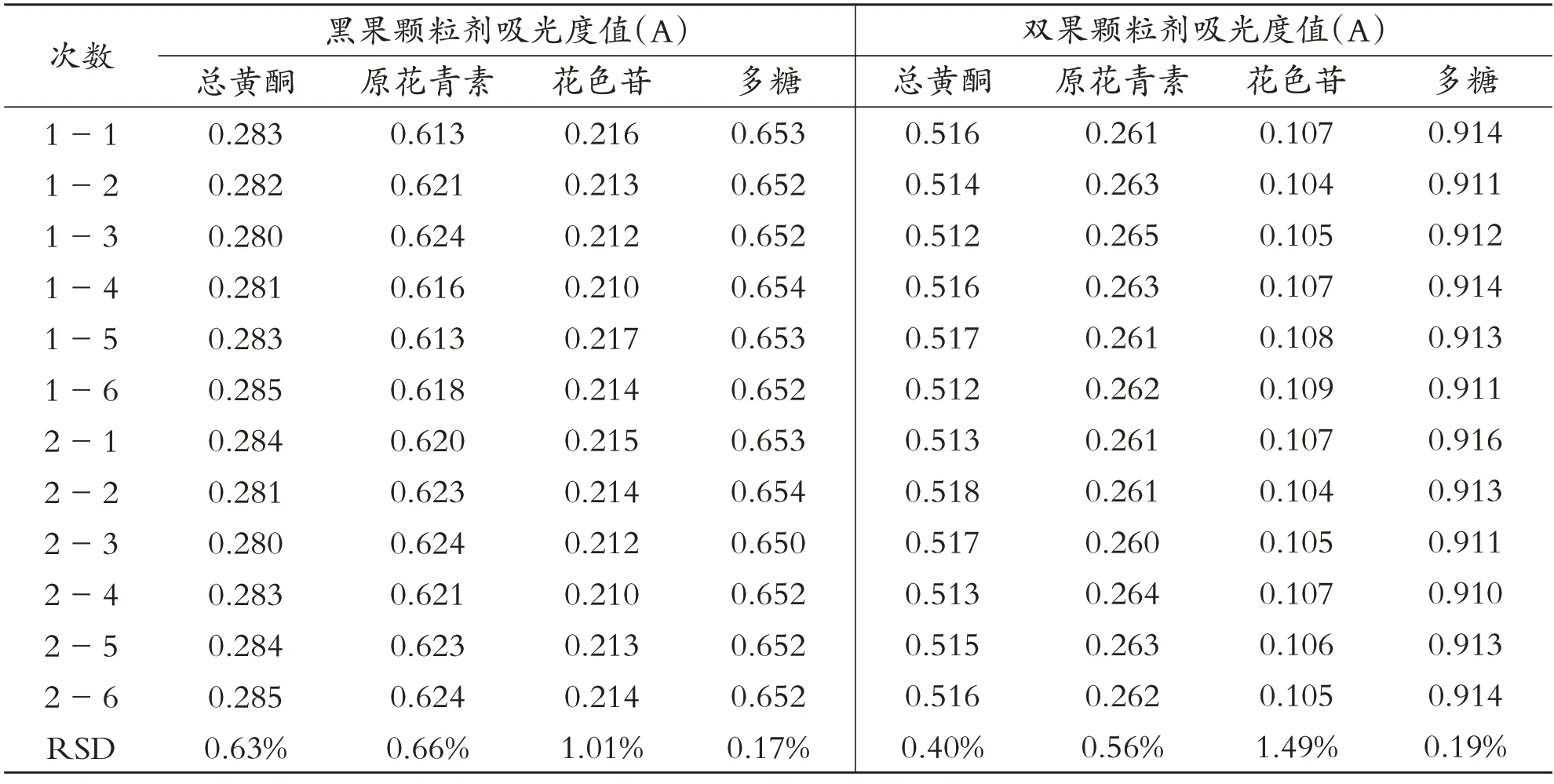
表4 精密度的实验结果
4.1.5加样回收率的实验结果
如表5所示,黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷、多糖的加样回收率分别为98.63%~102.50%和98.27%~103.00%,且RSD<2.0%,表明此测定方法加样回收率良好.
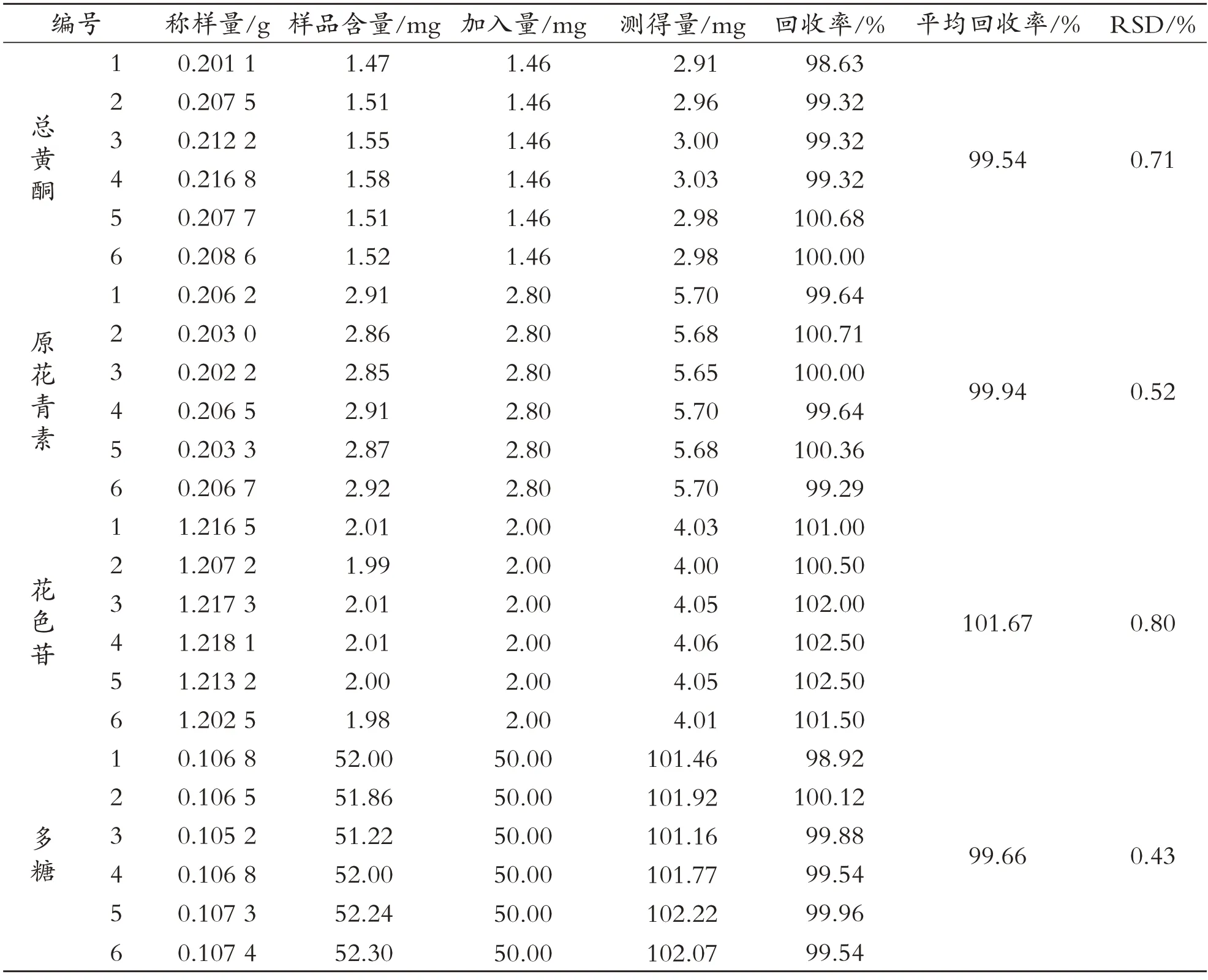
表5 黑果颗粒剂加样回收率的实验结果
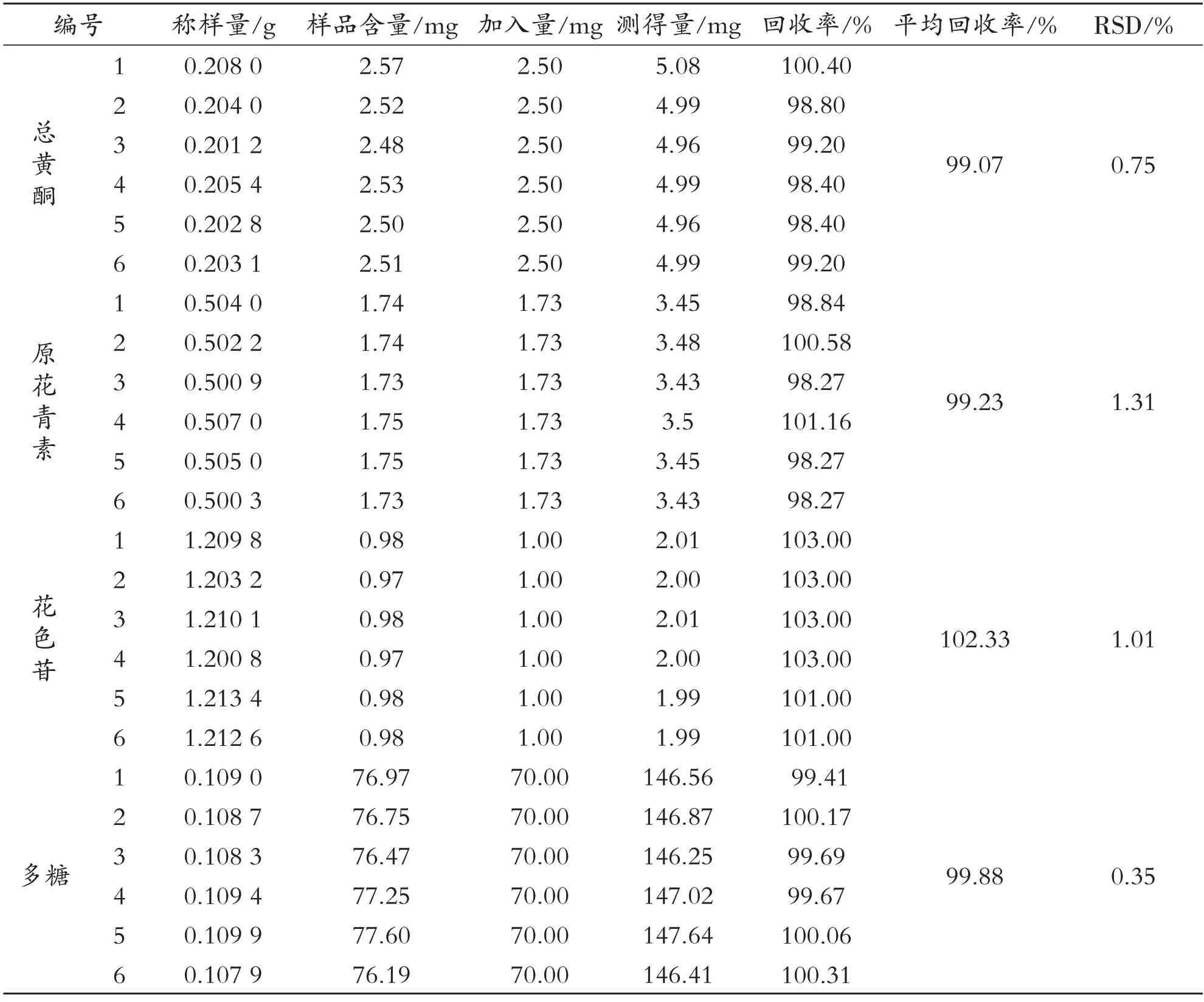
表6 双果颗粒剂加样回收率的实验结果
4.1.6黑果颗粒剂和双果颗粒剂含量测定的实验结果
如表7 所示,3 批黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷、多糖的含量平均值分别为7.27、14.10、1.56、473.95 mg/g和12.35、3.44、0.80、700.12 mg/g.

表7 黑果颗粒剂和双果颗粒剂含量测定的实验结果
4.2 体外活性研究的实验结果
4.2.1清除亚硝酸盐能力的实验结果
黑果颗粒剂线性方程为y=11.676 3x+34.020 3(R2=0.992 4).双果颗粒剂线性方程为y=10.973 8x+30.434 5(R2=0.968 2).Vc对照线性方程为y=13.614 6x+34.299 6(R2=0.985 8).根据上述线性方程可知,黑果颗粒剂、双果颗粒剂、Vc的IC50值为1.37、1.78、1.15 mg/mL.样品对亚硝酸盐均具有一定清除能力,在一定的条件下,其能力大小为Vc>黑果颗粒剂>双果颗粒剂.
4.2.2脲酶活性抑制率的实验结果
黑果颗粒剂线性方程为y=13.731 5x+31.904 5(R2=0.992 1).双果颗粒剂线性方程为y=16.455 8x+20.114 6(R2=0.988 7).根据上述线性方程可知,黑果颗粒剂和双果颗粒剂的IC50值为1.32 mg/mL和1.82 mg/mL.样品对脲酶活性均具有一定抑制能力,在一定的条件下,其能力大小为黑果颗粒剂>双果颗粒剂.
4.2.3α-葡萄糖苷酶活性抑制率的实验结果
黑果颗粒剂线性方程为y=12.494 0x+31.843 4(R2=0.981 6).双果颗粒剂线性方程为y=11.888 1x+32.817 7(R2=0.985 6).阿卡波糖线性方程为y=15.193 8x+33.706 1(R2=0.981 2).根据上述线性方程可知,黑果颗粒剂、双果颗粒剂、阿卡波糖的IC50值为1.45、1.44、1.07 mg/mL.样品对α-葡萄糖苷酶活性均具有一定抑制能力,在一定的条件下,其能力大小为阿卡波糖>双果颗粒剂>黑果颗粒剂.
4.2.4胰脂肪酶活性抑制率的实验结果
黑果颗粒剂线性方程为y=15.809 6x+25.582 7(R2=0.978 5).双果颗粒剂线性方程为y=15.466 7x+19.011 2(R2=0.968 4).根据上述线性方程可知,黑果颗粒剂、双果颗粒剂的IC50值为1.54 mg/mL 和2.00 mg/mL.样品对胰脂肪酶活性均具有一定抑制能力,在一定的条件下,其能力大小为黑果颗粒剂>双果颗粒剂.
5 结论
由实验数据得出,黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷、多糖均在显色前360 min 内和显色后60 min 内有良好的稳定性,重复性RSD≤1.0%,精密度RSD<2.0%,加样回收率分别为98.63%~102.50%和98.27%~103.00%,且RSD<2.0%,经方法学验证可以满足制剂中含量测定要求.3 批黑果颗粒剂和双果颗粒剂中有效成分总黄酮、原花青素、花色苷、多糖的含量平均值分别为7.27、14.10、1.56、473.95 mg/g和12.35、3.44、0.80、700.12 mg/g.
根据体外活性实验结果可知,两种颗粒剂均具有清除亚硝酸盐的能力、抑制脲酶活性、α-葡萄糖苷酶活性、胰脂肪酶活性的能力,预示着黑果制剂可能具有抗肿瘤活性、降低尿酸的活性、降低血糖的活性、抑制甘油三酯吸收的活性.本文建立的两种颗粒剂中4 类有效成分总黄酮、原花青素、花色苷和多糖的含量测定方法,可为黑果腺肋花楸制剂的质量控制提供依据,为黑果制剂后续的上市开发提供依据.

