六倍体小黑麦×六倍体小麦杂交后代中染色体遗传与结构变异鉴定
杨漫宇,姚方杰,杨足君,杨恩年
研究报告
六倍体小黑麦×六倍体小麦杂交后代中染色体遗传与结构变异鉴定
杨漫宇1,姚方杰1,杨足君2,杨恩年1
1. 四川省农业科学院作物研究所,农业农村部西南地区小麦生物学与遗传育种重点实验室,农业农村部天府种业创新重点实验室(部省共建),粮油作物绿色种质创新与遗传改良四川省重点实验室,成都 610066 2. 电子科技大学生命科学与技术学院,成都 611731
六倍体小黑麦是普通小麦品种遗传改良的重要基因资源,可以拓宽小麦的遗传基础。本研究以六倍体小黑麦为供体向普通小麦转移黑麦染色质,以探明六倍体小黑麦×六倍体小麦杂交、回交后代的染色体遗传特性,为小黑麦种质材料的后续研究和利用奠定基础。以六倍体小黑麦16引171为母本,六倍体小麦川麦62为父本配制杂交及回交组合,利用非变性荧光原位杂交技术(non-denaturing florescencehybridization,ND-FISH)对F1、BC1F1和BC1F2植株进行细胞学跟踪鉴定。结果表明,杂种F1回交结实率为2.61%;BC1F1植株2R染色体传递频率最高;BC1F2植株中黑麦染色体在后代的传递率为6R>4R>2R,小麦背景中5B-7B相互易位染色体在BC1F2植株中表现出严重偏分离。在BC1F1和BC1F2植株中观察到24种结构变异染色体,包括染色体片段、等臂易位染色体、易位染色体以及双着丝粒染色体,且部分BC1F2植株的种子表现粒长和千粒重均优于六倍体小麦亲本川麦62。因此,在利用六倍体小黑麦作为桥梁向普通小麦导入黑麦遗传物质时,应尽量采取多次回交的方式,使D组染色体迅速恢复,保证后代育性的恢复,同时关注染色体结构变异材料的潜在应用价值。
六倍体小黑麦;六倍体小麦;染色体遗传;ND-FISH;染色体结构变异
小麦作为人类最重要的口粮,其安全生产对经济发展和社会稳定均具有重要意义。在小麦遗传改良过程中,长期的定向选育、单一骨干亲本过度使用以及优良品种的大面积推广等,致使品种间同质化现象日趋明显,大量有潜在价值的多态性基因位点丢失,遗传基础日渐狭窄,最终导致现代栽培种产量难以突破以及抗病虫害、抗逆性的能力严重下降[1~3]。要突破当前小麦育种的瓶颈,就必须拓宽遗传基础,丰富小麦遗传多样性,继而提高小麦产量、增强抗病(逆)能力,以满足人类对小麦总量的需求。
黑麦(L.,RR,2=2x=14)是小麦的三级基因源,是最早用于小麦遗传改良育种的近缘物种之一,具有许多优良性状,如抗旱耐盐碱[4]、耐低温[5]、抗锈病[6,7]、抗白粉病[8]和抗蚜虫[9]等。六倍体小黑麦(2=6x=42,AABBRR)是利用四倍体硬粒小麦和黑麦杂交然后进行染色体加倍而形成的双二倍体,结合了双亲的有益基因,不仅保持了普通小麦的高产、优质和早熟特性,而且具有黑麦的长势旺、抗病和抗逆性强等特点[10,11]。因此,六倍体小黑麦是普通小麦品种遗传改良的重要基因资源,可以拓宽小麦的遗传基础。六倍体小黑麦更易于与普通小麦杂交,并且利用六倍体小黑麦和普通小麦杂交向普通小麦导入黑麦遗传物质可以避开普通小麦基因亲和抑制作用[12],使得六倍体小黑麦显示出得天独厚的重要桥梁作用,目前已成功创造出了许多优异种质,在小麦抗病育种改良中发挥了重要作用。舒焕麟等[13]利用六倍体小黑麦与六倍体小麦进行杂交、回交,选育出一批表现为抗条锈病和(或)抗白粉病的株系;李集临等[14]利用六倍体小黑麦与六倍体小麦杂交,选育出抗干旱、抗锈病且育性稳定的小麦-黑麦代换系;陈耀锋等[15]通过六倍体小麦与六倍体小黑麦杂交、多元复交和花培纯合,成功地将小黑麦抗条锈基因定向导入普通小麦中,创制了12份抗条锈新种质。Liu等[16]利用六倍体小黑麦“Certa”与六倍体小麦“晋麦47”杂交并回交,选育出条锈病抗性较好的BC1F4:5株系。Han等[17]利用六倍体小黑麦“中饲237”与六倍体小麦“淄麦17”杂交、回交再自交多代,选育出农艺性状优于亲本“淄麦17”且抗白粉病的新种质AL69。
六倍体小黑麦16引171引自国际玉米小麦改良中心,在四川种植多年表现为条锈病高抗、结实率高且籽粒大,千粒重55 g左右,是优良的六倍体亲本。川麦62为四川省农业科学院作物研究所选育的小麦品种,含一对5B-7B相互易位染色体[18],省区试千粒重49.4 g。本研究以六倍体小黑麦16引171为母本,六倍体小麦川麦62为父本进行杂交及回交,并利用非变性原位杂交(non-denaturing florescencehybridization,ND-FISH)技术进行跟踪鉴定,明确每一代植株的染色体构成特点,同时将六倍体小黑麦16引171的高千粒重和粒长等优良性状导入六倍体小麦川麦62中,为持续利用黑麦优异染色质及其诱导的遗传变异,以及小黑麦的优异性状到小麦育种中的后续研究奠定基础。
1 材料与方法
1.1 试验材料
本研究利用六倍体小黑麦材料16引171和六倍体小麦川麦62构建试验群体。2020年3月,在四川省农业科学院现代农业科技创新示范园以16引171为母本、川麦62为父本构建杂交组合。2021年3月,以杂种F1为母本、川麦62为父本进行回交,剩余麦穗套袋进行自交。2022年3月,杂种BC1F1抽穗后套袋自交,获得的BC1F2种子用于后续实验。
1.2 ND-FISH分析
利用寡核苷酸探针分别对亲本16引171、杂种F1、BC1F1和BC1F2进行ND-FISH分析。种子萌发、根尖预处理、固定以及染色体制备参照Han等[19]描述的方法。利用Oligo-1162、Oligo-pSc119.2-1、Oligo-pTa535-1和Oligo-(GAA)7共4种寡核苷酸探针用于识别黑麦和小麦染色体[20,21],探针序列参考Fu等[20]和Tang等[21],由上海英骏生物技术有限公司合成。分别在Oligo-1162和Oligo-pTa535-1的5′端用6-carboxytetramethylrhodamine(Tamra)进行标记,在Oligo-pSc119.2-1的5′端用6-carboxyfluorescein (6-FAM)进行标记,在Oligo-(GAA)7的5′端用cyanidin 5(Cy5)进行标记。ND-FISH程序参照Fu等[20]方法。染色体用4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)进行染色,使用德国徕卡荧光显微镜DM4B进行杂交信号检测和图像采集。
1.3 数据分析
Microsoft Excel 2007 用于统计分析。DPS统计软件用于卡方检验分析。
2 结果与分析
2.1 亲本核型分析
六倍体小麦川麦62含一对5BS·7BS和一对5BL·7BL易位染色体,具体核型参照文献[18]的描述。本研究利用Oligo-1162、Oligo-pSc119.2-1、Oligo-pTa535-1和Oligo-(GAA)7共4种寡核苷酸探针对六倍体小黑麦亲本16引171的根尖有丝分裂中期染色体进行ND-FISH分析(图1,a和b)。结果显示,16引171的根尖细胞含有42条染色体,包括7对A基因组染色体、7对B基因组染色体和7对R基因组染色体,为完全双二倍体小黑麦(AABBRR),建立的标准核型见图1c,该核型用于杂交后代中小麦和黑麦染色体的识别及染色体结构变异的确认。
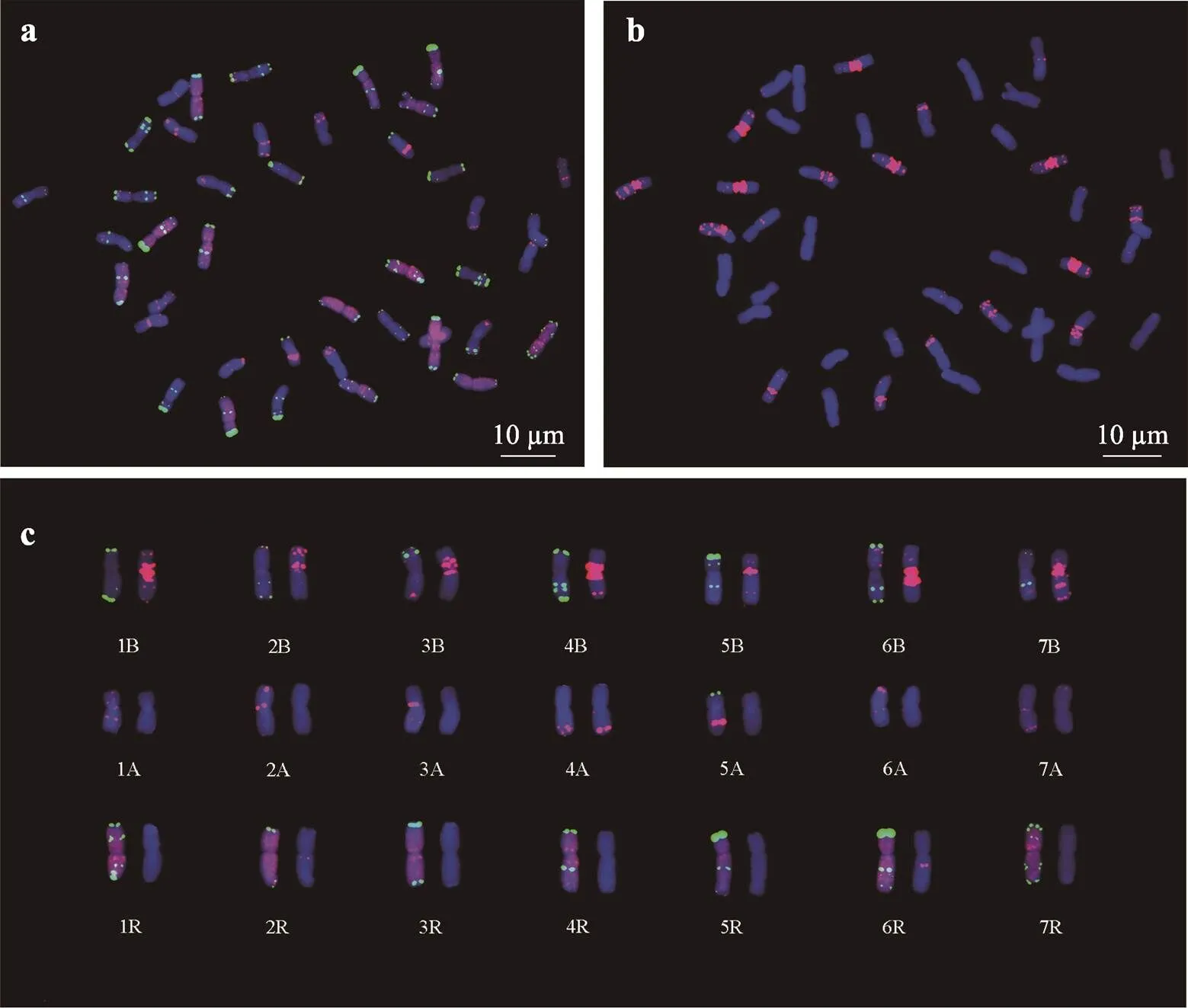
图1 六倍体小黑麦16引171根尖中期染色体标准核型图
a:以Oligo-1162(红色信号)、Oligo-pTa535-1(红色信号)和Oligo-pSc119.2-1(绿色信号)作为探针;b:以Oligo-(GAA)7(红色信号)作为探针;c:染色体分别来自于图a和图b。染色体被DAPI染为蓝色,标尺长度为10 μm。
2.2 六倍体小黑麦×六倍体小麦杂种F1、BC1F1结实率及染色体组成
以六倍体小黑麦16引171为母本,六倍体小麦川麦62为父本配制杂交组合,共获得5粒杂交种。ND-FISH结果显示(图2),5个杂种F1植株染色体条数均为42,包括7对A基因组染色体、7对B基因组染色体(其中,正常5B和7B各1条,源自亲本16引171;5BS·7BS和5BL·7BL易位染色体各1条,源自亲本川麦62)、7条D基因组染色体和7条R基因组染色体,染色体组成为AABBDR(2=42)。结果表明获得的杂种为真杂种。
杂种F1套袋自交不结实,未获得F2种子。以杂种F1为母本,川麦62为父本进行回交,对人工去雄的230个小花进行授粉,成功获得6粒种子(结实率为2.61%)。6个BC1F1植株(编号分别为:Z9-1、Z9-2、Z9-3、Z9-4、Z9-5和Z9-6)套袋自交,仅植株Z9-1可育,获得104粒BC1F2种子,其余5个BC1F1植株均不育,未能获得BC1F2种子。ND-FISH分析发现,6个BC1F1植株的染色体数目分布在39~44条之间,黑麦染色体数目分布在0~5条之间,植株Z9-3不含黑麦染色体,其余5个植株含有黑麦染色体,其中1个植株含1R,5个植株含2R,3个植株含3R,3个植株含4R,3个植株含5R,3个植株含6R,4个植株含7R(表1,图3)。植株Z9-1染色体数目为44条(表1;图3,a、d、m),含2R、6R、4R等3条黑麦染色体,其中4R染色体主要以长臂端部断裂4RBroken的形式存在,含5B、7B、5BS·7BS和5BL·7BL各1条,其余A组和B组染色体完整,D组染色体数为13条,仅缺失1条6D染色体。其余5个植株的A组和B组染色体完整(除植株Z9-1含3条7A外),D组染色体缺失数目较多,在3~7条之间。

图2 六倍体小黑麦×六倍体小麦杂种F1根尖中期染色体核型图
a:以Oligo-1162(红色信号)、Oligo-pTa535-1(红色信号)和Oligo-pSc119.2-1(绿色信号)作为探针;b:以Oligo-(GAA)7(红色信号)作为探针。染色体被DAPI染为蓝色,标尺长度为10 μm。

表1 六倍体小黑麦×六倍体小麦回交BC1F1育性及染色体组成
染色体数目44(3)代表这个植株是44条染色体,其中含有黑麦3条染色体。
除染色体数目变化外,BC1F1植株中还存在染色体结构变异现象。例如,植株Z9-1中黑麦4R染色体长臂端部断裂(图3,a、d、m),Z9-4中黑麦3R染色体长臂断裂(图3,g、j、m),Z9-4中含有4DS·4DL-2RL易位染色体(图3,i、l、m)。
2.3 六倍体小黑麦×六倍体小麦杂种BC1F2染色体组成
对植株Z9-1套袋自交获得的104粒BC1F2种子进行ND-FISH分析,染色体组成如表2所示。所有BC1F2植株的平均染色体数为42条,分布在40~45条之间(不完整染色体计数为0.5),其中含41条和42条染色体的植株最多,分别占35.58%和32.69%。黑麦染色体数目分布在0~4条之间,含1条黑麦染色体的植株最多,占40.38%,不含黑麦染色体的植株数次之,占29.81%。后代中含有黑麦染色体2R、4RBroken和6R的BC1F2植株分别为23、35和41株,所占比例分别为22.12%、33.65%和39.42%。由此可见,黑麦染色体在后代的传递率为6R>4RBroken>2R。

图3 BC1F1植株根尖中期染色体核型图
图a、b、c、g、h和i以Oligo-1162(红色信号)、Oligo-pTa535-1(红色信号)和Oligo-pSc119.2-1(绿色信号)作为探针;图d、e、f、j、k和l以Oligo-(GAA)7(红色信号)作为探针。染色体被DAPI染为蓝色。图m染色体分别来自图a、b、d、e、g、h、i、j、k和l。箭头指示黑麦染色体,标尺长度为10 μm。

表2 BC1F2植株的染色体组成
在BC1F1植株Z9-1中,6D为单体,5B/7B/ 5BS·7BS/5BL·7BL染色体为杂合型。在BC1F2植株中(表3),不含6D染色体的植株数为20,占19.23%;含1条6D和2条6D的植株数分别为65和19,分别占62.50%和18.27%,卡方检验表明,不含6D和含6D所占植株数的比例符合1∶3 (>0.05)。另外,根据ND-FISH分析结果统计,5B/7B/5BS·7BS/ 5BL·7BL染色体在BC1F2植株中的存在方式分为4类(前3种类型是主要类型):第一类是1*5B+1*7B+ 1*5BS·7BS+1*5BL·7BL,为杂合型,植株数为51(49.04%);第二类是2*5B+2*7B,为纯合型,植株数为13(12.50%);第三类是2*5BS·7BS+2* 5BL·7BL,为纯合型,植株数为31(29.81%);第四类是其他类型,植株数为9(8.65%)。按照2对杂合染色体计算,后代中纯合类型比例的理论值为1/16,本研究中2*5B+2*7B和2*5BS·7BS+2* 5BL·7BL这2种纯合类型分别占12.50%和29.81%,均大于理论值,经卡方检验,这2类的值分别为0.02和0.00(<0.05),表现为显著偏分离。
2.4 六倍体小黑麦×六倍体小麦杂种BC1F2中的染色体结构变异
本文观察了104个BC1F2植株,发现24个单株存在染色体结构变异,共21种结构变异染色体(表4,表5),涉及A、B、D和R基因组,包括染色体片段2RS-、4RL?-、6RS-、6RL-和4BL-、2RS·2RLBroken(图4,g、h、i)、6RS·6RLBroken(图4,b、e、i)、2BS·2BLBroken(图4,a、d、i)、4BSBroken·4BL (图4,c、f、i)和6BSBroken·6BL (图6,a、d、i),等臂染色体4BS·4BS (图5,b、e、g)、4BL·4BL (图5,b、e、g)、2RL·2RL (图5,a、d、g)和2RS·2RS (图5,c、f、g),小麦-黑麦整臂易位染色体5BL·6RL (图6,b、e、i)、6BS·2RL(图6,a、d、i)和7DL·2RS (图6,c、f、i),黑麦-黑麦染色体易位4RLBroken·6RL (图6,g、h、i),以及双着丝粒染色体3DL·3DL·2RL (图7,a、d、g)、6DS·6DL·2AL (图7,b、e、g)和7DL·7AS·7AL (图7,c、f、g)。这些染色体结构变异主要涉及R基因组、B基因组、D基因组染色体和少量A基因组染色体,分别包含13、8、4和2种。其中,R基因组变异染色体涉及了2R(7种)、4R(2种)和6R(5种),A基因组变异染色体涉及2A(1种)和7A(1种),B基因组变异染色体涉及2B(1种)、4B(4种)、5B(1种)和6B(2种),D基因组变异染色体涉及3D(1种)、6D(1种)和7D(2种)。总之,BC1F2植株中的染色体结构变异不仅包含了小麦染色体断裂、黑麦染色体断裂,还包含了小麦-黑麦易位、小麦-小麦易位以及黑麦-黑麦易位。
3 讨论
3.1 六倍体小黑麦×六倍体小麦杂种后代育性的恢复
六倍体小黑麦×六倍体小麦杂种F1的染色体组型是AABBDR,有两个单倍染色体组,理论上减数分裂中期(I)染色体配对构型为14II+14I。然而,相关研究证明,F1在进行减数分裂时,黑麦的单倍体R染色体组影响ABD组染色体的正常联会,最终形成大量遗传组成失衡的没有生活力的配子,因此表现出高度不育[22]。同样,六倍体小黑麦×六倍体小麦杂种F1的回交结实率也很低[23],并且六倍体小黑麦/小麦//小麦这一转移异源遗传物质的途径中可以连续多个世代出现较多育性不正常的非整倍体[23]。本研究中,杂种F1套袋自交不结实,且回交结实率2.61%,该结果与前人的研究相吻合。对6个BC1F1植株套袋自交,仅1个植株可育,其余5个植株均不育,未能获得BC1F2种子。ND-FISH分析结果表明,可育植株Z9-1染色体数目为44条,含3条黑麦染色体,仅6D染色体为单体,其余5个不育植株中D组染色体缺失数目较多,在3~7条之间,大多数D组染色体呈单体存在。笔者推测BC1F1植株的育性与D组染色体缺失数目多少相关,含D组染色体越多,后代的生活力越强。因此,在利用六倍体小黑麦作为桥梁向普通小麦导入黑麦遗传物质时,应尽量采取多次回交的方式,使D组染色体迅速恢复,保证后代育性的恢复,从而获得有效的材料便于育种应用。

表3 BC1F2植株中6D和5B/7B/5BS·7BS/5BL·7BL染色体传递情况
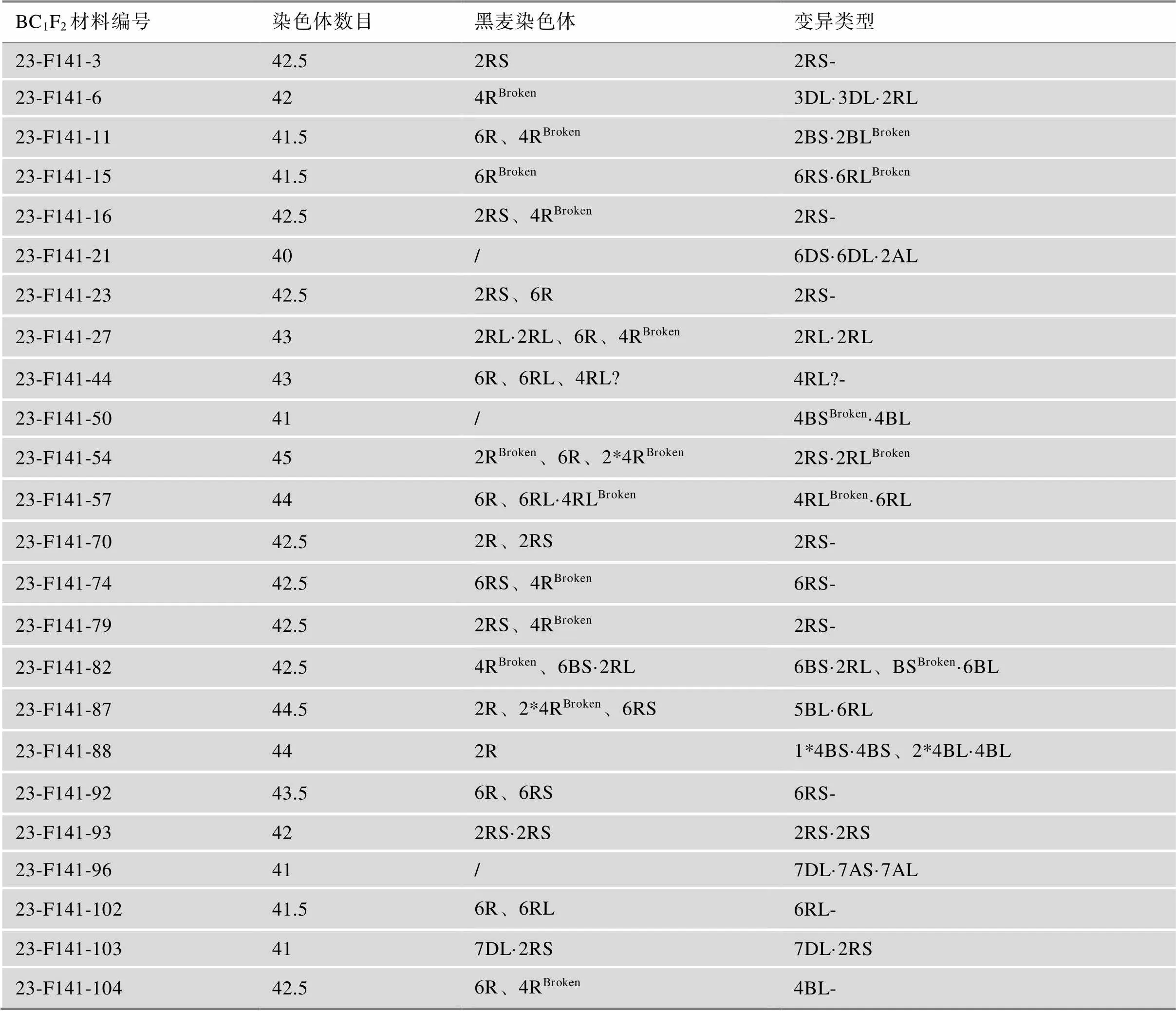
表4 BC1F2植株中染色体结构变异

表5 染色体变异类型
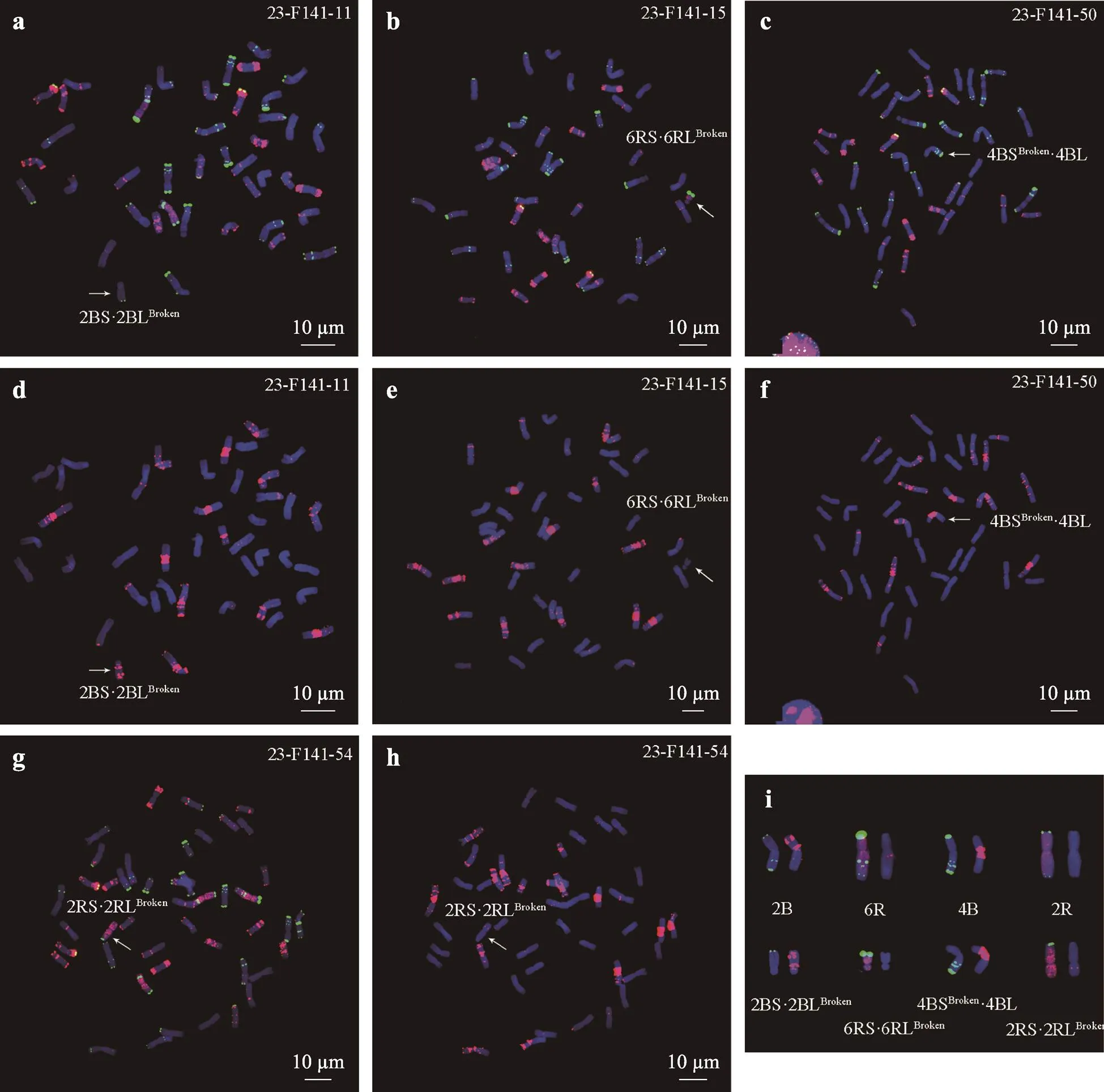
图4 BC1F2植株中断裂染色体示例图
图a、b、c和g以Oligo-1162(红色信号)、Oligo-pTa535-1(红色信号)和Oligo-pSc119.2-1(绿色信号)作为探针;图d、e、f和h以Oligo-(GAA)7(红色信号)作探针。染色体被DAPI染为蓝色。图i染色体分别来自图a、b、c、d、e、f、g和h。箭头指示断裂染色体,标尺长度为10 μm。
3.2 六倍体小黑麦×六倍体小麦杂种后代染色体的传递特点
研究黑麦染色体在小黑麦和小麦杂交后代中的传递特点有助于育种应用。早在1982年,Lukaszewski等[24]利用六倍体小黑麦和六倍体小麦杂交,发现在F2代中黑麦染色体存在偏分离现象,4R或7R的传递率最高,其次是1R,再次是3R、2R和5R,6R的传递率最低。任正隆等[25]利用八倍体小黑麦和六倍体小麦杂种的不同世代研究黑麦染色体的传递率,发现后代中,1R的传递率最高,3R次之,4R和7R的传递率相近,5R和6R最低。符书兰等[26]对八倍体小黑麦与六倍体小麦杂交后代进行分析,发现除1R外,4R的传递效率相对较高。本研究对6个BC1F1植株进行ND-FISH分析,发现1个植株不含黑麦染色体,5个植株含有黑麦染色体,其中1个植株含1R,含2R染色体的植株数(5株)最多,含7R染色体的植株数(4株)次之,含1R染色体的植株数(1株)最少,含3R、4R、5R和6R染色体的植株数均为3株。说明,2R染色体在BC1F1中的传递频率最高。此外,104个BC1F2后代中,含有黑麦染色体2R、4RBroken和6R的BC1F2植株占比分别为22.12%、33.65%和39.42%,说明黑麦染色体在BC1F2的传递率6R>4RBroken>2R。Liu等[16]研究发现以相同的六倍体小黑麦为母本,不同的六倍体小麦为父本配制杂交组合,后代中黑麦染色体的出现频率表现很大差异,认为黑麦染色体的传递率受到六倍体小麦背景的影响。本研究中,我们观察到的黑麦染色体的传递频率与前人的研究结果差异较大,因此,推测可能与六倍体小麦川麦62的遗传背景中特异染色体结构有关。

图5 BC1F2植株中等臂染色体示例图
图a、b和c以Oligo-1162(红色信号)、Oligo-pTa535-1(红色信号)和Oligo-pSc119.2-1(绿色信号)作为探针;图d、e和f以Oligo-(GAA)7(红色信号)作为探针。染色体被DAPI染为蓝色。图g染色体分别自于图a、b、c、d、e和f。箭头指示等臂染色体,标尺长度为10 μm。
对源自BC1F1植株Z9-1的104个BC1F2后代研究发现,不含6D和含6D所占植株数的比例符合1∶3(>0.05),即符合孟德尔分离比例。由于六倍体小麦亲本川麦62含5BS·7BS和5BL·7BL易位染色体各1对,其5B/7B/5BS·7BS/5BL·7BL染色体在BC1F2植株中主要以3种方式存在,第一类是杂合型1*5B+1*7B+1*5BS·7BS+1*5BL·7BL(49.04%),第二类是纯合型2*5B+2*7B(12.50%);第三类是纯合型2*5BS·7BS+2*5BL·7BL(29.81%)。2种纯合类型占比均显著大于理论值1/16(P<0.05),表现为偏分离,且纯合型2*5BS·7BS+2*5BL·7BL的比例显著大于纯合型2*5B+2*7B。说明纯合型2*5BS·7BS+2*5BL·7BL在后代中出现的概率更高。据报道,许多欧洲小麦品种携带5BS·7BS/5BL·7BL易位染色体[27,28]。四川省农业科学院作物研究所小麦新材料课题组也首次成功培育出了含有5BS·7BS/5BL·7BL易位染色体的小麦新品种[18,29,30],并且在长期的育种应用中发现,大部分高产、抗病且农艺性状优良的高代品系中均能追踪检测到5BS·7BS/5BL·7BL这对易位染色体。因此,本研究中纯合型2*5BS·7BS+2*5BL·7BL在后代中出现的频率高于纯合型2*5B+2*7B的传递率,结果解释了5BS·7BS/5BL·7BL染色体在欧洲冬小麦品种高频率存在,以及在育种的优势后代中5BS·7BS/ 5BL·7BL易位染色体的优先传递。

图6 BC1F2植株中易位染色体示例图
图a、b、c和g以Oligo-1162(红色信号)、Oligo-pTa535-1(红色信号)和Oligo-pSc119.2-1(绿色信号)作为探针;图d、e、f和h以Oligo-(GAA)7(红色信号)作为探针。染色体被DAPI染为蓝色。图i染色体分别来自图a、b、c、d、e、f、g和h。箭头指示易位染色体,标尺长度为10 μm。
图a、b和c以Oligo-1162(红色信号)、Oligo-pTa535-1(红色信号)和Oligo-pSc119.2-1(绿色信号)作为探针;图d、e和f以Oligo-(GAA)7(红色信号)作为探针。染色体被DAPI染为蓝色。图g染色体分别来自图a、b、c、d、e和f。箭头指示双着丝粒染色体,标尺长度为10 μm。
3.3 六倍体小黑麦×六倍体小麦杂种后代中染色体结构变异
大量研究表明,在以小黑麦为供体向六倍体小麦转移黑麦染色质的过程中,小黑麦与六倍体小麦的染色体很容易发生重组,产生新的结构变异染色体。Badaev等[31]对六倍体小黑麦与六倍体小麦杂交后代进行细胞遗传学分析,发现5RS·5RS等臂染色体和5DL·5R易位染色体。Taketa等[32]研究发现六倍体小黑麦Bronco 90 中携带了5RS.5RL-4DL易位染色体。利用GISH和FISH方法、微卫星和染色体特异性标记对染色体结构进行比较分析,Orlovskaya等[33]明确了在小黑麦与六倍体小麦杂交过程中基因组发生重组,包括外源物质的渗入和六倍体小麦染色体重排。Fu等[34,35]在小麦-黑麦附加系和代换系后代中观察发现染色体着丝粒和末端异染色质发生变化及染色体结构变异。Liu等[36]通过多色GISH和FISH分析,在小麦-黑麦附加系后代中发现了大量的染色体畸变,如小染色体、环状染色体以及着丝粒的减少和扩增。此外,丰富的小麦染色体结构变异在小麦-黑麦杂交后代中被观察到[16,37]。在本研究中,BC1F1和BC1F2植株均观察到大量的染色体结构变异现象。110个植株中,26个单株存在染色体结构变异,共24种结构变异染色体,包括染色体片段、等臂染色体、小麦-黑麦整臂易位染色体、黑麦-黑麦易位以及双着丝粒染色体,涉及R基因组、B基因组、D基因组染色体和少量A基因组染色体。该结果印证了黑麦外源染色体的导入能够诱导染色体结果变异。许多结构变异染色体在小麦遗传改良中发挥了重要作用。例如,小麦-黑麦1RS·1BL易位系在抗逆、抗病、产量方面显示出了独特的优越性,在全世界小麦育种工程中得到广泛应用[38]。此外,抗白粉病的小麦-黑麦5DS-4RS·4RL易位系[39]、4BL·4RL和7AS·4RS易位系[40],兼抗条锈病和白粉病的2BL·1RS易位系[41]等都是宝贵的抗病遗传种质资源。本研究中,含结构变异染色体的BC1F2植株23-F141-15、23-F141-16、23-F141-44和23-F141-88的籽粒长度分别为0.96、0.9、0.92和0.88 cm,比亲本川麦62(0.77 cm)增加24.68%、16.88%、19.48%和14.29%,均优于川麦62(图8),其中植株23-F141-44的千粒重(53.2 g)高于川麦62(51.3 g),说明这些植株成功地将六倍体小黑麦16引171的粒长和高千粒重的优良性状导入川麦62中,虽然本研究获得的结构变异材料在遗传上还不稳定,但是对普通小麦遗传改良仍然具有重要意义。
[1] Hao CY, Dong YC, Wang LF, You GX, Zhang HN, Ge HM, Jia JZ, Zhang XY. Genetic diversity and construction of core collection in Chinese wheat genetic resources.,2008, 53(10): 1518–1526.
[2] Fu YB, Somers DJ. Genome-wide reduction of genetic diversity in wheat breeding., 2009, 49(1): 161– 168.
[3] Gao Y, Yu JL, Zhao WF, Cheng DM, Peng T, Yin GH, Chen K. Evaluation and usage of wheat germplasms., 2020, 48(15): 48–50.高燕, 于金林, 赵伟峰, 成东梅, 彭涛, 尹国红, 陈坤. 小麦种质资源的鉴定评价与利用. 安徽农业科学, 2020, 48(15): 48–50.
[4] Howell T, Hale I, Jankuloski L, Bonafede M, Gilbert M, Dubcovsky J. Mapping a region within the 1RS.1BL translocation in common wheat affecting grain yield and canopy water status., 2014, 127(12): 2695–2709.
[5] Jung WJ, Seo YW. Identification of novel C-repeat binding factor (CBF) genes in rye (L.) and expression studies., 2018, 684: 82–94.
[6] Wehling P, Linz A, Hackauf B, Roux SR, Ruge B, Klocke B. Leaf-rust resistance in rye (L.). 1. Genetic analysis and mapping of resistance genesand., 2003, 107(3): 432–438.
[7] Han GH, Liu SY, Wang J, Jin YL, Zhou YL, Luo QL, Liu H, Zhao H, An DG. Identification of an elite wheat-rye T1RS·1BL translocation line conferring high resistance to powdery mildew and stripe rust., 2020, 104(11): 2940–2948.
[8] Zhu SY, Du HN, Su FY, Wang J, Meng QF, Liu TL, Guo R, Chen ZZ, Li HH, Liu WX, Ma PT, He AG. Molecular cytogenetic analyses of two new wheat-rye 6RL translocation lines with resistance to wheat powdery mildew., 2023, 11(2): 584–592.
[9] Marais GF, Horn M, Torr FD. Intergeneric transfer (rye to wheat) of a gene(s) for Russian wheat aphid resistance., 2010, 113(4): 265–271.
[10] Hao M, Luo JT, Zhang LQ, Yuan ZW, Yang YW, Wu M, Chen WJ, Zheng YL, Zhang HG, Liu DC. Production of hexaploid triticale by a synthetic hexaploid wheat-rye hybrid method., 2013, 193(3): 347–357.
[11] Gupta PK, Priyadarshan PM. Triticale: present status and future prospects., 1982, 21: 255–345.
[12] Yu JJ. Cytological identification of hexaploid tritical- common wheat hybrids F2[Dissertation]. Sichuan Agricultural University, 2017.余建军. 六倍体小黑麦-普通小麦杂种F2细胞学鉴定[学位论文]. 四川农业大学, 2017.
[13] Su HL, Yang JJ, Li GR. Gliadin analysis of new wheat germplasm with disease resistance derived from 6x triticale., 1999, 17(4): 349–353. 舒焕麟, 杨足君, 李光蓉. 含6×小黑麦血缘的抗病小麦新材料的选育及醇溶蛋白分析. 四川农业大学学报, 1999, 17(4): 349–353.
[14] Li JL, Wang N, Guo DL, Guo CH, Xu XL. Studies on wheat-rye chromosomes substitution., 2002, 22(2): 220–223.李集临, 王宁, 郭东林, 郭长虹, 徐香玲. 小麦-黑麦染色体代换的研究. 植物研究, 2002, 22(2): 220–223.
[15] Chen YF, Song YX, Li ZQ, Lu HP, Guo DW, Han DJ, Li CL, Ren HL. Development of wheat new germplasm with stripe rust resisitance I.Transfer of gene resistant to stripe rust new races from hexaploid Triticale into., 2003, 31(4): 19–22.
陈耀锋, 宋运贤, 李振岐, 陆和平, 郭东伟, 韩德俊, 李春莲, 任惠莉. 小麦抗条锈新种质的创制Ⅰ.外缘抗条锈基因的导入. 西北农林科技大学学报(自然科学版), 2003, 31(4): 19–22.
[16] Liu CY, Song QH, Zhang HJ, Yang ZJ, Hu YG, Miedaner T. Molecular cytogenetic characterization and phenotypic evaluation of new wheat–rye lines derived from hexaploid triticale 'Certa'×common wheat hybrids., 2017, 136(6): 809–819.
[17] Han GH, Li HW, Cao LJ, Liu SY, Yan HW, Wang J, Zhou YL, An DG. A novel wheat-rye 2R (2D) disomic substitution line pyramids two types of resistance to powdery mildew., 2022, 106(9): 2433–2440.
[18] Yang MY, Yang ZJ, Yang WY, Yang EN. Development and identification of new wheat varieties(lines) with multiple translocation chromosomes via cytogenetic method., 2018, 38(2): 127–133.杨漫宇, 杨足君, 杨武云, 杨恩年. 多重易位小麦新品种(系)的选育及细胞学鉴定. 麦类作物学报, 2018, 38(2): 127–133.
[19] Han FP, Lamb JC, Birchler JA. High frequency of centromere inactivation resulting in stable dicentric chromosomes of maize.2006, 103(9): 3238–3243.
[20] Fu SL, Chen L, Wang YY, Li M, Yang ZJ, Qiu L, Yan BJ, Ren ZL, Tang ZX. Oligonucleotide probes for ND-FISH analysis to identify rye and wheat chromosomes., 2015, 5(1): 10552.
[21] Tang ZX, Yang ZJ, Fu SL. Oligonucleotides replacing the roles of repetitive sequences pAs1, pSc119.2, pTa-535, pTa 71, CCS1, and PA WRC.1 for FISH analysis., 2014, 55(3): 313–318.
[22] 王占斌, 孙仲平. 六倍体小黑麦与普通小麦杂交的细胞遗传学研究. 生物技术, 1999, 9(2): 4–6.
[23] Su HL, Yang ZJ, Li GR. Selection and evaluation of a wheat line SY95-71 as new yellow rust spreader., 1999, 17(3): 249–253.舒焕麟, 杨足君, 李光蓉. 创新诱发材料SY95-71选育和利用价值研究. 四川农业大学学报, 1999, 17(3): 249–253.
[24] Lukaszewski AJ, Gustafson JP, Apolinarska B. Transmission of chromosomes through the eggs and pollen of triticale × wheat F1hybrids., 1982, 63(1): 49–55.
[25] Ren ZL, Lelley T, Robbelen G. Transmission of the wheat and rye chromosomes in octaploid triticale × common wheat populations., 1991, 18(2): 161–167.任正隆, Lelley T, Robbelen G. 小麦和黑麦染色体在小黑麦×小麦杂种的不同世代群体中的传递. 遗传学报, 1991, 18(2): 161–167.
[26] Fu SL, Tang ZX, Ren ZL. Establishment of wheat-rye addition lines and de novo powdery mildew resistance gene from chromosome 5R., 2011, 33(11): 1258–1262.符书兰, 唐宗祥, 任正隆. 小麦-黑麦附加系的创制及5R抗白粉病新基因的发现. 遗传, 2011, 33(11): 1258–1262.
[27] Law CN, Worland AJ. The control of adult-plant resistance to yellow rust by the translocated chromosome 5BS-7BS of bread wheat., 1997, 116(1): 59–63.
[28] Badaeva ED, Dedkova OS, Gay G, Pukhalskyi VA, Zelenin AV, Bernard S, Bernard M. Chromosomal rearrangements in wheat: their types and distribution., 2007, 50(10): 907–926.
[29] Yang MY, Li GR, Wan HS, Li LP, Li J, Yang WY, Pu ZJ, Yang ZJ, Yang EN. Identification of QTLs for stripe rust resistance in a recombinant inbred line population., 2019, 20(14): 3410.
[30] Hu ZL, Luo JT, Wan LR, Luo J, Li YZ, Fu SL, Liu DC, Hao M, Tang ZX. Chromosomes polymorphisms of Sichuan wheat cultivars displayed by ND‑FISH landmarks., 2021, 5(2): 1–10.
[31] Badaev NS, Badaeva ED, Bolsheva NL, Maximov NG, Zelenin AV. Cytogenetic analysis of forms produced by crossing hexaploid triticale with common wheat., 1985, 70(5): 536–541.
[32] Taketa S, Nakazaki T, Schwarzacher T, Heslop-Harrison JS. Detection of a 4DL chromosome segment translocated to rye chromosome 5R in an advanced hexaploid triticale line Bronco 90., 1997, 97(1): 91–96.
[33] Orlovskaya OA, Leonova IN, Adonina IG, Salina EA, Khotyleva LV, Shumny VK. Molecular-cytogenetic analysis of triticale and wheat lines with introgressions of the tribespecies genetic material.2016, 6: 527–536.
[34] Fu SL, Lv ZL, Guo X, Zhang, XQ, Han FP. Alteration of terminal heterochromatin and chromosome rearrangements in derivatives of wheat-rye hybrids., 2013, 40(8): 413–420.
[35] Fu SL, Yang MY, Fei YY, Tan FQ, Ren ZL, Yan BJ, Zhang HY, Tang ZX. Alterations and abnormal mitosis of wheat chromosomes induced by wheat-rye monosomic addition lines., 2013, 8(7): e70483.
[36] Liu C, Wang J, Fu SL, Wang L, Li HW, Wang M, Huang YH, Shi QH, Zhou YH, Guo XR, Zhu CL, Zhang J, Han FP. Establishment of a set of wheat-rye addition lines with resistance to stem rust., 2022, 135(7): 2469–2480.
[37] Tang ZX, Li M, Chen L, Wang YY, Ren ZL, Fu SL. New types of wheat chromosomal structural variations in derivatives of wheat-rye hybrids., 2014, 9(10): e110282.
[38] Rabinovich SV. Importance of wheat-rye translocations for breeding modern cultivar ofL., 1998, 100 (1): 323–340.
[39] Fu SL, Ren ZL, Chen XM, Yan BJ, Tan FQ, Fu TH, Tang ZX. New wheat-rye 5DS-4RS·4RL and 4RS-5DS·5DL translocation lines with powdery mildew resistance., 2014, 127(6): 743–753.
[40] An DG, Zheng Q, Zhou YL, Ma PT, Lv ZL, Li LH, Li B, Luo QL, Xu HX, Xu YF. Molecular cytogenetic characterization of a new wheat-rye 4R chromosome translocation line resistant to powdery mildew., 2013, 21(4): 419–432.
[41] Wang CM, Zheng Q, Li LH, Niu YC, Wang HB, Li B, Zhang XT, Xu YF, An DG. Molecular cytogenetic characterization of a new T2BL·1RS wheat-rye chromosome translocation line resistant to stripe rust and powdery mildew., 2009, 93(2): 124–129.
Investigation of chromosomal genetic characteristics and identification of structural variation in the offspring of hexaploid triticale×hexaploid wheat
Manyu Yang1, Fangjie Yao1, Zujun Yang2, Ennian Yang1
Hexaploid triticale is an important genetic resource for genetic improvement of common wheat, which can broaden the genetic basis of wheat.In order to lay a foundation for the subsequent research and utilization of triticale germplasm materials, the chromosomal genetic characteristics of cross and backcross offspring of hexaploid triticale×hexaploid wheat were investigated in the process of transferring rye chromatin from hexaploid triticale to hexaploid wheat. Hybrid and backcross combinations were prepared with hexaploid triticale 16yin171 as the maternal parent and hexaploid wheat Chuanmai62 as the paternal parent.The chromosomes in root tip cells of F1, BC1F1and BC1F2plants were traced and identified non-denaturing florescencehybridization (ND-FISH).The results indicated that the backcross setting rate of hybrid F1was 2.61%. The transmission frequency of 2R chromosome was the highest in BC1F1plants while the transmissibility of rye chromosome in BC1F2plant was 6R>4R>2R, and the 5B-7B wheat translocation in BC1F2plants showed severe segregation. A total of 24 structural variant chromosomes were observed both in BC1F1and BC1F2plants, including chromosome fragments, isochromosomes, translocations, and dicentric chromosomes.In addition, the seed length and 1000-grain weight of some BC1F2plants were better than that of the hexaploid wheat parent Chuanmai 62.Therefore, multiple backcrosses should be adopted as far as possible to make the rapid recovery of group D chromosomes, ensuring the recovery of fertility in offspring, when hexaploid tritriale is used as a bridge to introduce rye genetic material into common wheat. At the same time, the potential application value of chromosomal structural variation materials should be also concerned.
hexaploid triticale; hexaploid wheat; chromosomal inheritance; ND-FISH; chromosome structural variation
2023-08-04;
2023-09-15;
2023-10-12
四川省小麦育种攻关项目(编号:2021YFYZ0002),四川省财政专项项目(编号:2021ZYGG-003, 2022ZZCX003),四川省科技计划项目(编号:2022ZDZX0014)和四川省农业科学院项目资助[Supported by the Sichuan Wheat Breeding Community (No. 2021YFYZ0002),the Sichuan Financial Special Project (Nos. 2021ZYGG-003, 2022ZZCX003), the Sichuan Science and Technology Program of China (No. 2022ZDZX0014), and the Sichuan Academy of Agricultural Sciences]
杨漫宇,博士,助理研究员,研究方向:小麦遗传育种及分子细胞遗传学。E-mail: yangmanyu19861225@163.com
杨恩年,博士,研究员,研究方向:小麦遗传育种。E-mail: yangennian@126.com
10.16288/j.yczz.23-212
(责任编委: 王秀娥)

