磁共振参数及TNF-α、IL-1α 水平在阿尔兹海默病中的诊断价值研究
余梁俊,凌迎春
1.绍兴市第七人民医院放射科,浙江绍兴 312000;2.绍兴市第七人民医院检验科,浙江绍兴 312000
阿尔兹海默病(Alzheimer’s disease, AD),是一种进行性神经退行性疾病,会导致患者认知障碍、行为异常和日常生活能力受损等问题[1-3]。中国作为全球AD 患者最多的国家,老年人AD 患病率高,患者群体基数大,人均花费高,给国家、家庭和患者个人带来了沉重的负担。因此,提高AD 的早期诊断效率有助于实施AD 的早期干预。多模态磁共振成像(magnetic resonance imaging, MRI)是临床上诊断早期AD 的重要手段。即使患者还未出现AD 的症状,磁共振成像技术也可通过磁共振信号检测出大脑灰质萎缩的位置和程度[4]。但是,正常人衰老过程中脑部均会出现不同程度的萎缩。因此,磁共振成像检测出脑萎缩并不能成为确诊阿尔茨海默病的唯一标准。研究表明,阿尔兹海默病的发生与血清中肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白细胞介素1α(interleukin-1α,IL-1α)的水平密切相关,通过检测血清TNF-α、IL-1α 含量可初步判断阿尔茨海默病患者病理改变[5]。为探讨多参数磁共振和TNF-α、IL-1α 水平检测在阿尔海默兹病中的诊断价值,本文进行了以下研究,现报道如下。
1.资料与方法
1.1 一般资料
选取2020 年7 月至2022 年7 月绍兴市第七人民医院收治的60 例阿尔兹海默病患者为观察组,其中,男性26 例(43.33%),女性34 例(56.67%),年龄60~81 岁,平均年龄为(68.21±4.01)岁。另选取同时期60 例60 岁以上的体检健康老年人为对照组,其中,男性28 例(46.67%),女性32 例(53.33%),年龄60~79 岁,平均年龄为(69.24±3.87)岁。对照组均自愿参加本研究;无药物酒精依赖史;无头部外伤、精神疾病和神经疾病史;无磁共振扫描禁忌。本研究经绍兴市第七人民医院医学伦理委员会批准(伦理审批号:2022-003-01),所有患者均签署知情同意书。
纳入标准:①年龄>60 岁;②观察组临床确诊为阿尔兹海默病;③观察组存在AD 症状,如认知功能异常、记忆力减退、情感淡漠等病程超过6 个月,严重程度不一;④观察组均为首次发病,无AD 治疗史;⑤观察组简易精神状况量表(MMSE)评分低于24 分或蒙特利尔认知评估(MoCA)评分低于26 分。
排除标准:①3 个月内服用过精神类药物者;②装有心脏支架、血管支架、心脏搭桥、带有人工心瓣膜者;③伴恶性病变、自身免疫系统疾病等可引起血清TNF-α、IL-1α 升高的疾病者;④其他疾病导致的认知障碍者;⑤合并严重的血液系统疾病、脏器功能衰竭者。
1.2 方法
1.2.1 血清TNF-α、IL-1α 水平检测 入院抽晨起外周静脉血5ml,于室温下静置30min 后,放入离心机中3000r/min 离心15min,留取上层血清装入干净EP 管,置于-80℃冰箱保存备用。根据厂商说明书,使用ELISA 试剂盒检测血清TNF-α、IL-1α 两种促炎因子水平。
1.3 观察指标
1.3.1 DKI 参数 所有受试均进行磁共振波谱检查,使用GE 1.5T 磁共振成像仪对观察组患者和正常组健康者的颅脑进行DKI 序列扫描,诊断采用连续的3mm 轴向 T2权重图像,得到颅脑图像后,进行DKI 参数分析,包括平均扩散系数(mean diffusivity,MD)、各向异性分数(fractional anisotropy, FA)、平均弥散峰度值(mean kurtosis, MK)、轴向峰度(axial kurtosis, AK)、径向峰度(radial kurtosis, RK)[6]。
1.3.2 血清TNF-α、IL-1α 水平 从–80℃冰箱中取出血清,放于室温下解冻,根据厂商说明书,使用ELISA 试剂盒检测上清液中TNF-α 和IL-1α 两种促炎因子。
1.4 统计学方法
采用SPSS 25.0 统计学软件对所有数据进行统计分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间差异比较采用t检验,计数资料以例数(百分率)[n(%)]表示。采用Pearson 相关分析评估磁共振参数与血清标志物之间的线性关系。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清TNF-α、IL-1α 水平比较
观察组TNF-α 水平显著高于对照组,IL-1α 水平显著低于对照组,组间比较,差异有统计学意义(P<0.05),见表1。
表1 两组血清TNF-α、IL-1α水平比较(±s,pg/mg)

表1 两组血清TNF-α、IL-1α水平比较(±s,pg/mg)
组别 n TNF–α IL–1α观察组 60 25.83±0.53 36.57±0.54对照组 60 15.32±0.80 70.48±1.31 t 24.094 –37.596 P <0.001 <0.001
2.2 两组DKI 参数比较
2.2.1 观察组、对照组组间MD 值比较 与对照组相比,观察组颞叶、顶叶皮质下白质、丘脑、尾状核头、齿状核、红核的MD 值均显著升高(P<0.05)。海马、黑质部位的MD 值有升高趋势(图1),但差异无统计学意义(P>0.05),见表2。
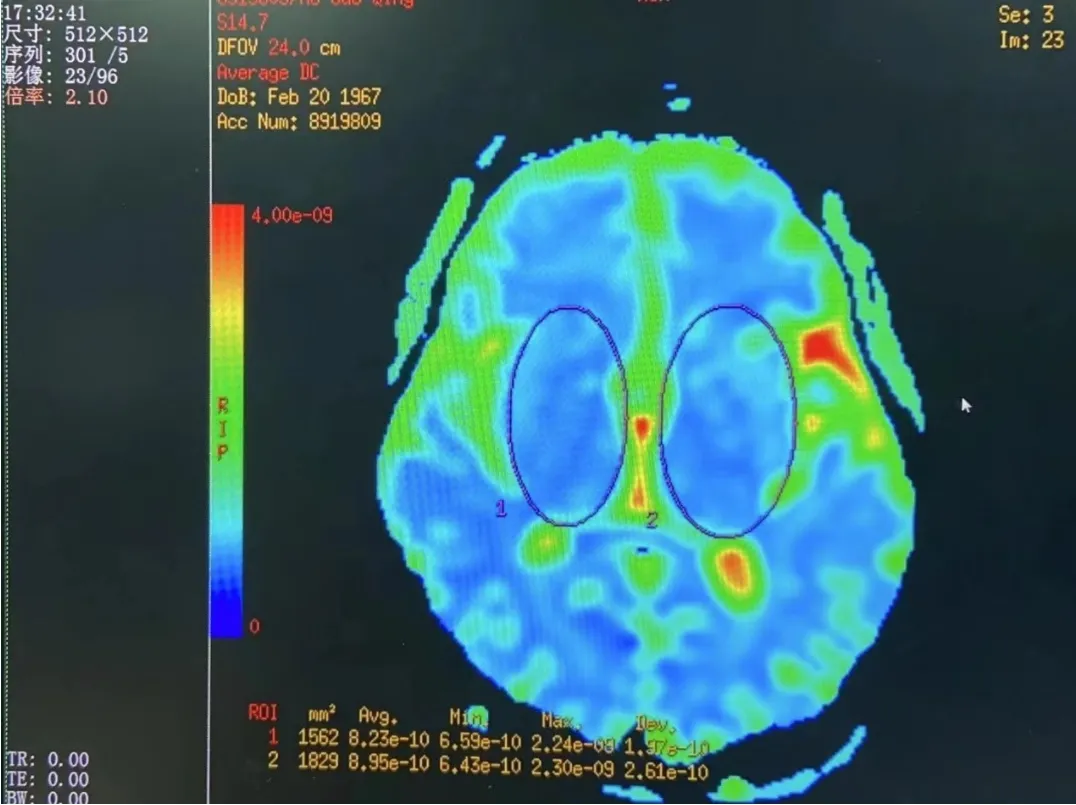
图1 阿尔兹海默病患者MD 值图
表2 两组MD 值比较(±s,n=60)
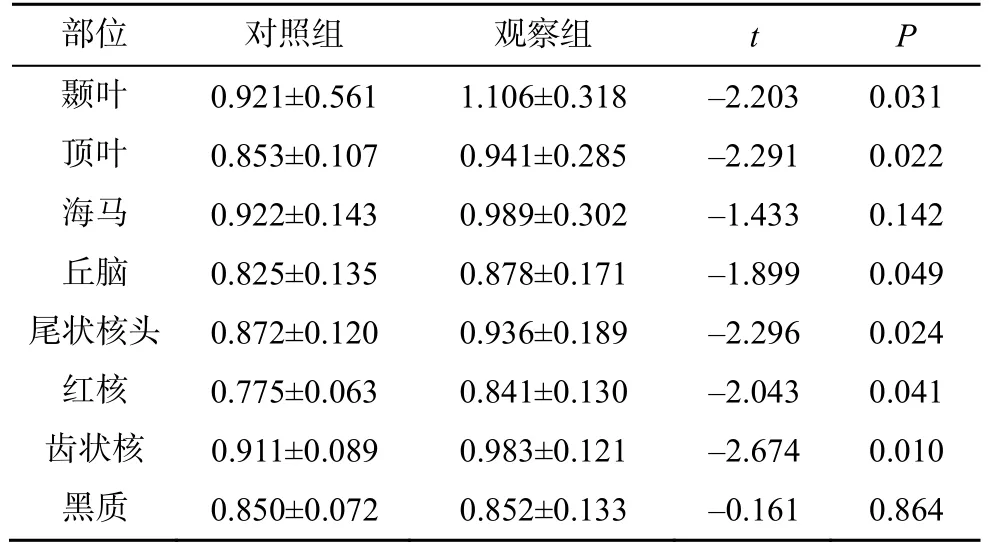
表2 两组MD 值比较(±s,n=60)
部位 对照组 观察组 t P颞叶 0.921±0.561 1.106±0.318 –2.203 0.031顶叶 0.853±0.107 0.941±0.285 –2.291 0.022海马 0.922±0.143 0.989±0.302 –1.433 0.142丘脑 0.825±0.135 0.878±0.171 –1.899 0.049尾状核头 0.872±0.120 0.936±0.189 –2.296 0.024红核 0.775±0.063 0.841±0.130 –2.043 0.041齿状核 0.911±0.089 0.983±0.121 –2.674 0.010黑质 0.850±0.072 0.852±0.133 –0.161 0.864
2.2.2 两组组间FA 值比较 与对照组相比,观察组颞叶及顶叶皮质下白质、海马、黑质的FA 值减小,尾状核头、红核、齿状核的FA 值升高(图2),差异均有统计学意义 (P<0.05)。丘脑FA 值有升高趋势,但升高不明显,差异无统计学意义(P>0.05),见表3。

图2 阿尔兹海默病患者FA 值图
表3 两组组间FA 值比较(±s,n=60)

表3 两组组间FA 值比较(±s,n=60)
部位 对照组 观察组 t P颞叶 0.453±0.028 0.422±0.076 2.155 0.032顶叶 0.442±0.023 0.421±0.055 4.076 <0.001海马 0.408±0.049 0.319±0120 5.237 <0.001丘脑 0.319±0.036 0.335±0.059 –0.354 0.719尾状核头 0.230±0.038 0.256±0.091 –3.286 0.002红核 0.482±0.041 0.539±0.051 –2.506 0.017齿状核 0.319±0.051 0.341±0.063 –2.419 0.018黑质 0.562±0.036 0.558±0.046 3.921 <0.001
2.2.3 两组组间RK 值比较 与对照组相比,观察组颞叶及顶叶皮质下白质、海马、丘脑的RK 值显著降低(P<0.05),黑质部位的RK 值显著升高(P<0.05),尾状核头、红核、齿状核的RK 值有降低的趋势,但差异无统计学意义(P>0.05),见表4。
表4 两组组间RK 值比较(±s,n=60)

表4 两组组间RK 值比较(±s,n=60)
部位 对照组 观察组 t P颞叶 1.089±0.313 0.811±0.315 4.339 <0.001顶叶 0.934±0.419 0.672±0.321 3.138 0.002海马 0.921±0.339 0.654±0.310 3.441 0.001丘脑 0.872±0.227 0.689±0.229 2.448 0.013尾状核头 0.495±0.193 0.449±0.175 1.263 0.221红核 1.836±0.623 1.408±0.662 1.638 0.107齿状核 1.243±0.236 1.205±0.332 1.141 0.225黑质 1.110±0.629 1.435±0.513 –2.226 0.025
2.2.4 两组组间AK 值比较 与对照组相比,观察组颞叶及顶叶皮质下白质、丘脑、齿状核部位的AK 值显著降低(P<0.05),黑质部位的AK 值显著升高(P<0.05),海马部位的AK 值有降低趋势,尾状核头、红核部位的AK 值有升高趋势,但差异均无统计学意义(P>0.05),见表5。
表5 两组组间AK 值比较(±s,n=60)
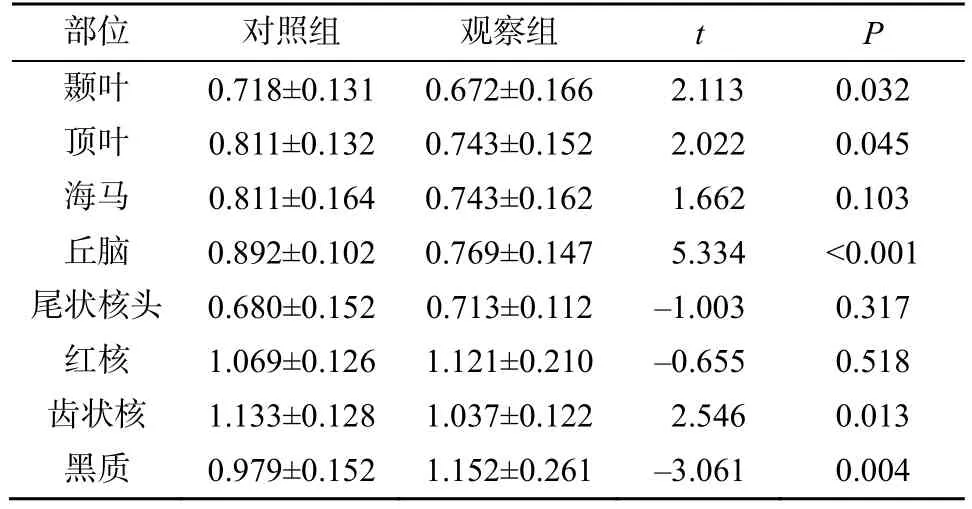
表5 两组组间AK 值比较(±s,n=60)
部位 对照组 观察组 t P颞叶 0.718±0.131 0.672±0.166 2.113 0.032顶叶 0.811±0.132 0.743±0.152 2.022 0.045海马 0.811±0.164 0.743±0.162 1.662 0.103丘脑 0.892±0.102 0.769±0.147 5.334 <0.001尾状核头 0.680±0.152 0.713±0.112 –1.003 0.317红核 1.069±0.126 1.121±0.210 –0.655 0.518齿状核 1.133±0.128 1.037±0.122 2.546 0.013黑质 0.979±0.152 1.152±0.261 –3.061 0.004
2.2.5 两组组间MK 值比较 与对照组相比,观察组颞叶及顶叶皮质下白质、海马、丘脑部位的MK值显著降低(P<0.05),尾状核头、黑质部位的MK值显著升高(P<0.05)。红核部位的MK 值降低,齿状核的MK 值显著升高,但差异均无统计学意义(P>0.05),见表6。
表6 两组组间MK 值比较(±s,n=60)

表6 两组组间MK 值比较(±s,n=60)
部位 对照组 观察组 t P颞叶 0.838±0.137 0.774±0.205 4.471 <0.001顶叶 0.851±0.376 0.680±0.189 2.991 0.003海马 0.822±0.121 0.718±0.210 3.219 0.002丘脑 0.813±0.161 0.710±0.152 4.610 <0.001尾状核头 0.538±0.102 0.631±0.121 –2.553 0.012红核 1.371±0.241 1.337±0.419 0.238 0.810齿状核 1.126±0.287 1.142±0.201 –0.230 0.819黑质 1.139±0.191 1.401±0.422 –3.220 0.002
2.3 磁共振参数与TNF-α、IL-1α 的相关性分析
Pearson 分析结果显示,TNF-α 与MD 呈正相关关系,与FA、RK、MK 呈负相关关系(P<0.05),与AK 无相关关系(P>0.05),IL-1α 与FA、RK、MK 呈正相关关系,与MD、AK 呈负相关关系(P<0.05),见表7。

表7 磁共振参数与TNF-α、IL-1α的相关性分析
3 讨论
近年来,阿尔兹海默病患病率逐年升高,寻找生物学标志物对AD 进行早期的生物学诊断是当下的研究热点。人脑中是具有数亿个神经细胞组成的复杂的神经系统,当这个复杂的系统发生非衰老的病理性改变的时候,主要特征为认知功能障碍和认知行为损害的中枢神经系统的退行性疾病,使得理解、自我控制和记忆等能力发生退化和智能损害,进而出现场景性记忆和功能性记忆明显衰退,认知困难等临床症状,严重影响日常的生活和社交能力。临床上AD 的诊断主要依靠临床症状、体液标志物和影像学检查,其中,腰椎穿刺查脑脊液Aβ 为有创性,AD 的影像学上PIB-PET、AV1451- PET 可为痴呆的早期识别和诊断提高帮助,但PET 价格昂贵,不适合人群筛查。寻找体液中诊断AD 的有效生物学标志物和多功能核磁的运用均是早期识别诊断阿尔兹海默病未来研究的重点[5]。
磁共振成像在AD 的临床识别中发挥了重要作用,采用磁共振技术可以观察到阿尔兹海默病患者的颞叶萎缩。弥散张量成像也是磁共振技术的一种,它利用水分子的位移来测量脑白质纤维束的完整性,弥散张量成像的主要指标包括MD 和FA。扩散峰度成像是在弥散张量成像的技术上进一步优化的磁共振新技术,其不但能够提供MD、FA 参数,还有MK、KA、RK、AK 等,这些参数能提供更多的微观结构信息[6]。目前,扩散峰度成像已经广泛应用于认知功能障碍患者海马区及全脑灰白质的研究[7]。本研究结果显示,与对照组相比,观察组多个扩散峰度成像参数均发生变化,表明阿尔兹海默病患者的许多脑解剖区域存在显著改变。Raj 等[8]研究发现,AK 诊断阿尔兹海默病的特异性最高,可以提示脑白质轴突丢失或脱髓鞘等微观结构改变,甚至AK 有助于轻度认知障碍的早期诊断。另一项研究采用FA、MD、和MK 分析白质微观结构变化,探讨DKI 参数的诊断效能,结果发现与对照组相比,阿尔兹海默病患者FA 降低,MD 明显升高,提示阿尔兹海默病患者存在脑结构异常[9]。本研究发现,阿尔兹海默病患者RK、AK、MK 值比对照组高,其中尾状核头的MK 值升高最明显,其他黑质的弥散峰度值差异虽然无统计学意义,但也有升高趋势,这说明阿尔兹海默病患者脑部黑质部分结构变复杂,水分子弥散程度下降。此外,研究结果也显示,阿尔兹海默病患者尾状核头的FA 值显著升高,说明各向异性增加。此前有研究表明,老年斑、神经元纤维缠结增加可导致FA 值升高,FA 值可在一定程度上反应脑病的进展和病变过程。本研究结果与以往研究结果一致,说明DKI 参数可以为阿尔兹海默病的诊断提供依据。
随着生物学对AD 发病机制的不断研究,生物学标志物的发现对AD 的诊断提供了充足证据。神经炎症在AD 的发病机制中起着重要的作用。慢性神经炎症会损害血-脑脊液屏障,引起活化的小胶质细胞释放促炎因子,比如TNF-α、IL-1、IL-6 等[10]。慢性神经炎症的发生,调节血-脑脊液屏障和脑血管通透性,改变效应区域脑血流量[11]。这些细胞因子可能作为血清中的生物学标志物对阿尔兹海默病的诊断具有一定的价值。Shen 等[12]通过一项Meta 分析炎症在AD 中的作用发现,与对照组相比,AD 患者外周血和脑脊液中的炎症标志物,比如IL-6、IL-8 等的水平有显著变化。该研究结果表明,AD 伴全身性和中枢神经系统衍生的炎症过程。Wang 等[13]在研究牙周感染时发现,TNF-α 的全身性上调促进了大脑中的促炎环境,从而促进了AD 样病理和认知功能障碍的发展。另一项研究则通过AD 患者IL-1α、TNF-α浓度的改变部分证实了AD 与神经炎症反应的相关性[14]。本研究结果也表明,与对照组相比,AD 患者血清中的IL-1α 水平降低,TNF-α 水平升高,这在一定程度上证明AD 患者炎症相关因子表达失调,与既往研究结果一致。神经炎症过程是AD 的关键特征,大量研究表明促炎因子水平增加导致AD 病变,外周血特定细胞因子水平的改变反映了AD 免疫系统的紊乱情况[15]。在AD 中,β 淀粉样蛋白积聚在大脑中,形成斑块,被认为促进疾病的发展和进展。此外,tau 蛋白有病理性积累,形成神经原纤维缠结,也与AD 病理有关[16]。Çakir 等[17]在记忆衰退大鼠中同时观察到β 淀粉样蛋白积累增加,tau 磷酸化伴随着TNF-α 和IL-1β 水平的升高。这些结果表明,TNF-α和IL-1 与其他已知生物学标志物(如β-淀粉样蛋白、tau 蛋白等)之间具有关联性,可能在AD 诊断中具有价值。但是TNF-α 和IL-1 水平在阿尔兹海默病诊断中仍然有局限性,比如它们是否仅在某些特定病程阶段中具有诊断价值还需要进一步的研究。此外,本研究表明,AD 患者磁共振参数与血清TNF-α、IL-1α 之间存在一定程度的相关性,这为进一步探讨磁共振参数与血清标志物在AD 诊断中的潜在价值提供了新的方向。
综上所述,DKI 参数系数MD、FA、MK、AK、RK 与阿尔兹海默病的相关性良好;同时,TNF-α、IL-1α 与AD 之间具有相关性,即AD 患者血清TNF-α 水平升高,IL-1α 水平降低。利用磁共振DKI参数对患者进行诊断,不仅可以减少创伤,而且能够准确获取患者脑部微观结构,通过将DKI 参数与血清TNF-α、IL-1α 水平变化联合使用,可有效提高阿尔兹海默病的诊断正确率,具有进一步研究和推广价值。

