补肾固胎合剂通过调控PKA/CREB/AQP5通路改善流产模型大鼠子宫蜕膜组织及螺旋动脉血供的机制*
甘雨娟,张迎春,2**,萧 闵,刘佳文,刘菏婧,潘 琴,徐瑶瑶
(1.湖北中医药大学第一临床学院 武汉 430065;2.湖北省妇幼保健院 武汉 430064;3.湖北中医药大学中医药实验中心 武汉 430065;4.湖北中医药大学中医临床学院 武汉 430065)
流产是指以妊娠不足28 周,胎儿体重不足1000 g而自然殒堕为临床表现,与同一性伴侣连续发生至少2次以上的自然流产,包括连续发生的生化妊娠,称为复发性流产(Recurrent spontaneous abortion,RSA),其中连续3次以上的流产患者再次妊娠流产率高达40%-80%[1-2]。RSA 病因复杂,在育龄妇女中的发病率已达到1%-5%,给患者生活和身心健康带来了不同程度的危害,现代医学认为其已知病因主要包括胚胎因素如染色体、卵泡发育、胎盘异常及母体因素如感染、血栓前状态、免疫等[3]。临床上多采用口服或肌注黄体酮等黄体支持法,低分子肝素抗凝或联合泼尼松、羟氯喹抗炎等药物治疗RSA[4],但是有一定的副作用,如肝素会影响母体肝功能。而中药治疗RSA 副作用小,临床疗效确切[5-7]。
补肾固胎合剂是由经典方“寿胎丸”(《医学衷中参西录》)及“胶艾汤”(《金匮要略》)加减化裁而成[8-9]。本课题组前期临床研究结果示补肾固胎合剂保胎效果显著提升,疗效优于西药治疗[7],但机制不清。目前研究已发现,水通道蛋白(Aquaporins,AQPs)功能异常可能是导致流产、羊水量异常、胎儿畸形和胎儿生长受限等潜在病理因素,而AQPs 也成为治疗妊娠相关疾病的潜在靶点[10]。近期动物实验研究显示寿胎丸可上调部分AQPs 表达水平,使母胎界面水液转运得以调节平衡,以维持妊娠[11]。同时AQPs的表达异常也会导致子宫螺旋动脉(Spiral artery,SpA)重组障碍。为此,本实验通过观察补肾固胎合剂对羟基脲片联合米非司酮诱导的流产模型大鼠子宫蜕膜组织中磷酸化蛋白激A(Phosphorylated protein kinase A,p-PKA)/蛋白激酶A(Protein kinase A,PKA)、磷酸化cAMP 反应元件结合蛋白(cAMP response element binding protein,p-CREB)/cAMP 反应元件结合蛋白(Cyclic adenosine monophosphate response element binding protein,CREB)、水通道蛋白5(Aquaporin 5,AQP5)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)的蛋白表达情况以及螺旋动脉生理性重铸变化,以进一步揭示补肾固胎合剂的保胎机制。
1 材料
1.1 实验动物
将SPF 级SD 大鼠90 只(雌:雄=2:1),雌鼠体质量240-260 g,雄鼠体质量290-310 g,将同性别大鼠分笼适应性喂养7 天。在湖北中医药大学动物实验中心SPF 级动物房饲养,维持室温20-22℃、相对湿度维持在50%-70%左右,12 h 光暗交替,常规喂养。本实验大鼠于三峡大学实验动物中心购入,许可证号:SCXK(鄂)2020-0018,经湖北中医药大学动物实验伦理委员会批准后进行(HUCMS202107004)。
1.2 实验主要药物及试剂
中药补肾固胎合剂由菟丝子、桑寄生、续断、当归、熟地黄、白芍(各15 g),川芎、党参、黄芪、阿胶、艾叶、黄芩、砂仁、甘草(各10 g)组成,所有饮片均购于湖北省妇幼保健院中药房,由湖北省妇幼保健院中医科徐昕鉴定,在煎药室煎煮,过程符合《医疗机构中药煎药室管理规范》,先加入自来水没过草药食指一横指浸泡30 min 后煎煮第1 次,取出药液;再加水煎煮,过滤药渣提取药液,与第1次药液混匀,倒入蒸发器中得生药含量为2.0 g·mL-1的汤剂,将溶液分别密封于无菌量瓶。
羟基脲片(批号:国药准字H37021289,齐鲁制药有限公司),地屈孕酮片(批号:H20170221,公司:Abbott Biologicals B.V.),米非司酮(批号:H20033551,湖北葛店人福药业有限公司),VEGF antibody(批号为19003-1-AP1:200,武汉三鹰生物技术有限公司),DNA断裂的原位末端标记(TUNEL)法细胞凋亡检测试剂盒(批号为11684817910,上海罗氏制药有限公司),BCA蛋白定量分析试剂盒(批号为A53225,赛默飞世尔科技公司);RIPA 裂解液、EDTA 抗原修复液(50X)(批号分别为P0013D、P0085,碧云天生物技术公司);蛋白Marker(批号为26616,美国赛默飞世尔公司)、PKA 一抗(批号为12232-1-AP,三鹰生物技术有限公司)、p-PKA 一抗、CREB 一抗、AQP5 一抗(批号分别为AF8017、AF6188、AF5169,江苏亲科生物研究中心有限公司)、GAPDH一抗、p-CREB一抗(批号分别为ab8245、ab32096,艾博抗上海贸易有限公司)、HRP-山羊抗兔二抗、HRP-山羊抗鼠二抗(批号分别为E-AB-1003、E-AB-1001,伊莱瑞特生物)、山羊抗兔鼠通用二抗(HRP)(批号为K5007,上海睿铂赛生物科技有限公司)。
1.3 实验主要仪器
DYY-6C 型电泳仪、DYCZ-24 型电泳槽、DYCZ-40D 型转膜槽(北京六一),Microfuge 26 型高速离心机(美国贝克曼库尔特),RM2016 型病理切片机(上海徕卡),Enspire 酶标仪(珀金埃尔默),PANNORAMIC 型全景切片扫描仪(匈牙利3DHISTECH),NIKON ECLIPSE E100 型正置荧光显微镜、NIKON DS-U3 型成像系统(日本尼康)。
2 实验方法
2.1 实验动物造模、分组和给药
参考梁程程等[11]的造模方法,具体如下:将大鼠以2:1 比例随机合笼制备孕鼠60 只,合笼第2 天6∶00 显微镜下雌鼠阴道涂片可观察到大量精子则作为妊娠第1 天,将孕鼠依其妊娠顺序随机分为6 组,每组10 只,分别为补肾固胎合剂组(低、中、高剂量),正常妊娠组、模型组及地屈孕酮组,除正常组,余下各每组孕鼠于妊娠1-9 天每天17∶00 予羟基脲片水溶液灌胃(450 mg·kg-1),妊娠第10 天10∶00 予米非司酮片水溶液灌胃(4.0 mg·kg-1)。妊娠第1-9 天每日9∶00,补肾固胎合剂低、中、高剂量组分别予补肾固胎合剂中药液灌胃(0.5、1.0、2.0 g·kg-1);地屈孕酮组予地屈孕酮水溶液灌胃(3.02 mg·kg-1),模型组和正常妊娠组予等量0.9%生理盐水灌胃。补肾固胎合剂中剂量药效等效于临床用药[7]。
2.2 取材与制备标本
各组孕鼠均于末次给药24 h 后,以1%戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉大鼠,无菌条件下钝性分离子宫壁,随机选着床部位(5个),将胚胎及胎盘自着床部位剥脱,组织剪分离着床部位的蜕膜组织,PBS预冷后冲洗蜕膜组织,装入无酶EP 管并置于-80℃冰箱冻存备用,剩余蜕膜组织洗净后,迅速置于4%多聚甲醛中固定备用。
2.3 苏木素-伊红染色观察各组孕鼠子宫蜕膜组织中螺旋动脉形态并测量管腔直径及管壁厚度
取出多聚甲醛固定的蜕膜组织,脱水、包埋,放置石蜡切片机上制成4 μm 石蜡切片,切片脱蜡,苏木素染色0.25 h,冲洗,分化,再冲洗,返蓝,流水冲洗。切片依次入85% 和95% 乙醇脱水各5 min,再染色5 min,脱水后封片。切片用全景切片扫描仪全扫描,每组5 张,每张切片随机测3 条螺旋动脉,用CaseViewer2.2RTM 进行观察测量管腔直径和管壁厚度,取平均值进行统计学分析。
2.4 TUNEL法检测孕鼠子宫蜕膜组织蜕膜细胞凋亡
脱蜡前步骤同2.3 项,后蛋白酶K 覆盖组织,37℃孵育15 min。PBS 洗3 次,后破膜液孵育10 min,PBS再洗3 次,取适量TdT 和dUTP(1∶9)混合后覆盖组织,将切片于湿盒内平放,37℃恒温孵育1 h,在避光环境下将玻片放置PBS 溶液中用脱色摇床晃洗3 次(每次5 min)。切片稍干后,滴入DAPI 染液,室内恒温避光静置10 min,最后再洗涤3 次,稍甩干后封片。紫外线下细胞核显为蓝色,使用FITC 标记,荧光显微镜下见到绿色荧光即为凋亡蜕膜细胞。
2.5 免疫组化学法(IHC)检测蜕膜组织中血管内皮生长因子的表达
同2.3 项进行石蜡切片脱蜡,切片于抗原修复缓冲液中进行烤片30 min 抗原修复,3%双氧水中孵育25 min,滴加3% BSA 封闭后,加入VEGF 抗体(稀释比为1:200)4℃孵育过夜,脱色洗涤加入HRP 室温孵育50 min 后,进行DAB 显色;浸入苏木素染液复染,冲洗,分化,再冲洗,返蓝,流水冲洗,脱水,树胶封片。利用图像采集系统采集并分析结果。苏木素染细胞核为蓝色,DAB中阳性表达为棕黄色。
2.6 蛋白免疫印迹法(Western blot)检测各组孕鼠子宫蜕膜组织中p-PKA、PKA、p-CREB、CREB、AQP5 的蛋白表达情况
取各组子宫蜕膜组织50 mg,剪成小块置于无酶EP 管中,加入适量裂解液匀浆,冰浴30 min 后离心(4℃ 12 000 r·5 min-1),收集上清液。使用BCA检测蛋白浓度,制胶、灌胶、点样、电泳、转膜,将条带分别放入PKA、p-PKA、CREB(1∶1000)、p-CREB(1∶2500)一抗稀释液中,4℃孵育过夜,用TBST 洗5 次后置于HRP-山羊抗兔二抗、HRP-山羊抗鼠二抗(1∶3000)稀释液中,继而孵育、TBST 用ECL 化学发光试剂盒进行发光检测,系统显影,Image J 分析条带灰度值。AQP5与GAPDH 相 比 较,p-PKA 与PKA 比 较,p-CREB 与CREB比较相对灰度值即为相对表达量。
2.7 统计学方法
图片采用CaseViewer2.2软件,数据采用SPSS 26.0软件分析。若数据正态分布、方差齐性,运用单因素方差分析(ANOVA);若数据不符合正态分布或者方差不齐,用非参数检验;结果采用均值 ± 标准差(±s)表示,P<0.05表示有统计学意义。
3 实验结果
3.1 对流产大鼠蜕膜组织中螺旋动脉的影响
HE染色后,CaseViewer 测量显示,与正常组相比,模型组的螺旋动脉平均管腔直径显著降低(P<0.01),管壁厚度显著升高(P<0.01),与模型组相比,地屈孕酮组和补肾固胎合剂高、中、低剂量组的螺旋动脉平均管腔直径显著上升(P<0.01),管壁厚度显著降低(P<0.05,P<0.01),与地屈孕酮组相比,补肾固胎合剂低剂量组螺旋动脉平均管腔直径较低(P<0.01),高剂量组较高(P<0.05),中剂量组无明显差异(P>0.05),补肾固胎合剂低剂量组螺旋动脉平均管壁厚度较低(P<0.05),高、中剂量组螺旋动脉管壁厚度接近,无明显差异(P>0.05),见表1和图1。
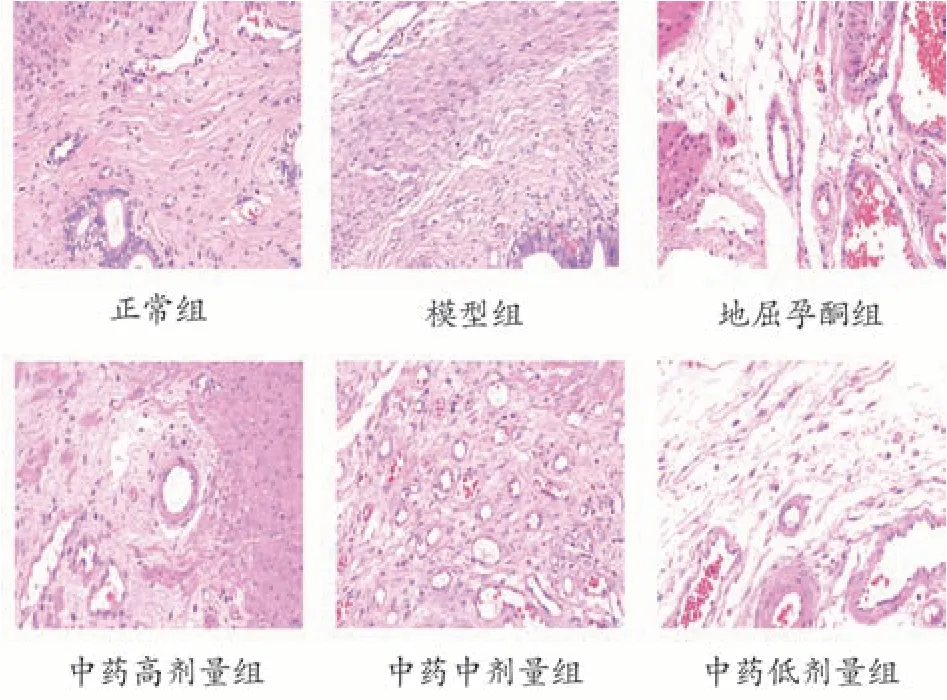
图1 各组典型螺旋动脉HE染色图(×400)
表1 各组大鼠蜕膜组织螺旋动脉的管腔直径及管壁厚度(±s,n=10)
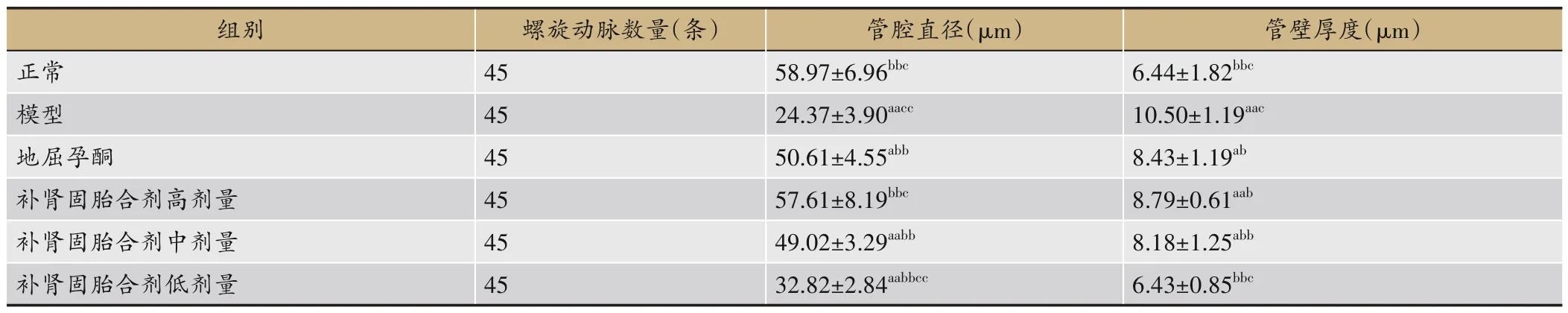
表1 各组大鼠蜕膜组织螺旋动脉的管腔直径及管壁厚度(±s,n=10)
注:与正常组比较,aP<0.05,aaP<0.01;与模型组比较,bP<0.05,bbP<0.01;与地屈孕酮组比较,cP<0.05,ccP<0.01。
管壁厚度(μm)6.44±1.82bbc 10.50±1.19aac 8.43±1.19ab 8.79±0.61aab 8.18±1.25abb 6.43±0.85bbc组别正常模型地屈孕酮补肾固胎合剂高剂量补肾固胎合剂中剂量补肾固胎合剂低剂量螺旋动脉数量(条)45 45 45 45 45 45管腔直径(μm)58.97±6.96bbc 24.37±3.90aacc 50.61±4.55abb 57.61±8.19bbc 49.02±3.29aabb 32.82±2.84aabbcc
3.2 对流产大鼠子宫蜕膜组织蜕膜细胞凋亡及VEGF蛋白表达的影响
VEGF 主要表达在蜕膜细胞胞浆中,且在蜕膜中阳性染色强。与正常组相比较,模型组大鼠子宫蜕膜组织VEGF 表达量显著降低(P<0.01),与模型组比较,地屈孕酮组和补肾固胎合剂高、中、低剂量组VEGF表达量显著升高(P<0.01,P<0.05)。与地屈孕酮组相比较,补肾固胎合剂高、中剂量组VEGF表达量显著升高(P<0.01),低剂量组VEGF 表达量较低(P<0.01)(见表2和图2)。
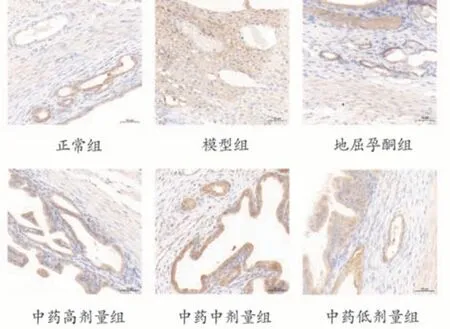
图2 补肾固胎合剂对各组孕鼠鼠子宫蜕膜组织VEGF蛋白表达的影响(IHC,×200)
表2 补肾固胎合剂对流产大鼠子宫蜕膜组织蜕膜细胞凋亡及VEGF蛋白表达的影响(±s,n=10)
注:与正常组比较,aP<0.05,aaP<0.01;与模型组比较,bP<0.05,bbP<0.01;与地屈孕酮组比较,ccP<0.01。
组别正常模型地屈孕酮补肾固胎合剂高剂量补肾固胎合剂中剂量补肾固胎合剂低剂量剂量(g·kg-1)--0.003 25 2 1 0.5阳性细胞率(%)1.72±0.19bbcc 15.80±0.25aacc 4.30±0.12aabbcc 4.20±0.28aabb 0.55±0.07aabbcc 9.09±0.51aabbcc VEGF/平均光密度值0.130±0.002bb 0.090±0.006abcc 0.120±0.004bbcc 0.190±0.018aabbcc 0.150±0.008aabbcc 0.100±0.001aabcc
TUNEL 法检测细胞凋亡:荧光下细胞核显蓝色,凋亡细胞为绿色。与正常组比较,模型组大鼠子宫蜕膜组织 TUNEL 阳性细胞明显增多(P<0.01);与模型组比较,补肾固胎合剂高、中、低剂量组及地屈孕酮组TUNEL 阳性细胞率显著降低(P<0.01);与地屈孕酮组比较,补肾固胎合剂中剂量组阳性细胞数显著减少(P<0.01),低剂量组显著增多(P<0.01),高剂量组无明显差异(P>0.05),见表2和图3。
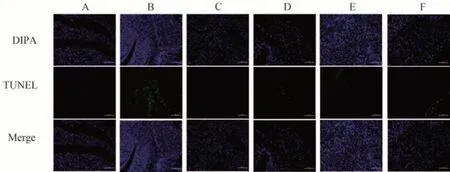
图3 补肾固胎合剂对各组流产大鼠子宫蜕膜组织蜕膜细胞的凋亡影响(IF,×200)
3.3 对流产大鼠子宫蜕膜组织p-PKA/PKA、p-CREB/CREB、AQP5的影响
与正常组比较,模型组流产大鼠子宫蜕膜组织p-PKA/PKA、p-CREB/CREB、AQP5 的相对表达量均显著降低(P<0.01)。与模型组比较,地屈孕酮组和补肾固胎合剂高、中、低剂量组流产大鼠子宫蜕膜组织p-PKA/PKA、p-CREB/CREB、AQP5 表达显著升高(P<0.01)。与地屈孕酮组比较,补肾固胎合剂量高、低剂量组p-PKA/PKA、p-CREB/CREB、AQP5 相对表达量降 低(P<0.05,P<0.01),中 剂 量 组p-PKA/PKA、p-CREB/CREB 表达水平无明显差异(P>0.05),AQP5 相对表达量较低(P<0.01),见表3和图4。
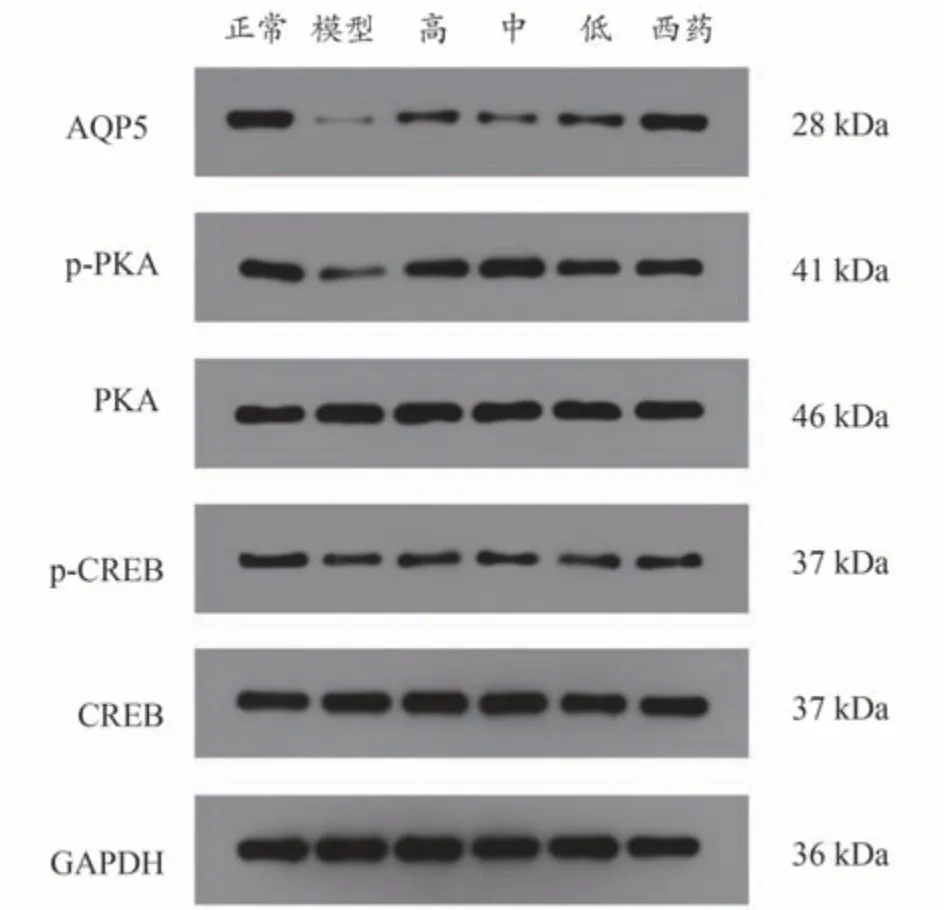
图4 各组孕鼠子宫蜕膜组织PKA、p-PKA、CREB、p-CREB和AQP5蛋白表达电泳条带
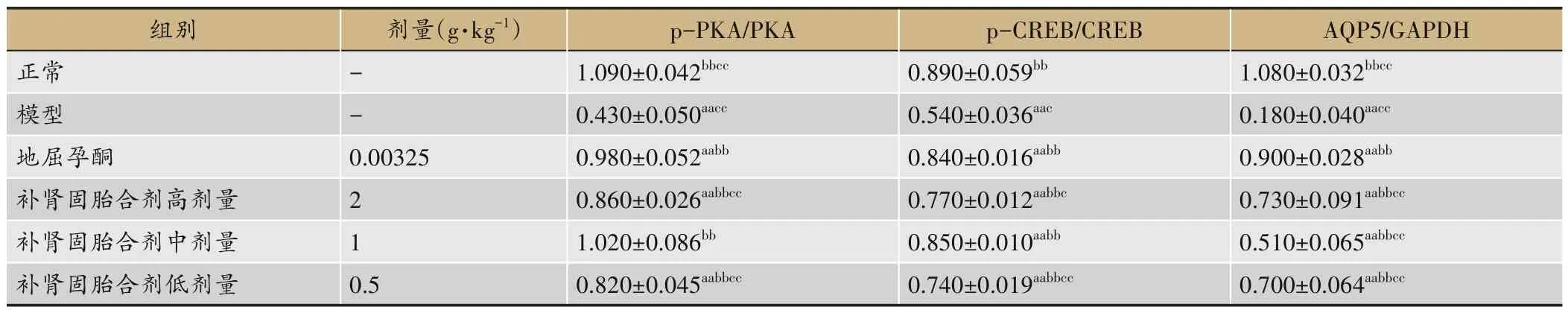
表3 补肾固胎合剂对流产大鼠子宫蜕膜组织p-PKA/PKA、p-CREB/CREB和AQP5蛋白表达的影响
4 讨论
RSA 属于祖国传统医学“滑胎”的范畴,其发病机制为冲任虚损、胎元不固,病因多责之于脾肾亏虚,气血两虚兼有血瘀、血热、肝郁,治疗当以补肾健脾为主,配以活血化瘀、清热凉血、解郁理气安胎[12]。补肾固胎合剂由“寿胎丸”及“胶艾汤”加减化裁而成,方中熟地黄滋阴,菟丝子、续断、桑寄生补肾固冲,白芍、党参、黄芪养血益气,当归、川芎活血化瘀,阿胶养血止血,艾叶温经散寒、调经安胎,黄芩、砂仁安胎,甘草调和诸药,与白芍相须缓急止痛。全方共奏补肾安胎、养血活血、益气固冲之效。张迎春教授运用此方治疗肾虚气血两虚之滑胎近30年,临床疗效确切[5-7]。现代药理学研究发现寿胎丸及胶艾汤中药效成分具有雌孕激素类似样作用,并且可以抑制子宫平滑肌收缩,同时还具有抗炎、调节免疫的作用[13]。此外地屈孕酮作为孕激素的替代药,也能够抑制子宫平滑肌收缩及诱导淋巴细胞生成孕酮诱导组织因子调节母胎免疫来延长妊娠天数,是孕早期的常用药[14]。白芍中的山奈酚、β-谷甾醇,当归中的豆甾醇,川芎中的川芎哚和菟丝子中的檞皮素、异鼠李素这些药理成分能双向调节胎盘生长因子及炎症因子水平,在调节滋养细胞功能、增强子宫内膜血管通透性、改善盆腔血供、子宫内膜容受性,调节母胎免疫微环境等多方面促进胚胎着床及妊娠维持[15]。
SpA 是母体向胎儿输送营养物质的管道,研究发现RSA 患者早期螺旋动脉重组障碍,表现为SpA 管腔狭窄、管壁增厚、重铸异常、胎盘形成受阻等,进而导致胚胎缺血、缺氧引起一系列病理妊娠,在临床上,子宫螺旋动脉血流动力学参数值是反映孕期胚胎血供的重要指标[16]。本实验结果显示:地屈孕酮组和补肾固胎合剂组大鼠SpA 平均管腔直径均大于模型组,管壁厚度均小于模型组,这与临床上SpA 重组障碍表现一致,给予补肾固胎合剂及地屈孕酮干预后,SpA管腔直径增大,管壁变薄,这提示补肾固胎合剂可以有效促进SpA重铸,改善子宫血供。VEGF是一种多功能因子,在胚胎发育过程中参与胚胎血管生成及调节血管通透性,激活胚泡着床[17-18]。本实验免疫组化结果显示,补肾固胎合剂可上调孕鼠蜕膜组织中VEGF 的蛋白表达量,提高SpA 生理性重铸率,达到改善子宫血供的目的。
AQPs 作为水和中性分子通过生物膜的孔道,广泛分布于与液体分泌吸收密切相关的上皮及内皮细胞内。迄今在哺乳动物体内已发现共有13种AQP(0-12),有研究证实雌性大鼠怀孕期间,AQP5 的表达要高于其他AQP 亚型[19-21]。AQP5 是一个横跨质膜的四聚体,其氨基酸序列含有PKA 潜在磷酸化位点,当PKA 被第二信使cAMP 激活后,活化的PKA 可促进CREB 丝氨酸133 号位点磷酸化,磷酸化的CREB 与细胞核内的环磷酸腺苷反应元件结合蛋白(CREB buliding protein,CBP)特异性结合后大幅度增加CREB转录活性并诱导AQP5基因的转录及蛋白的合成[22-25]。AQPs 表达异常导致细胞水平衡障碍,滋养细胞侵袭障碍及凋亡,影响正常胎盘的植入活动,导致胎盘形成障碍[10][26]。绒毛外滋养细胞在胚胎植入母体蜕膜后,侵袭到蜕膜取代SpA 血管内皮细胞完成胎盘血管的重建,以维持妊娠[27]。本研究结果显示,模型组子宫蜕膜组织p-PKA/PKA、p-CREB/CREB 的表达水平明显降低,地屈孕酮片与补肾固胎合剂分别干预后,结果逆转且补肾固胎合剂中剂量组效果最佳。此外,在给予地屈孕酮后,p-PKA/PKA、p-CREB/CREB 蛋白表达与补肾固胎合剂中剂量组相比无显著差异,这可能与地屈孕酮治疗流产的药理作用有关。与正常组相比,模型组的TUNEL 阳性细胞增多,表明流产大鼠子宫蜕膜组织的蜕膜细胞凋亡途径激活。给予补肾固胎合剂干预后,TUNEL 阳性细胞显著减少,提示补肾固胎合剂可更有效地通过AQP5 调节水液平衡来抑制蜕膜细胞的凋亡改善孕鼠子宫血供。
综上所述,补肾固胎合剂可有效地改善流产模型大鼠子宫供血,降低病理性妊娠率,机制可能是通过调控子宫蜕膜组织中PKA-CREB 通路及AQP5,以达到调节水液平衡、促进螺旋动脉生理性重铸,母胎界面血管新生改善微循环,抑制蜕膜细胞凋亡的作用。需要指出的是,补肾固胎合剂为中药复方,有多成分、多靶点特性,本研究仅初步探索PKA-CREB 通路以及AQP5 其对流产大鼠子宫血供的影响,作用机制仍有待进一步阐明。因此,后续实验将采用CREB 抑制剂继续深入研究,进行反向证明补肾固胎合剂对流产大鼠子宫供血和安胎的作用机制,以期更严谨的结论。

