川芎嗪通过PGC-1α途径抑制线粒体分裂与肾小管上皮细胞凋亡改善顺铂诱导的急性肾损伤*
韦泽丰,郑金花,王自强
(海南医学院第一附属医院 海口 570102)
顺铂(Cisplatin,Cis)是一种有效的抗肿瘤药物,可用于化疗方案治疗多种实体瘤[1]。急性肾损伤(Acute kidney injury,AKI)是Cis 引起的最严重的毒性反应之一,严重限制了Cis 临床应用[2-3]。然而,Cis 诱导AKI的确切发病机制尚未完全阐明。研究表明,氧化损伤及其所致的肾小管细胞损害是Cis 诱导AKI 发生重要致病机制[1],且线粒体损伤是Cis 诱发肾毒性的中心环节[4]。当线粒体分裂过度激活时,其可产生并释放过量的活性氧(Reactive oxygen species,ROS)损伤细胞,甚至诱导细胞凋亡的发生[5-6]。过氧化物酶体增殖物激活 受 体γ 辅 助 活 化 因 子1α(Peroxisome proliferator activated receptor γ coactivator factor 1α,PGC-1α)作为一种转录共激活因子,是调控线粒体相关蛋白表达并影响线粒体动力学、生物合成,ROS 产生等多种过程中的主导调控因子[7]。同时,近期有研究表明,几种提高PGC-1α表达的策略可以通过改善线粒体功能损伤来保护肾小管细胞免受多种应激源的伤害[8]。
川穹嗪(Tetramethylpyrazine,TMP)是存在于中药川穹中的一种天然化合物,具有血管舒张和抗血小板聚集等多种生物活性,常用于心血管患者,且对缺血性脑中风具有多种潜在益处[9-10]。同时,TMP还能通过清除氧自由基,发挥抗炎、抗氧化等多种作用来减轻大鼠的肾脏缺血再灌注损伤[11]。然而,TMP在Cis诱导的AKI 中作用研究较少,其具体作用及相关机制尚待阐明。本研究通过体内外实验探究TMP 在Cis诱导的AKI 和肾小管上皮细胞损伤中作用,并探讨线粒体分裂和PGC-1α是否参与这一过程。
1 材料与方法
1.1 材料
SPF 级雄性C57BL/6J 小鼠(6-8 周龄,体质量20-25 g)60只购自海南药物研究所有限责任公司;近端肾小管上皮细胞系HK-2 购自ATCC;胎牛血清(Fetal bovine serum,FBS)、青霉素(100 U·mL-1)、链霉素(100 U·mL-1)、DMEM/F12 培养基(美国Gibco 公司);顺铂(Cisplatin,Cis)、DCFH-DA 试剂、DHE 试剂(美国Sigma公司);兔抗PGC-1α多克隆抗体,兔抗磷酸化动力相关蛋白1(Phosphorylation of dynamin-related protein 1,p-Drp1),兔抗动力相关蛋白1(Dynaminrelated protein 1,Drp-1),兔抗β-actin(美国SantaCruz公司);兔抗电压依赖性阴离子通道(Voltagedependent anion channel,VDAC)(美国Bioworld 公司);山羊抗兔IgG 二抗(武汉三鹰生物技术有限公司);MitoTracker 试剂(美国Invitrogen 公司);TMP 单体(成都曼斯特生物科技有限公司);血尿素氮(Blood urea nitrogen,BUN)、血肌酐(Serum creatinine,Scr)检测试剂盒(南京建成生物科技有限公司);Annexin V-FITC/PI 凋亡试剂盒(美国BD bioscience 公司);细胞线粒体分离试剂盒,线粒体裂解液,TUNEL 细胞凋亡检测试剂盒(江苏碧云天生物技术公司);组织活性氧(reactive oxygen species,ROS)检测试剂盒(DHE),细胞裂解液,蛋白酶抑制剂(北京百奥莱博科技有限公司)。
1.2 方法
1.2.1 Cis诱导的AKI小鼠模型的建立
将小鼠在SPF 级饲养环境中适应性饲养1 周,环境温度为21±2℃,自由摄食、水,12 h光/暗循环。将实验小鼠随机分为对照组(Control,Ctl),TMP 组(TMP),Cis 组(Cis)和TMP 进行治疗的Cis 组(Cis+TMP),每组15 只。TMP 组的处理方式为参考文献方法[12],予以小鼠每天经腹注射TMP 20 mg·kg-1,连续3 天。Cis 组的处理方式为参考文献方法[13],予以小鼠单次腹腔注射20 mg·kg-1Cis进行建立AKI模型。Cis+TMP 组则使用20 mg·kg-1的Cis 单 次 腹 腔 注 射 后,每 天 予 以 小 鼠20 mg·kg-1TMP 进行腹腔注射,连续3 天。对照组仅使用相同体积的生理盐水进行单次腹腔注射。3天后经心脏采血收集各组小鼠血液样本后,在经腹注射1%戊巴比妥钠(50 mg·kg-1)的麻醉状态下处死各组小鼠,快速取小鼠肾脏标本进行后续相关检测。本实验所有操作均符合实验动物使用及保护条例,并通过我院伦理委员会审核通过。
1.2.2 各组小鼠BUN、Scr含量的检测
随机选取每组6 只小鼠的血液标本,静置后取上层血清,根据商品化试剂盒使用说明书检测各组小鼠血液样本中BUN、Scr的含量。实验单独重复3次。
1.2.3 各组小鼠肾组织的病理学检测
①HE 染色:取出固定于4%多聚甲醛中24 h 后的肾组织,PBS 溶液充分洗涤,常规使用梯度乙醇脱水、二甲苯透化、石蜡包埋及切片(5 μm)处理后,进行HE染色,倒置显微镜下进行观察拍照。②TUNEL 染色:取经4%多聚甲醛中固定24 h 后各组小鼠肾组织,按前述方法进行石蜡包埋,切片,脱蜡,水化后按照TUNEL 试剂盒说明书进行检测肾组织的细胞凋亡情况。③透射电镜观察:取约1 mm×1 mm×1 mm 的肾皮质组织碎片,在含2.5%戊二醛的0.15 mol·L-1醋酸盐缓冲液中于4℃下固定12 h,室温下1%四氧化三铯溶液中再次固定2 h 后,梯度乙醇脱水,环氧树脂包埋,超薄切片后,醋酸铀酰和柠檬酸铅双染,透射电镜观察肾皮质线粒体结构变化。以上实验均单独重复3次。
1.2.4 细胞的培养与处理分组
常规复苏HK-2 细胞后,置于含10%灭活FBS 与1%青霉素、链霉素的DMEM/F12 完全培养基中,并在37℃,5% CO2的培养箱中进行培养。取处于对数生长期的HK-2 细胞,调整细胞密度后,按每孔5×105接种至6孔板中,并将细胞分为正常培养的Ctl组,TMP 组,Cis 组和Cis+TMP 组。TMP 组的处理方式为参考文献方法[14]给予5 μg·mL-1的TMP 处理。Cis 组的处理方式为参考文献方法[15]给予20 μmol·L-1的Cis 处理。Cis+TMP 组则是应用5 μg·mL-1TMP 和20 μmol·L-1Cis 进行联合处理。按文献方法[15]取上述不同药物处理24 h后的各组细胞用于后续实验。
1.2.5 CCK-8实验检测各组HK-2细胞的增殖活性
取处于对数生长期的HK-2 细胞,调整细胞密度后,以每孔5×103接种至96 孔板后,按方法1.2.4 进行分组处理,并于分别于12、24、36、48 h 时向每孔加入10 μL 的CCK-8 试剂,在酶标仪490 nm 波长处检测每孔吸光度值。每组每个时间点设置5 个复孔,计算分析并绘制各组细胞的生长曲线。实验单独重复3次。
1.2.6 流式细胞术检测HK-2 细胞凋亡与线粒体膜电位水平
①流式细胞术结合Annexin V-FITC/PI 染色检测HK-2 细胞凋亡情况:收集上述各组HK-2 细胞,调整细胞密度,取约2×105个细胞至流式管中,500 μL 结合缓冲液重悬细胞后,分别加入5 μL 的Annexin V-FITC与PI 试剂,37℃下避光孵育20 min,2200 r·min-1离心5 min 后,取细胞沉淀加入100 μL 结合缓冲液重悬细胞,200 目滤网过滤后,上机检测各组细胞凋亡率。其中FITC+/PI-细胞群为早期凋亡,FITC+/PI+细胞群为晚期凋亡,两者之和为细胞的总调亡比例。②流式细胞术结合JC-1 染色检测HK-2 细胞膜电位水平:取上述各组HK-2细胞,按上述步骤取约2×105个细胞至流式管中,PBS 溶液充分洗涤细胞后,加入5 μmol·L-1的JC-1 染料,37℃下避光孵育30 min,PBS 充分洗涤后,上机分析。其中当线粒体膜电位处于正常较高电位时,JC-1形成聚合物,呈红色荧光,而当膜电位受损降低时,JC-1 为单体形式存在,为绿色荧光。上述实验均单独重复3次。
1.2.7 ROS检测
参考试剂盒说明书方法,加入10 μmol·L-1的DHE试剂,37℃下避光孵育30 min后,荧光显微镜检测新鲜肾组织切片中ROS 的红色荧光量;在体外实验中,取各组HK-2 细胞,加入终浓度为10 μmol·L-1的DCFHDA 试剂,37℃下避光孵育30 min 后,应用荧光显微镜下观察细胞中ROS 的绿色荧光量。上述实验均单独进行3次。
1.2.8 线粒体结构的mitoTracker检测
根据mitoTracker 试剂盒说明书进行,即取各组HK-2 细胞,加 入100 nmol·L-1的mitoTracker 试 剂与Hoechst33342 试剂,37℃下避光孵育30 min 后,荧光显微镜观察各组线粒体结构变化。实验单独重复3 次。
1.2.9 Western blot 检测肾组织与HK-2 细胞中PGC-1α与线粒体分裂蛋白Drp-1的表达
将各组小鼠肾皮质组织置于液氮中研磨,联合使用蛋白酶抑制剂与细胞裂解液进行提取肾组织匀浆与各组HK-2 中的总蛋白。将蛋白样品在4°C 下10 000 r·min-1离心10 min,收集上清液。用BCA 法进行检测蛋白浓度。将上述蛋白溶液与4×的上样缓冲液混合后,置于沸水中加热5 min。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离约40 μg的蛋白样品,并将其转移到聚偏氟乙烯膜上。5%BSA 封闭抗体,在4℃下与一抗孵育过夜:兔抗PGC-1α 抗体(1∶800)、兔抗Drp-1 抗体(1∶800)、兔抗p-Drp1Ser637抗体(1∶500)、兔抗β-actin 抗体(1∶1000)。用TBST 缓冲液清膜,再滴加二抗(1∶2000),37°C 孵育2 h。最后滴加增强化学发光液进行曝光拍照。使用Image J软件进行分析。以目标蛋白与内参β-actin 的比值作为其相对含量。实验单独重复3次。
1.2.10 线粒体分裂蛋白Drp-1在线粒体中的表达
应用线粒体分离试剂盒分离各组HK-2细胞中的线粒体,联合使用线粒体裂解液与蛋白酶抑制剂提取线粒体中的蛋白后,按方法1.2.9 的Western blot 法检测线粒体中Drp-1 蛋白含量,其中加入一抗为:兔抗Drp-1 抗体(1∶500),兔抗VDAC 抗体(1∶1000)。以目标蛋白与内参VDAC 的比值作为其相对含量,其余步骤同上。
1.3 统计学方法
使用GraphPad Prism 6.0 软件对数据进行统计分析。计量数据结果用均值±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间比较使用Bonferroni’s 多重分析;以P<0.05 为差异具有统计学意义。
2 结果
2.1 TMP保护Cis诱导的AKI
各组小鼠的BUN 与Scr检测结果显示,与Ctl 组相比,TMP 组的BUN 与Scr 含量均无显著差异(P>0.05),而Cis 组与Cis+TMP 组均明显增加(P<0.05);与Cis 组相比,Cis+TMP 组的BUN 与Scr 含量均明显降低(P<0.05),见表1。各组小鼠肾脏的HE 染色结果观察显示,Ctl 组与TMP 组组织结构形态完整,无明显损伤现象;Cis 组肾脏组织损伤严重,表现为肾小管上皮细胞坏死、管腔内大量炎性细胞浸润、大量蛋白管型出现,肾小管间毛细血管充血、肾小球充血,而Cis+TMP 组小鼠的肾脏组织学特征较Cis 组明显改善,肾小管上皮细胞坏死面积减少,肾小球轻度充血,组织损伤介于Ctl 组与Cis 组之间,见图1A。TUNEL 染色结果显示,Ctl组与TMP组无明显肾组织细胞凋亡发生,而Cis组与Cis+TMP 组均出现肾组织细胞凋亡现象,其中较Cis 组相比,Cis+TMP 组细胞凋亡水平明显降低(P<0.05),见图1B。
表1 各组小鼠的血BUN与Scr浓度检测(±s,n=6)
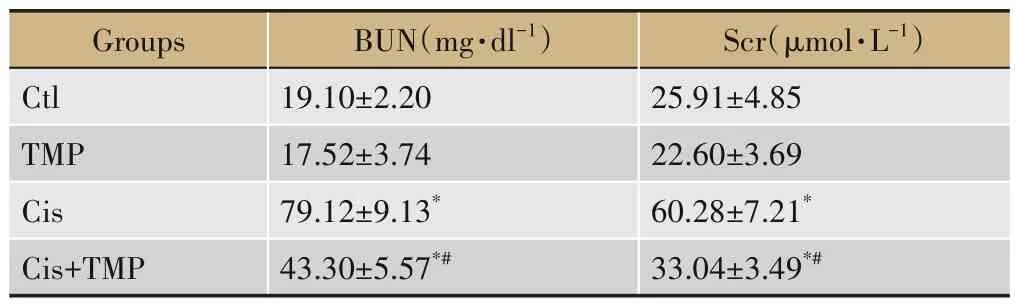
表1 各组小鼠的血BUN与Scr浓度检测(±s,n=6)
注:与Ctl组相比,*P<0.05;与Cis组相比,#P<0.05。
Groups Ctl TMP Cis Cis+TMP BUN(mg·dl-1)19.10±2.20 17.52±3.74 79.12±9.13*43.30±5.57*#Scr(μmol·L-1)25.91±4.85 22.60±3.69 60.28±7.21*33.04±3.49*#
2.2 TMP 对各组小鼠肾组织中线粒体结构与ROS 含量的影响
透射电镜观察结果显示,Ctl 组与TMP 组小鼠肾皮质组织的线粒体结构完整,Cis 组的线粒体数目显著减少,线粒体结构破坏严重,表现为线粒体呈球形或不规则形状,线粒体膜肿胀明显,线粒体棘突变短,Cis+TMP 组线粒体结构损伤处于Ctl 组与Cis 组之间,见图2A。DHE荧光探针检测结果显示,与Ctl组相比,TMP 组小鼠肾组织中ROS 含量无明显差异(P>0.05),Cis组与Cis+TMP组中ROS含量显著增加(P<0.05);与Cis 组比较,Cis+TMP 组中ROS 含量明显增加(P<0.05),见图2B。
2.3 TMP 对各组小鼠肾组织中PGC-1α 与线粒体分裂蛋白表达的影响
Western blot 检测结果显示,与Ctl 组相比,PGC-1α 与线粒体分裂蛋白Drp1 的Ser637 位点磷酸化水平(p-Drp1Ser637/Drp1)在TMP组小鼠肾组织中无明显变化(P>0.05),Cis 组与Cis+TMP 组中显著降低(P<0.05);与Cis 组相比,PGC-1α 与Drp1 的Ser637 位点磷酸化水平(p-Drp1Ser637/Drp1)在Cis+TMP 组中显著升高(P<0.05),见图3。
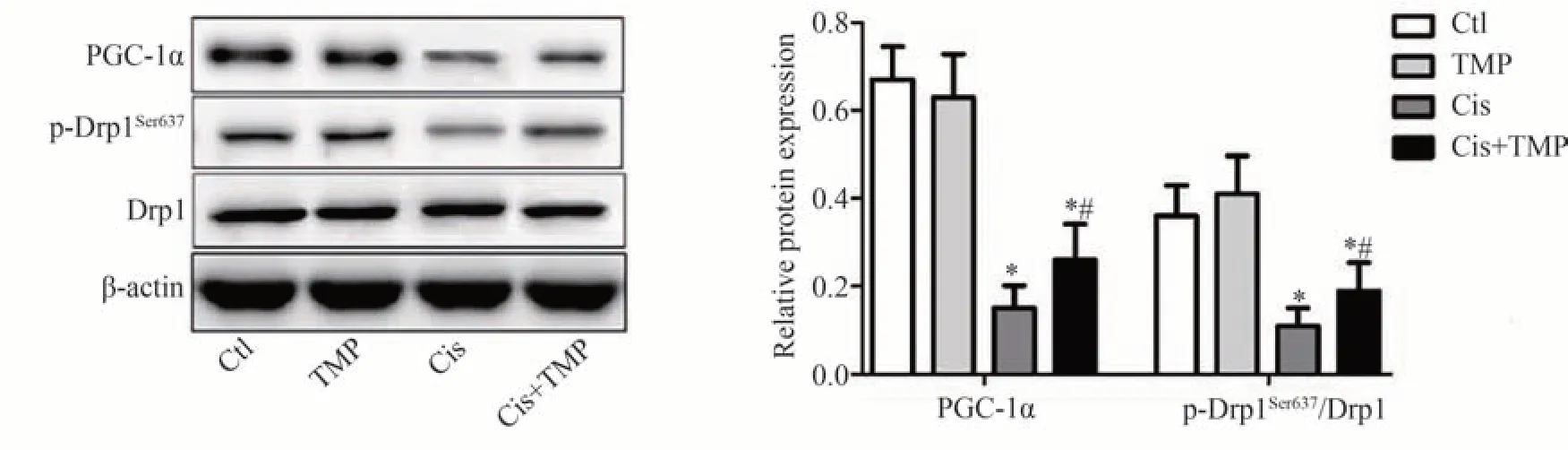
图3 Western blot实验检测各组小鼠肾组织中PGC-1α与Drp1的蛋白表达水平
2.4 TMP对各组HK-2细胞的增殖活性与凋亡影响
CCK-8 检测结果显示,与Ctl 组相比,TMP 组HK-2 细胞的增殖活性无明显变化(P>0.05),Cis 组和Cis+TMP 组显著降低(P<0.05);与Cis 组相比,Cis+TMP 组HK-2 细胞的增殖活性明显升高(P<0.05),见图4A。流式术检测结果显示,与Ctl 组相比,TMP 组HK-2 细胞凋亡率无明显改变(P>0.05),Cis组和Cis+TMP 组细胞的凋亡率显著升高(P<0.05);与Cis 组比较,Cis+TMP 组HK-2 细胞 凋亡 率 明显 降低(P<0.05),见图4B。

图4 各组HK-2细胞的增殖活性与凋亡率
2.5 TMP对各组HK-2细胞的线粒体功能影响
DCFH-DA 荧光探针法检测结果表明,与Ctl 组相比,TMP 组HK-2 细胞线粒体中ROS 含量无明显差异(P>0.05),Cis 组和Cis+TMP 组HK-2 细胞中ROS 水平均明显升高(P<0.05);与Cis组相比,Cis+TMP组HK-2细胞中ROS 水平明显降低(P<0.05),见图5A。JC-1法检测结果显示,与Ctl 组相比,TMP 组HK-2 细胞线粒体膜电位无明显改变(P>0.05),Cis 组、Cis+TMP 组显著降低(P<0.05);与Cis 组相比,Cis+TMP 组HK-2细胞线粒体膜电位明显升高(P<0.05),见图5B。
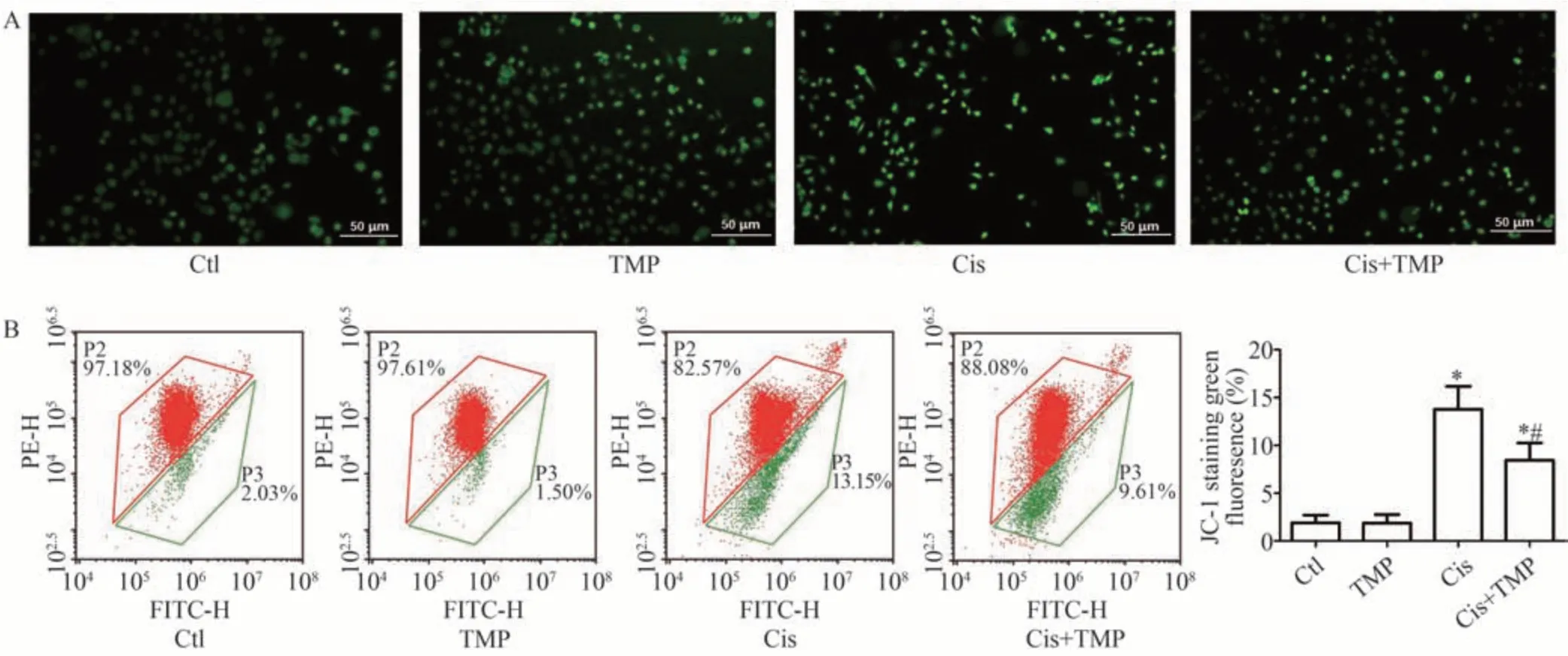
图5 各组HK-2细胞线粒体中ROS表达与线粒体膜电位
2.6 TMP对各组HK-2细胞线粒体结构的影响
MitoTracker 染色观察线粒体形态学变化的结果显示,Ctl 组与TMP 组中的线粒体呈片状或丝状正常结构,Cis 组线粒体的碎片状增多,Cis+TMP 组的线粒体损伤介于Ctl组与Cis组之间,见图6。
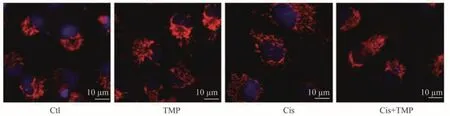
图6 MitoTracker染色观察各组各组HK-2细胞线粒体形态改变
2.7 TMP 对各组HK-2 细胞中PGC-1α 与线粒体分裂蛋白表达的影响
Western blot 法检测结果显示,与Ctl 组相比,PGC-1α 蛋白与线粒体分裂蛋白Drp1 的Ser637 位点磷酸化水平(p-Drp1Ser637/Drp1)在TMP 组HK-2 细胞中无明显改变(P>0.05),Cis 组与Cis+TMP 组显著降低(P<0.05);与Cis 组 相 比,PGC-1α 蛋 白 表 达 与p-Drp1Ser637/Drp1比值在Cis+TMP组中显著升高(P<0.05)。各组HK-2 细胞的线粒体中Drp1 蛋白标的Western blot 法检测结果显示,与Ctl 组相比,TMP 组线粒体中Drp1 蛋白无明显变化(P<0.05),Cis 组与Cis+TMP 组明显升高(P<0.05);与Cis 组比较,Cis+TMP 组HK-2细胞线粒体中Drp1 蛋白表达水平显著降低(P<0.05),见图7。
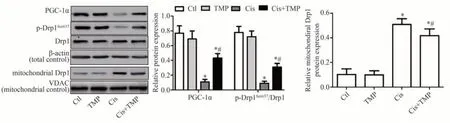
图7 Western blot法检测各组HK-2细胞中PGC-1α与Drp1的蛋白表达
3 讨论
肾毒性是Cis 临床应用剂量的主要限制因素[1]。因此,积极探究并研发预防和治疗Cis 诱导肾毒性的策略具有重要意义。而关于TMP 在Cis诱导肾毒性中作用的研究较少,但为数不多的数据均报道TMP 能够保护Cis 诱导的肾功能损伤[12,16-17]。然而,这种保护作用的具体机制尚在探究当中。如Michel 等[12]研究表明,TMP可能通过上调高迁移率族蛋白1/toll样受体4/核因子κB 信号通路来改善Cis 诱导的肾毒性、氧化应激、炎症、细胞凋亡。Ali 等[16]与Liu 等[17]的研究团队均发现,TMP 可改善Cis 诱导的大鼠肾毒性的组织学、生理和生化指标,并提示TMP 可能是一种潜在的肾保护剂,但未深入探究相关作用机制。本研究通过体内外实验表明,TMP 可在体内外保护Cis 诱导的AKI,显著改善肾小管上皮细胞的增殖活性,抑制细胞的凋亡,而这可能与TMP能够通过PGC-1α途径抑制线粒体分裂,保护线粒体结构与功能并抑制ROS 的产生相关。本研究进一步揭示了TMP 保护Cis 诱导AKI 的相关机制,对TMP 成为降低Cis 化疗肾毒性的临床应用药物提供了支持与依据。
研究表明,Cis 可破坏线粒体动力学,导致线粒体过度分裂,大量产生的ROS 可致使细胞损伤甚至凋亡[1-3]。而补充抗氧化剂是一种有效改善Cis 诱导AKI的保护策略[18-19]。近年来关于TMP 生物活性的研究证实,TMP 在抑制氧化应激和维持线粒体功能方面具有显著作用。如在阿霉素诱导心脏毒性的研究中发现,TMP 可通过上调内皮细胞保护因子14-3-3-3 表达,抑制ROS 产生,降低死亡信号相关蛋白的表达和线粒体膜转换孔的开放,以改善线粒体功能,最终达到减轻阿霉素诱导的血管内皮损伤作用[20]。在造影剂引起的肾毒性研究中,TMP 能够抑制造影剂诱导的CCL2/CCR2 通路的激活,改善氧化应激和线粒体动力学的异常,并调节肾小管上皮细胞的自噬,从而发挥保护作用[21]。本研究结果同样表明,TMP能够改善Cis诱导的近端肾小管上皮细胞线粒体结构损伤与功能损伤,保护线粒体膜电位水平,并减少ROS 的产生。众所周知,细胞中线粒体数量与功能的维持不仅需要核基因的调控,还需要线粒体基因的复制和自身有序的融合与分裂活动的协调。近年来研究显示,氧化应激和细胞损伤与线粒体亢进有关。Drp-1是介导线粒体分裂的关键因子。在正常生理情况下,位于胞浆中的Drp-1 活性受到其丝氨酸磷酸化位点的调控,而Drp-1 的丝氨酸637(ser637)位点磷酸化可使Drp-1 的活性减弱,从而降低线粒体的分裂活动。当外源性应激发生时,Drp-1从胞质中招募至线粒体表明,通过与多种蛋白相互作用,诱导线粒体分裂的发生,而过度的线粒体分裂可导致ROS 的大量生成与释放[22-23],后者的累积可引起线粒体损伤的发生,导致线粒体膜电位的降低,并将线粒体中凋亡相关分子释放至胞质中,从而引发线粒体途径的细胞凋亡。为进一步明确线粒体分裂是否参与Cis 诱导的AKI,课题组对Cis 诱导的AKI小鼠肾组织进行透射电镜观察,并结合Cis处理的近端肾小管上皮细胞损伤模型的Mitotraker 染色的研究结果表明,TMP 可以升高Drp-1 的ser637 位点的磷酸化水平,降低Cis 诱导线粒体的分裂增加。这表明TMP 可通过作用于线粒体分裂调节线粒体动力学来改善Cis诱导AKI。
PGC-1α 不仅在线粒体正常形态结构的维持和线粒体分裂与融合等动力学稳态方面具有关键地位,同时还被证实在肾脏疾病的发生与进展过程中发挥重要作用[24-25]。在Cis 诱导的AKI 中,近端小管中的PGC-1α 缺乏被证明会加重肾小管损伤和肾功能障碍。促进PGC-1α表达的策略可以通过改善线粒体功能障碍来保护肾小管上皮细胞免受多种应激源的损伤[24]。如在肾缺血再灌注损伤中,抑制FOXO1 表达可通过cAMP 反应元件结合蛋白/PGC-1α 途径改善线粒体动力学稳态,维持其正常功能,从而加速肾缺血再灌注损伤的恢复[26]。在重铬酸钾诱导的AKI大鼠模型中,姜黄素可逆转重铬酸钾导致的PGC-1α表达降低,从而减少线粒体分裂,促进其融合,发挥保护肾脏的作用[27]。与上述文献结果一致,本研究也表明,在Cis诱导的AKI小鼠中,PGC-1α 在肾组织与HK-2细胞中的表达显著降低,而TMP 的处理可明显升高PGC-1α表达。同时,在TMP作用后的HK-2细胞也观察到,线粒体碎片化程度减轻,细胞中ROS 的产生和线粒体膜电位水平的降低被抑制,胞质中Drp-1 磷酸化水平升高。这表明,TMP 降低线粒体的分裂,维持线粒体的正常结构与功能可能与PGC-1α途径相关。
综上,本实验结果表明,TMP 可在体内外通过降低线粒体分裂与氧化应激保护Cis诱导AKI,而这可能与PGC-1α 途径相关。本研究进一步证实了TMP 在Cis诱导AKI中的保护作用,并初步揭示了其可能的作用机制,有望为TMP 的临床应用提供相关理论与实验室依据。

