胸腺肽α1对伴MVI的肝细胞癌患者解剖性肝切除术后免疫功能和预后的影响
钟平勇,刘欣,牟廷刚,卿明,谢飞
内江市第一人民医院 肝胆胰脾外科,四川 内江 641000
原发性肝癌作为一种常见的恶性肿瘤,其发病率和病死率在我国所有恶性肿瘤中分别排名第4 和第2,肝癌手术后5年的复发率也高达70%,严重威胁人民的生命健康[1]。解剖性肝段切除被认为是最符合肿瘤根治性原则,可降低局部复发,使肝癌患者获得良好预后的主要手术方式[2]。研究表明微血管侵犯(microvascular invasion,MVI)显著增加肝细胞癌(hepatocellular carcinoma,HCC)患者术后复发转移的风险[3-4]。HCC患者外周血细胞免疫功能低下,增加肿瘤细胞免疫逃逸而易致肿瘤复发转移或再发,严重影响患者长期预后[5-6]。因此,迫切需要对合并有高风险因素的肝癌患者术后辅助治疗方法进行研究,以延缓肿瘤复发,提高患者生存期。既往研究显示胸腺肽α1(thymosin α1,Tα1)可改善小HCC切除术患者的预后,但能否改善合并有MVI的HCC患者术后预后尚不清楚[5,7]。本研究对比分析了术后联合应用Tα1 治疗和术后常规治疗对伴有MVI的HCC患者解剖性肝切除术后免疫状态和预后的影响,现报道如下。
1 资料和方法
1.1 一般资料
回顾性分析2017年3 月至2021年6 月在内江市第一人民医院行解剖性肝切除的106例HCC患者的临床资料,术后病理报告镜下见MVI。其中男83例,女23 例;平均年龄(55.3±11.0)岁。所有患者均于术后1个月进行了预防性TACE治疗;合并有病毒性肝炎的患者接受了抗病毒治疗。根据术后是否联合应用Tα1,将患者分为Tα1 治疗组(Tα1 组,49例)和常规治疗组(常规组,57例)。本研究方案经医院伦理委员会批准(批号:2021-伦审批-19),获取患者及家属的知情同意。两组患者在年龄、性别、外周血中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、肝脏和肿瘤特征及手术指标等方面比较,差异无统计学意义(P>0.05),具有可比性,见表1。
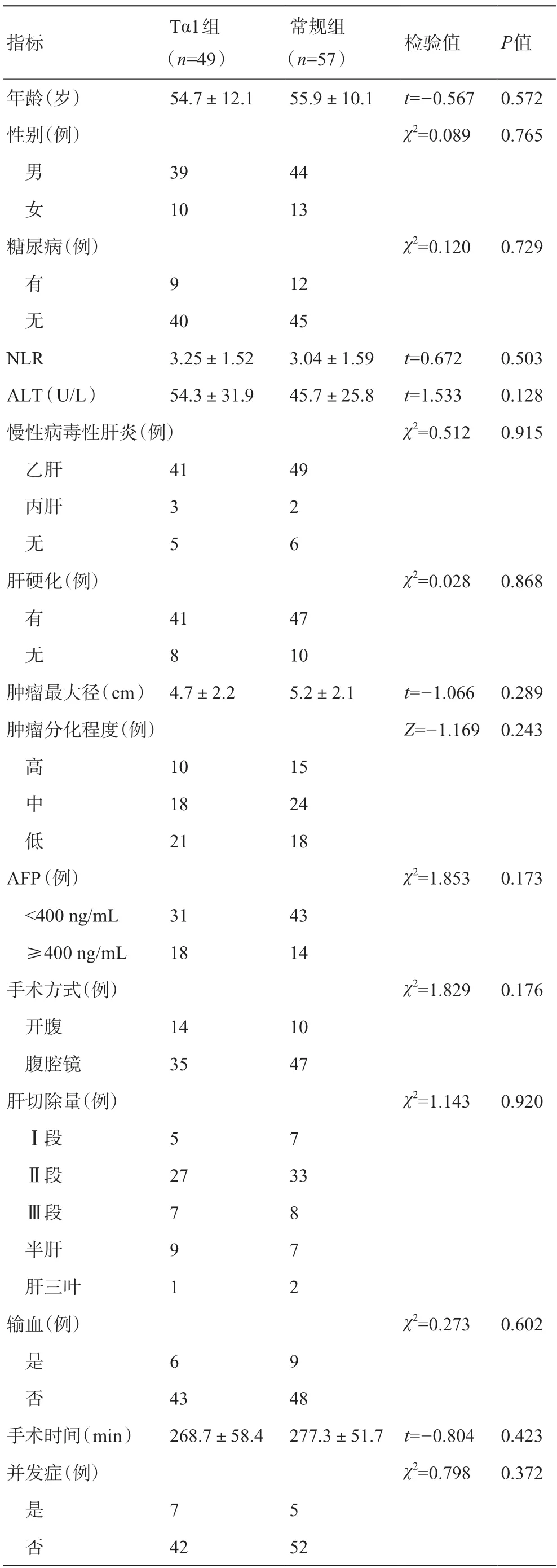
表1 Tα1组和常规组患者术前一般资料比较
1.2 病例纳入与排除标准
纳入标准:(1)手术方式为解剖性肝切除;(2)病理诊断为原发孤立性HCC,切缘阴性(R0 切除),显微镜下检查有MVI,但无大血管侵犯或远处转移;(3)肝功能良好,Child-Pugh A级;(4)术后接受了1次预防性TACE治疗;(5)本次为HCC初始治疗。排除标准:(1)合并肝外恶性肿瘤;(2)合并自身免疫性疾病或人类免疫缺陷病毒(HIV)抗体阳性;(3)伴有白细胞减少的脾功能亢进;(4)术前接受过肝切除术、TACE治疗、消融治疗、免疫治疗或肝移植术;(5)术前及术后随访期间,有临床证据表明合并有感染;(6)应用免疫抑制剂;(7)术后除应用TACE药物、Tα1外,使用了其他抗肿瘤药物。
1.3 手术方法
对所有患者均实施了解剖性肝段或联合肝段切除术。患者全身麻醉,取平卧位或右侧垫高体位,开腹手术患者采用右上腹部“反L型”切口,腹腔镜手术者采用传统五孔法。探查腹腔,离断肝周韧带,解剖第一肝门,降低肝门板,Glisson蒂肝蒂鞘外解剖法游离出目标肝段或肝叶所属的Glisson蒂,部分患者需劈开肝脏实质后显露。预置阻断带选择性阻断入肝血流,标记缺血线,结合术中超声标记肝静脉走行,确立肝表面切除线。开腹者术中经门静脉属支注射美蓝染色目标肝段,腹腔镜手术者采用吲哚菁绿正染或反染的方式确立个体化的切除界面。切肝时采用传统血管钳钳夹法或超声刀小口蚕食由浅入深离断肝实质,在目标肝段或肝叶门静脉根部离断肝蒂。切肝全过程显露并遵循肝静脉解剖标志。对小于3 mm的脉管予以电刀或超声刀凝闭后直接离断;大于3 mm的脉管予以丝线结扎或动脉夹夹闭后离断。完整切除包括肿瘤在内的目标肝段或肝叶,检查肝断面无渗血及胆漏后,经肝断面或温氏孔放置1~2根腹腔引流管。术后按快速康复外科原则管理。
1.4 Tα1的应用
Tα1 组患者出院后第1 周开始皮下注射Tα1 1.6 mg,每周2 次,持续6 个月;常规组患者术后未应用Tα1。
1.5 观察指标
随访方式为每个月门诊随访或电话随访1 次。所有患者术后每1~3 个月根据病情需要选择彩超、增强CT或增强MRI检查及血液学检验。随访截止至术后2年或肿瘤复发、失访。观察并比较两组患者术前及术后1、3、6个月外周血T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+细胞)数量百分比和外周血NLR变化;比较两组患者术后1 年复发率和无复发生存率情况。肿瘤复发评判标准遵循中国《原发性肝癌诊疗规范(2019年版)》[8]。
1.6 统计学分析
采用SPSS 26.0软件分析数据。对计量资料进行Shapiro-Wilk正态性检验,符合正态分布的计量资料以()表示,采用t检验,重复测量资料采用方差分析。计数资料采用χ2检验或Fisher确切概率法检验;等级资料比较用秩和检验。无复发生存率分析采用Kaplan-Meier法评估,并绘制无复发生存曲线,以Log-rank进行检验;用Cox比例风险回归模型评估HCC术后复发的预后影响因素。P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者外周血T淋巴细胞亚群数量百分比变化
数据采用重复测量方差分析。术前Tα1 组与常规组的T淋巴细胞亚群数量比较差异无统计学意义(P>0.05)。Tα1组CD3+、CD4+、CD4+/CD8+在术后1、3、6个月均显著高于常规组(P<0.05);两组术后CD8+比较差异无统计学意义(P=0.426)。Tα1组在术后1、3、6 个月时,CD3+、CD4+、CD4+/CD8+水平均显著高于术前(P<0.05),CD8+水平明显低于术前(P<0.05)。常规组在术后6个月时,CD3+、CD4+水平显著高于术前(P<0.05),CD8+水平明显低于术前(P<0.05);CD4+/CD8+水平在术后3、6个月时明显高于术前(P<0.05)。详见表2。

表2 Tα1组和常规组患者外周血T淋巴细胞亚群变化
2.2 两组患者外周血NLR变化
Tα1组患者的NLR在术后1、3、6个月下降率均明显高于常规组,差异有统计学意义(P<0.05),见表3。

表3 Tα1组和常规组患者术后NLR变化[例(%)]
2.3 两组患者术后肿瘤复发情况
本研究中,受试者术后随访时间为5~24个月,中位随访时间18 个月。随访期间Tα1 组患者有3 例失访,常规组有2例失访。Tα1组术后1年肿瘤复发率为18.4%,常规组为26.3%,差异无统计学意义(χ2=0.950,P=0.330)。Tα1 组术后无复发生存率明显优于常规组(χ2=4.348,P=0.037),见图1。
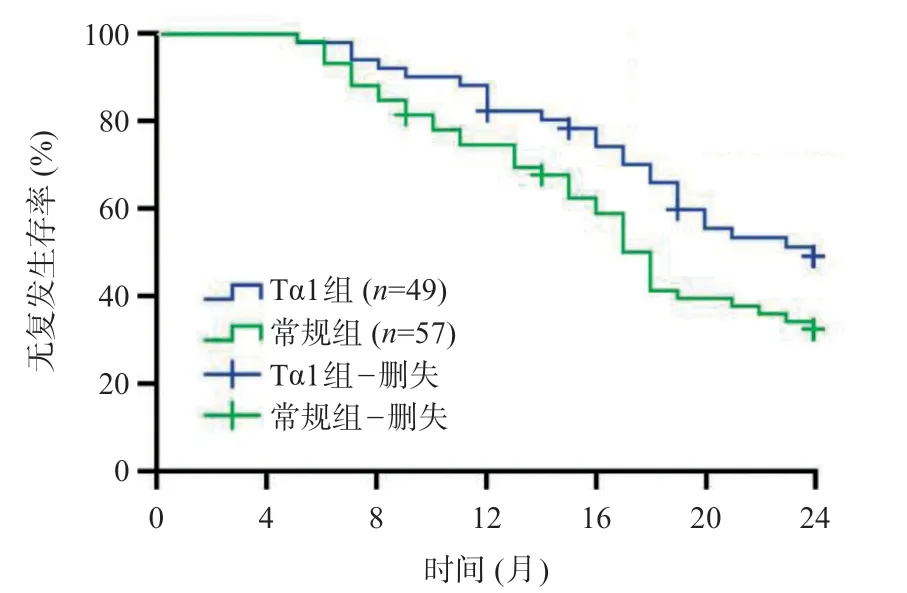
图1 Tα1组和常规组Kaplan-Meier无复发生存曲线
2.4 单因素及多因素Cox回归分析
在单因素分析中,NLR下降、肝硬化、肿瘤分化程度、AFP水平及是否术后联合应用Tα1 可能是影响HCC术后复发的相关因素(P<0.05)。将这5个相关因素纳入Cox比例风险回归模型,多因素Cox逐步回归结果显示,NLR下降、肝硬化、肿瘤分化程度、术后是否联合应用Tα1是显著影响HCC患者术后复发的独立危险因素(P<0.05),详见表4。

表4 影响HCC患者术后复发的因素分析
3 讨论
HCC肿瘤恶性程度较高,不仅降低患者生活质量、危及生命,也给患者家庭及社会带来巨大的经济负担。根治性切除术已被广泛接受并作为可切除HCC的标准治疗手段,尽管如此,HCC术后复发率仍高达70%;尤其是合并MVI、卫星灶、肿瘤低分化等早期复发危险因素的HCC,常在术后2 年内发生肿瘤复发[9-10]。研究表明,MVI是肝癌术后复发风险的独立危险因素,也是指导术后抗肿瘤复发治疗的重要病理学特征[10]。MVI增加肝癌的恶性程度及术后微小转移,导致预后不良[4,11-12]。在精准肝脏外科时代,随着解剖性肝段切除关键技术的应用,实现了手术的“3M”目标[13-14],同时清除了肿瘤主病灶和肝段内微小转移灶,因此患者的无复发生存率和长期预后得以提升[15-16]。
肝癌患者免疫功能受抑,表现为外周血T 淋巴细胞亚群中CD3+、CD4+细胞数量下降,抑制性CD8+细胞数量增加,CD4+/CD8+比例下调;围手术期的手术创伤、失血、炎症反应等各种应激又对免疫产生抑制作用,进一步损害了患者的免疫力[17-18]。肿瘤复发还与肿瘤炎性微环境密切相关。NLR是中性粒细胞与淋巴细胞的比值,反映了促肿瘤炎症反应与抗肿瘤免疫反应二者之间的拮抗状态,比值增高时提示炎性反应增强而机体免疫力减弱,常作为预后不良的监测指标之一[19-20]。若肝癌患者机体免疫功能持续受抑制,促肿瘤炎症反应增强,则HCC术后复发率将增加。因此,尽早提升HCC患者切除术后的免疫力并控制炎症,有助于延缓肿瘤复发,提高远期生存[21]。
对存在高危复发因素的肝癌患者,术后预防性TACE治疗得到广泛推荐,但TACE带来的炎性反应和化疗药物所致的免疫损伤不可被忽视[22]。本研究利用解剖性肝切除的优势,在术后预防性TACE治疗的基础上联合应用Tα1,调节免疫功能,以期进一步延迟或减少HCC复发。Tα1 是一种临床常用的传统非特异性免疫调节治疗药物,通过促进T淋巴细胞向CD3+、CD4+、CD8+细胞亚群转化,增强抗原递呈等多机制实现对肿瘤炎症和免疫功能的调节[23]。本研究结果显示,术后应用了Tα1 之后,HCC患者外周血T细胞亚群数量百分比得到改善,NLR持续降低,术后肿瘤炎症反应减轻。从患者生存预后来看,虽然两组HCC患者术后1年复发率差异无统计学意义,但Tα1组术后无复发生存率更优。多因素Cox分析显示,肝切除术后联合应用Tα1 是影响HCC患者术后复发的独立预后因素之一。
综上所述,Tα1可以通过调节炎症和免疫状态,提高伴有MVI的HCC患者在解剖性肝切除术后的无复发生存率,使患者生存预后获益。该结果有待前瞻性、大样本、多中心的研究来进一步验证。