福建省典型亚热带森林土壤细菌群落结构特征
顾亚宁,吴琳芳,林德宝,邹秉章,王思荣,周鲁宏,贺纪正
(1.福建师范大学地理科学学院,福建 福州 350117;2.福建师范大学湿润亚热带山地生态国家重点实验室培育基地,福建 福州 350117;3.福建省上杭白砂国有林场,福建 上杭 364205)
识别植被变化条件下土壤微生物的多样性和群落组成是理解植被-微生物-土壤反馈的基础。细菌是土壤中最丰富且分布最广的微生物类群,在地球生物化学循环和物质转换等地下生态过程中发挥核心作用[1]。土壤细菌生命活动所需的能量主要来自地上凋落物和地下根系分泌物[2]。植被的变化可影响土壤细菌的多样性、群落组成和生活策略,形成植物-土壤细菌反馈体系[3-4]。因此,土壤细菌的多样性及群落组成可作为反映森林转换和土壤健康的敏感性指标[5]。
提高森林覆盖率和森林质量被认为是缓解气候变化,提升森林碳汇功能的重要手段[6]。亚热带是我国最重要的人工林产区,占我国人工林总面积的65%以上。马尾松(Pinusmassoniana)是本区域重要的造林树种[7]。当前的纯林面临着生物多样性丧失、土壤退化和对病虫害抵抗力下降等生态风险[8]。相比纯林,混交林往往具有更高的生物多样性、生物量、土壤肥力和抵抗力,可提供更多样化的生态服务和森林产品[6,9-10]。因此,利用本土阔叶树种进行混交被认为是改善马尾松人工林的最有效方式[5,11]。有研究表明地上植物性状和地下土壤微生物群落特征具有相互依赖性,树种特征驱动土壤微生物群落变化[1]。树种丰富度增加会对土壤微生物群落多样性和结构产生一定影响[12]。森林类型转换以及树种多样性增加会显著改变地上生产力、土壤养分或土壤微环境,从而改变土壤微生物多样性和群落组成[13]。然而,从土壤微生物角度评估混交林和纯林土壤健康的差异依然十分匮乏,且结论存在差异[14]。如梁艳等[5]发现,亚热带马尾松人工林与针阔混交林的土壤细菌群落结构相似,但多样性和生物代谢通路功能显著高于阔叶纯林;丁国昌等[15]发现亚热带杉木林转换为黑木相思林后,表层土壤中革兰氏阳性、阴性菌和放线菌的丰度显著增加;杨世福等[16]发现从马尾松林演替为针阔混交林过程中,土壤细菌群落发生显著变化:酸杆菌门(Acidobacteriota)和浮霉菌门(Planctomycetota)的相对丰度显著增加,绿弯菌门(Chloroflexi)的相对丰度呈降低趋势,暗示群落养分策略由R策略者转变为K策略者细菌占优势。土壤微生物参与土壤碳循环、调控土壤养分循环、改善土壤环境,土壤微生物对于维持土壤健康具有重要意义[17]。朱永官等[18]认为土壤健康由土壤物理化学以及生物指标共同综合评估,其中的微生物指标因为其繁殖周期短对环境的变化更为敏感等多种优点,是综合诊断土壤健康的理想标志物,纯林和混交林的土壤健康是否达到天然次生林水平已经成为热点问题[19]。利用土壤微生物评价纯林、混交林以及天然次生林土壤健康标准可为亚热带森林可持续发展提供重要理论依据。此外,土壤具有高度的空间异质性,理化性质的垂直变化会影响土壤微生物的群落结构[19]。目前对于土壤微生物的研究大多数集中在20 cm的表层土壤,对更深层土壤微生物群落组成的研究非常匮乏。
本文以我国亚热带典型马尾松纯林、马尾松阔叶混交林、阔叶混交林和天然次生林为研究对象,分层采集(0~10 cm)和(30~50 cm)土壤进行16S高通量测序,阐明天然林、人工纯林和混交林中不同深度土壤细菌分类多样性和群落组成差异;并进一步识别影响细菌多样性和优势类群的因素,以期从土壤微生物角度评估森林混交改造对土壤健康和生态功能的影响,为亚热带人工林树种选择和马尾松纯林改造提供科学指导。
1 研究区和研究方法
1.1 研究区概况
研究区位于福建省龙岩市上杭县白砂国有林场(25°04′-25°15′ N,116°30′ -116°38′ E)[20]。研究区为中亚热带季风气候,年平均气温为20.1 ℃,年平均降水量1 600 mm,海拔400~800 m。土壤主要为花岗岩发育而成的红壤。2021年6月,选取典型的20年生马尾松成熟林(PM)、40年生马尾松过熟林(PO)、30年生马尾松阔叶混交林(PB)、20年生阔叶混交林(BM)和40年生天然次生林(SF)[20]。人工林由林场统一经营管理:马尾松成熟林与马尾松过熟林均为马尾松纯林;马尾松阔叶混交林补种4年阔叶树种,优势种为马尾松(P.massoniana)、米老排(Mytilarialaosensis)、火力楠(Micheliamacclurei)、枫香(Liquidambarformosana)等;阔叶混交林优势树种为米老排(M.laosensis)、火力楠(M.macclurei)、枫香(L.formosana)等;天然林优势树种为木荷(Schimasuperba)、赤楠(Syzygiumbuxifolium)和毛冬青(Ilexpubescens)等[11]。
每个森林类型设置3个样地,每个样地建立3个20 m×20 m样方。为减少异质性,在每个样方中分层采取9钻表层(0~10 cm)和深层土壤(30~50 cm),并混匀作为样方代表土壤样品[20]。收集每个样方中的凋落物。将混合土壤样品过2 mm筛,挑去根系及砾石,根据实验指标需求对混合土样保存于-80、4 ℃以及阴凉处风干,用于后续的微生物高通量测序、微生物生物量和其他土壤理化性质测定。
1.2 土壤微生物总DNA的提取、高通量测序和生物信息学分析
土壤总DNA采用Fast DNA Spin Kit试剂盒(MP Biomedicals,LLC,USA)按照说明手册的操作步骤进行提取。将提取的DNA用NanoDrop分光光度计(Thermo Fisher Scientific,Waltham,USA)和1%琼脂糖凝胶电泳检测DNA的浓度和质量。选取通用引物515F/907R,利用PCR扩增技术对细菌V4-V5区进行扩增。在Illumina MiSeq平台上进行测序。对原始测序序列进行拼接、质控和过滤,后使用UPARSE软件在99%相似度下对优化序列进行聚类,使用DADA2插件进行降噪处理后获得扩增子测序变体(ASVs)序列。代表性序列与Silva数据库对比注释用于后续分析[21]。
1.3 土壤基本理化性质的测定
土壤含水量利用烘干法测定。利用pH计(FE20-FiveEasyTMpH,MettlerToledo,German)对土壤悬浊液测定pH值。利用碳氮元素分析仪(VarioMAX,Elementar,Germany)测定总碳和总氮含量。使用流动分析仪(San++ System,Skalar,Holland)测定土壤硝态氮、铵态氮和速效磷含量[22-23]。采用氯仿熏蒸法测定微生物生物量碳氮磷[24],并使用岛津碳氮分析仪(TOC Vcph,Shimadzu,Kyoto Japan)测定可溶性有机碳。土壤粒径使用激光衍射粒度分析仪(Mastersizer 3000,Malvern,England)测定。
1.4 统计分析
计算Chao 1指数、Shannon指数和系统发育多样性指数来指示细菌alpha多样性。采用双因素方差来检验森林类型和土壤深度对微生物多样性的显著影响。采用Kruskal-WallisH检验进一步评估细菌优势门的组成差异。利用主坐标分析(PCoA)检验不同土壤深度中细菌群落组成在不同森林类型中的显著差异。此外,利用相关分析和随机森林模型来检验细菌多样性及优势细菌类型与凋落物和土壤生物物理化学因子间的关系。
2 结果
2.1 不同森林类型中表层和深层土壤细菌物种组成
对不同林型土壤样品进行16S rRNA高通量测序,经过质量修整和去除嵌合体后,得到12 595个细菌ASVs,聚类为33门,92纲,196目,308科,510属,924种。表层土壤中,相对丰度最高的优势菌门为酸杆菌门(Acidobacteriota:37.84%±0.03)、变形菌门(Proteobacteria:35.33%±0.02)、浮霉菌门(Planctomycetota:9.5%±0.02)以及放线菌门(Actinobacteriota:7.07%±0.01);类似地,深层土壤中相对丰度最高的为酸杆菌门(32.38%±0.01)、变形菌门(30.98%±0.03)、浮霉菌门(11.2%±0.02)以及绿弯菌门(Chloroflexi:10.71%±0.02)(见图1)。Kruskal-WallisH分析结果表明,酸杆菌门、变形菌门和浮霉菌门相对丰度在不同森林类型中有显著差异(表1)。在表层土壤中,酸杆菌门的相对丰度在阔叶混交林中最低(33.92%),而在马尾松过熟林和天然次生林较高,分别为40.82%和39.02%。表层土壤中变形菌门的相对丰度在天然次生林中最高,在马尾松过熟林中最低,分别为36.98%和32.42%;而在深层土壤中,其相对丰度在阔叶混交林中最低,为24.62%。在不同土壤深度中,浮霉菌门相对丰度均表现为在天然次生林中最高,在马尾松阔叶混交林中最低。

表1 Kruskal-Wallis H检验结果显示不同森林中主要细菌优势门的差异Tab.1 Results of Kruskal Wallis H test showing the difference of main bacterial phyla in different forests
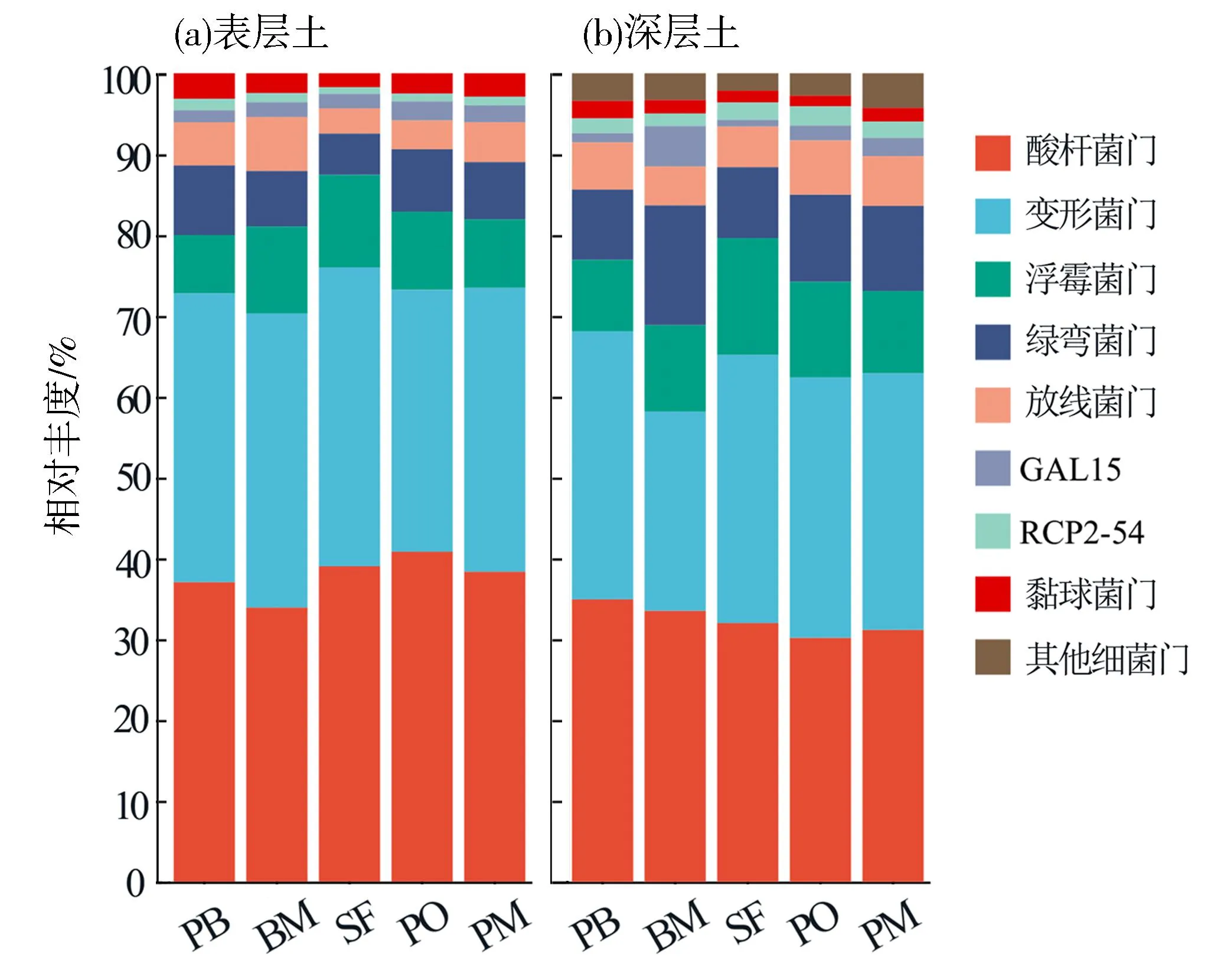
PB:马尾松阔叶混交林;BM:阔叶混交林;SF:天然次生林;PO:马尾松过熟林;PM:马尾松成熟林;n=9。图1 不同森林类型中细菌优势物种的相对丰度(门水平)Fig.1 Relative abundance of dominant bacterial phyla in different forest types(phylum level)
2.2 不同森林类型中表层和深层土壤细菌多样性指数
本研究以Chao1、Shannon指数以及谱系多样性指数来表征细菌alpha多样性。双因素方差分析结果表明,森林类型对Shannon指数以及谱系多样性指数存在显著影响(P<0.05),土壤深度则显著影响Chao1指数(P<0.05)(见图2)。

(a)Chao 1指数;(b)Shannon指数;(c)谱系多样性指数(Pd)。BM:阔叶混交林;PM:马尾松成熟林;PO:马尾松过熟林;PB:马尾松阔叶混交林;SF:天然次生林。*P<0.05;nsP> 0.05;n=9。 图2 不同森林类型之间土壤细菌群落的alpha多样性Fig.2 Alpha diversity of soil bacterial communities in different forest types
2.3 不同森林类型中表层和深层土壤细菌的群落组成分布
利用PCoA来研究不同森林类型间细菌群落组成的相似性或相异性(图3)。同一森林类型内土壤细菌群落有很好的相似性,不同森林类型间有较高的相异性。分析结果表明,在表层土壤中PCoA的两个维度分别解释了25.88%与9.53%的变异(R=0.85,P=0.001)。主坐标轴1可将马尾松纯林与其他森林类型分开,阔叶混交林和天然次生林的细菌群落较为相似。在深层土壤中前两轴分别解释了17.36%与11.39%的变异(R=0.61,P=0.001)。与表层土壤不同的是,马尾松阔叶混交林与天然次生林的细菌群落更为相似(见图3)。马尾松混交林和天然次生林的组内变异略大。
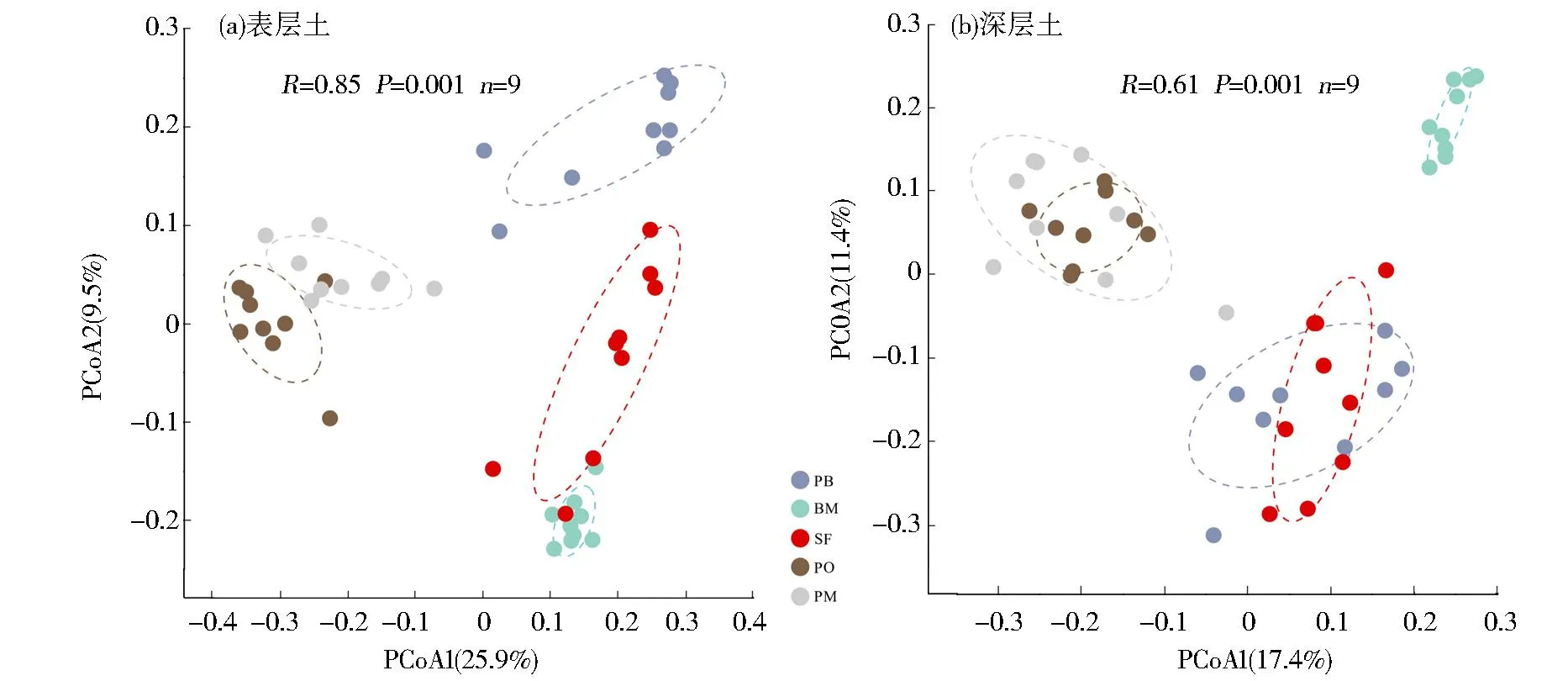
(a)表层土壤;(b)深层土壤。BM:阔叶混交林;PM:马尾松成熟林;PO:马尾松过熟林;PB:马尾松阔叶混交林;SF:天然次生林。图3 不同森林类型间土壤细菌群落的主坐标分析结果Fig.3 Principal coordinate analysis of soil bacterial communities in different forest types
2.4 土壤细菌群落的优势类群及alpha多样性指数的主要影响因素
表层土壤中酸杆菌门、拟杆菌门、RCP2-54、WPS-2与土壤pH值显著负相关,变形菌门、浮霉菌门与土壤pH值显著正相关(P<0.01),但在深层土壤中只有黏球菌门、RCP2-54与土壤pH值显著相关(P<0.01)。表明不同土壤深度主要优势细菌门与pH值关系有所差异。深层土壤中变形菌门、浮霉菌门与凋落物碳氮比显著负相关(P<0.01),绿弯菌门则相反。同时,绿弯菌门在表层土壤和深层土壤中均与土壤氮含量显著负相关,这表明其可能为贫营养菌群(见图4)。深层土壤中,酸杆菌门、变形菌门与土壤总碳呈显著正相关(P<0.05),变形菌门、浮霉菌门均与土壤总氮显著正相关(P<0.05);在表层土壤中速效磷与变形菌门、浮霉菌门呈显著负相关、放线菌门、绿弯菌门呈现显著正相关(P<0.05)。硝态氮与浮霉菌门和放线菌门也存在相关性(P<0.05)。而不论表层和深层土壤中浮霉菌门均与硝态氮显著负相关(见图4)。类似地,随机森林模型的结果也表明微生物生物量碳含量(MBC)和土壤pH分别是影响表层和深层土壤细菌Shannon指数最重要的理化因素(见图5)。此外,凋落物的碳氮比也显著影响土壤细菌的多样性。
3 讨论
3.1 亚热带典型森林中土壤细菌的优势类群和多样性
本研究中土壤优势细菌类群与前人报道一致。马翠霞[25]研究发现在毛竹人工林,杉木人工林以及阔叶林中土壤优势细菌门也为酸杆菌门、变形菌门、绿弯菌门和放线菌门,且研究中的人工林与天然林之间微生物群落组成存在差异。类似地,陈进等[26]对黔中马尾松林0~20 cm土壤的调查结果也表明,变形菌门、放线菌门和酸杆菌门为优势类群。研究结果表明,表层和深层土壤中优势的3个细菌类群的相对丰度均受到森林类型的显著影响(图1,表1,P<0.05)。一般来说,酸杆菌门为嗜酸的寡营养细菌,对较贫瘠和酸性的土壤有较强的适应性[27];变形菌门具有固碳、固氮和解磷等生态功能,参与养分矿化,可加速土壤有机质的分解[28];浮霉菌门是促进植物生长的关键细菌类群,其常与植物根际相关,在营养循环或病原体控制中发挥关键作用[29]。森林类型对土壤细菌优势门的显著影响暗示,在森林类型转换过程中,细菌参与的土壤碳矿化和养分循环发生显著变化。由于研究区土壤呈显著酸性且相对贫瘠,因此,嗜酸且耐贫营养的酸杆菌门相对丰度优势显著,这一推论也由其相对丰度分别与pH值和MBC含量极显著相关(P<0.001)来支持(图4)。
依据互补假说,多样的树种组合往往伴随着凋落物和根系分泌物数量和质量以及土壤微环境的高度异质性,可为土壤细菌提供更加多元化的生态位[30]。因此,很多研究表明,相比人工纯林,树种多样性增加或树种混交会显著促进土壤细菌多样性[4]。森林类型对土壤细菌Shannon多样性指数和谱系多样性指数有显著影响,符合互补假说。但森林类型对细菌丰富度无显著影响(图2),这与宋战超等[12]对广西混交人工实验林、Chen等[28]对湖南大山冲森林公园以及Lei等[31]对杉木人工林转化为混交林后的研究结果类似。这可能归因于微生物多样性的改变取决于某种特定植物的特征而不是植物多样性[12,32]。此外,研究样地转换时间较短,土壤细菌对原始土壤条件具有一定适应性,对土壤养分利用存在一定的偏好性。在评估森林转换的生态效应时,应将深层土壤纳入考虑。
3.2 亚热带典型森林中土壤细菌的群落组成差异
细菌群落组成指示着细菌的群落动态和生态功能。研究的PCoA结果显示,不同林龄的马尾松纯林土壤细菌群落相近,且第一轴将纯林与混交林和天然林分开。天然林与阔叶混交林表层土壤的细菌群落组成更为相近,而在深层土壤中,天然林与马尾松阔叶混交林土壤细菌群落组成更为相似(图3),这与以往的研究结果类似。Chen等[28]基于大山冲森林公园的研究发现,亚热带乔木群落距离与土壤细菌β多样性显著正相关,暗示树种组成对土壤细菌组成的影响强于树种丰富度。类似地,对亚热带森林研究表明,树种丰富度增加会增加变形菌门和放线菌门的相对丰度,反而降低酸杆菌门的相对丰度[33],并推测这是由于树种混交改善凋落物的质量,通过养分获得性来间接调节不同养分获取策略菌群的相对比例。研究结果表明,构建混交林在一定程度上可改善纯林微生物类型,可将土壤细菌群落调整至天然次生林水平。
3.3 土壤微生物优势菌群和多样性的影响因素
森林混交可通过调节土壤凋落物以及根系的数量和质量以及土壤理化性质来调节土壤微生物的群落组成和功能[12]。对全球尺度以及中国东部森林的研究表明,土壤pH值是影响细菌生态位分化和群落组成最重要的驱动因子[34-35]。此前的meta分析也表明植被组成是通过调节土壤pH间接影响土壤微生物多样性和群落结构,而非通过植物多样性[36]。据报道,酸杆菌门和放线菌门的相对丰度与土壤pH值显著负相关[7];绿弯菌门和WPS-2类群的相对丰度在贫瘠土壤中较高[37-38],这些研究结果暗示了这些类群适应低pH和贫瘠的生境,这与本研究中这些类群相对丰度与土壤pH值以及氮含量的显著负相关关系一致(图4)。类似地,放线菌门主要与硝态氮、速效磷和MBC含量显著正相关,暗示了研究区内放线菌门采用富营养养分策略,这也与曹升等[39]对南平亚热带杉木林中放线菌与有机质的协同关系一致。此外,本研究中的随机森林模型发现,土壤细菌alpha多样性主要受土壤pH值和凋落物养分调控,这与南亚热带混交人工林中pH和氮含量驱动力结果一致[12]。同样地,Lei等[31]发现土壤pH值和土壤有机质显著影响土壤细菌群落,强调了利用调节树种来进行近自然森林修复是通过调节土壤pH值和养分含量来间接调节根际的土壤细菌组成。
4 结论
亚热带主要森林土壤细菌主要类群为酸杆菌门、变形菌门、浮霉菌门和绿弯菌门。酸杆菌门、变形菌门和浮霉菌的相对丰度受到森林类型的显著影响。森林类型对土壤细菌丰富度Chao1指数无显著影响,但是显著影响土壤细菌Shannon指数和群落组成,暗示了森林类型转换显著影响土壤细菌的组成而非细菌丰富度,且对群落组成的影响在不同深度中有所不同。土壤pH值和养分含量是影响关键细菌类群和多样性的重要影响因素。研究结果为亚热带区域优化组配树种来提升地下生物多样性和生态系统功能的经营策略提供科学依据。土壤健康受到地上地下多种因素的共同作用,在后续的研究中要综合森林的微地形、植被生物量和覆盖度等多种数据,更加深层次、全面地阐明森林转换影响土壤健康的相关机制。

