小果蔷薇不同采收时期叶和茎中主要活性成分的变化
周瑶瑶,张晓元 ,陈 雄,罗韶刚,曾令杰
(1.广东药科大学中药学院,广东广州 510006;2.韶关市华工高新技术产业研究院,广东韶关 512027;3.华南理工大学工业技术研究总院,广东广州 510640)
小果蔷薇为蔷薇科蔷薇属(Rosa cymosaTratt.)的植物,别名小金樱、金樱根、倒钩簕、红荆藤、山木香等[1]。在我国广泛分布,其资源非常丰富[2]。小果蔷薇具有很高的药用价值,可用于治疗创伤、止泻、萎缩性胃炎、子宫脱垂等[3-7],同时,小果蔷薇也具有一定食用价值,被开发用于健脾开胃的甜酒曲、米酒酒曲等[8],其果实被广泛用于保健品的天然植物果实,其富含维生素、还原糖、粗蛋白和几种矿质元素,具有很高的营养价值[9],可熬糖、制汁等[10],在一些藏民族等地区常被使用制作成果酱。
通常,植物因受到外界环境等因素的影响,体内会产生和积累一些具有生物活性的次生代谢产物,而这些产物会表现出一定的变化[11]。已有研究发现,药用植物体内产生的二次代谢产物随着生长年限的增长,其含量会出现一定程度的波动[12-14]。从小果蔷薇分离得到的最多的化合物为三萜类有机酸,其次是糖苷类化合物[15-19]。目前,在实际生产过程中,每年对小果蔷薇采收至少在3 次以上,但对于小果蔷薇的采收时期及采收部位,各地区都不一样,没有统一标准。因此,不同的采收时期会影响小果蔷薇叶和茎活性成分的种类和含量,进而影响其质量。为了更好地开发、利用小果蔷薇资源,有必要了解生长过程中所含成分的变化规律,为此,本研究对不同采收时期小果蔷薇叶和茎中总多糖、总有机酸和鞣花酸的含量进行了动态观察与分析,旨在为小果蔷薇最佳采收期的确定提供实验数据。
1 材料与方法
1.1 材料与仪器
小果蔷薇样品 采自广东省韶关市武江区龙归镇野生环境,经华南理工大学张晓元教授鉴定为蔷薇科蔷薇属植物(Rosa cymosaTratt.),其采收时间为2021 年2 月25 日~12 月25 日,每月采样1 次,每次采样2 批,每批样品2 kg(以鲜品计),采收后茎和叶一起阴干,阴干后分离茎和叶,粉碎,过三号筛,样品信息见表1;鞣花酸 坛墨质检科技股份有限公司;熊果酸 成都曼斯特生物科技有限公司;无水葡萄糖、苯酚 天津市大茂化学试剂厂;无水乙醇 湖南汇虹试剂有限公司;甲醇 西陇科学股份有限公司;香草醛 上海展云化工有限公司;高氯酸 广州化学试剂有限公司;冰醋酸 西陇科学股份有限公司;硫酸 西陇科学股份有限公司;娃哈哈纯水 市售。LC-16 型高效液相色谱仪 岛津仪器苏州有限公司;UV-9000S 型紫外可见分光光度计 上海元析有限公司;SPD-M20A 型二极管阵列检测器 岛津仪器苏州有限公司,BSA224S 型分析天平 赛多利斯;GL-20M 型高速冷冻离心机 长沙易达仪器有限公司;HHS-11-4 型电热恒温水浴锅 上海博迅实业有限公司;SB25-12DTD 型超声波清洗机 宁波新芝生物科技有限公司;YB-4500A 型多功能粉碎机永康速峰工贸有限公司。

表1 小果蔷薇样品信息Table 1 Sample information of Rosa cymosa Tratt.
1.2 实验方法
1.2.1 总多糖含量的测定 参照管美玉等[20]方法,取样品粉末(过三号筛)1 g,精密称定,置圆底烧瓶中,加水200 mL,加热回流2 h,放冷后至250 mL 的量瓶中,用少量水洗涤4 次,洗液合并,加水至刻度,摇匀,滤过,精密量取10 mL,加无水乙醇25 mL,摇匀,冷藏1 h,取出,离心(4000 r/min)20 min,弃去上清液(必要时滤过),沉淀加热水溶解,转移至25 mL量瓶中,放冷,加水至刻度,摇匀,即得,备用。
精密量取样液1 mL,分别加5%苯酚溶液1 mL,混匀,迅速加入硫酸5 mL,摇匀,于100 ℃水浴中加热20 min,置冰水浴中5 min,取出,在488 nm 波长处测定吸光度,结果以葡萄糖(mg·g-1)表示。
1.2.2 总有机酸含量的测定 参照邵峰等[21]方法。称取样品粉末1.0 g,精密称定,置具塞锥形瓶中,加无水乙醇50 mL,摇匀,超声(40 kW,500 Hz)1 h,离心(6000 r/min)15 min,取上清液作为供试品溶液备用。
精密量取0.1 mL 供试品溶液于10 mL 试管中,置于100 ℃的水浴中,分别加5%香草醛-冰醋酸溶液0.3 mL,混匀,迅速加入高氯酸1.0 mL,摇匀,于60 ℃水浴中,取出,置冰水浴中5 min,加入5.0 mL 冰醋酸,混匀,室温放置10 min,取出,在波长550 nm 处测定吸光度,结果以熊果酸(mg·g-1)表示。
1.2.3 鞣花酸含量的测定
1.2.3.1 样品制备 称取样品1.0 g,精密称定,置具塞锥形瓶中,精密量取75%甲醇50 mL,摇匀,超声处理(40 kW,500 Hz)30 min,混匀,离心(6000 r/min)15 min,精密量取上清液0.5 mL,加75%甲醇定容至1 mL 容量瓶中,混匀,作为供试品溶液备用。
色谱柱选择:色谱柱:SunFire C18(250 mm×4.6 mm,5 μm)。
洗脱程序:流动相为以乙腈-0.2%磷酸溶液(15:85)为流动相;流速:1.0 mL/min;柱温:35 ℃;进样量为10 μL;检测波长为254 nm。
1.2.3.2 线性关系考察 精密量取鞣花酸对照品溶液,用甲醇溶解配制成质量浓度分别为50、20、10、5、1 μg/mL 的标准曲线溶液,按照色谱条件“1.2.3.1”项下依次进样,记录色谱峰面积。以峰面积(Y)为纵坐标,对照品质量浓度(X)为横坐标,绘制标准曲线。
1.2.3.3 精密度试验 取对照品溶液,按“1.2.3.1”项下色谱条件连续测定6 次,记录鞣花酸成分的峰面积,计算RSD。
1.2.3.4 重复性试验 取同一批采收时期的小果蔷薇叶和茎样品6 份,按“1.2.3.1”项下方法制备6 份供试品溶液,按“1.2.3.1”项下色谱条件测定,记录峰面积,计算小果蔷薇叶和茎中鞣花酸含量的RSD。
1.2.3.5 稳定性试验 取同一采收时期的小果蔷薇叶和茎样品,按“1.2.3.1”项下方法制备供试品供试品溶液,分别于0、2、8、12、24、36 h 按“1.2.3.1”项下色谱条件测定,记录峰面积,计算小果蔷薇叶和茎中鞣花酸峰面积的RSD。
1.2.3.6 加样回收率试验 取已知含量的小果蔷薇叶和小果蔷薇茎,分别加入一定量的鞣花酸对照品溶液,按“1.2.3.1”项下制成供试品溶液,在“1.2.3.1”项下色谱条件进行进样测定,计算加样回收率和RSD。
1.3 数据处理
所有数据平行测定三次,结果以 X±S(平均值±标准偏差)表示。利用SPSS Statisctics 26.0 软件对数据进行方差分析,P<0.05 表示差异显著;利用Origin 2021 软件进行绘图。
2 结果与分析
2.1 方法学考察结果
2.1.1 线性关系、精密度、重复性、稳定性和加样回收率考察 鞣花酸含量测定得到的回归方程分别为:Y=93370X-89010.7,r=0.999774。结果表明鞣花酸在1~100 μg/mL 范围内线性关系良好。
鞣花酸的精密度RSD 为0.21%。叶和茎的重复性和稳定性RSD 值分别为:2.78%和1.44%;1.65%和2.15%。表明仪器精密度良好、方法重复性良好且样品分别在36 h 内稳定。
由表2 结果显示,鞣花酸加样回收率的RSD 分别为1.08%、0.94%、0.91%(叶);0.74%、0.92%、1.86%(茎),表明回收率较好。
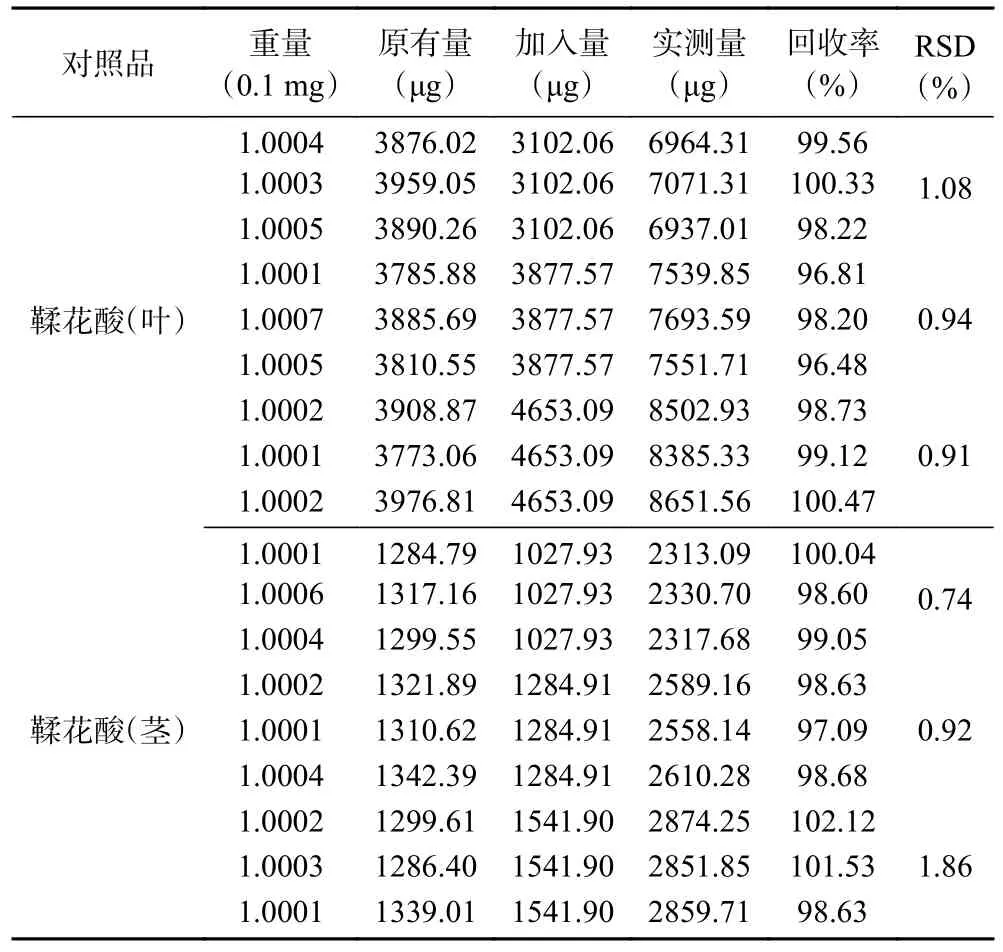
表2 加样回收率试验结果Table 2 Results of sample recovery rate test
2.2 不同采收时期小果蔷薇叶和茎中总多糖、总有机酸和鞣花酸含量的动态变化
2.2.1 不同采收时期小果蔷薇叶和茎中总多糖含量的动态变化 由表3~表4 测定结果可知,不同采收时期小果蔷薇叶和茎中总多糖含量差异性显著(P<0.05)。不同采收时期小果蔷薇叶和茎中总多糖含量范围分别为9.563~23.164 mg·g-1和0.763~15.650 mg·g-1。不同采收时期小果蔷薇叶和茎中总多糖含量整体上呈现波动式变化,叶在2 月到8 月采收的含量呈现逐渐上升趋势,在8 月采收的含量较高,为23.164 mg·g-1,8 月到11 月逐渐下降,随后在11 月到12 月回升,且在11 月采收的含量较低,为9.563 mg·g-1。茎在2 月到7 月采收的含量逐渐下降,其中在2 月采收的含量较高,为15.650 mg·g-1,而在7 月采收的含量较低,为0.763 mg·g-1,7 月到8 月采收的含量快速回升,最后在8 月到12 月采收的含量逐渐下降。研究结果分析得出,小果蔷薇叶和茎中总多糖含量分别在8 月和2 月达到了最高点,由此推测小果蔷薇叶和茎中总多糖可能与生长温度有关,夏季雨热同期且时间长,小果蔷薇植株生长较快,需要消耗大量的能量,根茎部总多糖含量往叶转移。经秋季结果期后,受到冬季低温霜冻等气候的影响,植物生理功能下降,小果蔷薇叶枯萎,有效成分往茎转移,导致部分活性成分含量达到峰值。这与陆廷祥等[22]研究土党参中总多糖活性成分的含量受采收期影响的结果一致。
表3 不同采收时期小果蔷薇叶中总多糖、总有机酸和鞣花酸含量测定结果(,n=3)Table 3 Results of total polysaccharide,total organic acid and ellagic acid content in leaf of Rosa cymosa Tratt.at different harvest periods (,n=3)
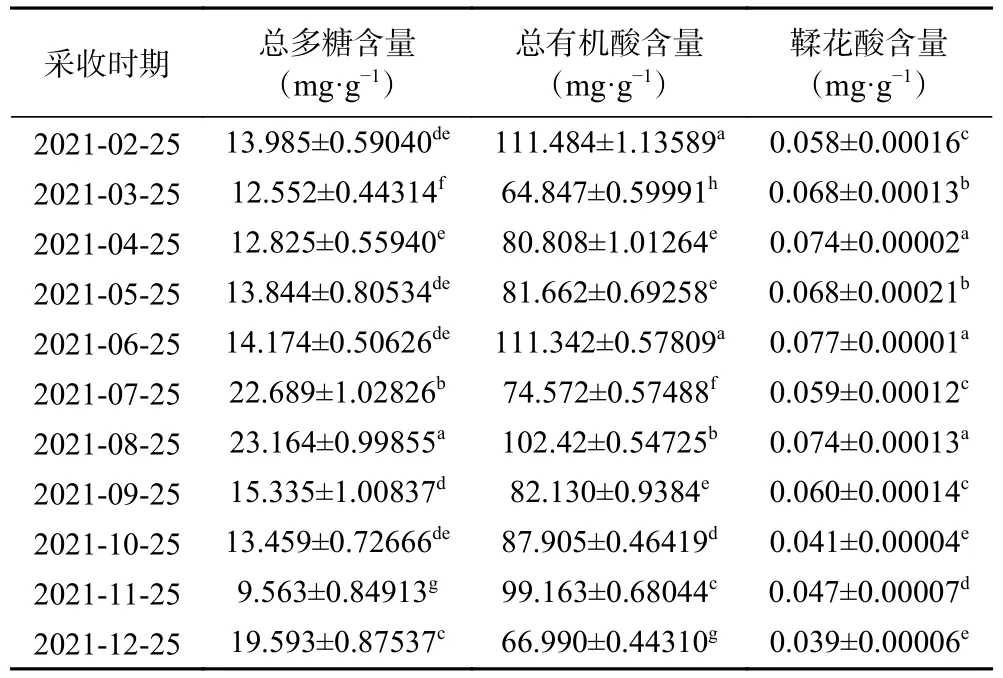
表3 不同采收时期小果蔷薇叶中总多糖、总有机酸和鞣花酸含量测定结果(,n=3)Table 3 Results of total polysaccharide,total organic acid and ellagic acid content in leaf of Rosa cymosa Tratt.at different harvest periods (,n=3)
注:同列标有不同小写字母者表示组间差异显著(P<0.05);表4同。
表4 不同采收时期小果蔷薇茎中鞣花酸、总有机酸和总多糖含量测定结果(,n=3)Table 4 Results of total polysaccharide,total organic acid and ellagic acid content in stem of Rosa cymosa Tratt.at different harvest periods (,n=3)
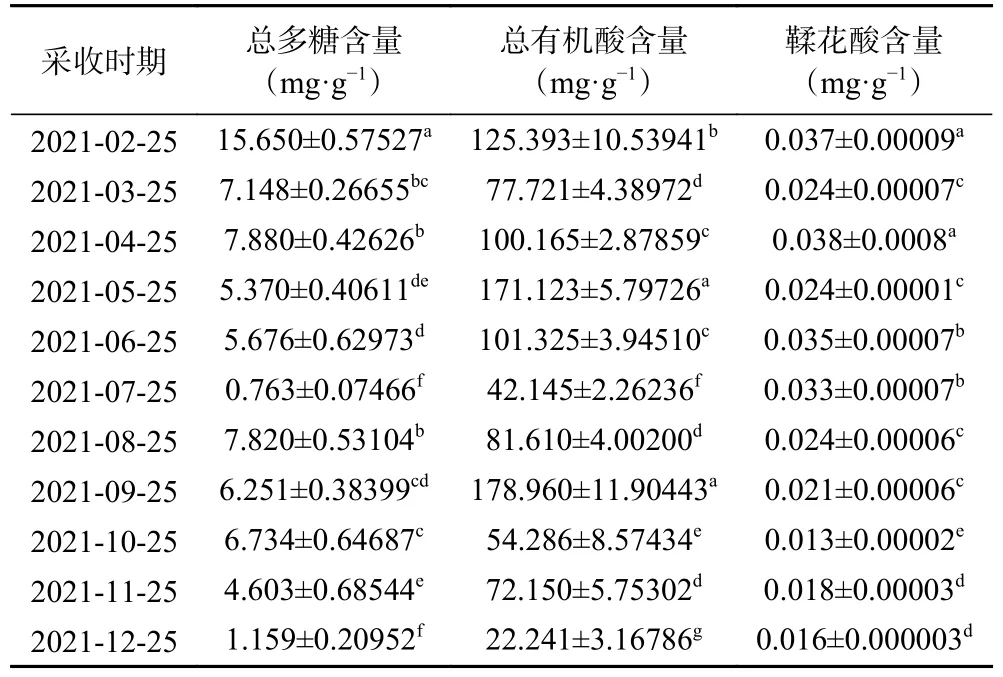
表4 不同采收时期小果蔷薇茎中鞣花酸、总有机酸和总多糖含量测定结果(,n=3)Table 4 Results of total polysaccharide,total organic acid and ellagic acid content in stem of Rosa cymosa Tratt.at different harvest periods (,n=3)
2.2.2 不同采收时期小果蔷薇叶和茎中总有机酸含量的动态变化 由表3~表4 测定结果可知,不同采收时期小果蔷薇叶中总有机酸含量差异性显著(P<0.05)。不同采收时期小果蔷薇叶和茎中总有机酸含量分别在64.847~111.484 mg·g-1和22.241~178.960 mg·g-1。不同采收时期小果蔷薇叶中总有机酸含量整体上呈现波动式变化,其中在2 月到3 月采收的含量快速下降,3 月到6 月采收的含量呈波动式上升,6 月到12 月采收的含量呈波动式下降;在2 月、6 月和8 月采收的含量较高,分别为111.484、111.342 和102.425 mg·g-1,而在3 月采收的含量较低,为64.847 mg·g-1。茎在2 月到5 月采收的含量呈现波动式上升,5 月到7 月采收的含量快速下降,7 月到9 月采收的含量逐渐上升,最后在9 月到12 月采收的含量波动式下降。其中在9 月到5 月采收的含量较高,分别为178.960 和171.123 mg·g-1,而在12 月采收的含量较低,为22.241 mg·g-1。
植物体内三萜类组成和含量随着植物的遗传背景、组织类型、生长年龄、生理状况及环境 因子的变化而发生变化[23-24]。结果表明,随着季节的升温,小果蔷薇植株的生长,叶和茎都进入快速生长时期,次生代谢产物含量明显升高,这与高伟城等[25]研究枇杷叶中总三萜酸在5 月采收含量最高基本一致;与王玉霞等[26]研究夏枯草最佳采收期相近。总有机酸在小果蔷薇不同部位及相同部位不同采收期的含量变化提示,其生物合成与植物生长发育不同阶段有关。
2.2.3 不同采收时期小果蔷薇叶和茎中鞣花酸含量的动态变化 由表3~表4 测定结果可知,不同采收时期小果蔷薇叶和茎中鞣花酸含量差异性显著(P<0.05)。不同采收时期小果蔷薇叶和茎中鞣花酸含量范围分别 在0.039~0.077 mg·g-1和0.013~0.038 mg·g-1。不同采收时期小果蔷薇叶和茎中鞣花酸含量在总体波动趋势下呈现下降趋势。其中叶在2 月到8 月采收的含量呈波动式上升趋势,在4 月、6 月和8 月采收的含量较高,分别为0.074、0.077 和0.074 mg·g-1,此后8 月到12 月呈下降趋势,到10 月和12 月采收的含量较低分别为0.041和0.039 mg·g-1。茎中鞣花酸含量从2 月和6 月采收呈波动式变化,在2 月和4 月采收的含量较高,分别为0.037 和0.038 mg·g-1,此后呈下降趋势,在10 月采收的含量较低,为0.013 mg·g-1。通过对比研究发现,小果蔷薇叶中鞣花酸含量高于小果蔷薇茎。
酚类物质在果实生长发育前期含量较高,主要是前期酚类物质合成速率较快;随着果实早期的快速生长发育,酚类物质合成与含量逐渐被“稀释”[27],因而从结果分析可以看出,鞣花酸含量在开花期4 月左右含量逐渐上升,在始果期8、9 月含量达到最大值,而在果实成熟期后呈降低趋势。这与黄仕清等[28]研究地稔最佳采收期为5~9 月相近,和王燕[29]研究大花紫薇叶中鞣花酸含量在始果期8 月下旬达到最高结果基本一致,与尹海波等[30]研究牻牛在六月末鞣花酸含量达到最大值一致。因此,据此含量变化规律,可确定小果蔷薇叶在4、6、8 月为适宜采收期,此时有效成分鞣花酸的含量较高。
2.3 聚类分析
运用SPSS26.0 软件对不同采收时期小果蔷薇叶和茎样品3 个成分的含量测定结果进行系统聚类,采用组间平均数联结法,以皮尔逊相关系距离为测度样得图1~图2。结果显示聚类明显,叶中,当类间距离为5 时,聚为3 类,一类为4、6、3、8、11、2,一类为7、10、12,另一类为5、9。茎中,当类间距离为15 时,聚为3 类,一类为2、11、6、10,一类为7、8、12,另一类为4、5、3、9。
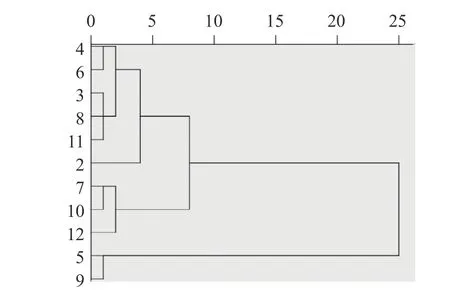
图1 小果蔷薇叶聚类分析图Fig.1 Cluster analysis of Rosa cymosa Tratt.in leaf
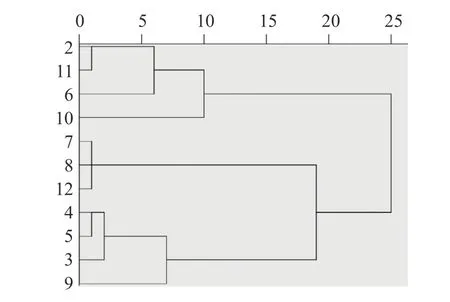
图2 小果蔷薇茎聚类分析图Fig.2 Cluster analysis of Rosa cymosa Tratt.in stem
2.4 主成分分析
以3 个成分含量测定结果为变量,采用SPSS 26.0 软件进行主成分分析,选取特征值大于0.7,其中叶和茎累计贡献率分别达到77.067%和82.970%的前2 个主成分,表明这2 个成分能够很好地代表小果蔷薇叶和茎主要特征及基本信息。根据各成分得分系数矩阵,分别按公式(1)、公式(4)计算主成分1 的因子得分(F1)、按公式(2)、公式(5)计算主成分2 的因子得分(F2),用各成分的方差贡献率为权重,以2 个主成分对小果蔷薇叶和茎进行综合评价并对结果进行排序,按公式(3)、公式(6)计算其综合评价F。
其中,F1、F2 中X1~X3参与计算的系数来源于表5 对应的数值。F 中参与计算的系数为表6中主成分1 和2 的方差贡献率。
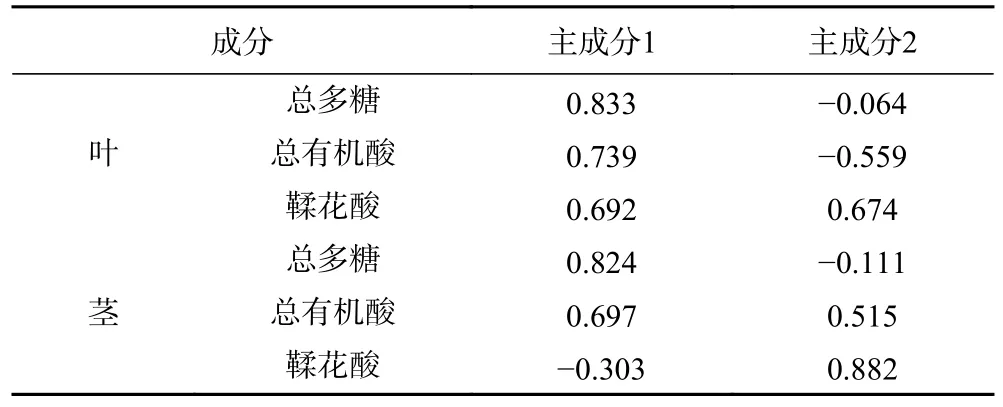
表5 各因子初始因子载荷矩阵Table 5 Initial factor load matrix of each factor
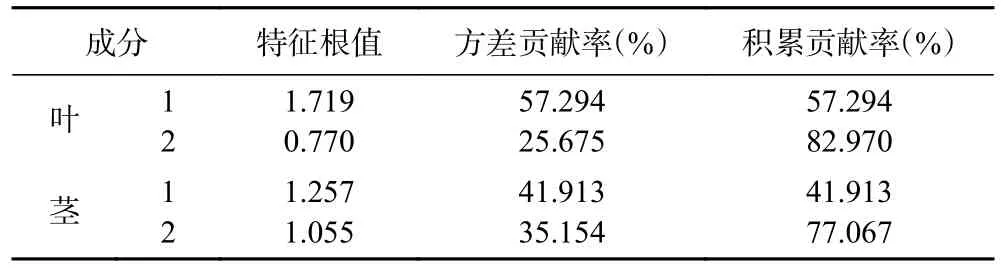
表6 特征根、各主成分的贡献率Table 6 Contribution rate of characteristic roots and principal components
由评价模型计算出小果蔷薇叶和茎各主成分得分、综合得分、排名情况,由表7~表8 可知,不同采收小果蔷薇叶综合得分由高到低依次为8 月、6 月、7 月、2 月、9 月、4 月和5 月、12 月、3 月、10 月;茎为2 月、4 月、5 月和9 月、6 月、8 月、7 月、11 月、3 月、10 月、12 月。
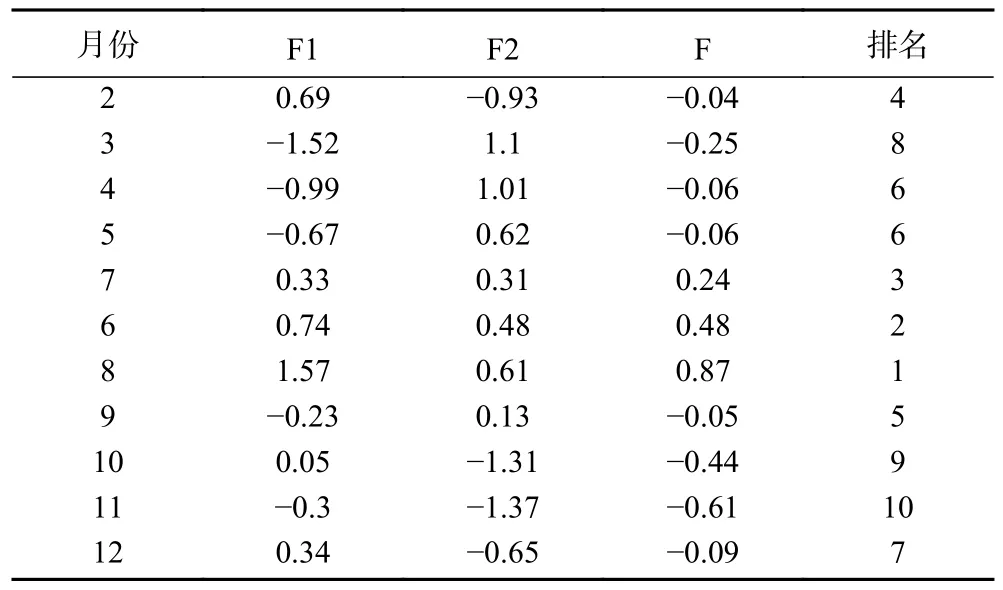
表7 不同采收时期小果蔷薇叶主成分评分和综合评分Table 7 Principal component score in leaf of Rosa cymosa Tratt.at different harvest periods
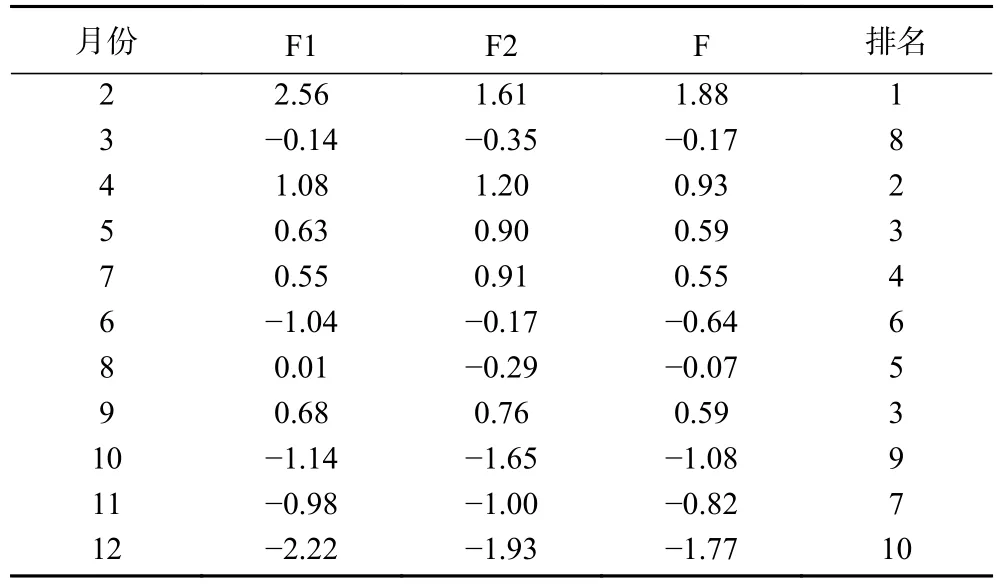
表8 不同采收时期小果蔷薇茎主成分评分和综合评分Table 8 Principal component score in stem of Rosa cymosa Tratt.at different harvest periods
由图3~图4 可以看出,根据 PC1、PC2 的得分情况,大致可以分三个部分:叶中,采收时期6 月、7 月、8 月均在PC1 和PC2 的正向区间(第一象限和第二象限),说明这三个时期采收的总多糖、总有机酸和鞣花酸含量较高,因此6 月、7 月、8 月采收品质较优,排名靠前;茎中,采收时期2 月、4 月和6 月均位于 PC1 和PC2 的正向区间(第一象限),说明这三个时期采收的总多糖、总有机酸和鞣花酸含量较高,因此,排名也相对靠前。
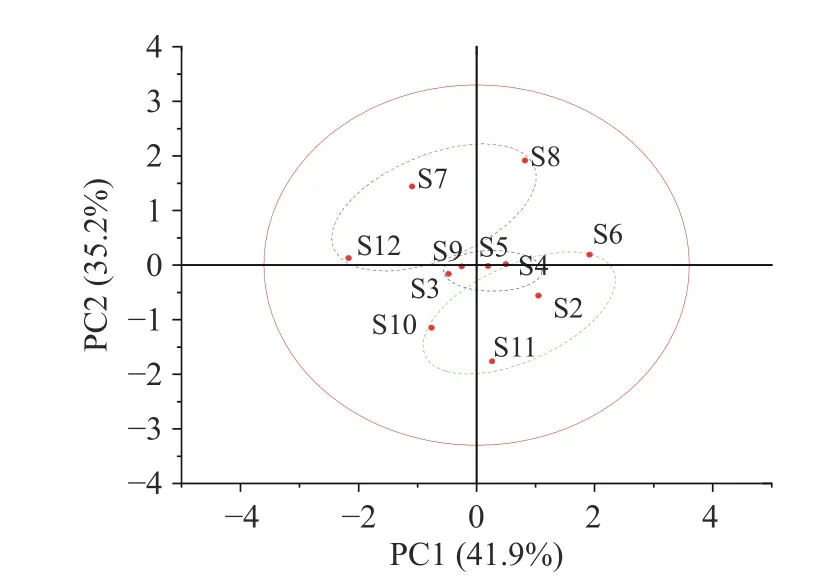
图3 小果蔷薇叶主成分得分图Fig.3 PCA scores of Rosa cymosa Tratt.in leaf
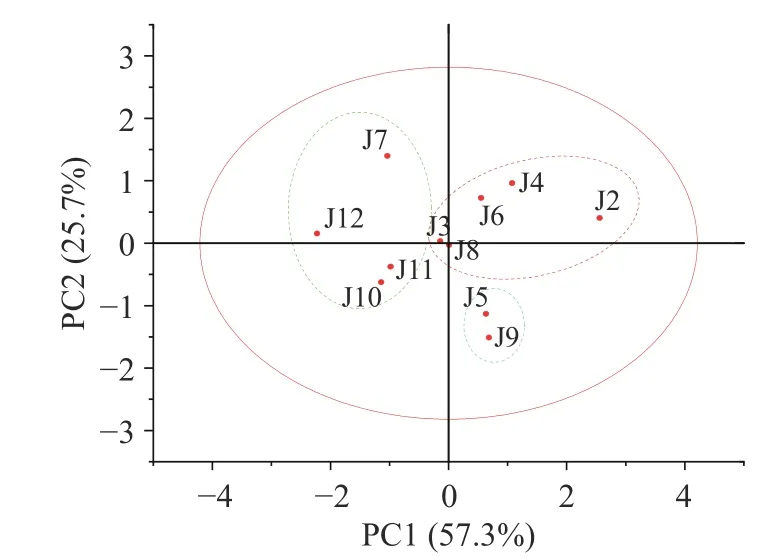
图4 小果蔷薇茎主成分得分图Fig.4 PCA scores of Rosa cymosa Tratt.in stem
3 结论
目前,文献对中药材采收及药效成分的动态积累研究中,通常只以日期或日历上节令为考察的时间节点,对于地域分布广泛的药用植物,难以获得普适性规律。本论文对不同采收时期小果蔷薇叶和茎中总多糖、总有机酸和鞣花酸的含量进行了测定,并进行了方差分析、聚类分析和主成分分析,结果显示,小果蔷薇叶的适宜采收时期为8 月,茎的适宜采收时期为2 月。本论文的研究结果可为小果蔷薇的采收提供参考。
因所有小果蔷薇样品均在野外采收,其采收条件具有一定的困难,因此后续可以采集小果蔷薇样品进行扦插栽培研究,并将野外采集的样品和栽培样品进行对比,以进一步开发和利用小果蔷薇资源。除了采收时期外,其他许多因素均可影响小果蔷薇的质量,需待进一步研究。

