桂花青脆李复合香型果酒的酿造工艺优化
陈君蕊,苏良敏,成 欣,周睫姝,罗婧云,陈安均
(四川农业大学食品学院,四川雅安 625000)
青脆李(Prunus salicinaLindell cv.Qingcui)属双子叶植物纲蔷薇目蔷薇科(Rosaceae)李属(PrunusL.),是我国西南地区的一种特色水果。青脆李产量大,由于其采收期天气炎热,导致果子呼吸旺盛,不耐贮藏,因此对其进行深加工、延长产品的生命周期,能有效避免浪费,同时也能提高产品品质[1-2]。目前青脆李加工多限于果脯蜜饯,对于青脆李果酒的相关研究相对较少,这主要是因为李酒产品往往酒体寡淡、香味不足,因而市场占有率低[3]。
桂花(Osmanthus fragransLour.)亦称木犀、山桂、岩桂、九里香,属木犀科(Oleaceae)木犀属(Osmanthus),原产中国西南部,是我国十大传统名花之一,已有2500 多年的栽培历史,不仅极具观赏性,还是我国传统的花卉食品,有着悠久的食用历史,因其具有很高的食用价值和独特的香气,自古以来被我国人民广泛作为食品辅料[4-5]。
香气成分是影响果酒品质的重要因素,也是决定消费者接受度和偏好的重要因素[6],此前未见有学者对加花型复合果酒的香气进行研究,也未见使用花卉与青脆李共同发酵的报道,因此本实验添加干桂花与青脆李共同发酵,以桂花独特的香气丰富青脆李酒的酒体,以期为青脆李酒的加工工艺提供更高品质和更具创新性理论依据。
1 材料与方法
1.1 材料与仪器
干桂花 四川香之源生物科技有限公司;新鲜青脆李 产自四川省阿坝藏族羌族自治州(糖度为11.2°Brix±0.1°Brix,pH 为3.57±0.02);KD 果酒-葡萄酒专用酵母 法国马丁威兰特公司;食品级焦亚硫酸钾 一诺生物科技有限公司;氢氧化钠、葡萄糖、酒石酸钾钠(四水)、硫酸铜(五水)、氯化钠、盐酸分析纯,成都市科隆化学品有限公司;甲醇、无水乙醇、环己酮 色谱纯,成都市科隆化学品有限公司;叔戊醇(标准品)色谱纯,上海易恩化学技术有限公司。
SHP-350 生化恒温培养箱 北京中兴伟业仪器有限公司;一联电子万用炉 北京市永光明医疗仪器有限公司;CPA225D 万分之一天平 德国Sartorius公司;7890A/59750 气相色谱-质谱联用仪 美国Agilent Technologies 公司;7890B 气相色谱仪 美国Agilent Technologies 公司。
1.2 实验方法
1.2.1 青脆李酒发酵工艺 图1 为青脆李酒的发酵工艺流程。护色杀菌:用食品级焦亚硫酸钾将果汁的SO2浓度调整为80 mg/kg;调整糖度:用蔗糖将原果汁糖度调整为24°Brix;酵母接种:称取0.03%KD 酵母,用5%浓度的糖水,于37 ℃条件下活化30 min;发酵过程:放置于20 ℃培养箱发酵,通过失重率判断发酵终点(当失重率接近0 且连续2 d 失重率不变即可判断发酵结束);澄清:参考曾顺德等[7]的方法进行澄清,称取2.00 g 壳聚糖,加入50 mL 沸水,搅拌至完全溶解用作澄清剂,以3.0 g/L 壳聚糖用量添加澄清剂至酒中,静置48 h 再次倒灌,分离沉淀即得到澄亮的原酒(发酵及澄清过程均用1000 mL玻璃瓶)。

图1 发酵工艺流程Fig.1 Fermentation process
1.2.2 单因素实验 选择发酵温度、桂花添加量、加花时间作为桂花青脆李酒的发酵因素,在1.2.1 青脆李酒发酵工艺的基础上添加干桂花共同发酵,分别考察不同发酵温度(16、18、20、22、24 ℃)、不同桂花添加量(0.1、0.2、0.3、0.4、0.5 g/100 mL)及不同加花时间(发酵第0、2、4、6、8 d)条件下,所制备桂花青脆李果酒的基础理化指标、挥发性风味物质及感官评价结果。不同发酵温度的样品固定桂花添加量为0.3 g/100 mL,固定加花时间为发酵第4 d;不同桂花添加量的样品固定发酵温度为20 ℃,固定加花时间为发酵第4 d;不同加花时间的样品固定发酵温度为20 ℃,固定桂花添加量为0.3 g/100 mL。
1.2.3 正交试验 基于单因素实验,选取发酵温度(A)、桂花添加量(B)、加花时间(C)这3 种因素采用正交表L9(34)设计正交试验,并以挥发性风味物质和感官评价为依据,确定最终最佳酿造工艺条件。如表1 所示。
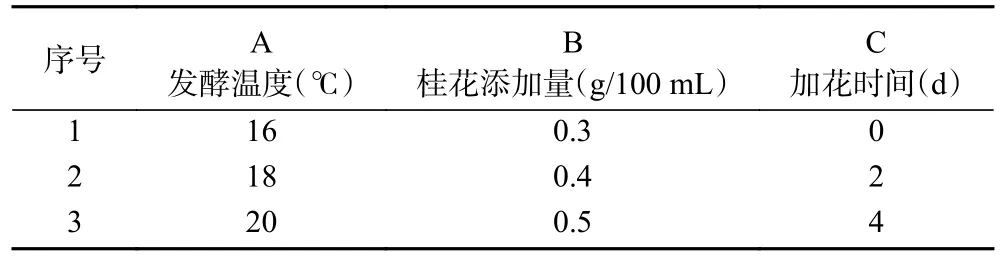
表1 正交试验因素水平设计Table 1 Factors and levels of orthogonal experiment
1.2.4 基础指标检测分析方法 酒精度采用GB 5009.225-2016《食品安全国家标准 酒中乙醇浓度的测定》中的密度瓶法进行测定[8];干浸出物、残糖和总酸采用GB/T 15038-2006《葡萄酒、果酒通用分析方法》测定[9];测定甲醇含量采用GB 5009.226-2016《食品中甲醇的测定》[10]中的方法。
1.2.5 挥发性风味物质的测定 挥发性风味物质参照XIAO 等[11]的方法,采用顶空固相微萃取(solidphase micro extraction,SPME)结合气相色谱/质谱联用法(gas chromatography-mass spectrometry,GCMS)对桂花青脆李酒中的挥发性风味物质进行测定。色谱条件:采用30 m×0.250 mm 的HP-5MS色谱柱,初始温度为40 ℃,保持时间1 min,以5 ℃/min 升至70 ℃,再以2 ℃/min 升至120 ℃,后以8 ℃/min 升至160 ℃,再以6 ℃/min 升至250 ℃,保持1 min,载气为氦气,流速为1.2 mL/min,不分流,进样口温度为260 ℃;质谱条件:电离方式EI,电离电压70 eV,灯丝流量0.25 mA,连接杆温度280 ℃,电子倍增器电压为1500 V,扫描范围为30~350 AMU,离子源温度250 ℃。
1.2.6 香气成分分析 定性、定量分析:使用NIST 14 谱库对挥发性化合物谱图进行比对,选取匹配度大于等于70%的物质作为有效的挥发性风味物质,并结合相关资料进行后续的分析鉴定;以环己酮为内标,采用内标法进行半定量分析。
OAV 法:参照温华婷等[12]的方法,以气味活度值(odor activity value,OAV)评判香气贡献大小。查阅挥发性成分在水中的阈值,并根据每种香气成分的质量浓度与阈值的比值计算OAV,以此评价该香气成分对样品整体风味的贡献程度[13]。一般认为,当OAV<1 时,说明该物质对样品总体气味贡献不明显;当OAV≥1 时,说明该物质对样品总体气味有明显贡献,OAV 越大说明该物质对样品总体气味的贡献程度越大[14]。OAV 按式(1)计算:
式中:Ci为香气化合物的浓度,μg/L;OTi表示化合物在水中的嗅觉阈值,μg/L。
1.2.7 感官评价 感官评定方法采用排序法,由12 名评价员按顺序评价样品后,综合考虑香气、滋味、口感等,根据整体印象对样品进行排序,根据评价员对样品的排序计算各样品的总排序和,然后利用Kramer 检验法对数据进行统计分析。
1.3 数据处理
利用IBM SPSS Statistics 26 软件进行数据处理。采用单因素ANOVA 分析进行显著性分析,P<0.05 表示差异显著。结果用标记字母法表示。采用Origin 2021 进行绘图。所有实验均重复三次。
2 结果与分析
2.1 单因素实验结果
2.1.1 发酵温度对桂花青脆李果酒品质的影响 温度对酵母繁殖和代谢有一定的影响,它会改变微生物代谢产物的合成方向,从而影响果酒发酵[15]。由表2可知,桂花青脆李酒的酒精度随着发酵温度的升高呈现先升高后下降的趋势,16~20 ℃的发酵温度条件范围内,各样品间酒精度无显著性区别(P>0.05),在20 ℃时达到最大值,到较高温度条件22 ℃与24 ℃时,酒精度显著下降(P<0.05),在24 ℃时达到最低(12.52%vol±0.02%vol)。这与郑升海等[16]的研究结果一致,这可能是因为温度升高使酵母菌由生长对数期过早进入稳定期,从而发酵速度变快,发酵结束的时间早,导致酒精浓度下降。残糖随着发酵温度的升高而降低,在16 ℃时残糖含量最高(4.15±0.07 g/L),而24 ℃时残糖含量最低(3.08±0.04 g/L),这与胡康等[17]的研究结果相似。不同温度条件下,桂花青脆李酒的总酸含量随温度的升高而降低,在发酵温度为16 ℃时总酸的含量处于最高值(4.00±0.02 g/L),加花的样品总酸含量均低于青脆李原酒(4.01±0.01 g/L)。甲醇生成量与发酵温度成正比,在24 ℃条件下发酵的桂花青脆李酒甲醇含量最高(69.00±1.41 g/L),这与李梅等[18]关于欧李果酒中甲醇含量的研究结果相似,各温度样品甲醇含量均小于国家限量标准400 mg/L[19]。

表2 不同发酵温度的基础理化指标测定结果Table 2 Identifification of basic physicochemical indexes in different fermentation temperatures
由图2 可见,挥发性风味物质的总量随着温度的升高呈现先升高后下降的趋势,其中在18 ℃条件下发酵的桂花青脆李酒的物质总量、醇类物质、酮类物质、其他物质的含量皆为最高,说明在18 ℃条件下发酵时,桂花的加入能最大程度上优化青脆李酒的挥发性风味物质含量,16 ℃次之,20 ℃与CK(青脆李原酒)之间在物质总量上无显著性差异(P>0.05)。由图3 可知,18 ℃及20 ℃条件下发酵的桂花青脆李酒的物质总数最多,16 ℃次之。
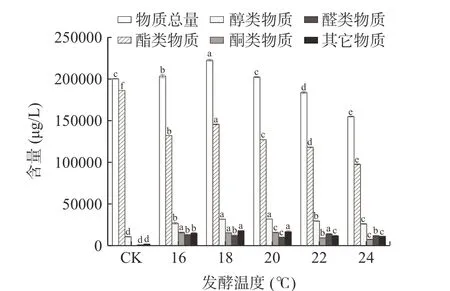
图2 不同发酵温度条件下各类挥发性风味物质的总量Fig.2 Total amount of various volatile flavor compounds in different fermentation temperatures
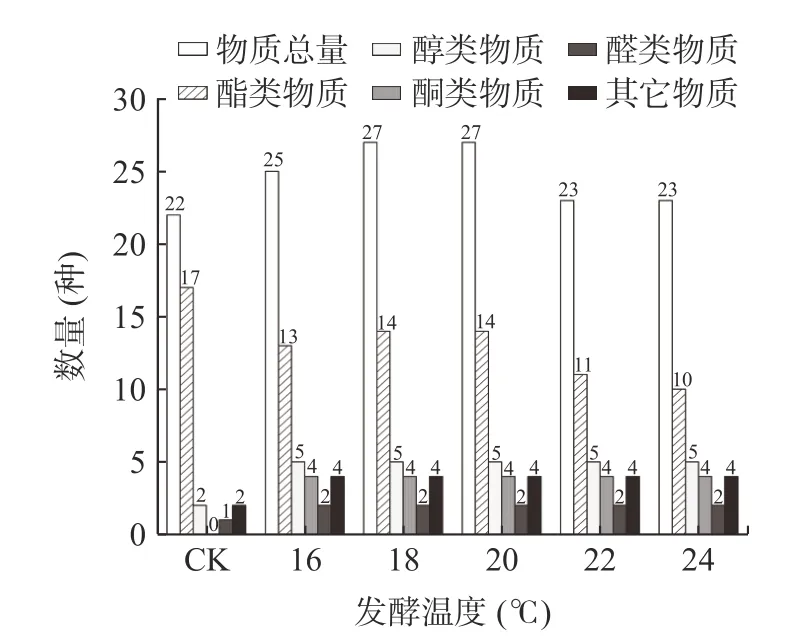
图3 不同发酵温度条件下挥发性风味物质的数量Fig.3 Quantity of volatile flavor compounds in different fermentation temperature
12 名评价人员品评了不同温度条件下发酵的桂花青脆李酒及CK 酒样,对6 组样品的整体风味进行了接受程度的排序,排序结果结果见表3。参考汪浩明[20]的排序检验法,得出评员数J=12,每组样品数P=6 时的临界值,见表4。

表3 不同发酵温度感官排序结果Table 3 Sensory ranking of different fermentation temperature

表4 J=12,P=6 时临界值表Table 4 Critical values when J=12,P=6
先通过上段临界值来检验样品间是否有显著差异,把每个样品的秩次和同上段最大值Rimax和最小值 Rimin相比较,一组样品中若存在某个排序和≥最大值Rimax或者≤最小值Rimin,即为在对应显著水平存在显著性差异,否则没有显著差异。由表3 对应表4 上段临界值(25~59)可知,R18℃=20<R16℃=24<Rimin=28,Rimin=28<R20℃=36<R22℃=47<R24℃=55<Rimax=59,Rimax=59<RCK=68,所以这6 个样品可以分为三组:16℃、18 ℃为一组,20 ℃、22 ℃、24 ℃为一组,CK 为一组。
因此,在1%的显著水平,16、18 ℃样品感官质量最佳,20、22、24 ℃处在同一水平且在感官质量上无显著性差异,CK 感官质量最差。
综合挥发性风味物质和感官排序结果,选择16、18、20 ℃进行后续正交试验。
2.1.2 桂花添加量对桂花青脆李果酒品质的影响由表5 可知,添加桂花后,酒精度随着添加量的增加没有呈现明显的变化趋势。在不同添加量的共发酵型青脆李酒样中,干浸出物含量随着桂花添加量的增加呈增加趋势,添加0.5 g/100 mL 桂花的样品干浸出物含量最高(30.20±0 g/L)。残糖含量随着添加量的增加呈上升趋势,添加0.1 g/100 mL 桂花的样品残糖含量最低(3.17±0.07 g/L),而0.5 g/100 mL 添加量的样品残糖含量最高(3.81±0.02 g/L)。总酸含量与桂花添加量呈反比,随着添加量的增加,总酸含量不断减少,0.1、0.2 g/100 mL 桂花添加量的样品总酸含量最高(4.00±0.02 g/L),0.5 g/100 mL 添加量的样品总酸含量最低(3.64±0 g/L)。甲醇含量随着添加量的增加而不断升高,但是含量均小于国家限量标准400 mg/L。
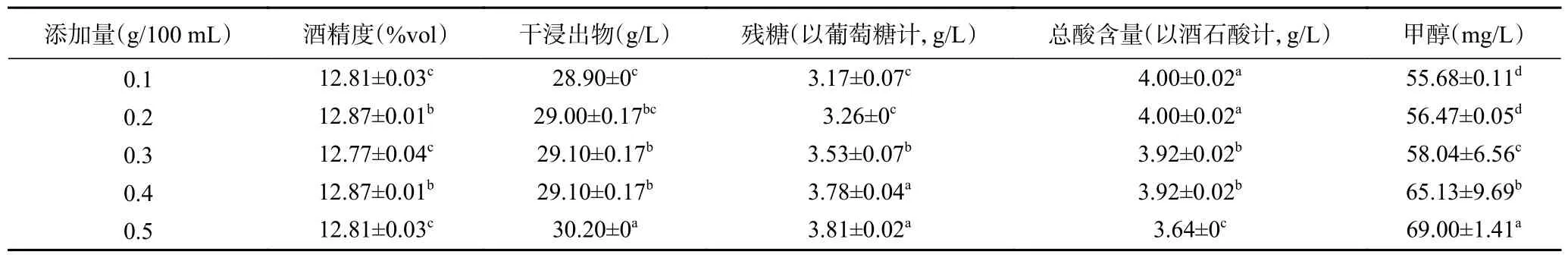
表5 不同桂花添加量的理化指标测定结果Table 5 Identifification of basic physicochemical indexes in different additions of Osmanthus
由图4 可知,添加桂花发酵之后,酯类物质的含量相较青脆李原酒明显下降,醇类物质、醛类物质及其他物质均增加,物质总量除了0.1 g/100 mL 以外都较原酒有所增加,其中,在没有添加桂花的青脆李原酒中未检出酮类物质,这说明桂花青脆李酒中的酮类物质主要由桂花提供。由图5 可知,添加0.2、0.3、0.4、0.5 g/100 mL 桂花发酵的酒样挥发性风味物质总数均高于青脆李原酒。

图4 不同桂花添加量的各类挥发性风味物质的总量Fig.4 Total amount of various volatile flavor compounds in different additions of Osmanthus
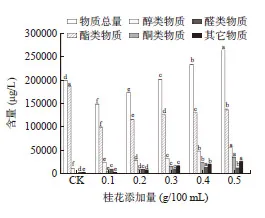
图5 不同桂花添加量的挥发性风味物质的数量Fig.5 Quantity of volatile flavor compounds in different additions of Osmanthus
由表6 结合表4 上段临界值(25~59)可知,R0.4=22<Rimin=25,Rimax=59<RCK=71,说明在1%显著水平,CK 及不同桂花添加量的样品之间存在显著性差异。接着通过表3 的排序秩和对应表4 下段临界值(28~56)可以检查样品间差异程度,若秩次和在下段范围内,则可将其划为一组,该组内的样品间无显著差异,如果秩次和在下段范围的上限之外和在下限之外的样品可分别组成一组。表3 和表4 下段可知,R0.4=22<R0.5=23<Rimin=28,Rimin=25<R0.3=34<R0.2=47<R0.1=55<Rimax=56,Rimax=56<RCK=71,所以这6 个样品可以分为三组:0.4、0.5 g/100 mL 为一组,0.2、0.3、0.1 g/100 mL 为一组,CK 为一组。在1%的显著水平,0.4、0.5 g/100 mL 添加量的样品感官质量最佳,0.2、0.3、0.1 g/100 mL 次之,CK 感官品质最差,组间均无显著性差异。

表6 不同桂花添加量感官排序结果Table 6 Sensory ranking of different additions of Osmanthus
综合挥发性风味物质和感官排序结果,选择0.3、0.4、0.5 g/100 mL 添加量进行后续正交试验。
2.1.3 加花时间对桂花青脆李果酒品质的影响 由表7 可见,加花时间越早,即桂花参与发酵过程的时间越长,酒精度越低,在发酵第0 d 添加桂花发酵的样品酒精度最低(11.58%vol±0.01%vol),而发酵第8 d 加花的样品酒精度最高(13.03%vol±0.04%vol),不同加花时间的桂花青脆李酒样品的酒精度均低于原酒(13.19%vol±0.01%vol),结合表5 中不同桂花添加量对桂花青脆李酒酒精度的影响结果,可知桂花的加入对于青脆李酒的酒精度有明显影响,桂花参与的程度越深,酒精度越低。不同的加花时间对于干浸出物的影响不显著(P>0.05),在发酵第8 d 加花的样品干浸出物含量略低(28.90±0 g/L),加花的酒样干浸出物含量均高于青脆李原酒(27.90±0 g/L)。残糖的含量均随着桂花参与时间的延后而下降,发酵第0 d的残糖含量最高(3.59±0.07 g/L),发酵第8 d 的残糖含量最低(3.24±0.04 g/L)。总酸随着桂花参与度的降低而增加,加花时间越靠后,总酸的含量越高。甲醇的含量无显著性变化且均小于国家限量标准。

表7 加花时间对基础理化指标的影响Table 7 Identifification of basic physicochemical indexes in different time to add Osmanthus
由图6 和图7 可知,在不同时间添加桂花参与青脆李酒的发酵过程对于最终挥发性风味物质含量和数量的形成有明显的影响作用,其中在第6 d 添加桂花发酵而成的酒样挥发性风味物质的总量最少,比原酒还要少。在发酵第0 d 添加桂花在最大程度上参与了发酵过程,最终呈现的香气物质总量及总数(28)都显著优于其他样品(P<0.05),发酵第2 d 添加桂花也在很大程度上参与了发酵,其结果仅次于发酵第0 d 加花的样品,而发酵第4 d 正好是发酵开始旺盛的时候,在此时添加桂花也能明显增加青脆李酒的品质,第6 d开始酒样失重比较大,这时添加的桂花香气流失比较严重。而到第8 d 发酵趋于平静阶段,虽然时间较晚,此时添加桂花参与发酵进程的时间较短,但是结果仍然在含量上优于第6 d 加花的酒样。

图6 不同加花时间的各类挥发性风味物质的总量Fig.6 Total amount of various volatile flavor compounds in different time to add Osmanthus
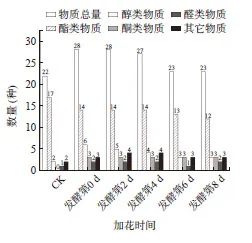
图7 不同加花时间的挥发性风味物质的数量Fig.7 Quantity of volatile flavor compounds in different time to add Osmanthus
根据表8 对应表4 上段临界值(25~59)可知,R第0d=24<R第2d=25≤Rimin=25,Rimax=59<RCK=70,说明在1%显著水平,CK 及不同温度发酵的样品之间存在显著性差异。接着对应表8 及表4 下段临界值(28~56)检查样品间差异程度,对样品进行分组,R第0d=24<R第2d=25≤Rimin=28,Rimin=28<R第4d=33<R第8d=48<R第6d=52<Rimax=56,Rimax=56<RCK=70,因此这6 个样品可以分为三组:发酵第0 d,第2 d 加花为一组,第4 d,第6 d,第8 d 为一组,CK 为一组,组间无显著性差异。
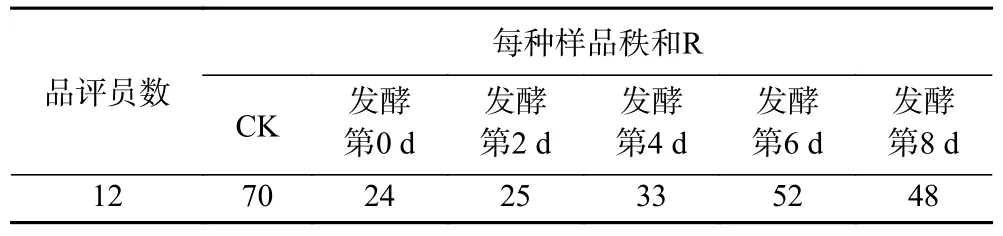
表8 不同加花时间的感官排序结果Table 8 Sensory ranking of different time to add Osmanthus
因此,在1%的显著水平,发酵第0 d,第2 d 加花的样品感官质量最佳;第4 d,第6 d,第8 d 次之且处于同一水平;CK 感官质量最差。
综合挥发性风味物质和感官排序结果,选择发酵第0 d、第2 d 和第4 d 加花作为进行后续正试实验的加花时间。
2.2 正交试验结果
根据单因素实验结果,以发酵温度、桂花添加量、加花时间为影响因素,以挥发性风味物质和感官评价为主要评价指标,采用L9(34)正交试验设计对桂花青脆李复合果酒发酵工艺进行优化。正交试验设计方案见表9。
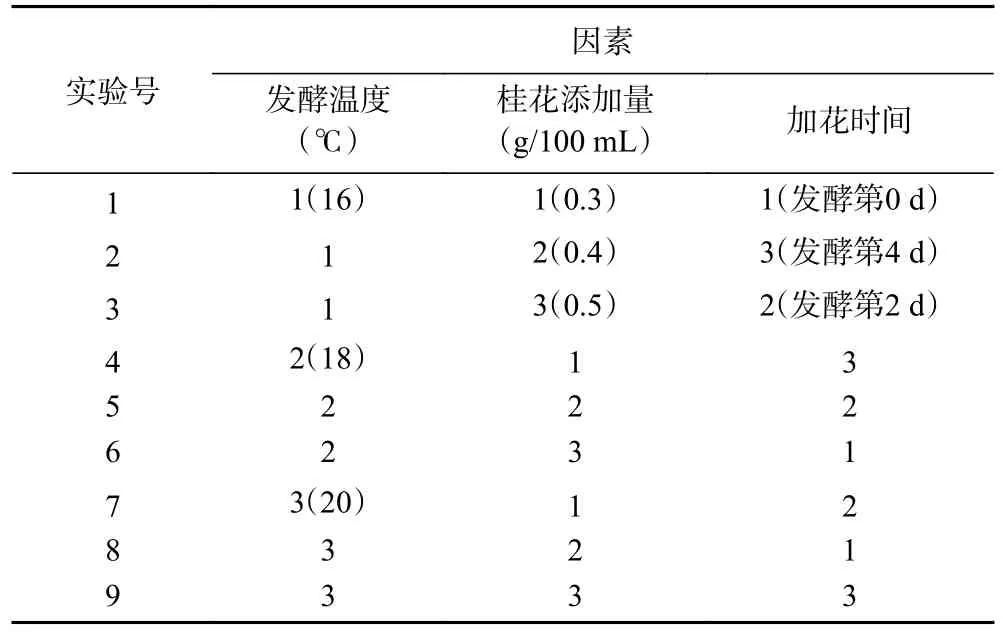
表9 正交试验设计及结果Table 9 Orthogonal experimental design and results
由表10 可知,正交试验9 组样品共鉴定出39 种香气物质,包括15 种酯类、8 种醇类、4 种酮类、3 种醛类、9 种其他类,其中芳樟醇、二氢-β-紫罗兰醇、酮类物质中的二氢-β-紫罗兰酮和β-紫罗酮以及其他类中的茶香螺烷等都是桂花中特有的物质[21]。

表10 正交试验香气质量浓度检测结果Table 10 GC-MS analysis of volatile aroma components in results of orthogonal experimental design
根据表11 正交试验香气质量浓度检测结果数据再对应阈值可得到各物质的气味活度值(OAV),OAV 可作为评价挥发性香气成分在食品基质中贡献大小的更精准的标准[34]。本文中阈值参考里奥·范海默特[23],同时参考文献中报道的化合物香气阈值。OAV 分析结果如表11 所示。对各样品气味活度值的总和进行极差分析,以此作为正交试验结果分析的主要依据(表12)。
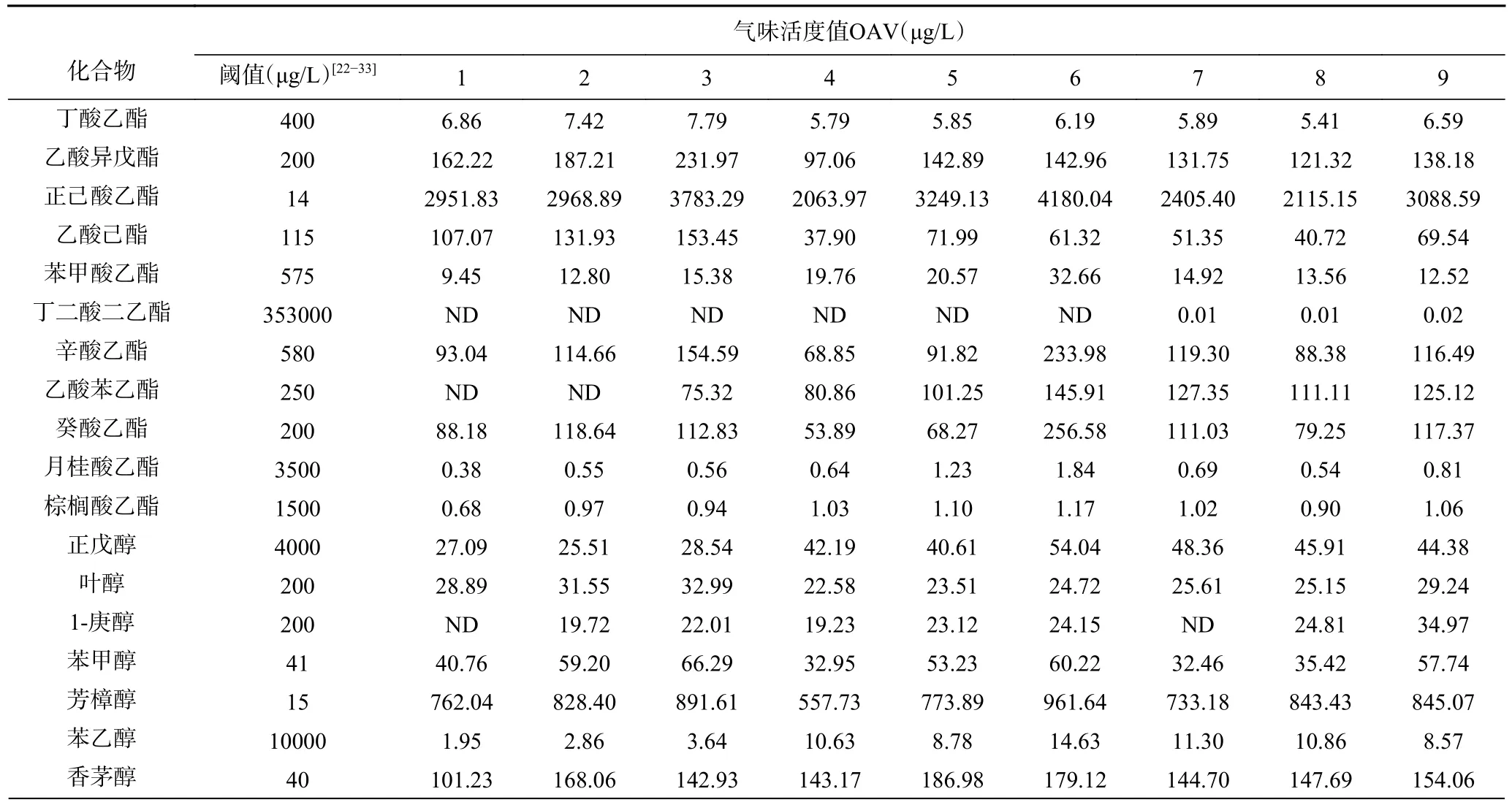
表11 正交试验结果香气的OAV 值Table 11 OAV values of volatile aroma components in results of orthogonal experimental design

表12 正交试验结果分析Table 12 Analysis of orthogonal experimental results
由正交试验分析可知对于气味活度值的影响程度,桂花青脆李果酒发酵各因素之间主次顺序为:桂花添加量>加花时间>发酵温度,最优的发酵条件为:发酵温度18 ℃,添加量0.5 g/100 mL,加花时间第0 d,与序号6 的条件一致。因此从正交试验分析结果来看,序号6 的样品香气贡献最佳。但是果酒对于香气的贡献除了来源于香气化合物自身阈上浓度贡献外,还可能存在阈下浓度的协同增效作用,因此要结合感官结果综合评价。
由表13 结合表14 上段显著性水平在5%的(α=5%)临界值(38~82)可知,Rimin=38<R6=39<R3=43<R2=48<R1=53<R5=58<R7=R8=77<R9=79<Rimax=82,所以这9 个样品不存在显著性差异,但是编号2、3、6 的样品相对更受欢迎,其中样品6 的排序秩次和最小(R6=39)。

表14 J=12,P=9 时临界值表Table 14 Critical values when J=12,P=9
综合正交试验样品的香气贡献总量分析结果(序号6 的样品香气贡献总量最高,为47470.04 μg/L)及感官排序结果,可以确定样品6 为最佳发酵工艺条件,工艺参数为:发酵温度18 ℃,添加量0.5 g/100 mL,加花时间第0 d。
3 结论
由单因素实验结果可知,桂花的添加对于青脆李酒挥发性风味物质有明显的影响:当固定添加量为0.3 g/100 mL,加花时间为发酵第4 d 时,物质总数均高于原酒,在物质的总量上,只有较低温度条件发酵的样品(16、18 ℃)显著高于青脆李原酒(P<0.05),20 ℃的样品物质总量于原酒无显著性差别;在20 ℃温度条件下,于发酵第4 d 加花时,桂花添加量不低于0.3 g/100 mL 的样品挥发性风味物质的含量及种类均显著高于青脆李原酒;当固定添加量为0.3 g/100 mL,于20 ℃温度条件下发酵时,发酵第0 d、第2 d 加花的样品挥发性风味物质的含量显著高于原酒,加花的各样品物质数量均高于未加花的原酒,数量随着参与时间的延后而减少。根据感官排序结果,所有加花的样品均显著优于原酒,说明添加桂花对于青脆李酒感官品质的改善是颇具价值的。
通过正交试验结合各样品OAV 贡献总量,得到最优组合(发酵温度18 ℃,添加量0.5 g/100 mL,加花时间第0 d),再对应感官排序结果可知该组合条件下感官品质也最优,且正好为正交设计中序号6 的样品。工艺条件的确定从加花增香型复合果酒的角度出发,为提高青脆李酒产品品质提供了新的理论依据。

