干燥方式对黄精片干燥特性和微观结构的影响*
黄纪民,王溱兰,邱展鸿,吴钊龙,4,覃海波,4,李秉正,4,5**,黄志民**
(1.广西科学院,广西微波先进制造技术重点实验室,广西南宁 530007;2.南宁学院食品科学与质量工程学院,广西南宁 530200;3.广西华泰药业有限公司,广西贺州 546800;4.广西科学院大健康研究所,广西南宁 530007;5.广西科学院来宾分院,广西来宾 546100)
红花滇黄精(PolygonatumkzngzanumColl.et Hemsl.)是百合科(Liliaceae)植物红花滇黄精干燥后的根茎,收录于《中华人民共和国药典(一部)》(2020年版)[1],又称为“鸡头黄精”和“鸡头参”。多花黄精根茎中富含多酚、多糖以及甾醇类生物活性物质[2],是药食同源性的滋补中药。鲜黄精收获时间短,水分含量极高,容易腐坏变质,不能长期保存,不利于贮藏和运输[3]。将黄精干燥不仅能消除刺激性和毒性,还能转变其药性,有利于有效成分的保存与积累,而且干燥后的黄精可以有效减少水分含量,延长贮藏期,减少后期炮制黄精的工作量[4]。
目前黄精的干燥方法通常采用自然晒干和热风干燥(Hot Air Drying,HAD)等传统加工方法。衡银雪等[5]研究发现微波真空干燥法能更加有效地保留黄精中的多糖、酚类、皂苷类化合物等活性成分。刘怡菲[2]研究发现真空冷冻干燥(Vacuum Freeze Drying,VFD)处理得到的黄精片样品的硬度、弹性及咀嚼性等指标最接近于新鲜状态下的黄精片,且其品质均优于自然干燥、热风干燥、热泵干燥、变温压差膨化干燥等4种干燥方式处理过的黄精片。黄夏[6]研究发现黄精真空冷冻干燥过程中的干燥时间、加热板温度及干燥室真空度对黄精色差值均具有显著影响。近年来,干燥技术在食品加工中的应用越来越广泛,虽然黄精的干燥方法多样,但是对于确定黄精最适的干燥方法缺乏系统性的定论[7]。
本研究通过探究热风干燥、真空冷冻干燥、真空干燥(Vacuum Drying,VD)、微波干燥(Microwave Drying,MD)等4种干燥方式对红花滇黄精(以下简称“黄精”)片的干燥特性、有效水分扩散系数、色泽、收缩率、复水比、单位能耗以及微观结构的影响,确定黄精片的最适干燥方式,为黄精片的深加工提供理论依据。
1 材料与方法
1.1 原料及预处理
新鲜黄精购自广西百色市隆林各族自治县,经广西农业职业技术大学莫勇生高级工程师鉴定为红花滇 黄 精 (PolygonatumkzngzanumColl.et Hemsl.)。挑选无病虫害和机械损伤的新鲜黄精,清洗除去表面的泥沙和杂质并沥干,采用旋转切片机切成厚度为4 mm 的黄精切片。
1.2 仪器与设备
微波干燥机(Webox-A6型,株洲市微朗科技有限公司),鼓风干燥箱(DHG-9240A 型,上海一恒科学仪器有限公司),冷冻干燥机(Sciontz-12N/c型,宁波市新芝生物科技股份有限公司),真空干燥箱(DZF-6050型,上海一恒科学仪器有限公司),电子天平(JJ1000型,常熟市双杰测试仪器厂),水分测定仪(DHS-20A 型,上海立辰仪器科技有限公司),色彩色差计(CR-10Plus,日本Konica Minolta公司),扫描电子显微镜(S-3400N,日本Hitachi公司)。
1.3 干燥方法
将黄精片均匀分成4组,每组360 g,然后均匀平铺于物料盘内,分别采用以下4 种方式进行干燥处理,干燥至黄精片干基含水量为0.125 g/g。①真空冷冻干燥:-40℃预冷冻24 h,冷阱温度为-50℃,真空度50 Pa以下,每隔120 min称一次质量。②热风干燥:温度为70℃,每隔30 min 称一次质量。③真空干燥:温度为70℃,每隔30 min称一次质量。④微波干燥:微波功率为280 W,加热时间固定为2 min,间歇时间为1 min,利用间歇时间记录干燥过程中的质量。
1.4 指标测定及计算方法
1.4.1 初始含水量
采用DHS-20A 型快速水分测定仪测定黄精片的含水量,得到黄精片平均初始含水量为77.78%。
1.4.2 干基含水量
干基含水量为湿物料中的水分质量与湿物料中的绝对干料质量之比,按式(1)计算[8]:
式中,M为干燥至t时刻的物料干基含水量(g/g);mt为干燥至t时刻的物料质量(g);m为绝对干料的质量(g)。
1.4.3 平均干燥速率
平均干燥速率是指单位时间内物质中水分的减少量,按式(2)计算[9]:
式中,DR为干燥速率,g/(g·min);M0为物料初始干基含水量(g/g);Mω为试验结束时物料的干基含水量(g/g);t为干燥时间(min)。
1.4.4 水分比
水分比表示样品中剩余的未被去除的水分,按式(3)计算[10]:
式中,MR为水分比;Mt为干燥至t时刻的物料干基含水量(g/g)。
1.4.5 有效水分扩散系数
有效水分扩散系数(Deff)是用来衡量物料在干燥过程中其水分蒸发速率快慢的重要指标,Deff越高,则脱水能力越强,并且该系数对物料内部水分扩散过程的深入分析具有重要意义[8]。运用Fick非稳态第二定律方程计算干燥过程中水分有效扩散系数:
式中,L为黄精片厚度的一半(mm);t为干燥时间(s);Deff为有效水分扩散系数(m2/s)。从而得到lnMR和干燥时间t的线性关系,将直线方程的斜率k代入公式(5)中可求出有效水分扩散系数[11]。
1.4.6 色泽
色泽是评价中药材干制品质量的重要指标之一,是评判黄精片等级的重要参数。利用色彩色差计测定黄精片的颜色,测定样品的亮度L*值,其值越大,产品的亮度越高,可以间接反映产品色泽的好坏[12]。每个样品重复测定3次,取平均值。
1.4.7 收缩率
将黄精片视为圆柱体,利用游标卡尺测量黄精片的直径和厚度,收缩率表达式如(6)所示[13]。
式中,SR为收缩率(%);V0为初始时刻的体积(mm3);Vt为t时刻的体积(mm3)。
1.4.8 复水比
取2 g左右黄精片放入水浴锅中,80℃恒温浸泡30 min后放在无风处沥水20 min,再用滤纸吸去表面水分,最后称质量,计算复水比,如式(7)所示[14]。
式中,RR为复水比(g/g);m1为样品复水后沥干水分所称得的质量(g);m0为样品复水前的质量(g)。
1.4.9 单位能耗
用去除1 kg黄精片水分所消耗的能量来表征黄精片的干燥能耗[(k W ·h)/kg],通过电能表测定[15]。
1.4.10 微观结构测定
将干燥后的黄精片切成2 mm×2 mm 的小块,使用扫描电子显微镜观测,将样品置于涂有一层导电胶的载物台上,并轻轻按压使其黏附,喷金,工作电压为15.0 k V,放大倍数为150倍[16]。
1.5 数据分析
试验均重复3次,试验结果以平均值±标准偏差表示。采用SPSS 27.0软件对试验数据进行显著性差异分析和邓肯多重极差检验,采用Origin 8.0软件绘图。
2 结果与分析
2.1 不同干燥方式对黄精片干燥特性的影响
2.1.1 不同干燥方式对黄精片干基含水量及干燥时间的影响
由图1(a)可知,随着干燥时间的延长,不同干燥方式下黄精片的干基含水量持续降低。由图1(b)可知,VFD、HAD、VD、MD 的干燥时间分别为660、240、340、131 min,可见MD 的干燥时间最短,与VFD、HAD、VD 相比,用时分别缩短80%、45%、61%。
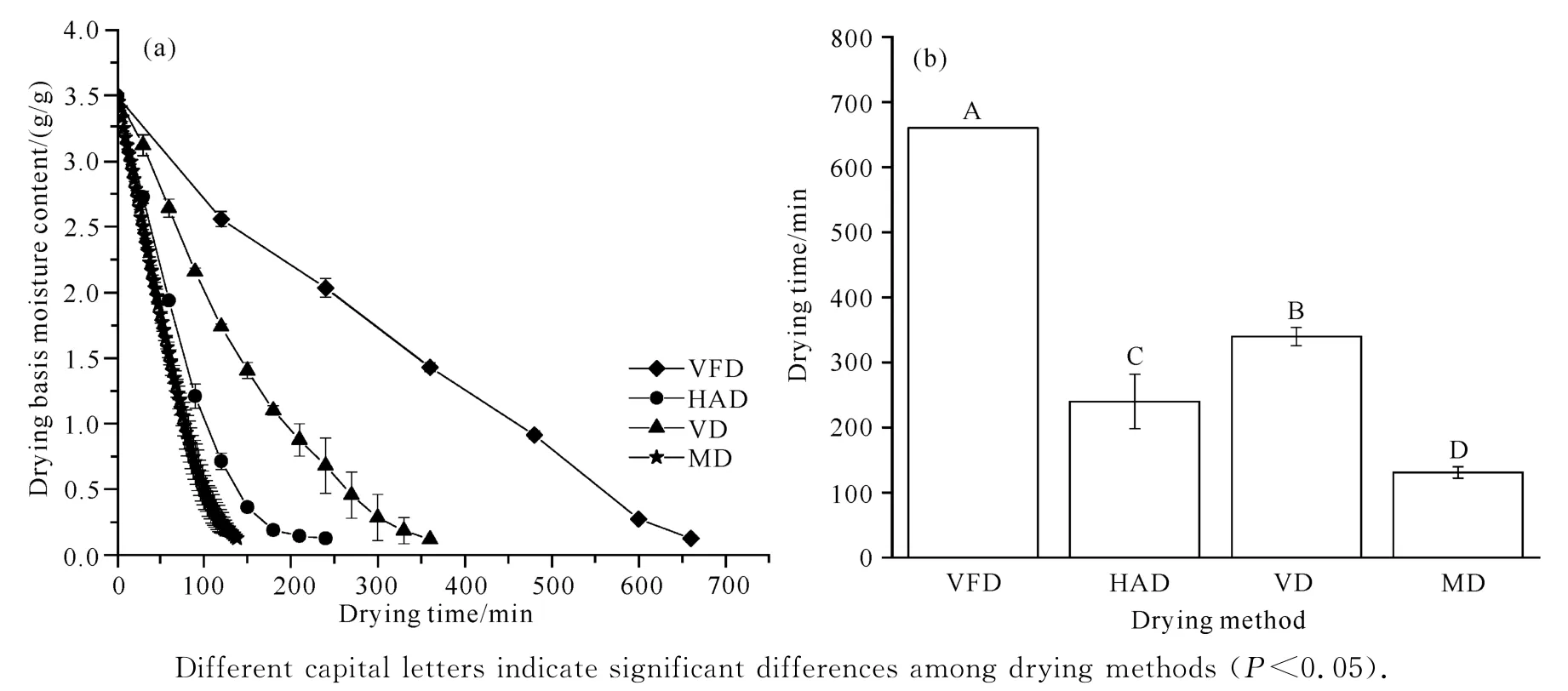
图1 不同干燥方式下黄精片的干基含水量及干燥时间Fig.1 Drying basis moisture content and drying time of P.kzngzanum Coll.et Hemsl.slices under different drying methods
2.1.2 不同干燥方式对黄精片平均干燥速率和有效水分扩散系数的影响
由图2可知,黄精片的平均干燥速率大小依次为MD>HAD>VD>VFD,与金鑫等[17]的研究结果类似。可能是因为微波具有较强的穿透性和只对极性分子加热的高选择性,使其可以穿透物料内部对物料整体进行加热,把水分从内部转移到表面,使物料受热更加均匀,并且能快速蒸发水分,因此干燥用时短[18]。

图2 不同干燥方式下黄精片的平均干燥速率Fig.2 Average drying rate of P .kzngzanum Coll.et Hemsl slices under different drying methods
由表1可知,4种干燥方式干燥后的黄精片的有效水分扩散系数为1.46×10-10-6.49×10-10m2/s,均在食品干燥的有效水分扩散系数(1×10-12-1×10-7m2/s)范围内[19]。MD 的干燥时间最短,有效水分扩散系数最高,为6.49×10-10m2/s;而VFD的干燥时间最长,有效水分扩散系数最低,为1.46×10-10m2/s。综上,MD 的有效水分扩散系数要高于其他3种干燥方式,主要是因为微波干燥速率快,该结果与孟建升等[20]的研究结果类似。
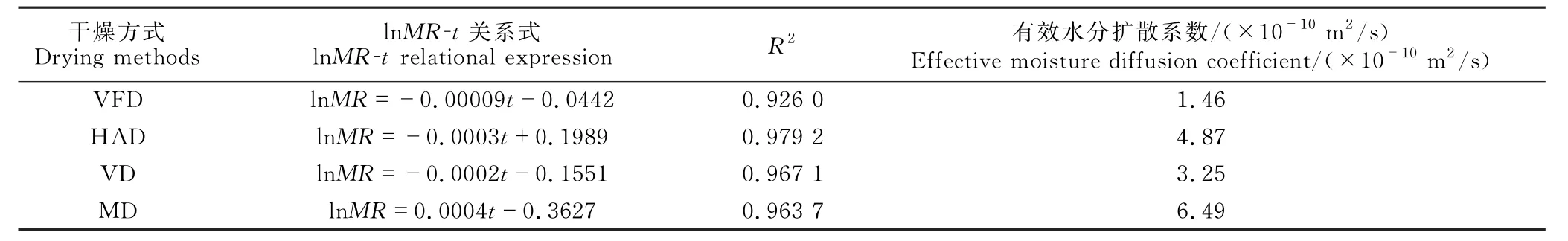
表1 不同干燥方式下的有效水分扩散系数Table 1 Effective moisture diffusion diffusivities coefficient under different drying methods
2.2 不同干燥方式对黄精片色泽的影响
由图3可知,4种干燥方式下黄精片的L*值在75.00-78.00内小幅波动,HAD 的黄精片L*值与VFD存在显著性差异,而MD、VD 与VFD 无显著差异,表明采用真空、微波和真空冷冻干燥方式能够更好地保持黄精片的颜色。这是因为在真空或者干燥时间短的条件下,黄精片在干燥过程中酶促褐变和非酶促褐变的程度都相对较低,因此VFD、VD 以及MD 的产品具有较好的色泽。相比之下,热风干燥过程中由于水分和酶的作用、氧化和较高温度引起的酶促褐变及美拉德反应等因素,导致样品色泽变化较大[21]。
2.3 不同干燥方式对黄精片收缩率的影响
从图4可知,MD 和VFD 的黄精片收缩率较低,分别为69.42%和69.36%,两者间无显著性差异;HAD 和VD 的黄精片收缩率显著高于MD 和VFD,分别为73.67%和73.04%,且两者间无显著性差异。究其原因可能是因为真空冷冻干燥过程中黄精片的水分以冰晶态直接升华排出,能较好地保持黄精片结构的完整性,故收缩率相对较小;在微波干燥过程中,黄精片内部的高水蒸气压力会使细胞膨胀,从而降低黄精片的收缩率[22]。
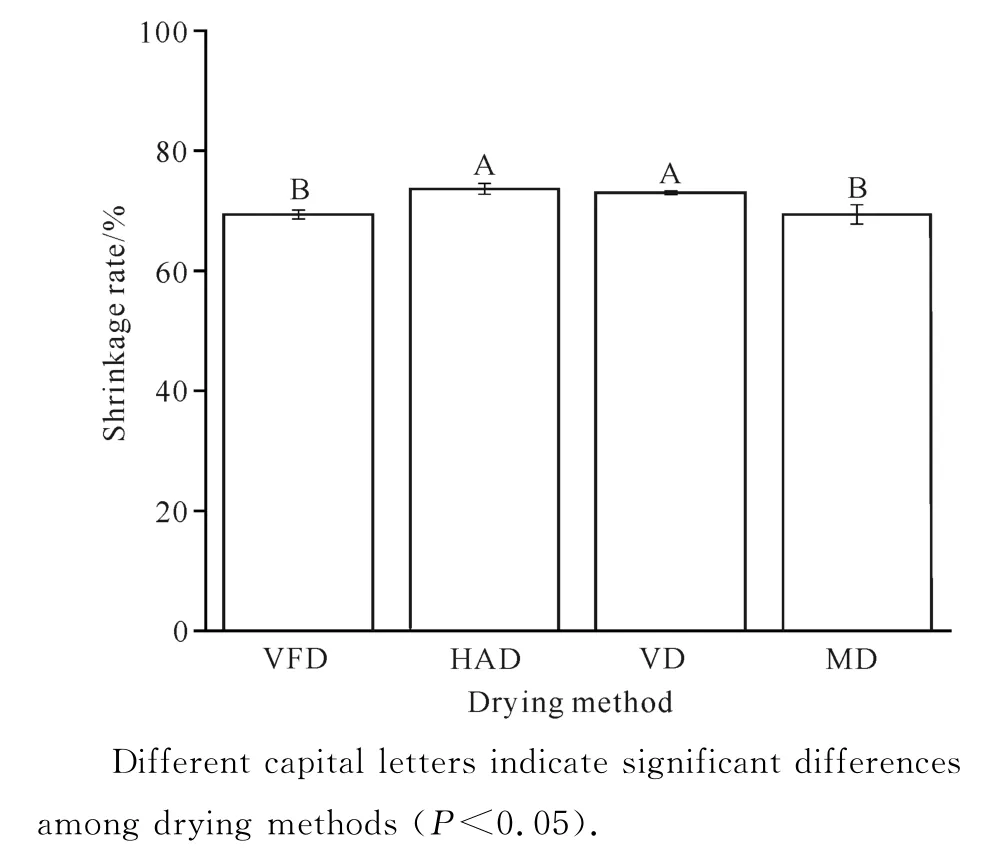
图4 不同干燥方式下黄精片的收缩率Fig.4 Shrinkage rate of P.kzngzanum Coll.et Hemsl.slices under different drying methods
2.4 不同干燥方式对黄精片复水比的影响
由图5可知,MD 和VFD 的黄精片复水比无显著差异,分别为4.39、4.88 g/g;HAD 和VD 的复水比分别为3.33、3.48 g/g,显著低于MD 和VFD 的黄精片(P<0.05),可能是因为HAD 和VD 的黄精片干燥时间相对较长,细胞损伤程度较高,且容易出现皱缩和硬化结壳现象,因此复水率较低。VFD、MD的黄精片具有较高的复水比,可能是因为真空冷冻干燥对黄精片的组织和分子结构破坏较小,能保持其原有的疏松结构,而微波干燥过程中的膨化效应,也赋予了干制品良好的复水性能[23]。
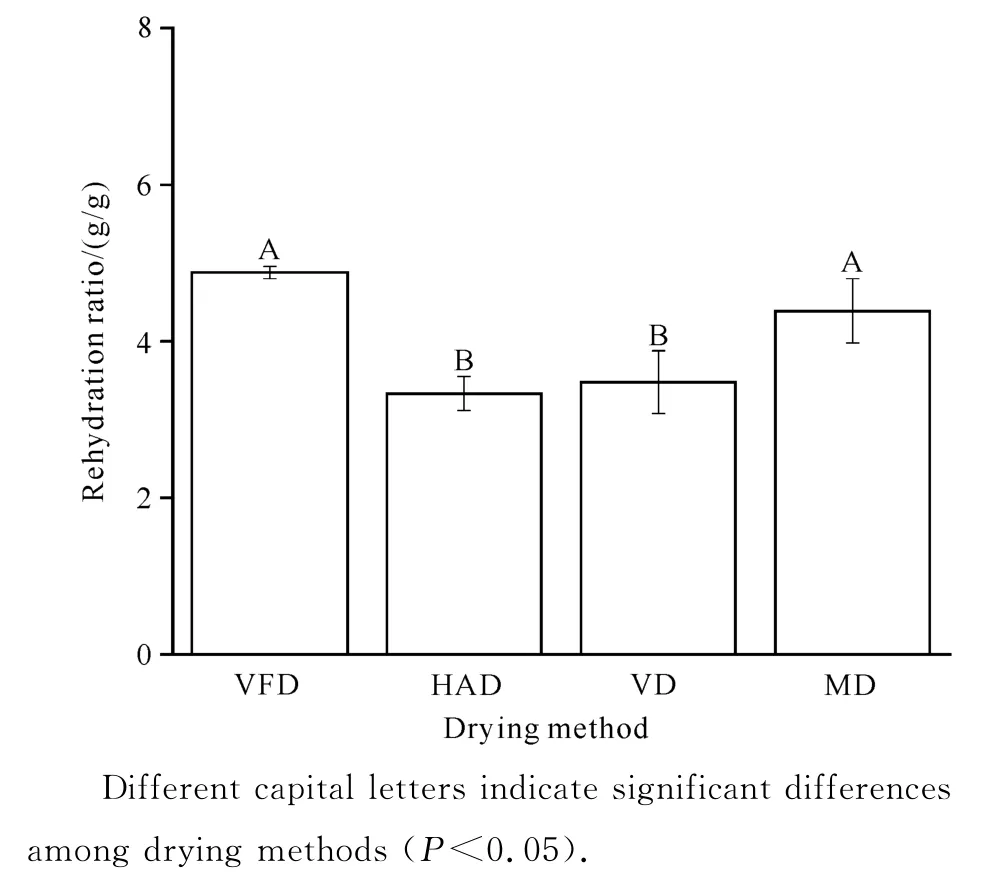
图5 不同干燥方式下黄精片的复水比Fig.5 Rehydration ratio of P.kzngzanum Coll.et Hemsl.slices under different drying methods
2.5 不同干燥方式对黄精片单位能耗的影响
由图6可知,VFD 的黄精片干燥至规定的干基含水量所需的单位能耗最高[27.44(k W·h)/kg],可能是因为VFD 中的黄精片干燥速率和水分减少较慢,因而干燥时间长,单位能耗高。MD 的黄精片干燥至规定的干基含水量所需的单位能耗最低[5.78(k W·h)/kg],与VFD、HAD、VD 相比,单位能耗分别减少79%、9%、22%,主要是因为微波干燥会使黄精片的内部温度升高,内部组织遭到破坏,从而形成更大的通道使得水分流失,因此单位能耗减少[24]。

图6 不同干燥方式下黄精片的单位能耗Fig.6 Unit energy consumption of P.kzngzanum Coll.et Hemsl.slices under different drying methods
2.6 不同干燥方式对黄精片微观结构的影响
由图7可知,VFD 的黄精片组织结构最疏松多孔且微孔道最大,因此其黄精干片相对而言收缩较少,组织细胞坍塌较少,复水比较高[25]。HAD 和VD的黄精片的组织结构较为致密,微孔道小且数量少,主要是热风干燥和真空干燥后的黄精片组织结构孔隙收缩较大所致。此外,组织结构还会增加水分扩散的阻力,阻碍水分的迁移,因此复水较少。MD 的黄精片也有较多孔隙,主要是因为黄精片内部吸收大量的微波能并产生较大的内压,促使内部水分快速向外蒸发,导致样品内部形成孔隙结构,与Yan等[26]研究的微波干燥法对甘薯丁微观结构的影响结果基本一致。
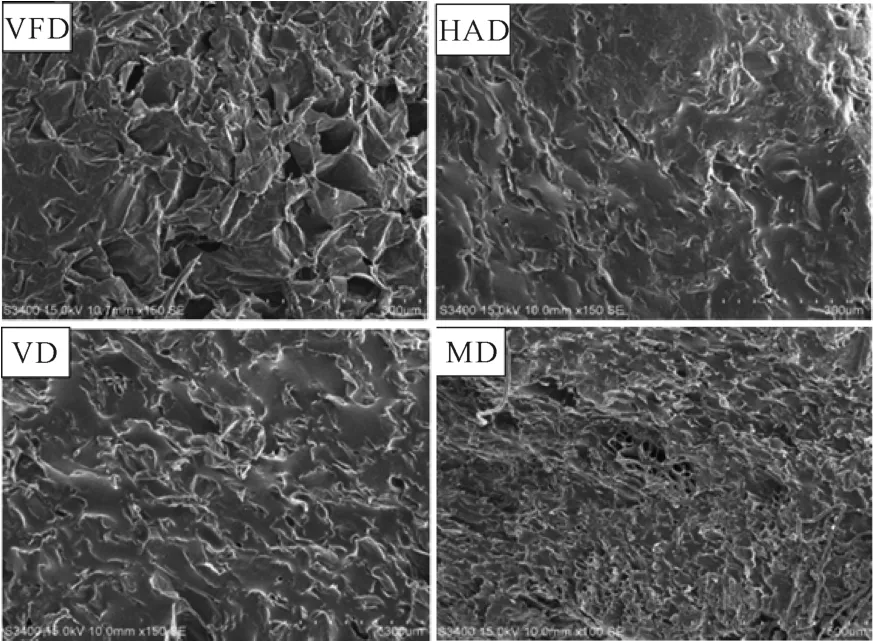
图7 不同干燥方式下黄精片的SEM 图Fig.7 SEM images of P.kzngzanum Coll.et Hemsl.slices under different drying methods
3 结论
真空冷冻干燥、热风干燥、真空干燥及微波干燥4种干燥方式对黄精片的干燥特性、色泽、收缩率、复水比及单位能耗均有显著影响。微波干燥与其他干燥方式相比,不仅能大幅度缩短干燥时间,而且能降低干燥的单位能耗,且相比热风干燥的样品具有良好的外观和较疏松多孔的结构,降低了色泽劣变。同时微波干燥的黄精片的L*值、收缩率、复水比和微观结构均接近真空冷冻干燥样品,显著优于热风和真空干燥样品。综上,采用微波干燥法干燥黄精片的工艺最佳且单位能耗最低,为黄精片干燥方式的应用提供了理论支持。