生物信息学分析IFN-γ诱导银屑病的关键基因及作用机制
杨 丽,李东海
(1.广州中医药大学第一临床医学院,广州 510405;2.广州中医药大学第一附属医院,广州 510405)
银屑病是一种慢性的炎症反应性疾病,被认为具有强烈的遗传易感性和自身免疫致病特性[1-2],但对于其发病机制尚不清楚。现代研究认为[3]其与角质形成细胞增殖和免疫细胞浸润以及真皮血管新生有关。有研究显示[4]在病毒性肝炎患者皮内注射IFN-γ后,在注射部位出现点滴状的银屑病皮损,提示IFN-γ可能与诱导银屑病皮损相关,但对IFN-γ如何导致银屑病的相关研究非常少,目前也没有对于IFN-γ导致银屑病相关的靶点基因及作用机制的研究。本文基于生物信息学,筛选了IFN-γ导致银屑病的10个关键基因,分别为:ISG15、IFIT1、RSAD2、MX1、IFIT3、IFIT2、IRF7、STAT2、MX2、OASL,根据相关文献分析这10个基因导致银屑病可能的作用机制。目前国内外虽已有通过生物信息学或其它的方法分析导致银屑病的关键基因的报道,但对IFIT3、IFIT2、OASL这3个基因与银屑病的联系研究较少。由于本文只是通过生物信息学做了理论推导,IFIT3、IFIT2、OASL等3个差异基因是否在银屑病致病机制中发挥重要作用和如何发挥作用尚需大量的实验来证明和研究。
1 资料与方法
1.1 一般资料
本次研究对象是从GEO数据库[5]的GPL571平台下载的GSE32407 mRNA基因芯片数据集。GSE32407数据集的实验者做这个实验的目的是为了确定IFN-γ是否诱导了银屑病皮损。方法:将IFN-γ或安慰剂单次皮内注射于10例健康人的皮肤和10例银屑病病人的非皮损的皮肤区域内,并在24 h后收集皮肤标本活检。结果:10例健康人的皮肤和10例银屑病病人无皮损的皮肤区域内均出现了银屑病皮损关键的病理和组织学特征,而安慰剂注射后均无任何改变。根据本文研究的目的及下载的GSE32407 mRNA基因芯片数据集,对样本进行基因转录谱分析,并对样本进行分组研究[6],需要特别说明的是,GSE32407数据集的实验者是在银屑病病人身上选取的无皮损的皮肤区域,后在注射IFN-γ后出现银屑病皮损,而注射安慰剂未出现银屑病皮损,所以在本文中“银屑病病人”和“银屑病皮损”是两个不同的概念,分组情况见表1。
1.2 方法
1.2.1 筛选DEGS
应用R语言的 “limma”包下载基因矩形文件,将健康人组的10例注射IFN-γ后出现银屑病皮损的皮肤和10例注射安慰剂后未出现皮损的皮肤进行分析,设定阈值为|Log2(FC)|≥1且P<0.05[7],筛选出差异基因。同理,筛选出银屑病病人组的差异基因。然后分别将健康人组的差异基因和银屑病病人组的差异基因的数据分别导入GraphPrism8.0.2,并用X,Y轴数据列表绘制火山图。同时,利用R语言函数中的“VennDiagram”包绘制韦恩图。
1.2.2 DEGs的GO分析及KEGG分析
在做前面部分的火山图和韦恩图时,是用健康人组和银屑病病人组(分组情况见表1)分别做的差异基因的研究,是为了证明不管是健康人组还是银屑病病人组由IFN-γ引起的有皮损的皮肤和由安慰剂引起的无皮损的皮肤相比基因表达都是有差异的。因为本文是为了研究IFN-γ对银屑病基因表达的影响,所以应该是有银屑病皮损和无银屑病皮损的皮肤做对比,但由于健康人和银屑病病人是两个群体,所以采用分别分析出两组有皮损和无皮损皮肤的差异基因,再进行差异基因的汇总和去重。总的差异基因即是(健康人组的10例注射IFN-γ后出现银屑病皮损的皮肤和10例注射安慰剂后未出现皮损的皮肤进行分析得来的差异基因)+(银屑病病人组10例注射IFN-γ后出现银屑病皮损的皮肤和10例注射安慰剂后未出现皮损的皮肤进行分析得来的差异基因)-(健康人组和银屑病病人组共同的差异基因)。在做后面的分析研究时(包括GO分析及KEGG分析,PPI网络构建,热点基因的筛选),用的差异基因都是总的差异基因。
用EXCEL将健康人组和银屑病病人组所有筛选出来的DEGs汇总,并将两组的重复值去掉[8]。再将整理好的Excel表格里的数据导入DAVID在线数据库[9]( https://david.ncifcrf.gov/)进行数据富集分析,用R语言函数包"ggplot2"进行KEGG通路分析和GO分析的可视化。P<0.05作为富集分析的筛选条件[10]。其中GO分析分为三类,分别为细胞定位分析(CC,Cellular components)、分子功能分析(MF,Molecular function)、生物学途径分析(BP,Biological process)[11]。为了展示比较重要的结果,筛选GO分析和KEGG分析的排名前20做可视化分析。
1.2.3 差异基因的 PPI网络构建
由于差异基因有1 321个,数量过多,根据本研究在汇总的差异基因里再次选取|Log2FC|≥2,P<0.05的差异基因[12]。在String公用数据库[13]( https://string-db.org)中,将新得到的397个DEGs置入。在String公用数据库中下载得到目标基因和靶基因相互作用的数据,进一步探寻这些DEGs之间的相互联系,置信度设置为超高置信度(置信度>0.9)。利用STRING数据库得到的数据作为数据集导入Cytoscape[14]3.7.0,得到初步的蛋白质互作网络。再将DEGs和对应的Log2FC值用Excel表整理后作为属性表1导入Cytoscape3.7.0,将DEGs和对应的Degree值作为属性表2导入Cytoscape3.7.0。利用Log2FC的值设置颜色,利用Degree值设置填充图形大小,映射方式均选择Continuous Mapping。同时用Mcode[15]插件筛选PPI网络中选择最为紧密的集簇,用Cytohubba[16]插件利用Degree值筛选排名前十的热点基因,并将排名前十的关键基因的名字和主要功能以表格的形式列出。
2 结 果
2.1 差异基因的筛选结果
用R语言对GSE32407基因芯片进行分析后,健康人组有皮损和无皮损皮肤的差异基因有323个,上调基因用红色表示(Log2( FC) ≥1,P<0.05),下调基因用绿色表示(Log2( FC)≤1,P<0.05),上调基因共208个,下调基因共115个,健康人组的差异基因的火山图见图1a。银屑病病人组有皮损和无皮损皮肤的差异基因共有1 307个,其中674个基因表达上调,633个基因表达下调。银屑病病人组的差异基因的火山图见图1b,颜色标注和筛选方法和图1a相同。韦恩图红色代表健康人组有皮损和无皮损皮肤的差异基因个数,蓝色代表银屑病病人组有皮损和无皮损皮肤的差异基因个数,交集代表健康人组和银屑病病人组共有的差异基因个数。韦恩图结果显示健康人组和银屑病病人组共有的差异基因有309个,总的差异基因为1 321个(总的差异基因的算法见本文1.2.2小节的分析),韦恩图见图2。

图1 有皮损组和无皮损组的DEGs火山图Fig.1 Volcano map of DEGs between skin lesion group and normal group
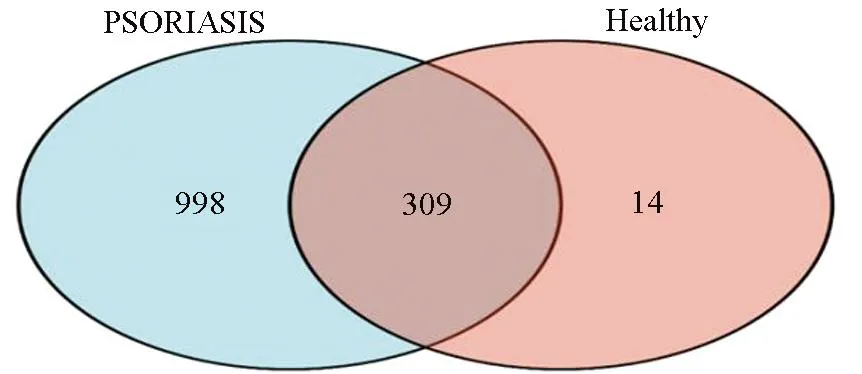
图2 健康人组和银屑病病人组的DEGs韦恩图Fig.2 The venn graph of DEGs in Healthy people and patients with psoriasis
2.2 DEGs的GO和KEGG分析结果
做GO分析及KEGG分析、PPI网络构建、热点基因的筛选时用的差异基因都是总的差异基因,共1 321个。GO分析和KEGG富集分析图中X轴代表以10为底矫正后的P值(通过Benjamini-Hochberg 方法纠正错误发现率,即FDR值)倒数的对数,X轴数值越大,代表越富集,Y轴显示具体的富集结果。GO分析得出差异基因主要在含胶原的细胞外基质、质膜外侧面、膜微区、细胞膜区、吞噬泡内。差异基因的主要功能是细胞因子及受体结合,Toll样受体结合,糖胺聚糖结合。主要生物学过程是:病毒防御反应,白细胞迁移,细胞因子产生的正调控,细胞趋化性。KEGG富集分析发现,差异基因主要可能与破骨细胞分化,病毒蛋白与细胞因子和细胞因子受体的相互作用, NF-kappa B信号通路, TNF信号通路等有关。KEGG/GO分析结果见图3。
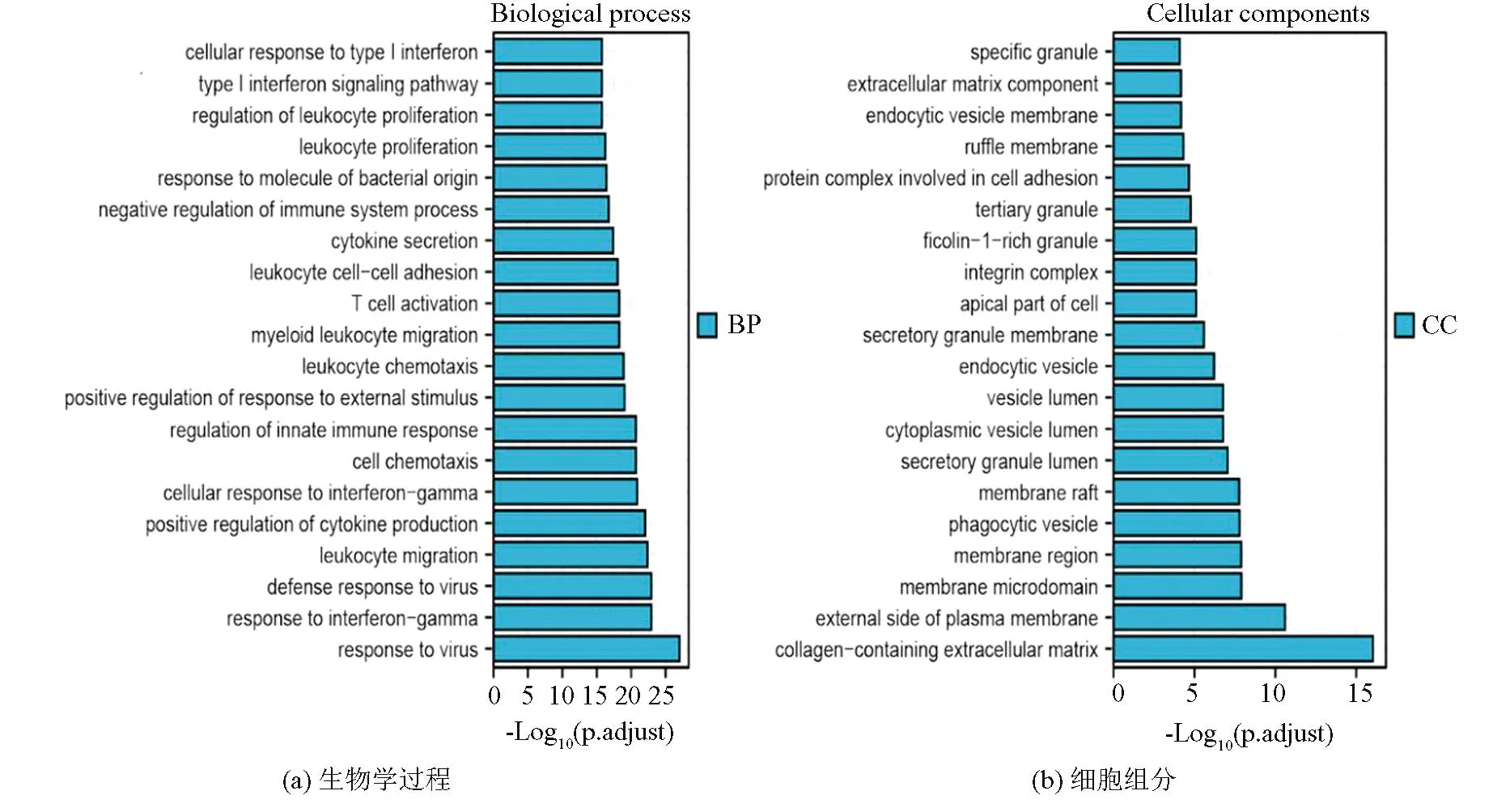
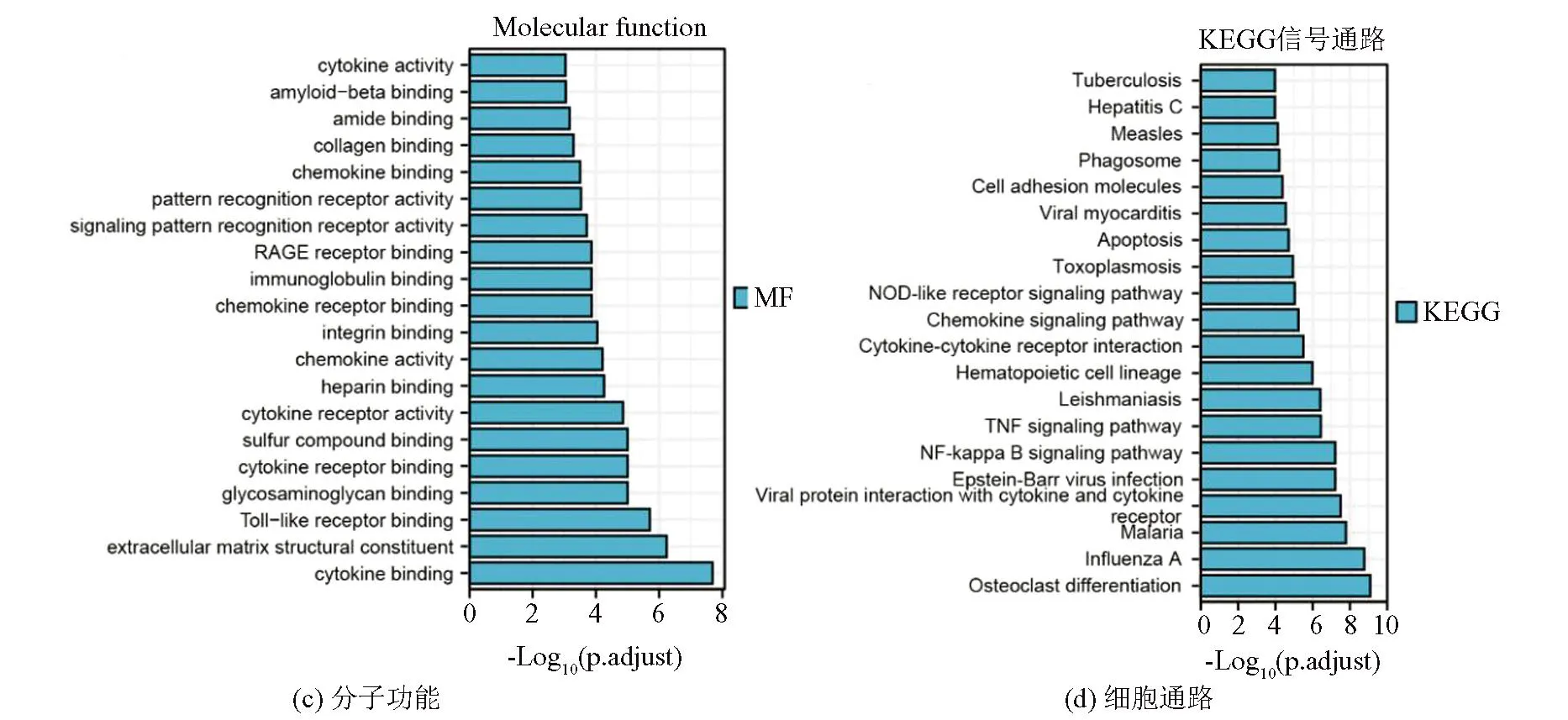
图3 GO富集分析和KEGG通路富集分析柱状图Fig.3 Bar charts of KEGG pathway enrichment analysis ang GO enrichment analysis
2.3 PPI网络分析结果
PPI网络共有187个节点、702条边,为了方便研究,将Degree值小于或等于3的节点和连线去掉,得到94个节点,572条边,见图4(颜色表示Log2FC值的排名,颜色越深,表示差异越大,填充大小表示Degree值的排名,尺寸越大,表示基因蛋白连接度越高)。通过Mcode插件寻找出了连接最为紧密的6个关键子网,每个子网表示子网内的基因相关程度高,见图5。通过CytoHubba插件按照Degree为标准,最终筛选10个热点基因,分别为:ISG15、IFIT1、RSAD2、MX1、IFIT3、IFIT2、IRF7、STAT2、MX2、OASL。它们的功能见表2。
3 讨 论
由前面的GO分析和KEGG分析得知差异基因的主要功能是细胞因子及受体结合,Toll样受体结合,糖胺聚糖结合;主要生物学过程是:病毒防御反应,白细胞迁移,细胞因子产生的正调控,细胞趋化性;KEGG富集分析发现,差异基因主要可能与破骨细胞分化,病毒蛋白与细胞因子和细胞因子受体的相互作用, NF-kappa B信号通路, TNF信号通路等有关。

图4 PPI网络Fig.4 Protein-protein interaction network
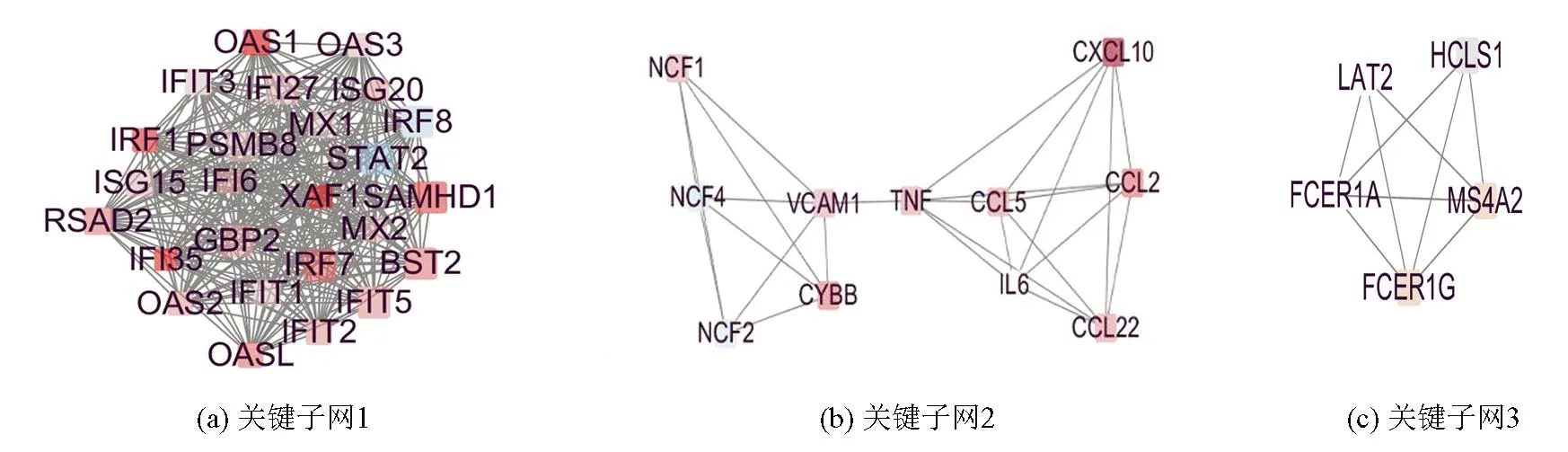
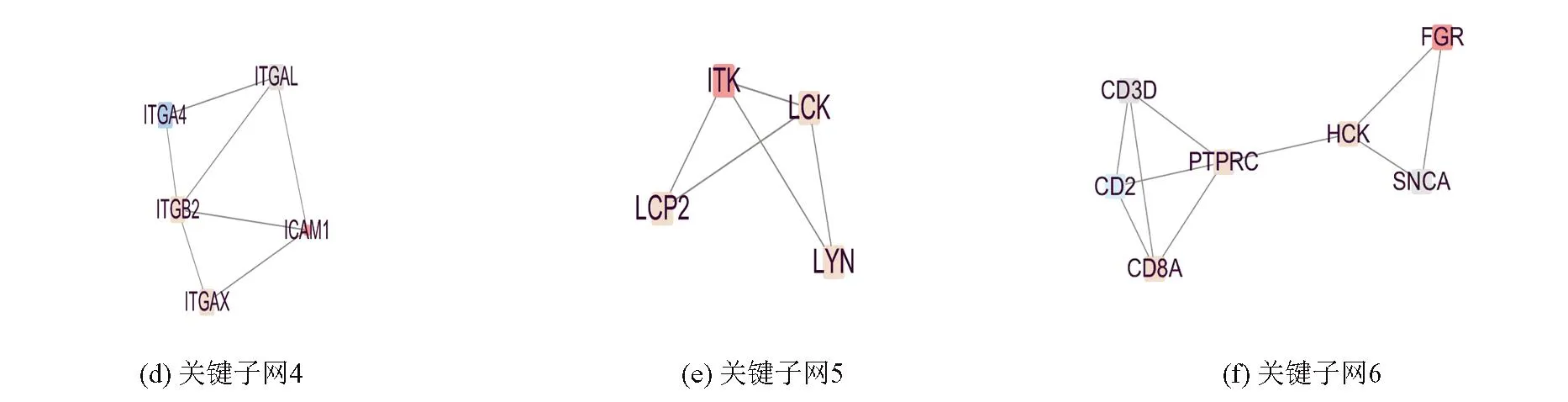
图5 关键子网的PPI 网络图Fig.5 PPI network of key subnetworks
由PPI可得到10个关键基因:ISG15、IFIT1、RSAD2、MX1、IFIT3、IFIT2、IRF7、STAT2、MX2、OASL。这10个基因蛋白由表2可看出绝大部分是抗病毒蛋白。这些热点基因导致银屑病的发生可能主要通过四个途径:①促进角质形成细胞增殖:MX2蛋白[17]参与调控细胞核质运输及细胞分裂周期。而银屑病的病理机制[18]与角质形成细胞的细胞周期有关,二者可能具有相关性。另外ISG15[19-21]可以通过被称为“ISG修饰”的可逆过程与蛋白质底物结合,这些蛋白质结合底物包括MX1,IFIT1,STAT2,结合后会促进角质细胞增殖,形成银屑病鳞屑;②促进中性粒细胞浸润:未结合底物的ISG15蛋白[22]可诱导自然杀伤细胞增殖,并且作为嗜中性粒细胞的趋化因子,促进局部微脓肿的产生;③促进树突细胞成熟:IFN-γ注入后,RSAD2[23]和IRF7高表达会促进树突细胞成熟,RSAD2被认为是树突细胞成熟的标志物。成熟的树突细胞[24]能有效激活初始T细胞,增强分泌细胞因子和抗原提呈的作用。并且成熟的树突细胞和激活的T细胞在IFN-γ的刺激下又能分泌IFN-γ,形成正反馈[25]。但成熟的树突细胞在IFN-γ导致银屑病中发挥的作用的更精确和更系统的机制尚不清楚; ④诱导炎症反应: IFN-γ注入后,导致IRF7磷酸化,并移位到细胞核诱导IFN-α产生。IFN-α[26]激活髓样树突状细胞,进而产生肿瘤坏死因子和IL-23 ,随后IL-23 联合其他炎性细胞因子促进自身免疫性T细胞的活化、增殖、迁移并大量的聚集于表皮,活化的T细胞产生大量的细胞因子,如IFN-γ、IL-17 和IL-22。其中IL-17[27]是中性粒细胞激活和募集导致炎症的重要介质,可强烈诱导中性粒细胞趋化因子的表达,导致大量中性粒细胞聚集于表皮,从而促进炎症反应。对于IFIT3、IFIT2、OASL这三个关键基因目前的研究较少,它们对于银屑病皮损发生的相关机制尚不清楚。但IFIT3、IFIT2均是IFIT家族的成员,可能与IFIT1发挥相似的作用。有研究显示OASL蛋白[28]的异位表达通过cGAS(环磷酸鸟苷-腺苷合成酶)-STING(干扰素刺激蛋白)感应途径抑制IFN诱导。IFIT3、IFIT2、OASL这三个关键基因是否能作为银屑病致病途径中关键的靶点基因还需要实验研究和验证,本文通过生信推导的结果仅做理论参考。

表2 10个枢纽基因的名称及其功能Table 2 Name and function of 10 pivotal genes
4 结 论
1)IFN-γ诱导银屑病的10个关键差异基因是ISG15、IFIT1、RSAD2、MX1、IFIT3、IFIT2、IRF7、STAT2、MX2、OASL,国内外已有研究对IFIT3、IFIT2、OASL等3个基因与银屑病的关系关注较少,这3个基因可能成为导致银屑病的重要基因,但尚需实验验证;
2)IFN-γ诱导银屑病的作用机制可能是通过关键差异基因的表达,促进角质形成细胞增殖、树突状细胞成熟和中性粒细胞浸润,导致局部炎症反应,从而导致银屑病,但这个推论仅是通过生信分析推导的,因此还需要进一步的实验验证;
3)目前银屑病靶向药物研究[29]是热点,本文可为治疗银屑病的靶向药物研究提供一定的理论依据。另外,在国内外银屑病动物模型[30]用咪喹莫特诱导的较多,但很少用IFN-γ诱导银屑病制作动物模型,可能在将来通过更多的实验研究验证后可应用于诱导银屑病动物模型。

