6种大型海藻甘油糖脂的吸湿保湿活性*
龙正康,易俪慧,李宇翔,孙颖颖,b,c
(江苏海洋大学 a.江苏省海洋生物资源与生态环境重点实验室; b.江苏省海洋生物产业技术协同创新中心; c.江苏省海洋生物技术重点实验室,江苏 连云港 222005)
0 引言
甘油糖脂是一类由亲水性糖基和亲脂性甘油酰基通过糖苷键连接而成的糖复合物[1],普遍存在于植物的类囊体薄膜中[2-3]。因具有独特的两亲性结构(见图1)[4],甘油糖脂具备了抗肿瘤[5]、抗氧化[6]、抗病毒[7]、抗炎[8]、抗菌[9]和促凝血[10]等多种不同的生物活性。甘油糖脂可作为食品添加剂用于食品的防腐保鲜,也可作为保湿剂用于提升化妆品性能,还可进一步应用于医药行业开发为抗肿瘤、抗病毒等药物,在医药、食品和化妆品等领域有着良好的应用前景。

图1 甘油糖脂结构Fig.1 Structure of glycerol glycolipids
目前,以山梨醇、丙三醇、丁二醇和聚乙二醇等为主要成分的保湿剂被广泛应用于化妆品[11]、食品[12]和医药[13]领域,给人们的生活带来了诸多便利。这类保湿剂大多为人工合成[14],对于合成保湿剂长时间使用的安全性目前仍有不少研究者和消费者持怀疑态度。随着人们健康和环保意识的增强,天然来源保湿剂的开发越来越受到关注[15]。有研究表明,某些植物提取物可作为天然保湿类活性物质加入到食品和化妆品中,且取得了相对较好的保湿效果,如山药多糖[16]和竹叶黄酮[17]。植物天然保湿剂主要包括植物多糖类,植物皂苷、黄酮和多酚类,植物氨基酸和肽类,以及植物油等4类保湿活性物质[18]。大型海藻资源丰富,是挖掘海洋活性化合物的理想来源[19]。从海藻中筛选出天然、高效和安全的保湿活性组分,用它们来代替合成的保湿剂成为食品、化妆品和医药行业发展的趋势。
甘油糖脂作为大型海藻中普遍存在的一类多功能化合物[20],其具有的亲水性糖基使甘油糖脂拥有吸湿保湿活性。然而,到目前为止国内外对甘油糖脂吸湿保湿活性的研究报道还很少。基于此,本文选用海水红毛菜、菊花江蓠、江蓠、条斑紫菜、海萝和石花菜等6种常见的大型海藻,采用甲醇浸提和液液萃取分离制备得到甘油糖脂组分,通过与常用吸湿保湿剂丙三醇[21]、山梨醇[22]和海藻酸钠[23]进行比较,研究这些组分的吸湿保湿活性及其对鲜切苹果的保湿作用,以期为该类甘油糖脂在食品和化妆品等领域的应用提供参考。
1 材料与方法
1.1 材料与设备
海水红毛菜、石花菜、海萝、菊花江蓠、江蓠和条斑紫菜干品均由江苏碧蓝海洋生物科技有限公司提供;变色硅胶,国药集团化学试剂有限公司;碳酸钠、无水硫酸铵、丙三醇,分析纯,国药集团化学试剂有限公司;甲醇、正己烷、乙酸乙酯和正丁醇,分析纯,南京化学试剂股份有限公司;二氯甲烷,分析纯,江苏碧蓝海洋生物科技有限公司;山梨醇、海藻酸钠,分析纯,阿拉丁生化试剂公司;硅胶板,青岛海洋化工厂分厂。
BS323S型电子天平,赛多利斯科学仪器(北京)有限公司;SK-1快速混匀器,金坛区西城新瑞仪器厂;DHG-9240A电热恒温鼓风干燥箱,上海一恒科技有限公司;XO-3200DTD超声波清洗器,南京先欧仪器制造有限公司;R5D28旋转蒸发仪,上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 海藻甘油糖脂组分的制备 依照文献[24]方法并进行适当修改来制备甘油糖脂。海藻干品经清洗、干燥、超微粉碎后,过40目筛备用。称取海藻干粉末10 g,加入到体积分数85%甲醇溶液中,摇匀后密封放入恒温超声波清洗仪器中,在料液比1∶30、温度55 ℃、功率350 W的条件下提取2 h。提取结束后,取出抽滤,45 ℃旋转蒸发除去甲醇,烘箱45 ℃下干燥12 h后得浸膏,产物称量质量。将所得浸膏用pH为2的缓冲液[25]溶解(pH=2缓冲液配制:分别称取25.000 0 g NaCl和3.727 5 g KCl,加入6.5 mL 2 mol/L盐酸,蒸馏水定容至1 000 mL),充分振荡,获得浸膏溶液。将浸膏溶液倒入分液漏斗,按照浸膏溶液与有机溶剂体积比2∶1先后加入正己烷萃取3次。正己烷相合并收集,减压蒸干,获得正己烷萃取相;萃余相减压蒸发除去正己烷后,采用相同方法,依次加入二氯甲烷、乙酸乙酯和正丁醇进行分部萃取,将所得萃取相进行硅胶薄层层析检测(取硅胶板分别距上下底0.5~1 cm画线,毛细管每间隔1 cm进行点样,于层析杠中以V(氯仿)∶V(甲醇)∶V(水)=65∶15∶2展开,与标准品SQDG(硫代异鼠李糖甘油二酯)、DGDG(双半乳糖甘油二酯)和MGDG(单半乳糖二酰甘油)比较。将含有甘油糖脂的萃取相旋转蒸发浓缩后,得到甘油糖脂组分。
1.2.2 海藻甘油糖脂组分的吸湿活性检测 采用文献[26-28]方法,进行适当修改后测定吸湿活性。取直径3 cm、洁净恒重的称量瓶若干,做好标记后用天平称质量并记录为m0。再分别称取适量(0.03~0.05 g)海藻甘油糖脂组分以及丙三醇、山梨醇和海藻酸钠于称量瓶中,记录称量瓶和样品的质量m1。称量后立即盖上瓶盖,将称量瓶分别放置于两个预饱和12 h的干燥器中,其中一个干燥器放饱和碳酸钠溶液(相对湿度RH=43%),另一个放饱和硫酸铵溶液(相对湿度RH=81%)。将称量瓶盖打开,盖上干燥器盖子,样品于干燥器中放置4,8,12,24,36,48,60,72 h后分别称质量,并记录下各时间点称量瓶和样品的质量m2。环境温度保持25 ℃,每组样品设3个平行。吸湿率计算公式为
式中:P1为吸湿率,%;m0为称量瓶质量,g;m1为称量瓶+样品质量,g;m2为放置在干燥器中不同时间段后的称量瓶+样品质量,g。
1.2.3 海藻甘油糖脂组分的保湿活性检测 参照文献[26-28]方法,进行适当修改后用于测定保湿活性。取直径为3 cm、洁净恒重的称量瓶若干,做好标记后用天平称质量并记录为m′0。再分别称取海藻甘油糖脂组分以及丙三醇、山梨醇和海藻酸钠(0.03~0.07 g),加入适量蒸馏水配制成质量分数10%的水溶液,记录下称量瓶和样品的质量m′1。称完立即盖上瓶盖,将称量瓶放置于硅胶干燥器中。将称量瓶盖打开,盖上干燥器盖子,样品于干燥器中放置2,4,8,20,30,42,54,66,72 h后分别称质量,并记录各时间点称量瓶和样品的整体质量m′2。环境温度保持在25 ℃,每组样品设3个平行。保湿率计算公式为
式中:P2为保湿率,%;m′0为称量瓶质量,g;m′1为称量瓶+样品质量,g;m′2为放置在干燥器中各时间段后称量瓶+样品质量,g。
1.2.4 鲜切苹果保湿活性检测 取90 mm洁净恒重的培养皿,做好标记后称量质量并记录M0;再称取海藻甘油糖脂组分(0.52~0.54 g),加入适量蒸馏水超声溶解,分别配制成质量分数10%的水溶液,将新鲜切块苹果放入浸泡1 min后,记录培养皿和样品的质量M1;称好后室温条件下放置4,8,20,36,48,60,72 h后分别称量质量,记录下各时间点培养皿和样品的质量My,每个实验设3个平行。保湿活性计算公式为
式中:W为保湿率,%;M0为培养皿质量,g;M1为培养皿+样品质量,g;My为放置在干燥器中各时间段后培养皿+样品质量,g。
1.2.5 数据处理
实验数据采用SPSS 27.0.1和OriginPro 2022进行独立样本检验统计分析,P<0.05为显著差异,P<0.01为极显著性差异。
2 结果分析
2.1 海藻甘油糖脂组分的制备与检测
海水红毛菜等6种海藻经甲醇超声波浸提、液液萃取后,获得6种甘油糖脂提取物。其中,海水红毛菜、石花菜和菊花江蓠的正己烷萃取物及正丁醇萃取物得率明显(P<0.05)高于其他溶剂的萃取物得率;海萝二氯甲烷萃取物和正丁醇萃取物得率较高,江蓠和条斑紫菜正丁醇萃取物得率明显(P<0.05)高于其他溶剂的萃取物得率(见表1)。据表2方差分析结果可知,各海藻甘油糖脂萃取物得率间有显著差异(P<0.01)。薄层层析检测表明,6种海藻的液液萃取物均含有甘油糖脂组分(见图2)。综合分析,选取正丁醇萃取物(甘油糖脂组分)进行后续吸湿保湿活性研究。
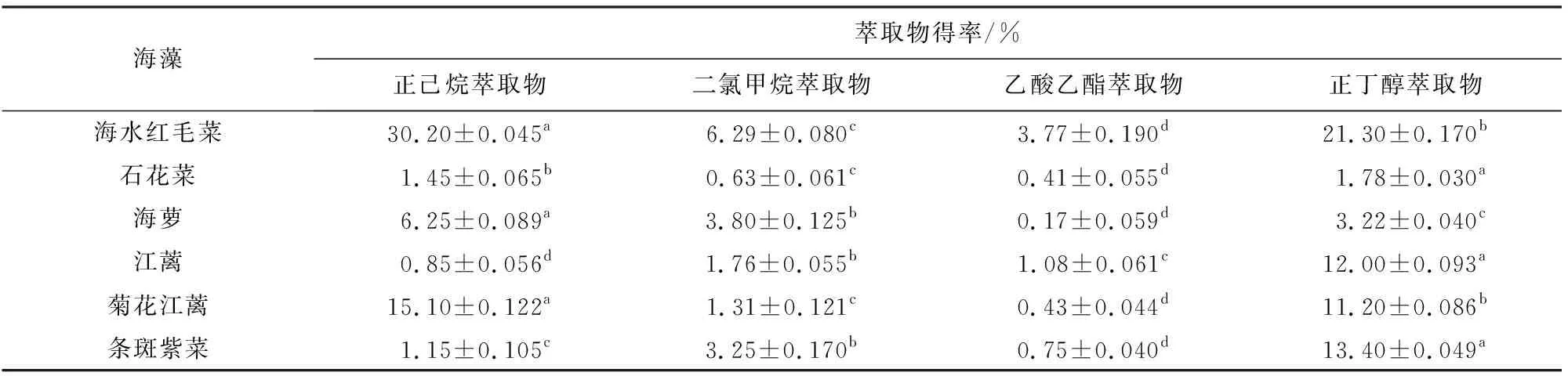
表1 6种海藻液液萃取物得率Table 1 Yields of liquid-liquid extracts of six macroalgae
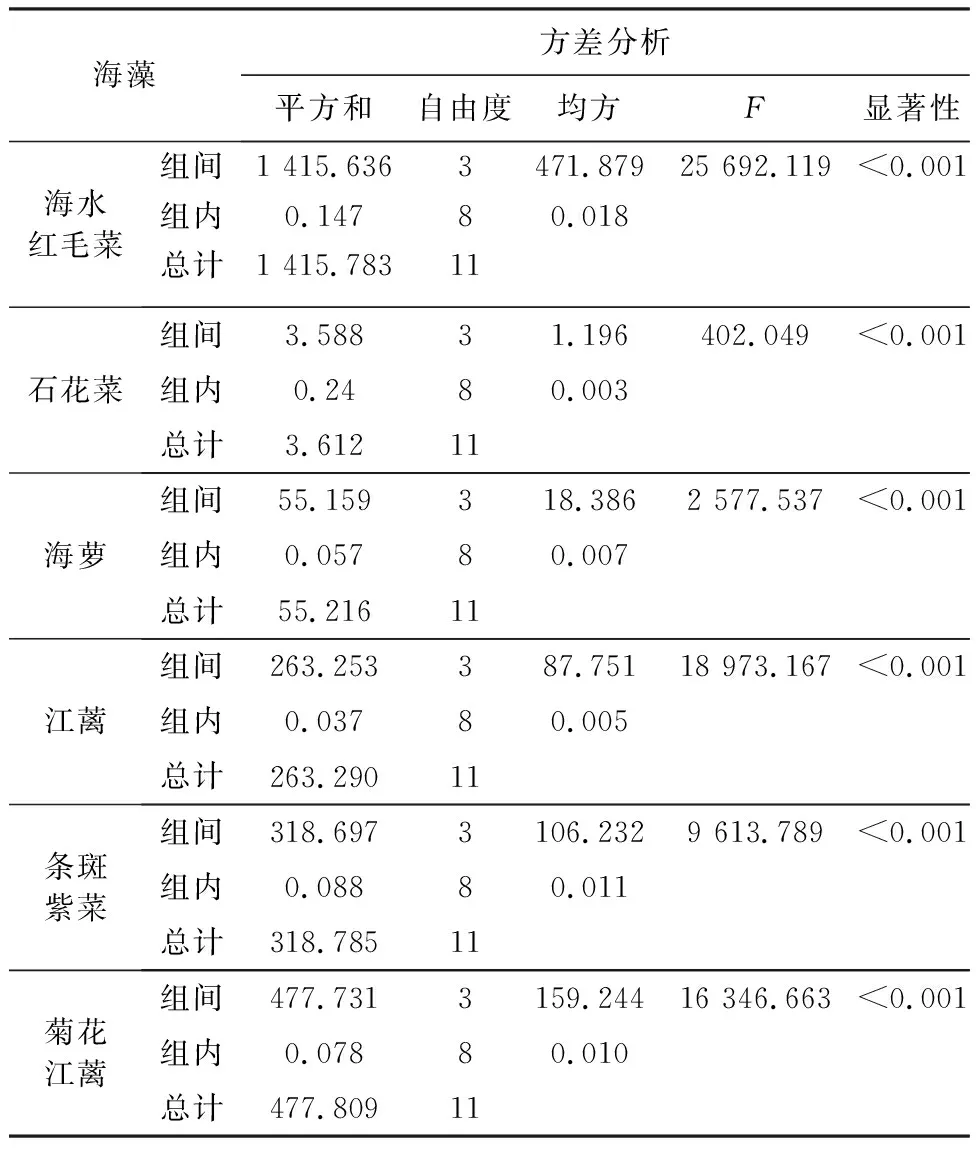
表2 液液萃取物得率方差分析Table 2 Variance analysis of the yields of liquid-liquid extracts

图2 海藻提取物甘油糖脂检测Fig.2 Detection of glycerol glycolipids of methanol extracts
2.2 海藻甘油糖脂的吸湿活性
由图3和表3可知,丙三醇、山梨醇和海藻酸钠吸湿能力顺序为丙三醇>山梨醇>海藻酸钠。对于6种海藻而言,除石花菜和菊花江蓠甘油糖脂组分吸湿活性随时间变化不明显外(P>0.05),其余4种海藻甘油糖脂的吸湿活性随时间延长而明显增大(P<0.05),尤其是江蓠。相对湿度为43%时,江蓠甘油糖脂吸湿活性明显(P<0.05)高于山梨醇;海水红毛菜和菊花江蓠甘油糖脂吸湿活性明显(P<0.05)高于海藻酸钠;条斑紫菜甘油糖脂则显示出与海藻酸钠非常接近(P>0.05)的吸湿活性。
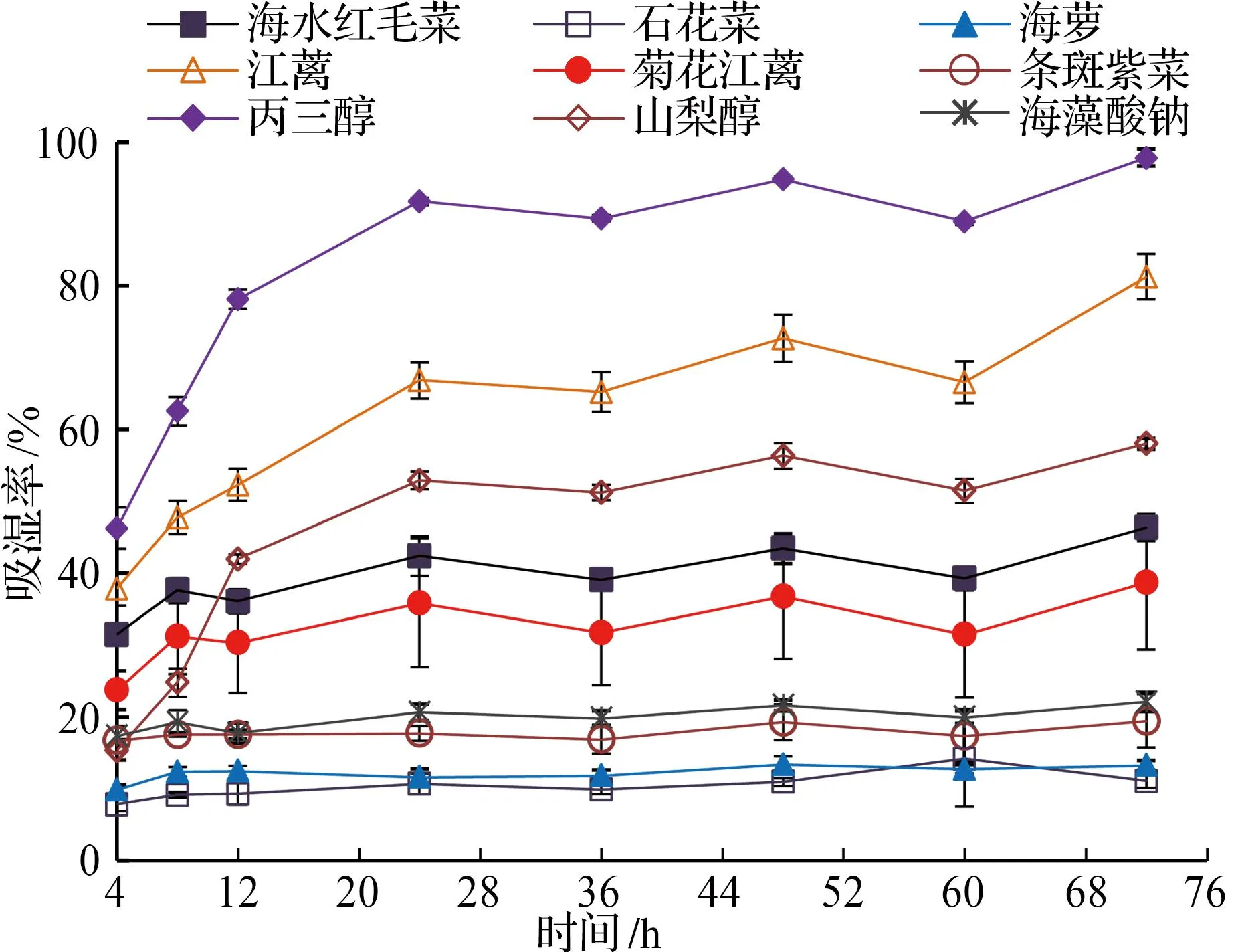
a 相对湿度43%
b 相对湿度81%图3 6种海藻甘油糖脂及常见吸湿剂的吸湿活性比较Fig.3 Comparison of hygroscopic activities of glycerol glycolipids of six macroalgae and common hygroscopic agents
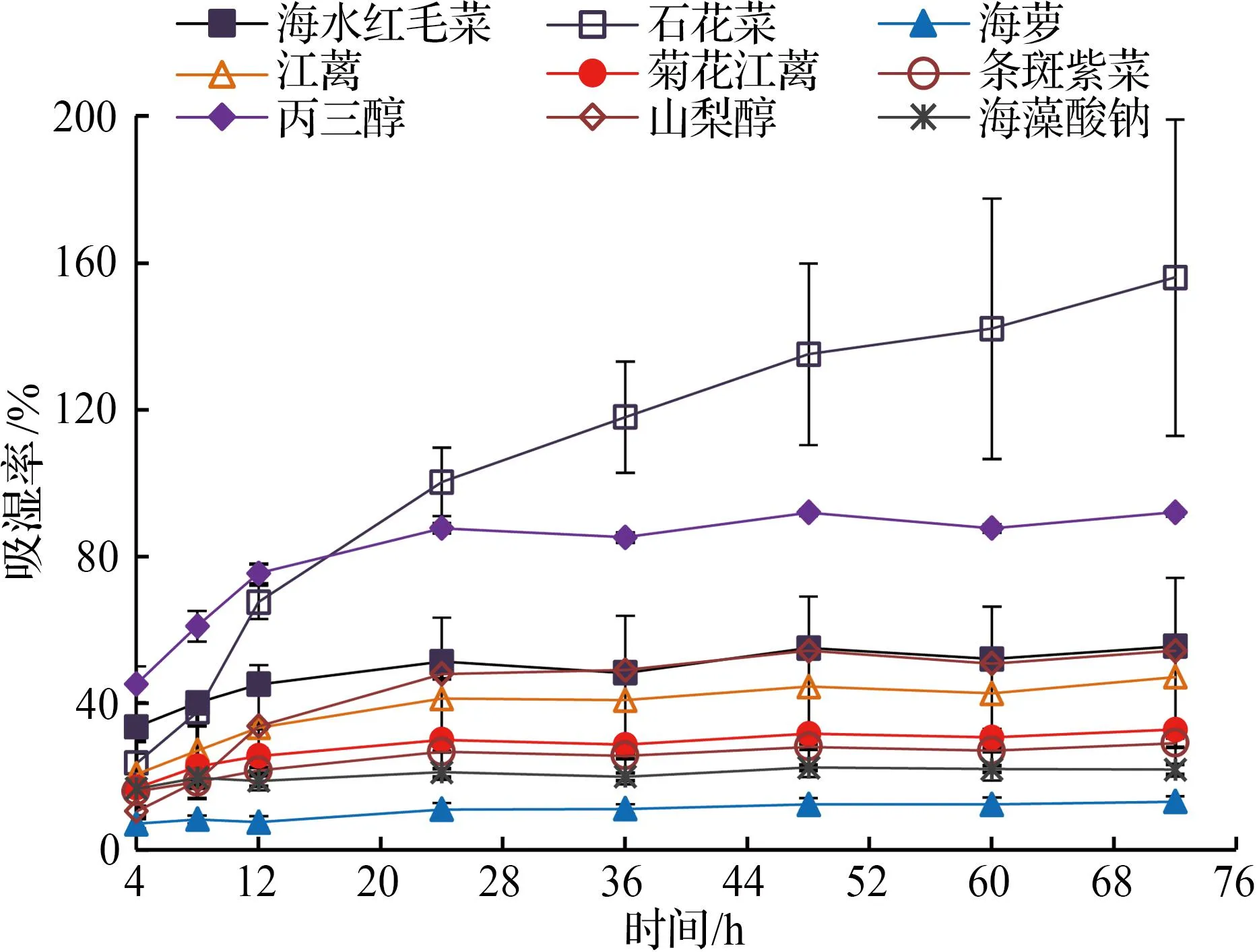
从图3和表4中6种海藻甘油糖脂及常见吸湿剂吸湿活性的结果可以看出,石花菜甘油糖脂组分的吸湿活性随时间延长明显(P<0.01)增加。在24 h后,石花菜甘油糖脂的吸湿活性明显(P<0.05)高于丙三醇。从图中可以看出,石花菜甘油糖脂组分各平行试验间存在一定误差,其原因可能是称量瓶前后摆放过于密集或位置的不同,造成了其中一组平行数据过大,但对整体吸湿率逐渐上升的试验结果影响不大,可忽略不计。结合表4方差分析可知,海水红毛菜和江蓠甘油糖脂组分的吸湿活性与山梨醇甘油糖脂组分的吸湿活性非常接近(P>0.05);条斑紫菜和菊花江蓠甘油糖脂组分的吸湿活性明显优于(P<0.01)海藻酸钠。在样品放置72 h时,石花菜甘油糖脂组分的吸湿率达到155.95%,海水红毛菜、菊花江蓠、条斑紫菜和江蓠甘油糖脂组分的吸湿率分别为55.42%,32.70%,29.09%和46.99%。从相关文献结果看,在相同环境湿度下纤细裸藻多糖的吸湿率仅为19.07%[29];在60 h时,羊栖菜岩藻多糖的吸湿率为45%左右[30],均低于本文中江蓠甘油糖脂组分吸湿率。
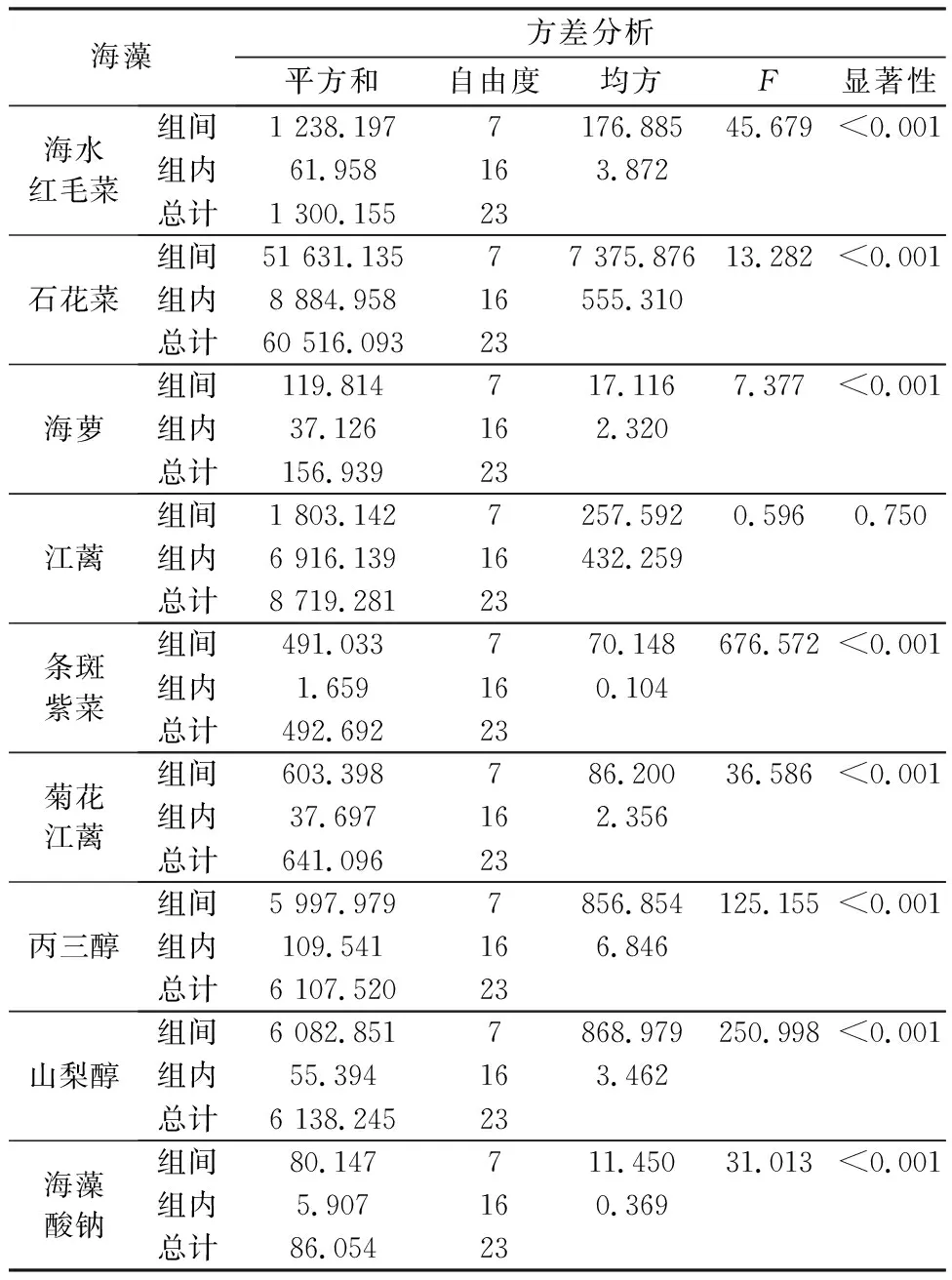
表4 6种海藻甘油糖脂及常见吸湿剂吸湿活性的方差分析(相对湿度81%)Table 4 Variance analysis for the hygroscopic activities of glycerol glycolipids of six macroalgae and common hygroscopic agents at RH 81%
从上述6种大型海藻甘油糖脂组分与常见吸湿剂吸湿活性的比较可以看出,江蓠、石花菜、海水红毛菜、条斑紫菜和菊花江蓠等5种大型海藻甘油糖脂组分的吸湿活性优于海藻酸钠,江蓠和石花菜甘油糖脂组分的吸湿活性优于山梨醇,石花菜甘油糖脂组分的吸湿活性甚至优于丙三醇(相对湿度为81%时)。
2.3 海藻甘油糖脂的保湿活性
图4表明,三种常见保湿剂的保湿能力为丙三醇>山梨醇>海藻酸钠。石花菜和江蓠甘油糖脂组分表现出与山梨醇和海藻酸钠非常接近(P<0.05)的保湿活性,其余海藻甘油糖脂组分的保湿活性均低于丙三醇和山梨醇,且据表5可知,各海藻不同时间段的保湿活性存在极显著差异(P<0.01)。浒苔多糖24 h时的保湿率为60.0%[31]。本文6种海藻甘油糖脂组分在30 h时的保湿率均在60.0%之上,显示出比浒苔多糖更优越的保湿效果。
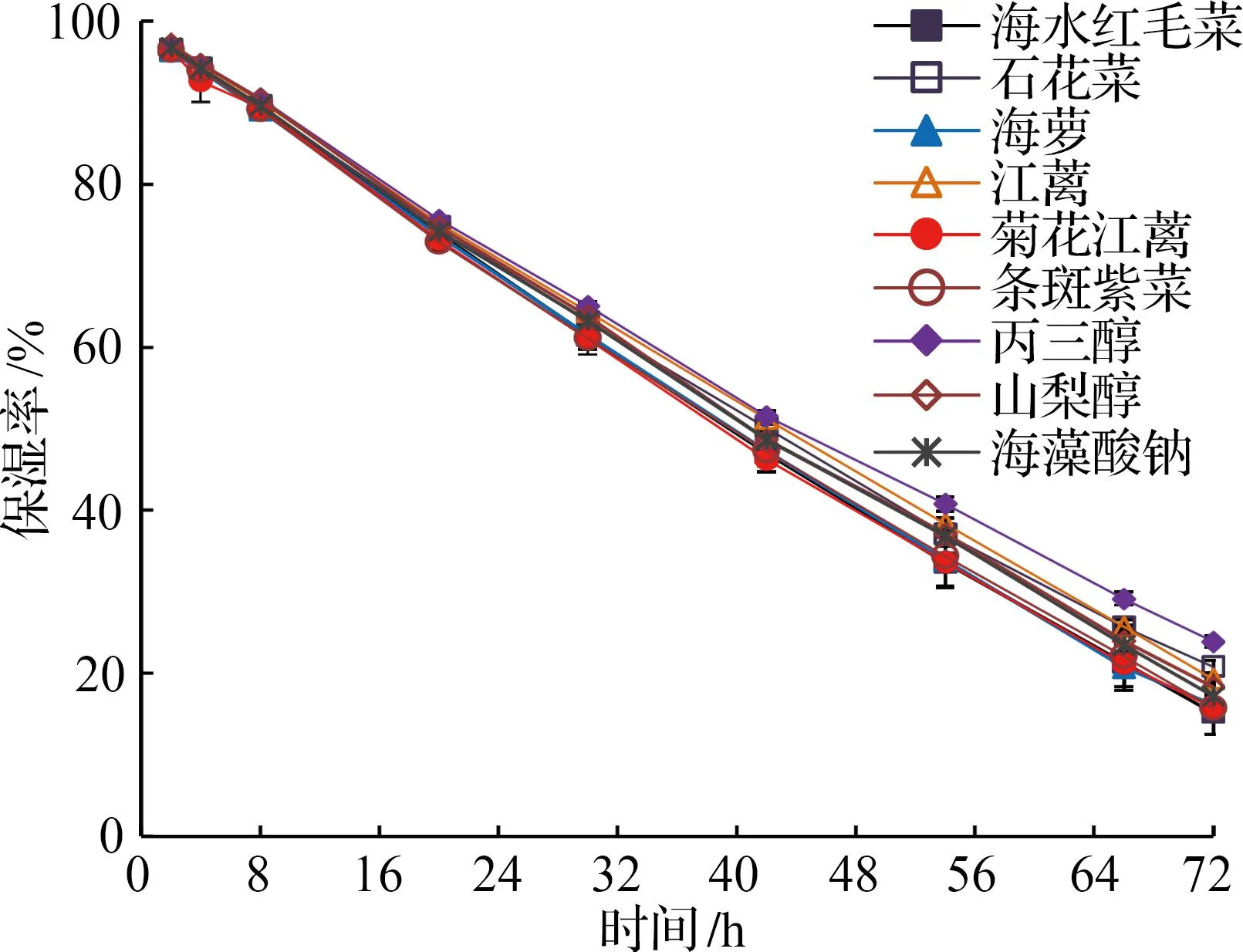
图4 6种海藻甘油糖脂及常见保湿剂的保湿活性Fig.4 Moisturizing activities of glycerol glycolipids of six macroalgae and common hygroscopic agents
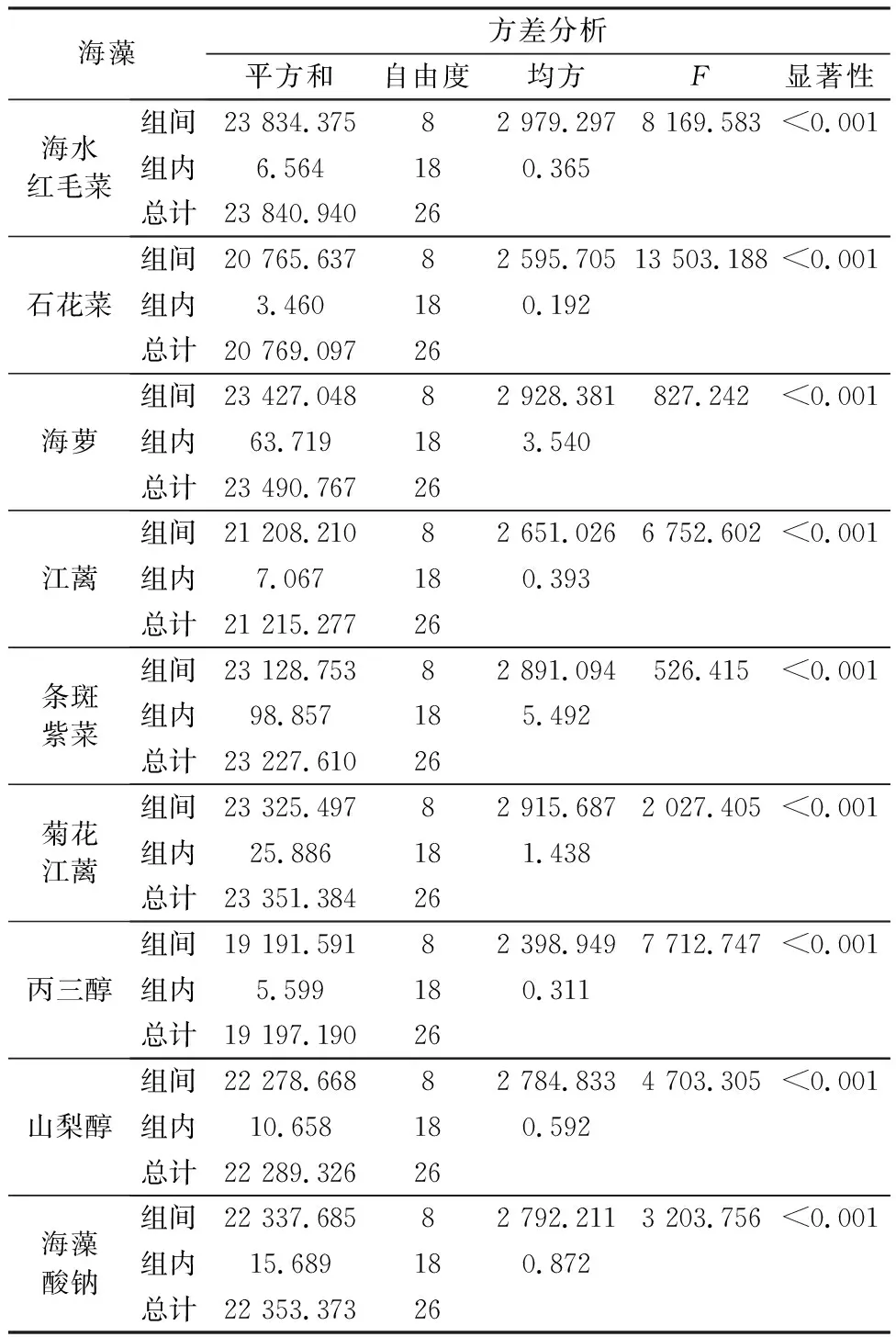
表5 6种海藻甘油糖脂及常见保湿剂保湿活性的方差分析Table 5 Variance analysis for the moisturizing activities of glycerol glycolipids of six macroalgae and common hygroscopic agents
2.4 海藻甘油糖脂对鲜切苹果的保湿作用
随着时间的延长,鲜切苹果中的水分含量不断下降(见图5)。浸泡海水红毛菜、石花菜、海萝和江蓠等4种海藻甘油糖脂的鲜切苹果水分含量下降趋势明显(P<0.05)缓于空白组(见表6)。在4~72 h,空白组鲜切苹果保湿率从95.0%下降至42.0%,水分损失53.0%;实验组鲜切苹果水分损失率在41.9%~51.7%。由表6可知,各海藻甘油糖脂组分在不同时间段对鲜切苹果的保湿活性间存在显著差异。海水红毛菜等4种海藻甘油糖脂组分对鲜切苹果显示出一定的保湿作用。

a 浸泡效果
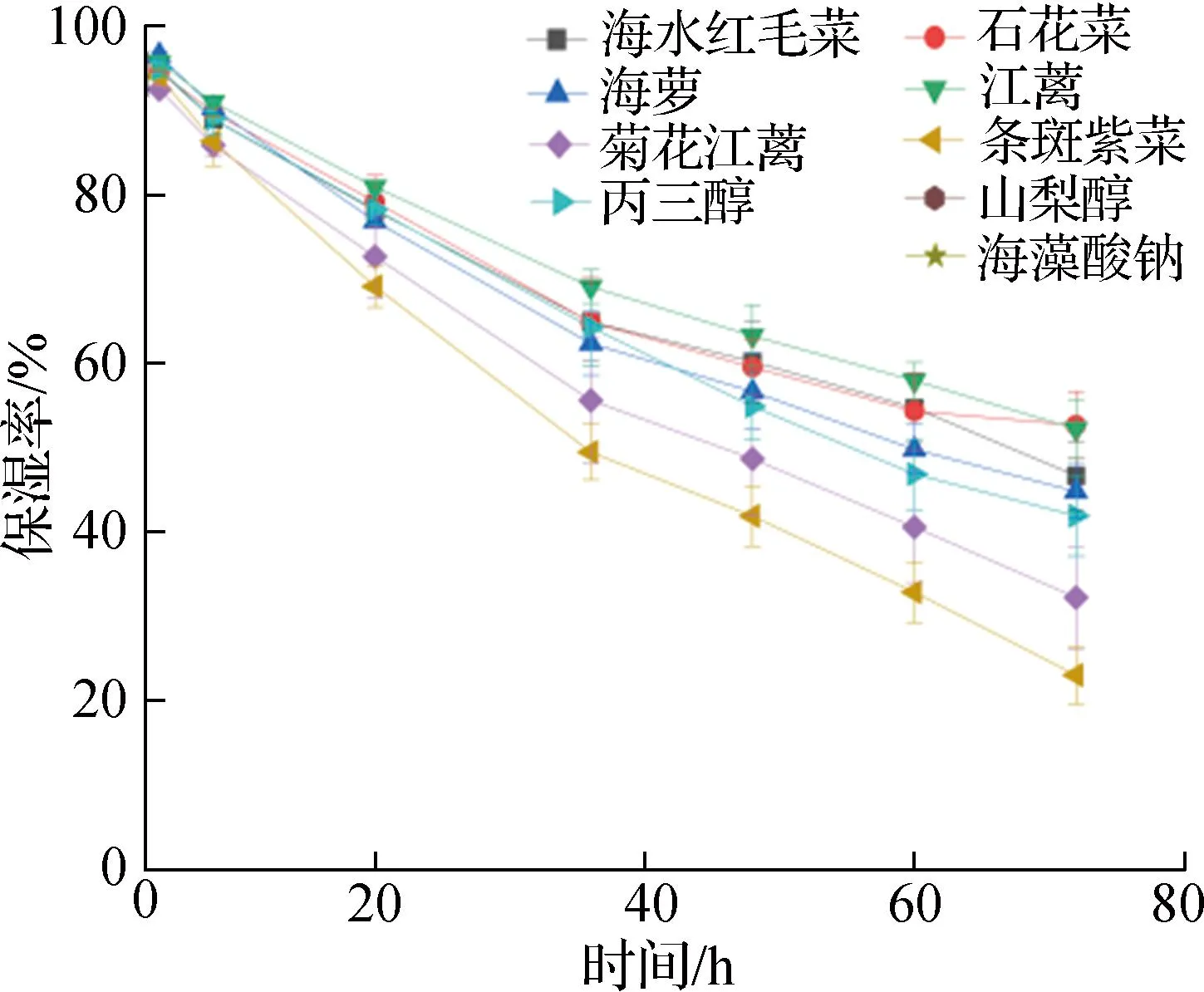
b 保湿率图5 6种海藻甘油糖脂对鲜切苹果保湿效果Fig.5 Moisturizing effects of glycerol glycolipids of six macroalgae on fresh-cut apples
表6 6种海藻甘油糖脂对鲜切苹果保湿效果的方差分析Table 6 Variance analysis of the moisturizing effect of glycerol glycolipids of six macroalgae on fresh-cut apples
此外,实验中还发现浸泡过海水红毛菜、石花菜、江蓠和海萝等甘油糖脂组分的鲜切苹果的褐变明显弱于空白组,推测这可能与甘油糖脂具有的抗氧化作用有关。后续将对其作进一步实验分析。
整体而言,6种海藻甘油糖脂组分对鲜切苹果均具有一定的保湿效果,相较于槐糖脂的Pickering 0.3%乳液组对完整苹果具有较好的保鲜防腐效果(63 d)而言[32],本实验能在短时间内检测出甘油糖脂组分是否具有保湿效果,不足之处是未进行毒理实验。基于本文研究结果,大型海藻甘油糖脂具有开发为食品保湿剂的潜力,后续可进行深入研究。
3 讨论
甘油糖脂是大型海藻中广泛存在的一类具有两亲性结构的代谢物。已有研究指出,甘油糖脂可被用于制备化妆品用的微乳液载体[33],也可被作为复合材料的原料,用于吸附大米粉中的镉金属[34]。本文通过研究海水红毛菜等6种大型海藻甘油糖脂的吸湿保湿活性,探讨了它们在食品和化妆品中的应用潜力。
在对6种海藻甘油糖脂萃取中得出,正己烷和正丁醇萃取物得率总体优于二氯甲烷和乙酸乙酯萃取物(见表1和图2)。实验前期,对甘油糖脂提取物直接用蒸馏水[24]溶解和用pH=2的缓冲液[25]溶解进行了比较,结果表明用pH=2的溶液溶解后,正己烷、二氯甲烷和乙酸乙酯所得萃取相的得率要大于用蒸馏水溶解得率;而用正丁醇萃取时,蒸馏水溶解所得萃取相得率要大于缓冲液溶解的得率(见表1),原因可能是正丁醇的沸点较高,不易浓缩,难以干燥至恒重,导致结果存在误差,因此选取pH=2的溶液作为溶剂。实验发现,在萃取过程中适当缩短萃取时间,少量多次萃取,也能很好地进行分离,且海水红毛菜等海藻的萃取物得率相较于孔令明等[25]从螺旋藻中所得萃取物得率要好。
研究表明,在相对湿度为43%和81%的环境条件下,海水红毛菜、石花菜、海萝、江蓠、条斑紫菜和菊花江蓠等6种海藻的甘油糖脂组分均具有一定的吸湿活性。丙三醇、山梨醇和海藻酸钠为常用食品工业用加工助剂[35-37],在本实验中,它们的吸湿活性顺序为丙三醇>山梨醇>海藻酸钠。除海萝外的5种海藻的甘油糖脂吸湿活性优于海藻酸钠,江蓠和石花菜甘油糖脂组分的吸湿活性还高于山梨醇,石花菜在81%相对湿度下的吸湿率高达155.9%,为丙三醇吸湿率的1.7倍。相对湿度40%条件下,刘新歌[38]添加了槐糖脂的烟丝在48 h时的吸湿率为25.0%;而本文在43%湿度条件下,江蓠、海水红毛菜和菊花江蓠在48 h时的吸湿率分别为72.7%,43.5%和36.8%。胡佩红等[39]在相对湿度为43%和81%条件下得出褐藻糖胶纯品的吸湿率分别为10.99%和16.96%。本文各海藻甘油糖脂组分在相对湿度43%下的吸湿率均优于褐藻糖胶,在湿度81%下,除海萝外,其余吸湿率也均优于褐藻糖胶。
在干燥硅胶环境中,6种海藻甘油糖脂组分均具有一定的保湿活性(见图4和表5)。其中石花菜和江蓠甘油糖脂组分的保湿活性要优于山梨醇和海藻酸钠,72 h时石花菜保湿率维持在20.8%。日常保湿剂的使用一般不会超过24 h(如化妆品),相较于景永帅等[40]得到的螺旋藻、昆布和石花菜粗多糖在24 h时的保湿率为9.50%,5.75%和0,本论文6种海藻甘油糖脂在30 h时的保湿率均大于60%。
在室温条件下,对6种海藻甘油糖脂组分进行的鲜切苹果保湿试验,结果表明海水红毛菜和石花菜等试验组的水分损失要小于空白组(见图5和表6)。该结果为浸泡样品1 min后得出,若在此基础上延长鲜切苹果的浸泡时间,可能会达到更好的保湿效果,这有待于进一步探索。目前已有研究发现槐糖脂对苹果和西红柿等具有一定的保鲜效果[41]。总体而言,海藻甘油糖脂组分的吸湿保湿活性介于丙三醇和海藻酸钠之间,符合保湿剂的选择标准。
4 结论
本文对海水红毛菜等6种大型海藻甘油糖脂的吸湿保湿活性进行了初步研究,并与常用的吸湿保湿剂丙三醇、山梨醇和海藻酸钠进行了比较,以明确该6种大型海藻甘油糖脂是否具有开发为吸湿保湿剂的潜力,为其在食品和化妆品等领域的应用提供实验参考。
丙三醇、山梨醇和海藻酸钠的吸湿能力顺序为丙三醇>山梨醇>海藻酸钠。江蓠、石花菜、海水红毛菜、条斑紫菜和菊花江蓠甘油糖脂的吸湿活性优于海藻酸钠;江蓠和石花菜甘油糖脂的吸湿活性均高于山梨醇;石花菜甘油糖脂在81%相对湿度时吸湿率甚至强于丙三醇,为丙三醇吸湿率的1.7倍。
丙三醇、山梨醇和海藻酸钠的保湿能力顺序为丙三醇>山梨醇>海藻酸钠。石花菜和江蓠甘油糖脂的保湿活性比山梨醇和海藻酸钠更好。在72 h时,石花菜和江蓠甘油糖脂的保湿效果与丙三醇接近,石花菜和江蓠甘油糖脂、丙三醇的保湿率分别为20.8%,19.3%和23.8%。
海水红毛菜、石花菜、海萝和江蓠甘油糖脂对鲜切苹果表现出一定的保湿作用,苹果水分损失率低于空白对照组。

