超声引导下微波消融对甲状腺微小癌的效果分析
王 彬,孙 亮,徐瑞雪
(南京市溧水区中医院<扬州大学医学院临床学院>超声科 江苏 南京 211200)
甲状腺微小癌是甲状腺癌的一种特殊类型,又称隐匿性甲状腺癌,肿瘤直径小于1 cm[1]。根据组织病理学类型可分为甲状腺微小乳头状癌、甲状腺微小滤泡状癌、甲状腺微小髓样癌,其中乳头状微小癌占所有成人甲状腺微小癌病例的70%左右[2]。近年来,我国甲状腺微小乳头状癌的发病率呈逐年上升的趋势。目前,手术切除是甲状腺微小癌的根治性治疗方法。传统的外科手术在临床应用上存在一定的局限性,如手术创伤大、术后机体恢复慢且颈部容易留下较大的手术疤痕。超声引导下微波消融术是通过在超声引导下将微波电针穿刺到肿瘤内利用热作用使肿瘤组织变性、坏死、失活的一种微创手术,具有多种优点,如手术时间短、安全性高、手术切口小不影响美观,已广泛用于治疗乳腺癌、肝癌和肾癌[3-4]。研究表明,超声引导下微波消融术也可以用于治疗甲状腺微小[5]。本研究旨在评估超声引导下的微波消融术在甲状腺微小癌中的临床疗效。现将具体内容报道如下。
1 资料与方法
1.1 一般资料
将2021 年1 月—2022 年12 月期间在南京市溧水区中医院住院治疗的甲状腺微小癌患者纳入本研究,共62 例。对照组(共31 例),男18 例,女13 例,年龄29 ~67 岁,平均年龄(43.74±4.59);肿瘤直径3.2 ~9.4 mm,平均直径(5.34±1.08)mm。观察组(共31 例),男14 例,女17 例,年龄31 ~68 岁,平均年龄(43.57±4.62);肿瘤直径3.3 ~9.2 mm,平均直径(5.41±1.12)mm。两组患者一般资料比较,差异无统计学意义(P>0.05),有可比性。
1.2 纳入标准和排除标准
纳入标准:①患者临床症状符合甲状腺微小癌的诊断标准,且经病理穿刺活检证实;②B 超显示为甲状腺一侧单发结节,直径不超过10 mm 且无明显钙化灶;③甲状腺功能正常,相关抗体水平在正常范围内;④既往无甲状腺相关疾病病史;⑤术前患者未出现声音嘶哑、病变对侧声带检测无异常。
排除标准:①合并严重心、肝、肾障碍,血液系统或其他系统恶性肿瘤;②肿瘤侵袭周围组织,出现颈部淋巴结肿大或远处淋巴结转移;③不能耐受手术,无手术指针;④凝血时间异常;⑤合并精神类疾病;⑥临床资料不完整。
1.2 方法
对照组:采取传统外科手术治疗。患者仰卧肩下垫软枕使颈部后仰,采用气管插管全麻。确认患者麻醉后,对手术部位进行常规的消毒、铺巾。手术切口位置距离胸骨上窝2 cm,切口长度5 ~6 cm。依次切开各层组织直至甲状腺及峡部显露,对肿瘤组织进行切除,确认没有出血后进行负压引流,并缝合各层组织。手术切除的标本送病理检查。
观察组:采用超声引导微波消融术治疗。患者仰卧于手术床上,抬高床头和肩部,保持颈部呈过伸状态,使手术部位完全暴露,然后进行消毒、铺巾。按操作程序对微波消融仪进行检测,确保仪器处于备用状态。使用1%利多卡因对穿刺部位及周围组织进行局麻,使用德国西门子公司生产的红杉树超声仪对肿瘤位置进行可视化,向甲状腺包膜周围注射适量的利多卡因0.9%氯化钠溶液混合液,以形成“液体隔离带”避免术中伤及食管、气管、颈部动脉和神经等重要器官和结构。使用手术刀切开穿刺点皮肤,经超声引导将微波天线从颈部皮肤切口处刺入肿瘤的中心位置并启动微波消融仪,从不同的点、面、角度并自下而上对肿瘤组织进行消融。微波消融仪的输出功率设定为40 W、消融时间设定为30 ~60 s,消融区域的范围距术前肿瘤边缘至少5 mm。治疗结束后缓慢地撤出消融针并行超声造影检测以确保肿瘤组织被完全清除。在治疗过程中及时与患者交流评估患者发声情况,术后测量生命体征,观察切口处有无活动性出血,按压并冰敷40 min 分钟,休息20 min,反复冰敷6 h,告知患者术后2 h 内不可进食。
1.3 观察指标
①记录两组患者手术时间、切口大小、出血量、住院时间手术相关指标。②记录两组患者术前及术后1 个月甲状腺激素水平,包括游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺素(TSH)的水平。③比较两组患者术后并发症(术后出血、伤口感染、饮水呛咳、甲状旁腺损伤)发生情况。④患者在术后第1、3、6 个月随访进行彩超检查,观察肿瘤复发、颈部淋巴结转移情况,据此判断治疗效果。并记录观察组术前和术后第1、3、6 个月时甲状腺结节缩小情况。
1.4 统计分析
采用SPSS 21.0 统计软件处理数据。符合正态分布的计量资料以均数±标准差(± s)表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验。以P<0.05 代表差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较
与对照组相比,观察组手术时间和住院时较短,术中出血量明显较少,差异有统计学意义(P<0.05),见表1。
表1 比较两患者手术指标的差异(± s)
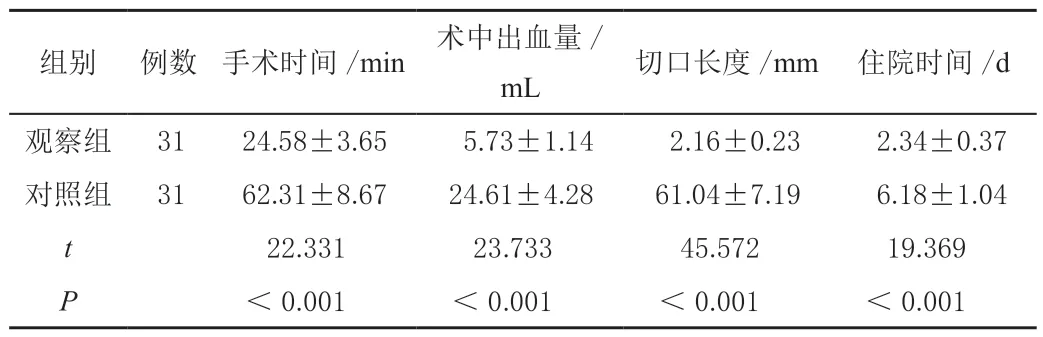
表1 比较两患者手术指标的差异(± s)
组别 例数 手术时间/min 术中出血量/mL 切口长度/mm 住院时间/d观察组 31 24.58±3.65 5.73±1.14 2.16±0.23 2.34±0.37对照组 31 62.31±8.67 24.61±4.28 61.04±7.19 6.18±1.04 t 22.331 23.733 45.572 19.369 P<0.001 <0.001 <0.001 <0.001
2.2 两组患者手术前、后甲状腺相关激素比较
术前,与对照组相比,观察组甲状腺相关激素水平差异无统计学意义(P>0.05)。术后1 个月时,与对照组相比,观察组FT3、FT4 水平明显较高,TSH 水平较低,差异具有统计学意义(P<0.05),见表2。
表2 两组患者手术前、后甲状腺相关激素比较(± s)

表2 两组患者手术前、后甲状腺相关激素比较(± s)
FT3/(pmol·L-1)组别 例数FT4/(pmol·L-1)术前 术后1 个月 术前 术后1 个月观察组 31 4.39±0.67 4.41±0.79 13.21±1.55 13.89±1.66对照组 31 4.31±0.59 3.48±0.46 13.47±1.61 10.28±1.17 t 0.499 5.664 0.647 9.897 P 0.619 <0.001 0.519 <0.001组别 例数TSH/(mIU·L-1)术前 术后1 个月观察组 31 2.53±0.37 1.64±0.21对照组 31 2.48±0.33 9.87±1.45 t 0.561 31.276 P 0.576 <0.001
2.3 两组患者术后并发症发生率的比较
术后,对照组的并发症总发生率36.67%,高于观察组(总发生率为9.67%),差异具有统计学意义(P<0.05),见表3。

表3 两组患者术后并发症发生率的比较[n(%)]
2.4 观察组术前与术后随访不同时间点甲状腺结节体积比较
术后6 个月两组患者随访复诊均未出现肿瘤复发和淋巴结转移的情况。与术前结节体积相比,观察组患者术后1 个月甲状腺结节的体积增加,术后6 个月体积明显缩小,差异有统计学意义(P<0.05)。见表4。典型病例微波消融术后结节超声影像图,见图1。
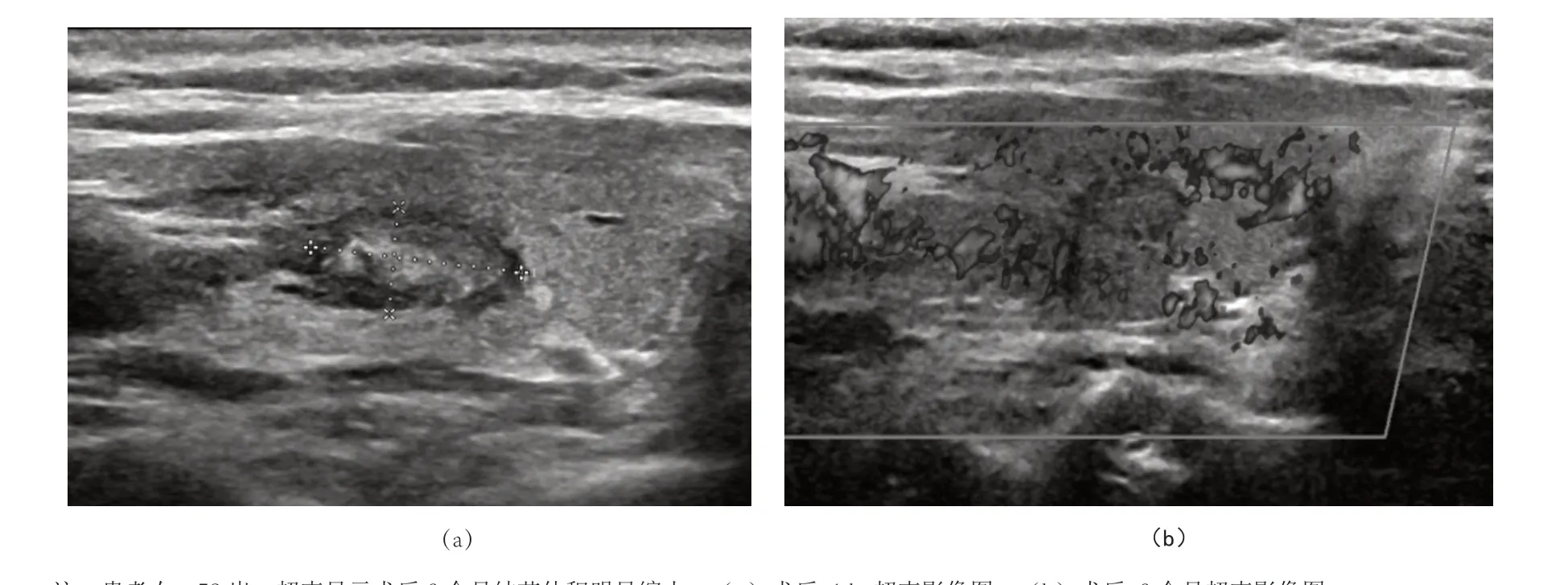
图1 不同时间点甲状腺结节体积
表4 观察组术前和术后不同时间点甲状腺结节体积比较(± s, mm3)

表4 观察组术前和术后不同时间点甲状腺结节体积比较(± s, mm3)
项目 术前 术后1 个月 术后3 个月 术后6 个月甲状腺结节体积 64.77±18.69 90.88±20.46 62.53±19.62 50.86±14.37 5.246 0.460 3.285 P<0.001 0.647 0.002 t
3 讨论
甲状腺微小乳头状癌作为甲状腺微小癌最常的类型之一,也是备受学者们关注的甲状腺癌类型。即使发生淋巴结转移甲状腺微小乳头状癌生物学行为的恶性程度仍较低一般预后较好,有研究表明部分患者确诊后甚至终生不会发生恶性进展[6]。美国甲状腺协会表明对于低风险的甲状腺微小乳头状癌可以通过随访而不是立即手术切除治疗,但目前缺乏可靠的临床特征来鉴别其风险的高低[7]。在我国一般建议手术切除联合术后抑制甲状腺激素治疗[8]。然而,一些患者存在手术禁忌证或者对术后疤痕形成影响美观产生担忧等,这些因素限制了传统外科手术的应用[9]。微波热消融技术已在其他多种疾病中被广泛应用并取得了较好的疗效。研究表明,微波消融在治甲状腺微小乳头状癌较传统手术表现出良好的优势,如患者痛苦小、康复快,术后生活质量显著提高[10]。
在超声的引导下微波消融术可以快速精准地定位肿瘤组织,在局部产生大量热量且可以控制治疗范围,在破坏肿瘤组织的同时能够尽可能避免甲状腺功能受损。与传统外科手术相比,超声引导下微波消融治疗费用更低、住院时间更短,部分患者术后留观24 h 即可出院[11]。此外,超声引导下微波消融安全性更高,术中在超声可视的条件下通过注射利多卡因0.9%氯化钠溶液可以在病灶组织和周围正常组织之间形成“液体隔离带”降低对周围组织和器官损伤的概率[12]。与先前的研究一致,本研究结果表明,观察组患者手术时间、住院时间、术中出血量、切口大小均低于对照组。观察组FT3、FT4 水平略有升高,且显著高于对照组。观察组TSH 水平明显降低,而对照组TSH 水平显著上高。分析原因是术后TSH 水平降低与微波消融对甲状腺正常组织损伤引起的甲状腺激素一过性的升高有关。术后并发症的总发生率观察组显著低于对照组。这表明超声引导下微波消融术能够更好地保留甲状腺功能,且减少了术后并发症的发生。本研究术后6 个月随访结果显示,两组患者术后均未出现肿瘤复发和淋巴结转移,且观察组结节体积逐渐缩小。
综上所述,本研究结果表明超声引导下的微波消融术与传统手术疗效相当,且切口小、康复快、对甲状腺功能影响小,在临床应用效果显著。

