中考化学“复分解反应”热点题型解读
许红弟
(江苏省连云港市新海初级中学,江苏 连云港 222001)
复分解反应是四种基本反应类型之一,可用通式表示为AB+CD=AD+BC.复分解反应的实质是酸、碱、盐在溶液中发生的离子之间互相交换成分的反应.但酸、碱、盐之间并不是都能发生复分解反应,只有当两种化合物互相交换成分,生成物中有水、沉淀或气体之一时,复分解反应才可以发生[1].
1 对复分解反应概念的理解
例1 (2023·株洲)下列化学方程式书写正确且属于复分解反应的是( )
A.铁与稀盐酸反应:
B.镁带在空气中燃烧:
C.在高温下CaCO3分解:
D.氢氧化铝治疗胃酸过多:


答案:D
2 考查离子的共存
例2 (2023·龙东)能在pH=5的溶液中大量共存,且溶液无色透明的一组离子是( ).

答案:D
3 考查物质的鉴别
例3 (2023·通辽)有A、B、C、D四种溶液,分别是硫酸铜溶液、氢氧化钠溶液、稀硫酸和氯化钡溶液中的一种.小明为鉴别以上溶液,进行如下实验:
Ⅰ.观察颜色,发现A呈蓝色,其余为无色.
Ⅱ.将A分别与B、C混合,观察到:A+C→蓝色沉淀,A+B→无明显现象.
回答下列问题.
(1)A为____.
(2)铁与A反应的化学方程式为____.
(3)B与D反应的化学方程式为____,现象为____.


4 考查物质的分离与提纯
例4 (2023·包头)除去表1物质中含有的杂质,所用试剂和方法正确的是( ).

表1 各杂质的试剂和方法
解析足量的Ba(NO3)2溶液与H2SO4反应生成BaSO4沉淀和HNO3,杂质H2SO4除去了,但是又引入了新的杂质HNO3,A错误;浓硫酸具有吸水性,且不与氧气反应,所以除去氧气中混有的水蒸气,将气体通过足量的浓硫酸,干燥,B正确;碳酸钙高温分解生成氧化钙和二氧化碳,没有除去杂质反而除去了原物质,不符合除杂原则,C错误;Na2CO3溶液能与Ca(OH)2反应生成CaCO3沉淀和NaOH,虽然除去了Ca(OH)2杂质,但是又引入了新的杂质——过量的Na2CO3,D错误.
答案:B
5 考查物质的转化
例5 (2023·广西)下列物质间转化均能通过一步反应实现的是( ).
A.Cu→Cu(NO3)2→KNO3
B.Fe→Fe2O3→FeCl2
C.Na2SO4→NaNO3→NaCl
D.KOH→Ba(OH)2→NaOH
解析A中的Cu能与AgNO3反应生成Cu(NO3)2和Ag,Cu(NO3)2能与KOH反应生成Cu(OH)2和KNO3,均能通过一步反应实现;B中的铁通过生锈能生成氧化铁,氧化铁与盐酸反应生成氯化铁,不能生成氯化亚铁;C中的硫酸钠与硝酸钡反应生成硝酸钠和硫酸钡,但硝酸钠不能与其他物质通过一步反应生成氯化钠;D中的KOH不能通过一步反应生成Ba(OH)2.
答案:A
6 考查物质的推断
例6 (2023·辽阳)小丽构建了有关酸、碱与甲、乙、丙三种初中常见物质之间的反应关系图(如图1所示),图中连线两端的物质均能发生反应,其中甲为黑色固体,乙、丙为氧化物.请回答:

图1 反应关系图
(1)Ca(OH)2的俗称为____.
(2)甲的化学式为____.
(3)乙与稀盐酸反应得到黄色溶液,写出该反应的化学方程式____.
(4)丙与甲反应过程会____(填“吸收”或“放出”)热量.
解析氢氧化钙能和酸、部分盐以及部分非金属氧化物发生反应;盐酸能和碱、部分盐以及金属氧化物发生反应;又因为甲能和乙、丙发生反应且甲是黑色固体,则甲是碳,乙是金属氧化物,丙是二氧化碳,代入验证,推理正确.

7 有关复分解反应发生条件的探究
例7 (2023·金昌)某校化学兴趣小组的同学利用稀盐酸、碳酸钠、Ba(OH)2溶液三种物质探究“复分解反应发生的条件”,做了如图2所示实验.
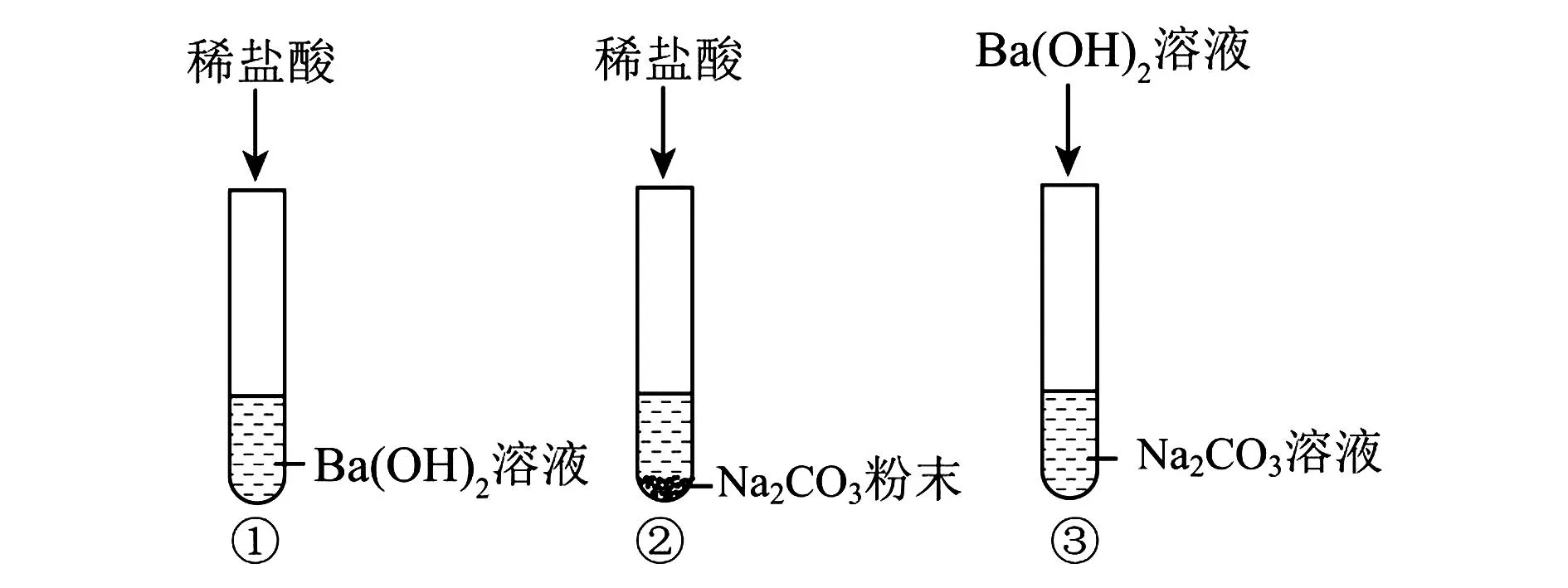
图2 探究“复分解反应发生的条件”实验
(1)大家一致认为在试管①中还需要加入____溶液才能证明发生了复分解反应.
(2)试管②中观察到的现象是____,试管③中反应的化学方程式为____.
(3)通过三组实验,同学们得出复分解反应发生的条件是____.
(4)兴趣小组的同学将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究.
【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:NaOH
猜想二:Ba(OH)2、NaOH
猜想三:____.
【设计实验】验证你的猜想正确(见表2).
【反思拓展】通过探究实验,同学们发现Ba(OH)2和NaOH化学性质相似,你认为Ba(OH)2的保存方法是____.

表2 设计实验
解析(1)试管①中的中和反应没有明显现象,所以需要滴入指示剂证明发生了反应,可以选择无色酚酞或者是紫色石蕊试液.(2)试管②中是稀盐酸和碳酸钠发生反应生成二氧化碳、氯化钠和水,实验现象为固体溶解,有气泡产生,试管③中是Na2CO3和Ba(OH)2反应生成NaOH和BaCO3沉淀.(3)通过三组实验,同学们得出复分解反应发生的条件是要有沉淀或有气体或有水生成.【猜想假设】 试管③中可能完全反应,滤液中溶质只含有NaOH;也可能Ba(OH)2过量,滤液中溶质是Ba(OH)2和NaOH;也有可能是Na2CO3过量,滤液中溶质是Na2CO3和NaOH.【设计实验】若猜想三正确,则滤液中溶质成分为Na2CO3和NaOH,则步骤一中加入的CaCl2和Na2CO3反应生成CaCO3沉淀,所以实验现象为有白色沉淀产生;步骤二中有蓝色沉淀产生,说明生成了氢氧化铜沉淀,则加入的是含有铜离子的盐,故可以滴加CuSO4或CuCl2、Cu(NO3)2等.【反思拓展】NaOH有吸水性,且在空气中容易变质,因为和NaOH化学性质相似,所以氢氧化钡需要密封干燥保存.
答案:(1)酚酞(或紫色石蕊) (2)固体溶解,有气泡产生 Ba(OH)2+Na2CO3= BaCO3↓ +2NaOH (3)要有沉淀或有气体或有水生成 (4)【猜想假设】NaOH、Na2CO3【设计实验】白色沉淀 CuSO4[或 CuCl2、Cu(NO3)2等] 【反思拓展】密封干燥保存

