乙肝病毒感染相关肝细胞癌组织中转化因子-β1/Smad2信号通路表达及其与临床病理特征、预后相关性
张 利,郭 明
张利,郭明,安吉县人民医院消化内科 浙江省湖州市 313300
0 引言
我国肝癌发病率呈上升趋势,其主要病理类型为肝细胞癌、混合型癌、胆管癌细胞癌,乙肝病毒(hepatitis B virus,HBV)占肝癌病因的90%左右,随着医疗水平进步,肝癌诊疗方法不断改善,但术后5年复发率较高,预后较差[1].大部分肝癌早期发病较为隐匿,临床症状不明显,确诊时已处于晚期,目前肝癌治疗以手术为主,合并HBV感染者治疗效果不佳,病死率较高,因而探究HBV感染相关肝癌发病机制及治疗靶点具有重要意义[2].转化生长因子-β1(transforming growth factor-β1,TGF-β1)与受体结合调控下游Smad蛋白表达,可调节细胞增殖、凋亡、转移等生物学行为,研究表明炎症因子释放量增加可激活TGF-β1,促进Smad蛋白表达,Smads根据其结构、功能不同分为受体调节性Smads(Smad1、Smad2等)、共介导Smads、抑制Smads,该信号通路可参与多种肿瘤发生发展过程[3,4].TGF-β1/Smads信号通路是否与HBV感染性肝细胞癌有关尚未明确,本研究比较HBV感染、非感染肝细胞癌组织中TGF-β1、Smad2表达量,分析其与患者临床病理特征相关性,为临床诊断、治疗HBV感染相关肝细胞癌提供参考.
1 材料和方法
1.1 材料 选取2016-02/2019-03本院经手术切除后病理诊断明确的肝细胞癌患者65例为研究对象,其中男43例、女22例,年龄40-60(50.26±3.17)岁,肿瘤直径4-7(5.10±0.35) cm.依据是否发生HBV感染分为感染者37例、非感染者28例.随访3年后失访8例,依据生存情况肝细胞癌患者分为2个亚组: 生存者36例、死亡者21例.收集肝细胞癌患者临床资料,包括分化程度、卫星病灶、肝硬化、TNM分期、淋巴结转移.本研究经本院伦理委员会批准,批准号: GJ7678.感染者、非感染者临床资料见表1,具有可比性.
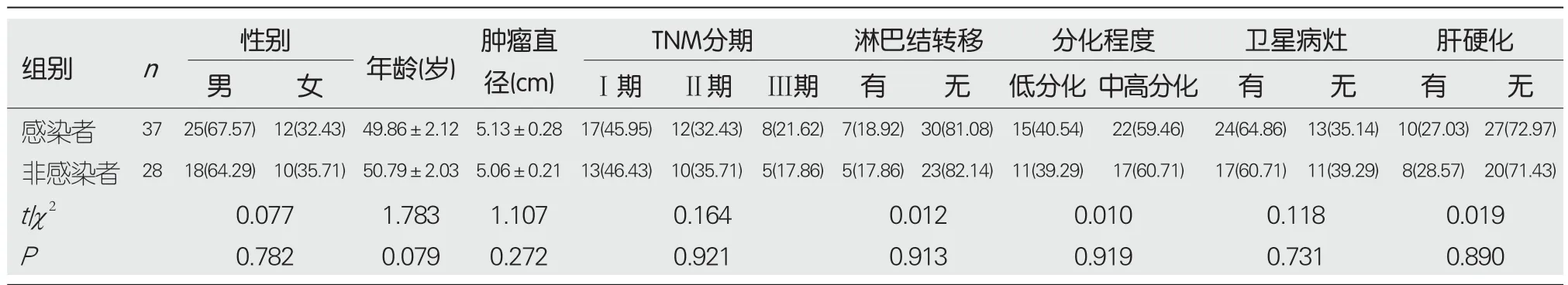
表1 两组临床资料比较
纳入标准: 符合肝细胞癌诊断标准[5],经影像学、病理学诊断确诊;HBV感染符合《慢性乙肝型肝炎防治指南》中诊断标准[6];术前未进行放化疗者;接受根治术、放化疗等治疗者;签署知情同意书.排除标准: 其他肝炎病毒所致肝细胞癌者;继发性肝细胞癌者;合并其他恶性肿瘤者;自身免疫系统疾病者;酒精性肝病者;药物性肝损伤者.HBV感染程度.
1.2 方法
1.2.1 Western blot法检测癌组织中TGF-β1、Smad2蛋白表达量: 采集肝细胞癌患者空腹外周静脉血3 mL,常规离心后分离血清,采用荧光定量聚合酶链式反应(RT-qPCR)检测HBV-DNA水平,上海新波生物公司提供检测试剂盒.分别在肝癌组织12点、3点、6点、9点位置上,于肝癌、癌旁组织交界处取材,在肿瘤组织内部取材1 块,并切取距肿瘤组织边缘>1 cm处肝组织作为癌旁组织,肝细胞癌组织、癌旁组织中分别加入500 μL RIPA裂解液(上海联迈生物工程有限公司)提取总蛋白.采用Western blot法检测组织中TGF-β1、Smad2蛋白表达量,操作方法如下: 二喹啉甲酸(BCA)法(武汉博士德生物工程有限公司)检测蛋白浓度,取上清液转移至新离心管,加入上样缓冲液(北京百奥莱博科技有限公司),100 ℃高温下变性10 min.取40 μg蛋白样品经SDS-PAGE(碧云天生物技术有限公司)反应,结束后蛋白质转移至PVDF膜(迈博瑞生物膜技术有限公司),使用5%脱脂牛奶封闭2 h,分别加入TGF-β1(1:1000)、Smad2(1:1000)、内参GAPDH(1:3000)一抗(美国CST公司,目录号: 3711、5678、8884)稀释液,4 ℃孵育24 h后弃一抗,加入二抗(北京中杉金桥生物技术有限公司,目录号: 2306)稀释液(1:5000)后室温孵育2 h,Tis-HCI缓冲液(TBST)洗涤(上海科拉曼试剂有限公司),增强型化学发光试剂(ECL)发光液(南京森贝伽生物科技有限公司)作用后显影,使用Quantity One软件对蛋白条带进行定量.
表2 肝细胞癌组织、癌旁组织中TGF-β1、Smad2表达量(mean±SD)
1.2.2 原代培养肝癌细胞: 取HBV感染的肝癌组织标本3 g,在含有少量PBS中使用眼科剪剪碎组织样本,加入11 mL消化酶后放入37 ℃水浴锅内处理30 min,使用孔径为70 μm筛网过滤细胞,然后加入10%灭活胎牛血清5 mL,促使胰蛋白酶失活,以10000 r/min转速离心10 min后细胞悬浮,将细胞接种于含有聚-L-赖氨酸的6孔板上,加入含有10%胎牛血清的DMEM培养基培养,培养48 h后收集肿瘤细胞.采用脂质体转染法分别将小分子干扰RNA(siRNA)TGF-β1(简称si-TGF-β1)、TGF-β1过表达(pcDNA-TGF-β1)加入肝癌细胞中,采用RT-qPCR法检测肝癌细胞中TGF-β1表达水平,si-TGF-β1、pcDNA-TGF-β1购自上海吉玛制药公司,RTqPCR法检测所需试剂均购自北京天根生化公司.
1.3 观察指标 (1)比较HBV感染者、非感染者中TGF-β1、Smad2表达量与不同临床病理特征的相关性;(2)以门诊复查、电话、微信等方式随访3年,平均随访时间(24.32±3.16) mo,统计随访期间生存情况;(3)分析生存者、死亡者中TGF-β1、Smad2表达量,及其与生存率相关性.
统计学处理应用SPSS 22.0处理数据,计量资料以(mean±SD)表示,两组比较采用独立样本t检验,多组间比较采用单因素方差分析;计数资料以n(%)表示,采用χ2检验;采用Kaplan-Meier生存曲线、Log-Rank检验分析3年生存情况,P<0.05表明差异有统计学意义.
2 结果
2.1 肝细胞癌组织、癌旁组织中TGF-β1、Smad2表达量 HBV感染的肝细胞癌患者血清HBV-DNA水平为(2.39±0.41) IgU/mL.与癌旁组织比较,肝细胞癌组织中TGF-β1、Smad2表达量升高(P<0.05),见图1,表2.HBV感染者中TGF-β1、Smad2表达量与HBV-DNA水平呈正相关(r=0.524、0.553,P=0.041、0.038).肝癌细胞中TGF-β1过表达处理前后,TGF-β1 mRNA表达水平分别为1.00±0.02、3.26±0.57,肝癌细胞中干扰TGF-β1表达处理前后,TGF-β1 mRNA表达水平分别为1.01±0.01、0.24±0.02,表明TGF-β1表达水平变化来源于肝癌细胞自分泌.
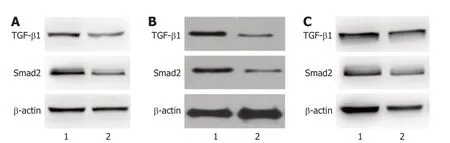
图1 Western blot检测TGF-β1、Smad2蛋白表达. A: 男性患者;B: 女性患者;C: 男性患者.1: 肝细胞癌组织;2: 癌旁组织.TGF-β1: 转化生长因子-β1;Smad2: 细胞信号转导分子2;β-Actin: β-肌动蛋白.
2.2 感染者、非感染者肝细胞癌组织及癌旁组织中TGF-β1、Smad2表达量 感染者、非感染者肝细胞癌组织中TGF-β1、Smad2表达量高于癌旁组织(P<0.05),且感染者肝细胞癌组织中TGF-β1、Smad2表达量高于非感染者(P<0.05),见图2、表3.
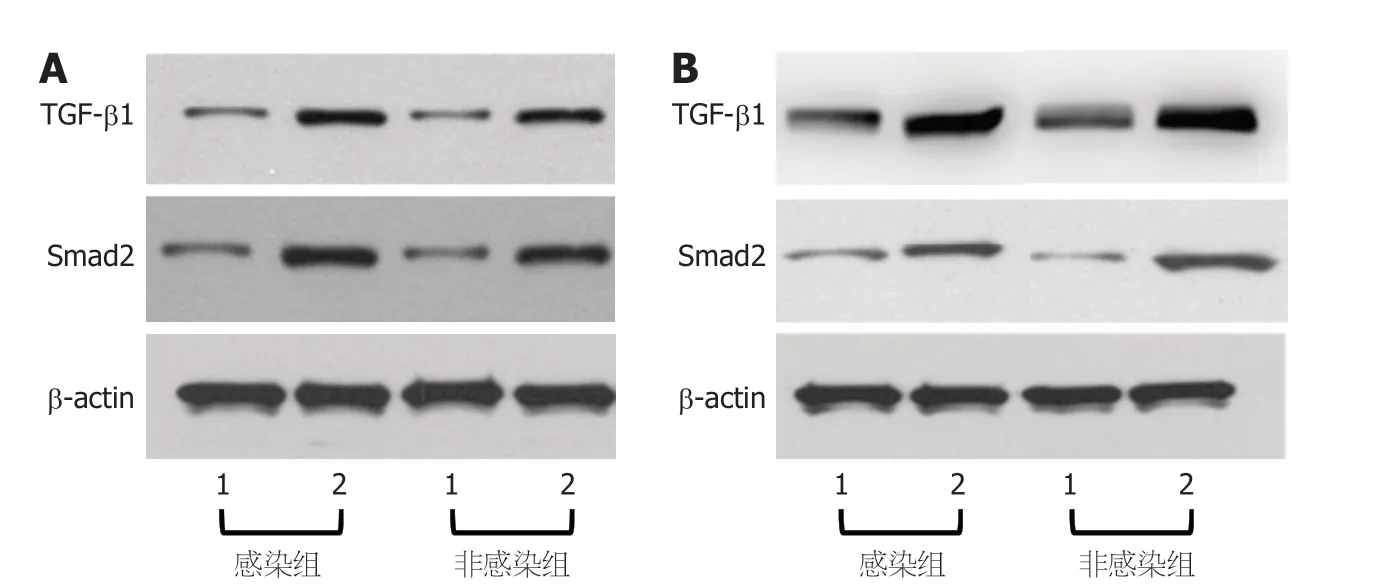
图2 Western blot检测TGF-β1、Smad2蛋白表达.A: 男性患者;B: 女性患者.1: 癌旁组织;2: 肝细胞癌组织.TGF-β1: 转化生长因子-β1;Smad2: 细胞信号转导分子2;β-Actin: β-肌动蛋白.

表3 HBV感染者、非感染者肝细胞癌组织及癌旁组织中TGF-β1、Smad2表达量(mean±SD)

表4 TGF-β1、Smad2表达量与不同临床病理特征相关性(mean±SD)

表5 不同预后肝细胞癌组织中TGF-β1、Smad2表达量(mean±SD)
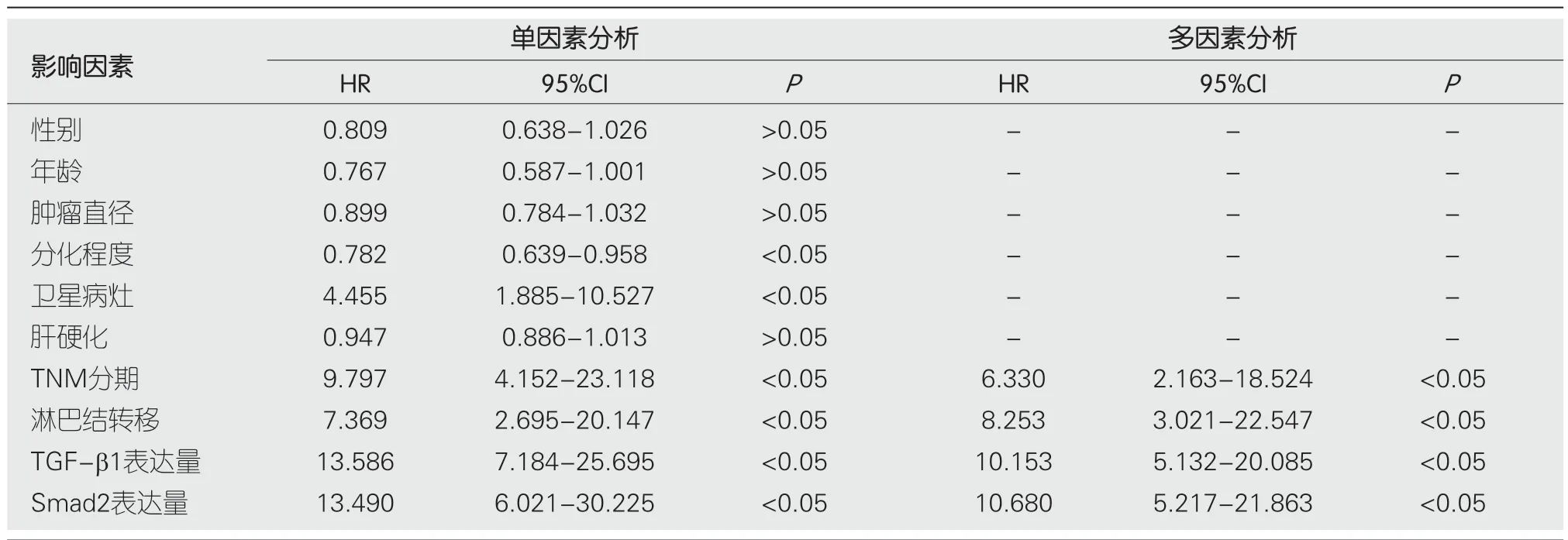
表6 Cox回归分析预后影响因素
2.3 TGF-β1、Smad2表达量与不同临床病理特征相关性 感染者、非感染者肝细胞癌组织中TGF-β1、Smad2表达量与分化程度、卫星病灶、肝硬化、TNM分期、淋巴结转移有关(P<0.05),见表4.
2.4 不同预后肝细胞癌组织中TGF-β1、Smad2表达量 随访3年,失访8例.死亡者肝细胞癌组织中TGF-β1、Smad2表达量高于生存者(P<0.05),见表5.
2.5 TGF-β1、Smad2表达与肝细胞癌患者生存率关系 随访结束后根据TGF-β1表达量平均值(0.80)、Smad2表达量平均值(0.55)将肝细胞癌患者分为TGF-β1高表达29例、低表达28例;Smad2高表达30例、低表达27例.TGF-β1高表达者3年生存率48.28%(14/29)低于低表达者78.57%(22/28)(P=0.003),见图3;Smad2高表达者3年生存率50.00%(15/30)低于低表达者77.78%(21/27)(P=0.012),见图4.
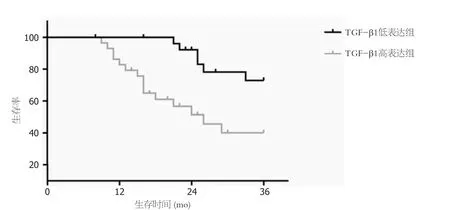
图3 TGF-β1不同表达者生存曲线. TGF-β1: 转化生长因子-β1.
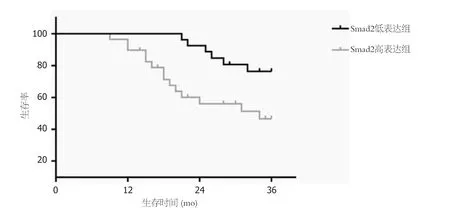
图4 Smad2不同表达者生存曲线.Smad2: 细胞信号转导分子2.
2.6 Cox回归分析预后影响因素 以预后情况为因变量(生存=0、死亡=1),以性别(男=1、女=2)、年龄(原值代入)、肿瘤直径(原值代入)、分化程度(低分化=1、中分化=2、高分化=3)、卫星病灶(无=0、有=1)、肝硬化(无=0、有=1)、TNM分期(Ⅰ期=1、Ⅱ期=2、Ⅲ期=3)、淋巴结转移(无=0、有=1)、TGF-β1表达量(原值代入)、Smad2表达量(原值代入)为自变量,Cox回归分析显示TNM分期、淋巴结转移、TGF-β1表达量、Smad2表达量为预后不良的独立危险因素(P<0.05),见表6.
3 讨论
肝细胞癌发病机制与HBV感染、酒精/非酒精脂肪性肝病、肝硬化、化学致癌物质病变、多种基因、蛋白表达异常有关[7,8].HBV感染后宿主肝细胞内HBV DNA整合、肿瘤抑制基因表达失调,且与肿瘤反应、肝功能、免疫学指标间相互作用,深入探究肝细胞癌发病机制可为抗HBV感染寻找潜在靶点[9,10].
TGF-β1/Smad2激活可促进细胞增殖、转移,抑制细胞凋亡,可能作为肿瘤靶向治疗的潜在靶点[11,12].TGF-β1与细胞膜表面受体结合后Smad2磷酸化,其与Smad4结合进入细胞核内可调控转录因子表达,促进肿瘤细胞侵袭、转移,抑制该信号通路可减弱肿瘤细胞转移能力[13].本研究显示肝细胞癌组织中TGF-β1、Smad2表达量升高,有无HBV感染与TGF-β1、Smad2表达量有关.TGF-β1在血细胞生成、细胞趋化、炎症反应等方面发挥重要调节作用,其表达量升高可诱发血管内皮细胞增生,促进肿瘤恶化[14].TGF-β1、Smad2表达上调可促进肝细胞癌细胞增殖、迁移、上皮-间质转化(epithelialmesenchymal transition,EMT),促使肿瘤细胞免疫逃逸、血管生成,研究表明上游基因特异性蛋白1、丝氨酸/苏氨酸激酶39可调节TGF-β1/Smad2通路,进而影响肝细胞癌细胞恶性生物学行为[15,16].由此推测TGF-β1、Smad2可能通过调节癌细胞生物学行为,影响肝细胞癌发生发展进程.本研究通过临床试验证实HBV感染者、非感染者肝细胞癌组织中TGF-β1、Smad2表达量与分化程度、卫星病灶、肝硬化、TNM分期、淋巴结转移有关,表明TGF-β1、Smad2表达水平升高与HBV感染相关肝细胞癌发生发展密切相关.
HBV病毒不断被复制可激活TGF-β1/Smad2通路,诱发肝细胞癌细胞发生EMT,具有极性的上皮细胞失去极性转化成间充质细胞,细胞迁移、侵袭能力增强,TGF-β1、Smad2可能为HBV感染相关肝细胞癌进展的关键基因.阻断TGF-β1/Smad2通路可抑制EMT,减弱肝细胞癌[17]、伯基特淋巴瘤[18]细胞增殖、迁移、侵袭能力.因而探究TGF-β1/Smad2通路与肝细胞癌发生发展的关联性具有重要意义.本研究显示HBV感染者低分化、伴有卫星病灶、伴有肝硬化、伴有淋巴结转移中TGF-β1、Smad2表达量高于非感染者,表明TGF-β1、Smad2表达水平升高可促进HBV感染者恶性进展,可能作为HBV感染相关肝细胞癌靶向治疗的潜在靶点.既往研究表明趋化因子受体(chemokine receptor7,CXCR7)可增加TGF-β1分泌量,调节肿瘤细胞增殖、迁移等生物学行为,促使肿瘤恶性进展,临床表现为淋巴结转移、临床分期增高等[19].LIM和SH3结构域蛋白1(LIM and SH3 domain protein 1,LASP1)表达增加可激活TGF-β1,沉默其表达可减弱TGF-β1诱导的肿瘤细胞增殖、侵袭、迁移能力[20].由此推测其原因可能为HBV感染后CXCR7、LASP1表达水平升高可激活TGF-β1/Smad2通路,增强肝细胞癌细胞增殖、转移能力,进一步参与HBV感染相关肝细胞癌病情进展,同时TGF-β1/Smad2通路异常还可能与HBV感染后发生的免疫耐受、病毒清除率有关.本研究尝试性分析TGF-β1、Smad2表达量与肝细胞癌患者预后相关性,结果发现死亡者肝细胞癌组织中TGF-β1、Smad2表达量高于生存者,且TGF-β1、Smad2高表达者生存率低于低表达者.既往研究表明TGF-β1激活后Smad2磷酸化,可增强KLüppel样因子8启动子活性,其高表达与患者预后不良有关[21].TGF-β1、Smad2表达量升高还与较低生存率有关[22].结合本研究结果分析其原因可能为TGF-β1/Smad2通路活化后可促进下游分子核心2β-1,6-乙酰氨基葡萄糖转移酶表达,诱导细胞周期进展,促进肿瘤恶性进展,导致患者预后不良[23].同时本研究发现TNM分期、淋巴结转移、TGF-β1表达量、Smad2表达量为预后不良的独立危险因素,提示TGF-β1、Smad2表达量可能作为评估肝细胞癌患者预后的潜在指标.
4 结论
综上所述,肝细胞癌组织中TGF-β1、Smad2表达水平升高,其表达量与HBV感染、分化程度、卫星病灶、肝硬化、TNM分期、淋巴结转移有关,且HBV感染者中TGF-β1、Smad2表达量与临床病理特征相关性更为密切,可能作为判断肝细胞癌预后的指标,还可为肝细胞癌个体化治疗提供新方向.但本研究仅观察TGF-β1、Smad2,下一步需探究Smad2与其他信号分子的磷酸化水平及其磷酸化机制,同时仍需增加HBV(+)肝癌细胞、HBV(-)肝癌细胞的体外表型验证,并分析其内在机制.
文章亮点
实验背景
携带乙肝病毒的肝癌患者病情恶化的速度更快,且手术后的预后效果、5年期生存率等不理想.停留在血液学生化指标的检测手段并不能充分了解患者治疗不理想的机制.
实验动机
转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad2信号通路能够肝癌细胞的增殖和分化.但是在同时感染乙肝病毒(hepatitis B virus,HBV)的情况下是否会对表达有影响报道较少.
实验目标
TGF-β1/Smad2信号通路在调控癌细胞的生长发挥了重要作用,本研究旨在探讨在乙肝病毒感染的肝细胞癌组织中TGF-β1、Smad2的表达情况及其与HBV的相关性.
实验方法
在临床病理学、影像学、血液学等检测手段的基础上确定研究对象,通过分子生物学、蛋白质化学的方法对TGF-β1、Smad2的表达进行检测,并对术后患者进行定期随访,了解预后情况.
实验结果
与癌旁组织比较,肝细胞癌组织中TGF-β1、Smad2表达量升高.感染者肝细胞癌组织中TGF-β1、Smad2表达量高于非感染者,且TGF-β1、Smad2表达量与HBV-DNA水平呈正相关.肝癌组织中TGF-β1、Smad2表达量与分化程度、卫星病灶、肝硬化、TNM分期、淋巴结转移、生存期有关.
实验结论
感染HBV的肝癌患者TGF-β1、Smad2表达量更高,预后效果更差.TGF-β1、Smad2的表达对肝细胞癌预后情况的判断,以及肝细胞癌个体化治疗具有一定的临床意义.
展望前景
TGF-β1、Smad2在调控肝癌病情发展中起到一定的作用,尤其与感染HBV的肝癌患者的病情发展和预后生存有较大的相关性.但是机制研究还需要探讨信号通路相关分子的磷酸化水平等.

