基于核酸适配体-磁珠的猪血IgG提取方法研究①
郭 嫒,王倩钰,凡思华,王文强,黄柳燕,张 强,王景涛
(1. 佳木斯大学公共卫生学院,黑龙江 佳木斯 154007;2.广东石油化工学院生物与食品工程学院,广东 茂名 525000)
我国每年出栏和屠宰猪的数量巨大。据国家统计局公布,2022年全国生猪出栏量约69995万头,屠宰量约为28538万头。根据实际情况,每头猪可生产约2.2公斤猪血,那么2022年中国猪血产量达到了62785吨[1]。目前我国猪血开发产品还比较单一。长期以来,由于人们对动物血液产品的特殊保健作用缺乏了解,血液产品加工技术落后,一般仅采用最原始热处理被加工成血粉,不仅破坏了一些蛋白质的功能特性,还导致产品的营养质量低、利用率低,而且极不卫生[2]。
免疫球蛋白(immunoglobulin,Ig)是仅次于白蛋白的血液中第二丰富的蛋白质。根据Ig理化性质尤其是免疫学性质,可分为五类,即IgG、IgM、IgA、IgD和IgE。在血浆蛋白中含量最高的Ig类型是IgG,约占总Ig的75%[3]。IgG补充剂具有提高免疫力,预防感冒和腹泻的功效;对于婴幼儿及青少年还可以促进生长发育,预防龋齿;对于体弱者和病人还能够促进身体恢复,预防继发疾病发生[4]。
目前,有关IgG提取和纯化方法中,冷乙醇沉淀是最常采用的方法。该方法使用不同浓度的乙醇,在低温下进行多步离心,达到初步提取IgG的目的。与传统的柱色谱法相比,冷乙醇沉淀法具有易于放大和操作相对简单的优点。然而,此方法也有一些不可忽视的缺点。例如,多步离心分级十分耗时,且易导致IgG损失,使用有机溶剂不仅影响IgG活性还会引起环境净化问题[5]。此外,现有的IgG提取方法如盐析法、辛酸沉淀法、层析法、低温乙醇法等[6, 7],均不同程度地存在回收率低、纯度低、成本高以及环境污染等不足[8]。随着人们对IgG功能的认识不断深化,市场对IgG相关产品的需求不断增长,对其质量的要求也越来越高。因此,研究和开发一种新型高效的IgG提取方法势在必行。
核酸适配体是通过指数富集配体系统进化(SELEX)技术,从合成的随机寡核苷酸序列库中,反复筛选得到的能与靶分子特异结合的一段寡核苷酸序列[9]。将核酸适配体应用于IgG提取具有突出的应用优势,如易合成、纯度高、特异性结合IgG、稳定好、易修饰标记等[10, 11]。基于以上核酸适配体的自身特性,结合磁珠在分离提取中具有的快速简便优势,本研究开展了猪血IgG核酸适配体-磁珠提取方法探索,以期为我国猪血资源化利用以及医药卫生产品开发提供新的技术。
1 材料与方法
1.1 仪器与试剂
TGL-20M台式高速冷冻离心机(上海卢相依实验室仪器有限公司);101-3AB电热鼓风干燥箱(天津市泰斯特仪器有限公司);THZ-92B气浴恒温振荡器(常州金坛精达仪器制造有限公司);JP-O7O5超声波清洗机(深圳市洁盟清洗设备有限公司);SC083276分析型超纯饮水机(四川沃特尔水处理设备有限公司);AE223电子天平(上海舜宇恒平科学仪器有限公司);WIX-EP300迷你垂直电泳仪(韦克斯科技有限公司);DR-3000酶标分析仪(无锡华卫德朗仪器有限公司);PHS-3C酸度计(杭州奥立龙仪器有限公司);HJ-2A数显恒温多头磁力搅拌器(常州亚特实验仪器有限公司);磁力架(广州齐云生物科技有限公司);四维旋转混合仪(北京中科科仪股份有限公司)。
羧基化磁珠(粒径为100-200 nm,浓度为10 mg/mL,江苏先丰纳米材料科技有限公司);末端氨基修饰的IgG核酸适配体(序列为5’-TAATACGACTCACTATAGCAATGGTACGGTACTTCCCCACTCA-C6-NH2,由生工生物工程上海股份有限公司合成);猪IgG酶联免疫分析试剂盒(上海烜雅生物科技有限公司);透析袋、柠檬酸三钠、氯化钠、氯化钙、EDTA、碳酸氢钠、Tween-20、磷酸二氢钠、磷酸氢二钾、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、MES缓冲液(0.2 mol/L,pH6.0)均为分析纯,均由上海毕得医药科技股份有限公司提供。
新鲜猪血取自茂名市茂南区高山食品公司城东屠宰场,按照9:1的比例加入了3.8% 的柠檬酸三钠溶液作为抗凝剂。在4 ℃条件下,3000 r/min离心30min分离血细胞和血浆。将分装于离心管中,于-20 ℃冰箱储存备用。
1.2 方法
1.2.1 磁珠与核酸适配体偶联
取100μL羧基磁珠悬浮液于5mL离心管中,加入2mL的MES缓冲液,轻微振摇3min清洗磁珠,然后磁分离,如此重复清洗3次。然后依次加入2mL的EDC(5mg/mL,MES溶解)和NHS(5mg/mL,MES溶解)溶液,混合均匀,室温下振摇30min,然后磁分离,此时磁珠表面的羧基已经活化。活化的羧基磁珠分别与末端氨基修饰IgG核酸适配核酸适配体进行偶联。用2mL的MES溶液将活化后的羧基磁珠洗涤两次,加入10μL的末端氨基修饰的核酸适配体(100μmol/L),室温振摇孵化1h,孵化结束后用2mL的PBST(0.01mol/L,1% Tween-20)缓冲液清洗3次。最后将洗涤后的磁珠-末端氨基修饰核酸适配体重悬于100μL的PBST储备液中,4 ℃保存,用于后续实验。
1.2.2 IgG提取条件优化
取血浆10mL,按血浆/磁珠体积比150:1、125:1、100:1、75:1、50:1加入磁珠,4℃条件下置于四维旋转混合仪上孵育,时间为0.5、1.0、2.0、4.0、6h。孵育结束后,至于磁力架分离磁珠,采用不同浓度NaCl(1.0、1.5、2.0、2.5mol/L)的PBS洗脱液洗脱IgG,获得IgG提取物。
1.2.3 透析
将透析袋剪成合适的小段,放在2%的碳酸氢钠和1mol/L的EDTA(pH=8)中将透析袋煮沸10min,然后用蒸馏水彻底清洗透析袋。再将清洗后的透析袋放在1mol/L的EDTA(pH=8)中煮沸10min,冷却后,将透析袋浸没在30%的乙醇中,每次使用透析袋之前,用蒸馏水将其清洗干净即可。用EP管和透析袋自制一个小型的透析管,将凝血酶原、IgG和SOD溶液转移到透析管中,在4℃条件下对蒸馏水进行透析,期间更换3~4次透析液,用1% AgNO3检验,直至Cl-离子透析完为止。得到干净的凝血酶原、免疫球蛋白和SOD溶液。凝血酶原溶液需要激活,IgG和SOD溶液可直接进行相应的检测。
1.2.4 IgG含量测定
采用猪IgG酶联免疫分析试剂盒,按照厂家说明书操作方法,测定提取IgG的含量及收率,收率计算公式如下:

1.3 统计学方法

2 结果
2.1 IgG提取单因素分析
2.1.1 血浆与核酸适配体-磁珠混合的体积比
通过ELISA测定分析,血浆与核酸适配体-磁珠混合的体积比对IgG提取效果具有较大影响。核酸适配体-磁珠在血浆中占比增加时,IgG提取量持续增加,当血浆与核酸适配体-磁珠体积比为100:1时,IgG提取量达到最大。但是,继续加大核酸适配体-磁珠占比,反而使IgG提取量降低。SDS-PAGE电泳实验结果显示了与ELISA分析一致的结果,如图1A。血浆与核酸适配体-磁珠体积比为100:1时,IgG提取蛋白条带相对最为明显。提取蛋白与IgG标准品轻链(相对分子质量约20 Kd)和重链(相对分子质量约45 Kd)相一致,如图1B。
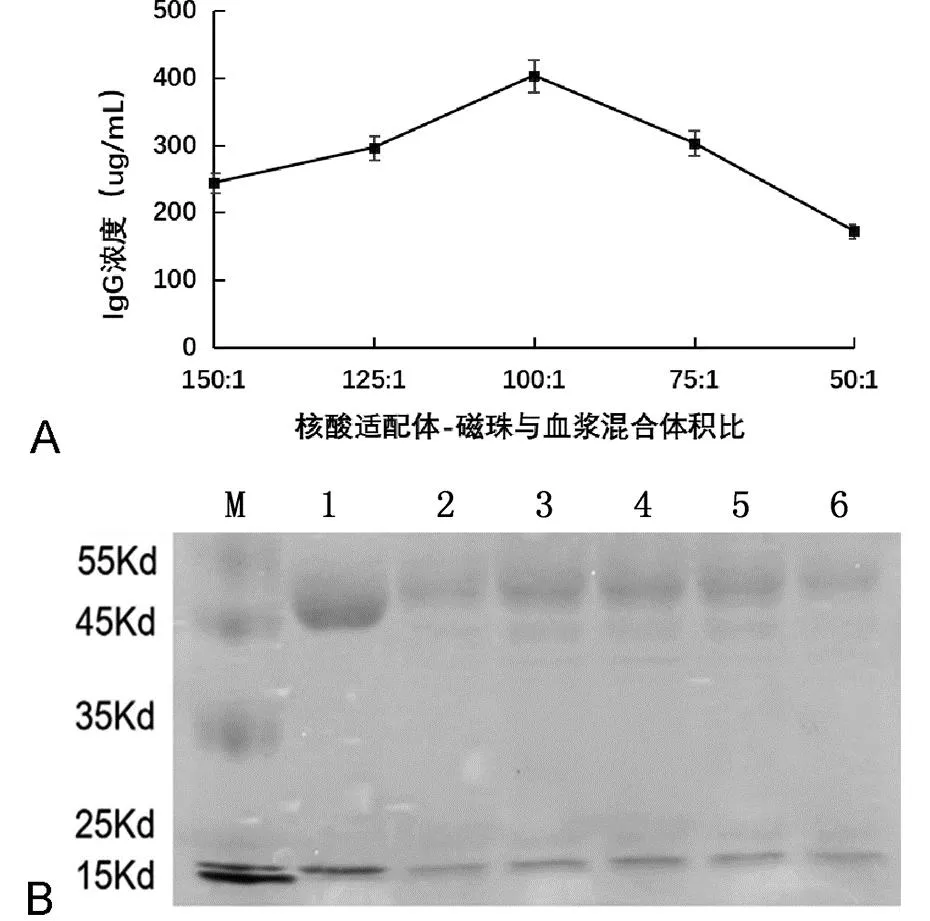
A: ELISA分析结果;B:SDS-PAGE分析结果。M:蛋白marker;1:IgG标准品;2-6:分别对应血浆与核酸适配体-磁珠混合体积比为150:1、125:1、100:1、75:1、50:1。
2.1.2 血浆与核酸适配体-磁珠孵育时间
ELISA测定结果显示,在血浆与核酸适配体-磁珠体积比为100:1情况下,血浆与核酸适配体-磁珠孵育时间对IgG提取量具有影响,当孵育时间在0.5~2.0h之间时,IgG提取量随孵育时间延长而增加,继续延长孵育时间不会增加IgG提取量,表明孵育2.0h可使核酸适配体-磁珠结合IgG达到饱和状态,如图2A。SDS-PAGE电泳实验结果显示了与ELISA分析一致的结果。与孵育0.5h和1.0h
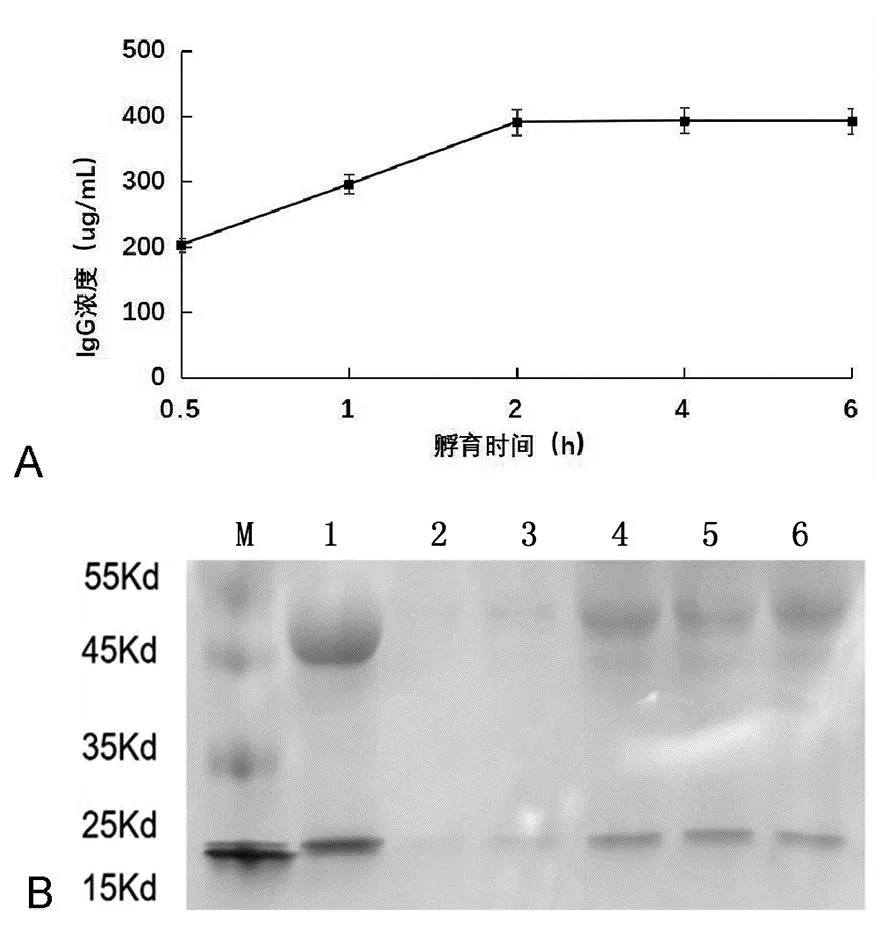
A: ELISA分析结果;B:SDS-PAGE分析结果。M:蛋白marker;1:IgG标准品;2~6:分别对应血浆与核酸适配体-磁珠孵育时间为0.5h、1.0h、2.0h、4.0h、6.0h。
相比,血浆与核酸适配体-磁珠孵育2.0h时,IgG蛋白条带更为明显,但孵育4.0h和6.0h,IgG蛋白条带没有加深趋势,如图2B。
2.1.3 洗脱液NaCl浓度
ELISA测定结果显示,在血浆与核酸适配体-磁珠体积比为100:1,时间为2.0h情况下,洗脱液(PBS)NaCl浓度对IgG提取量具有影响,当洗脱液中NaCl浓度为1.5mol/L时,核酸适配体-磁珠上的IgG洗脱最为充分,继续加大NaCl浓度对不会增加IgG提取量,反而产生不利影响,如图3A。SDS-PAGE电泳实验结果显示了与ELISA分析一致的结果。与其他NaCl浓度相比,洗脱液中NaCl浓度为1.5mol/L时,IgG蛋白条带更为明显,如图3B。
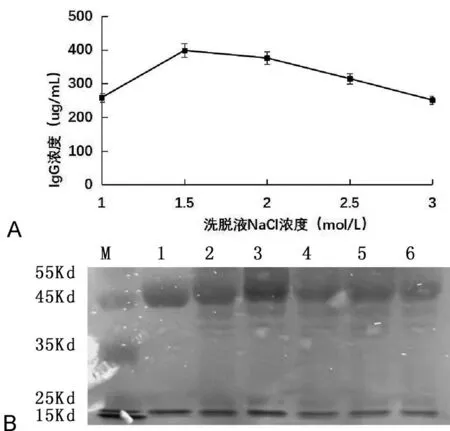
A: ELISA分析结果;B:SDS-PAGE分析结果。M:蛋白marker;1:IgG标准品;2~6:分别对应洗脱液NaCl浓度为1.0、1.5、2.0、2.5、3.0 mol/L。
2.2 IgG提取的正交试验结果
根据单因素试验结果,设计 L9(34)型正交试验,研究血浆与核酸适配体-磁珠混合体积比、孵育时间、洗脱液NaCl浓度共同作用下,IgG提取的最优条件,见表1。

表1 IgG提取试验因素水平表
影响猪血IgG含量因素的主次顺序为:C>A>B,即血浆与核酸适配体-磁珠孵育时间对IgG含量影响最显著,其次是混合体积比。最优组合为A2B2C3,即以猪血为原料提取IgG的最优条件为:反应体积比为100:1,孵育时间2.0h,洗脱液NaCl浓度1.5mol/L。此结果与单因素分析结果高度一致。在此最优条件下,IgG收率为91%,见表2。

表2 IgG提取正交试验结果
3 讨论
核酸适配体-磁珠在血浆中的占比,一方面影响到IgG的提取效率,另一方面也决定了提取成本,因此这一提取因素十分重要。本研究相关结果表明,当血浆与核酸适配体-磁珠体积比为100:1时,IgG提取量达到最大。核酸适配体-磁珠在血浆中占比低时,血浆中IgG过量,核酸适配体-磁珠不能充分结合IgG,导致提取率较低。但是,如果核酸适配体-磁珠在血浆中占比过高时,血浆IgG分配到核酸适配体-磁珠上的比例将会下降,在后续洗脱过程中,由于洗脱率不可能达到100%,因此导致IgG提取效率降低。血浆与核酸适配体-磁珠孵育时间决定了提取方法快速性,同时对保证IgG的生物活性起到至关重要的作用。本研究相关结果表明,当孵育时间在2.0h时,IgG提取效率达到最佳,继续延长孵育时间不会增加IgG提取量,原因是核酸适配体-磁珠与IgG结合达到饱和状态时,提取率将不会增加。核酸适配体与IgG以非共价方式结合,NaCl浓度洗脱液决定了洗脱液的离子强度,在高离子强度下,IgG将与核酸适配体-磁珠分离。本研究相关结果表明,当洗脱液中NaCl浓度为1.5mol/L时,核酸适配体-磁珠上的IgG洗脱最为充分,继续加大NaCl浓度对不会增加IgG提取量,反而产生不利影响,其原因主要是在IgG已经充分解离的情况下,进一步加大洗脱液中的离子强度可能导致IgG分子中Fc片段结构改变或破坏,而ELISA检测主要识别的是IgG分子中的Fc片段,导致测定结果显著下降。正交分析结果表明,在血浆与核酸适配体-磁珠混合体积比、孵育时间、洗脱液NaCl浓度共同作用下,影响猪血IgG含量因素的主次顺序为:血浆与核酸适配体-磁珠孵育时间>混合体积比>洗脱液NaCl浓度,IgG的最优提取条件为:反应体积比为100:1,孵育时间2.0h,洗脱液NaCl浓度1.5mol/L。此结果与单因素分析结果高度一致,表明单因素分析的结果比较可靠。
综上所述,本研究建立了基于核酸适配体-磁珠的猪血IgG提取方法,该方法具有快速、收率高、条件温和、不使用有机溶剂等优点,在猪血资源化利用以及医药卫生产品开发方面展现出良好的应用前景。

