多不饱和脂肪酸对结直肠癌细胞生物学功能的影响及其生物信息学分析*
董岩,周迪,谢亚书,程昭锦,范耀东△
1云南省肿瘤医院病理科(云南昆明 650118); 2湖北医药学院附属人民医院消化内科(湖北十堰 442000); 3云南省肿瘤医院神经外科(云南昆明 650118)
结直肠癌(colorectal cancer,CRC)是临床上最常见的消化系统恶性肿瘤之一,死亡率居第3位[1]。结直肠癌的发生、发展与生活方式(包括饮食、身体肥胖、营养因素等)的改变密切相关,其中,与ω-3/ω-6多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)的比值呈正相关[2]。ω-3 和 ω-6 PUFAs是人体的必需脂肪酸[3]。两种不饱和脂肪酸是构成细胞膜中脂肪酸的成分,具有不同的生物学功能[4-5]。ω-6 PUFAs及代谢产物形成促进炎症发生及肿瘤生长的微环境,而ω-3 PUFAs则是抵抗炎症的介质,抑制肿瘤细胞生长,在辅助治疗、营养治疗中发挥积极作用[6-8]。ω-3 PUFAs产生下游代谢产物二十碳五烯酸(eicosapentaenoic acid,EPA,C20:4 n-6)、二十二碳六烯酸(docosahexaenoic acid,DHA,C22:6 n-3),花生四烯酸(arachidonic acid,AA,C20:4 n-6)是ω-6 PUFAs核心代谢产物[9]。本研究于2020年6月至2022年3月完成拟比较分析三种代谢产物AA、DHA、EPA对结直肠癌细胞生物学功能及信号通路的影响、化疗药物的协同作用,探讨PUFA与结直肠癌发生、发展的关系,为临床应用PUFA营养治疗肿瘤提供理论依据。
1 材料与方法
1.1 细胞株与试剂 人结直肠癌细胞株RKO和HT29均为云南省肿瘤医院肿瘤研究所馈赠。RPMI 1640、胎牛血清购自Hyclon,细胞计数试剂盒(CCK-8)、Annexin V-FITC细胞凋亡检测试剂盒、PI细胞周期检测试剂盒、qRT-PCR相关试剂购自北京碧云天生物公司,AA、DHA、EPA购自Sigma公司,奥沙利铂(OXA)购自Solarbio公司,RNA提取、逆转录试剂盒及实时荧光定量聚合酶链反应(real-time fluorescent quantitative PCR,qRT-PCR)试剂盒购自北京天根生物公司。
1.2 细胞培养 HT29和RKO细胞孵育在含10%胎牛血清的RPMI 1640培养基中,于37℃含5%CO2孵箱中培养。每2~3 d更换细胞培养液,细胞融合度达70%~80%时进行消化传代培养。
1.3 细胞活力检测 接种100 μL细胞悬液(5×103个/孔)于96孔板,分为AA、DHA、EPA组及对照组,每组三个重复。AA、DHA、EPA处理组的浓度梯度为:50、100、150 μmol/L。待12 h细胞完全贴壁后,吸出培养基更换为上述浓度的AA、DHA、EPA。在培养0、24、48、72 h时每孔加入10 μL CCK-8试剂在培养箱内培养2 h。
1.4 OXA联合处理检测细胞活力 RKO和HT29细胞均分为4个组,AA组、DHA组、EPA组,选取40%IC50浓度的AA、DHA、EPA与0.2、0.4、0.8、1.6、3.2、6.4 μmol/L的奥沙利铂(Oxaliplatin,OXA)联合处理HT29和RKO细胞,CCK-8检测细胞活力。
1.5 PI染色法细胞周期检测 取2 mL(细胞数量约8×105个)对数生长期细胞接种于6孔板内,待细胞融合至约40%时,对照组加入2 mL完全培养基,实验组分别加入48 h IC50浓度的AA、DHA、EPA处理液。继续培养48 h后,按照PI细胞周期检测试剂盒说明处理细胞,24 h内用流式细胞仪进行检测。
1.6 Annexin V-FITC细胞凋亡检测 取2 mL(细胞数量约8×105个)对数生长期细胞接种于6孔板内,待细胞生长至约50%时,对照组加入2 mL完全培养基,实验组分别加入50、100、150 μmol/L的AA、DHA、EPA处理液。继续培养48 h后,按照Annexin V-FITC细胞凋亡检测试剂盒的说明处理细胞,于1 h内用流式细胞仪检测。
1.7 生物芯片结果分析及验证 以HT29细胞为研究对象,待细胞长到50%用50 μmol/L的PBS(对照)、AA、EPA处理细胞48 h后收集细胞提取RNA逆转录成cDNA后进行生物芯片分析。差异 mRNA 的筛选标准:AA、EPA实验组的组间差异mRNA筛选依据|log2FoldChange|>4,P值<0.05标准筛选差异基因集。芯片的数据分析聚类分析所用的软件为Gen Cluster 3.0;通路分析所采用的数据库为KEGG(http://www.pantherdb.org/tools/)。向HT-29细胞培养液中分别加入40%IC50浓度AA、DHA和EPA培养48 h后收集细胞,Trizol法提取总RNA,逆转录合成cDNA用于SYBRTMGreen试剂盒进行qRT-PCR验证。qRT-PCR检测各组中的MCAT、FASN、ACACB、NF-κB1、NF-κB3、FADD在mRNA水平的表达,GAPDH作为内参基因。引物序列见表1。

表1 RT-PCR引物序列
2 结果
2.1 多不饱和脂肪酸对HT29和RKO细胞存活率的影响 选用50、100、150 μmol/L浓度的AA、DHA、EPA处理结直肠癌细胞系HT29和RKO细胞,进行CCK8细胞活力实验。HT29和RKO细胞活力随着AA、DHA、EPA浓度增加而降低(表2、3),与对照组相比,除50 μmol/L的AA外,其他浓度的PUFAs与对照组相比差异均有统计学意义(P<0.01)。
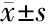
表2 RKO细胞中AA、DHA、EPA处理组的72 h吸光度

表3 HT29细胞中AA、DHA、EPA处理组的72 h吸光度
2.2 PUFAs联合OXA协同抑制结直肠细胞的增殖 结直肠癌根治性治疗后的OXA为基础的化疗是结直肠癌患者常见的治疗方案[10]。为了探究PUFAs是否可以协同OXA抑制结直肠癌细胞增殖。通过IC50实验,选取AA、DHA、EPA合适浓度(40%IC50浓度),见表4,与0.2、0.4、0.8、1.6、3.2、6.4 μmol/L的OXA联合处理HT29和RKO观察细胞的增殖。结果发现三种PUFAs均可以协同OXA抑制结直肠癌细胞增殖,其中,EPA效果最显著(图1)。

注:*与OXA比较P<0.01

表4 RKO和HT29细胞中AA、DHA、EPA 48hIC50及40%IC50值
2.3 PUFAs对结直肠癌细胞周期的影响 为了分析PUFAs是否通过影响细胞周期而抑制结直肠癌细胞的增殖,进行细胞周期实验进行验证。结直肠癌细胞株HT29和RKO经IC50浓度的AA、DHA、EPA分别作用48 h后细胞周期结果及对照组细胞周期结果见表5、6及图2。在HT29细胞中,DHA、EPA处理组与对照组相比,G0/G1期细胞比例显著增加(P<0.01),S期和G2期细胞比例显著降低(P<0.01),AA处理组对细胞周期的影响与对照组相比差异无统计学意义(P>0.05)。RKO细胞中,AA、DHA、EPA处理组G0/G1期细胞比例显著增加(P<0.01),S期和G2期细胞比例显著降低(P<0.01),提示DHA、EPA能够使细胞周期阻滞在G0/G1期,而AA在HT29细胞中作用不显著,在RKO细胞中使细胞周期阻滞在G0/G1期,说明PUFAs对细胞周期的影响可能与细胞本身特性相关。

注:A:RKO细胞;B:HT29细胞
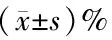
表5 RKO细胞中PUFAs处理后细胞周期比例
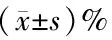
表6 HT29细胞中PUFAs处理后细胞周期比例
2.4 PUFAs对结直肠癌细胞凋亡的影响 为了分析PUFAs是否影响细胞凋亡,结直肠癌细胞株HT29和RKO经AA、DHA、EPA(50、100、150 μmol/L)分别作用48 h后细胞凋亡结果见表7、8及图2。HT29和RKO在对照组中未见明显的凋亡,活细胞比例为94.34%。在HT29和RKO中,50 μmol/L的DHA和EPA处理组的凋亡细胞较对照组差异有统计学意义(P<0.05),AA处理组(50 μmol/L)较对照组差异无统计学意义(P>0.05);100、150 μmol/L的AA、DHA、EPA处理组较对照组均差异有统计学意义(P<0.01);HT29和RKO凋亡细胞比例与AA、DHA、EPA浓度呈依赖关系。三种PUFAs产生的凋亡细胞比例为EPA>DHA>AA。

表7 不同处理组RKO细胞凋亡的比例
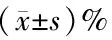
表8 不同处理组HT29细胞凋亡的比例
2.5 基因芯片检测AA/EPA干预引起HT29结肠癌细胞基因表达谱的变化 依据|log2FoldChange|>4且P值<0.05标准,cDNA芯片分析结果显示差异基因2 475个,其中2 023个基因上调,452个基因下调(图3)。如图3,使用KEGG代谢通路数据库分析差异基因功能,显示这些基因共参与34个信号通路包括脂肪代谢通路、与肿瘤发生相关的细胞凋亡、细胞周期等信号通路,其中差异基因富集最多的信号通路为癌症相关信号通路(hsa05200:Pathways in cancer),共40个差异基因(表9)。AA、EPA干预引起HT29脂肪酸代谢基因谱广泛改变,包括:脂肪酸生物合成、脂肪酸延长、脂肪代谢、脂肪消化与吸收通路。对主要通路差异基因进行荧光定量PCR测定验证基因表达水平。结果显示:FADD在AA组、DHA组和EPA组中表达水平逐渐上调,MCAT、FASN、ACACB、NF-κB1、NF-κB3在AA组、DHA组和EPA组中表达水平逐渐下降(图4)。验证结果与芯片表达结果一致,表明基因芯片结果可信。

注:A、B图中红色为上调基因,绿色为下调基因,C图蓝色点表示按照|log2FoldChange|> 4标准筛选的差异基因

表9 ω-6 AA/ω-3 EPA处理组中的10个差异信号通路
3 讨论
结直肠癌是临床上最常见的消化系统恶性肿瘤之一。生活习惯及饮食成分与结肠癌发生、发展密切相关[11-13]。OXA是结直肠癌具有显著抑制活性的铂类药物,约有30%~50%的结直肠癌患者对该药物的应答不敏感,容易出现复发及病情恶化的现象[14-15]。如将多种药物联合使用能够辅助提高抗肿瘤效应。本研究发现AA、EPA、DHA与OXA协同抑制结直肠癌细胞增殖方面,EPA作用效果最明显,提示EPA在结直肠癌细胞中对OXA增敏效果最佳。基因表达谱分析发现FADD mRNA表达水平在EPA处理组中较AA、DHA处理组显著提高,FADD蛋白又名Fas相关死亡功能域蛋白,主要通过Fas/FasL途径参与诱导细胞凋亡[16]。以往文献发现,通过额外补充ω-3 PUFA或体内转化增加ω-3/ω-6 PUFAs能显著抑制细胞增殖,促进细胞凋亡[17]。同时,对凋亡的调控是影响化疗药物发挥抑制细胞增殖的关键[18]。本研究表明EPA联合OXA抑制增殖可能与上调FADD介导的凋亡信号通路有关。
KEGG代谢通路数据库分析显示差异基因共参与34个信号通路,其中代谢及肿瘤相关信号通路的差异基因数量居多。qRT-PCR实验进行芯片结果验证时,EPA、DHA对比AA干预下,FASN基因表达被显著抑制,其中EPA作用效果最明显。以往研究发现,FASN在结直肠癌患者中的表达高于健康人群,并与淋巴转移和远处转移有关;FASN的表达对Wnt信号通路中肿瘤干细胞移动性相关的关键蛋白的基因表达有影响[19]。EPA、DHA较AA能显著抑制FASN的表达,提示EPA可能通过降低FASN表达抑制其介导的Wnt信号通路进而降低肿瘤的发生。
PUFAs作为强大的生物活性媒介物,影响胞内信号转导、修饰基因的表达水平,进而影响肿瘤的发生、发展,其中一部分抗肿瘤作用及机制仍未完全阐明,因此还需要补足实验不断探索PUFAs代谢与结直肠癌发生、发展的相关性,阐述其作用机制,推动PUFAs在结直肠癌高风险人群的预防、辅助治疗方面的应用。
利益相关声明:所有作者声明无利益冲突。
作者贡献说明:范耀东进行实验设计;董岩负责药物浓度的筛查和预实验及查阅相关文献;周迪负责细胞功能实验、化疗敏感性实验;谢亚书进行生物芯片结果验证;程昭锦负责数据处理,统计学分析;董岩进行论文撰写及审核。

