祁连山区不同海拔植被带土壤微生物磷脂脂肪酸分析
朱庆征, 冯志培, 冯二朋, 张广渊, 孔玉华†
(1.河南农业大学林学院,450000,郑州;2.西宁市林业科学研究所,810000,西宁)
土壤微生物是土壤的重要组成部分,在推动土壤养分转化、物质循环和能量流动过程中发挥重要作用,其结构和功能对周围环境变化特别敏感,常作为土壤养分状况的重要指示[1]。然而,土壤微生物组成复杂、数量巨大,用传统的研究方法往往低估土壤微生物的真实状况,不利于准确掌握微生物群落结构特征。近年来,磷脂脂肪酸(phospholipid fatty acid,PLFA)标记法在研究土壤微生物群落方面被认为具有一定优势。它不仅能够更精确地测定微生物的生物量,还可以通过微生物群落结构和多样性进一步反映土壤环境因子变化等生态学层面的信息[2],已被广泛应用于探究生态系统中土壤微生物群落结构差异及其与环境因子的关系。
当前,围绕土壤微生物群落的结构分布及其驱动因素的研究已成为土壤学和生态学的研究热点。吴则焰等[3]对武夷山国家保护区研究时发现,武夷山不同海拔从低到高表现出明显的植被垂直演替谱带,从而引起土壤养分含量和水热状况等因素随海拔呈规律性变化,导致土壤微生物PLFA标记种类和总量随海拔上升而降低;姚兰等[4]对黄山不同海拔植被带研究发现,不同植被类型影响土壤微生物生物量和活性,其中土壤微生物生物量碳、氮和微生物熵总体随海拔升高而增加;赵盼盼等[5]通过对戴云山国家级自然保护区不同海拔黄山松(Pinustaiwanensis)的研究表明,温度和活性有机氮是影响表层土壤微生物群落结构发生变化的主要因子,丛枝菌根真菌、革兰氏阴性菌、真菌、总磷脂脂肪酸,细菌:真菌均随海拔升高显著下降。还有研究表明,土壤微生物量在不同土层深度中表现为表层较高,在同一土层不同植被类型条件下差异较大[6]。上述研究发现,海拔通过引起植被类型变化,进而影响环境因子和土壤理化特征,对土壤微生物产生不同影响,且研究区域不同,得出的研究结论也有所差异。目前,有关祁连山区土壤微生物群落结构影响因子的研究还较匮乏。
祁连山是我国西部重要的生态安全屏障,是冰川与水源涵养的生态功能区。祁连山作为我国西北地区高大山系之一,受大陆性荒漠气候和高山寒冷气候的双重影响,森林类型、层次结构和树种组成等具有典型高寒半干旱气候特点,区域内的气候和植被类型随海拔呈规律性变化,祁连圆柏(Sabinaprzewalskii)作为祁连山主要树种之一,呈块状分布于祁连山海拔2 700~3 300 m地带。有关该地的研究集中在土壤养分发育规律[7]以林下植被与土壤水分相关关系等[8],对于祁连山区土壤理化性质和微生物群落受海拔影响的研究尚鲜有报道。因此,笔者采用PLFA生物标记法对祁连山区不同海拔 0~40 cm 土壤微生物群落结构进行研究,旨在探讨不同海拔植被带土壤微生物群落在0~40 cm土层土壤中的分布、差异及其影响因子,为揭示祁连山区土壤微生物群落变化规律提供理论依据,也为进一步探明土壤微生物群落结构对环境因子变化的响应规律奠定基础。
1 研究区概况
研究区位于互助县北山林场国家祁连圆柏良种基地(E 102°20′~102°26′,N 36°54′~36°55′),海拔在2 660~3 215 m之间,处于黄土高原向青藏高原的过渡地带。该区域属大陆性高原气候,夏季温暖多雨,冬季寒冷干燥且低温持续时间长;年平均气温3.8℃,年降水量470 mm,年蒸发量1 090 mm,年日照时间2 593.4 h,太阳年总辐射量584.9 kJ/m2,无霜期150 d。土壤为山地粟钙土,土层厚度约45 cm,A层厚度约5 cm,土壤质地为砂壤土,粒状结构。
2 材料与方法
2.1 样地设置及采样
于2019年5月在祁连圆柏林(2 830、2 860和2 890 m)、林草过渡带(2 900 m)和高山草甸(2 920 m)分别设置3个20 m×20 m样方,共计15个,同一海拔各样方间距离约50~60 m。5块样地坡向一致,依次记为E1、E2、E3、E4和E5,基本概况见表1。每个样地按照“S”型5点取样法采样,使用土钻分别采集0~10、10~20、20~30和30~40 cm的土壤样品后,将同一土层的5个土样混合作为1个土壤样品,共计60个。将采集的土壤样品带回实验室,分别保存于-80 ℃和4 ℃冰箱中,用于土壤微生物和理化性质的测定。

表1 研究区5个样地基本概况Tab.1 Basic information of 5 sampling plots in the study area
2.2 样品测定方法
土壤理化性质测定:土壤含水率利用烘干法测定;土壤粒径体积分数(黏粒:<0.002 mm;粉粒:>0.002~0.050 mm;砂粒:>0.050~2.000 mm)利用土壤粒径粒型测量系统(Mastersizer 2000,英国)测量;土壤pH值(土∶水=1∶2.5)用浸提酸度计(Hanna-HI98128,日本)测定[9];土壤全碳(total carbon,TC)和全氮(total nitrogen, TN)质量分数采用元素分析仪(EURO EA3000,意大利)测定。
磷脂脂肪酸测定参考Frostegård等[10]和Bossio等[11]的方法,根据测定结果(表2),对不同微生物的磷脂脂肪酸进行标记。

表2 表征微生物类群的磷脂脂肪酸标记物Tab.2 Characteristics of PLFA biomarkers for soil microbial groups
2.3 数据处理
采用单因素方差分析(one-way ANOVA)和最小差异显著法来比较不同海拔及不同土层间土壤理化性质和土壤微生物群落结构的差异,通过多因素方差分析(multi-way ANOVA)检验海拔与土层及其交互作用对土壤化学性质和微生物群落结构的影响。在进行去趋势对应分析后,选择冗余分析(redundancy analysis, RDA)来分析土壤理化性质与微生物群落结构之间的关系,并采用Pearson相关系数分析相关性。通过主成分分析(principal component analysis, PCA)检验不同海拔下土壤中微生物群落结构的差异。利用Origin 2018软件进行主成分分析,其他统计分析采用SPSS 19.0和Canoco 5.0软件进行,采用Excel 2010进行数据整理和制图。
3 结果与分析
3.1 土壤理化性质的变化特征
5块样地土壤的pH值范围为5.35~7.31,整体呈弱酸性(表3)。0~40 cm土壤的平均含水率随着海拔升高呈先增加后降低的变化趋势,大小依次为E3>E2>E4>E1>E5,其中E3显著高于E5(P<0.05),除E5样地外,其余样地中土壤 0~40 cm 平均含水率均在10%以上。同一海拔下,各土层间的含水率随土层深度的增加而逐渐降低,E4无明显变化规律。不同海拔土壤粒径体积分数无显著差异,均为砂粒比例最大。土壤TC和TN在不同海拔下0~40 cm土层中的平均质量分数随海拔升高也表现先增加后降低的趋势,大小依次为E3>E2>E4>E5>E1,且E3中的质量分数显著高于E1(P<0.05);在同一海拔各土层中,质量分数基本随土层降低而减小,各土层间均无明显差异。土壤C/N变化范围为9.65~12.17,0~40 cm土层的平均值在E3最大,不同海拔下的差异不显著(P>0.05)。

表3 不同海拔植被带土壤理化性质Tab.3 Soil physic-chemical properties in different vegetation zones along an altitudinal gradient
3.2 土壤微生物PLFA标记物种类及含量
本研究在5个海拔植被带土壤中共检测出31种PLFA标记物。海拔对土壤微生物群落结构的分布影响显著(表4)。14:0 iso、15:0 iso、16:0 iso、18:1 w7c和20:1 w9c这5种标记物在5个海拔的每个土层均有分布,属于完全分布;15:00和16:1 w9c只分布在E3、E4和E5土壤中,属于不完全分布。E3土壤中PLFA标记物种类最多(28种)、质量摩尔浓度最大(770.55 nmol/g),显著高于其他海拔(P<0.05);E1土壤中PLFA标记物有25种,质量摩尔浓度最小(343.18 nmol/g),显著低于其他海拔;E2、E4和E5土壤中PLFA标记物种类分别有22、24和23种,质量摩尔浓度分别为为631.32、583.62和546.54 nmol/g。
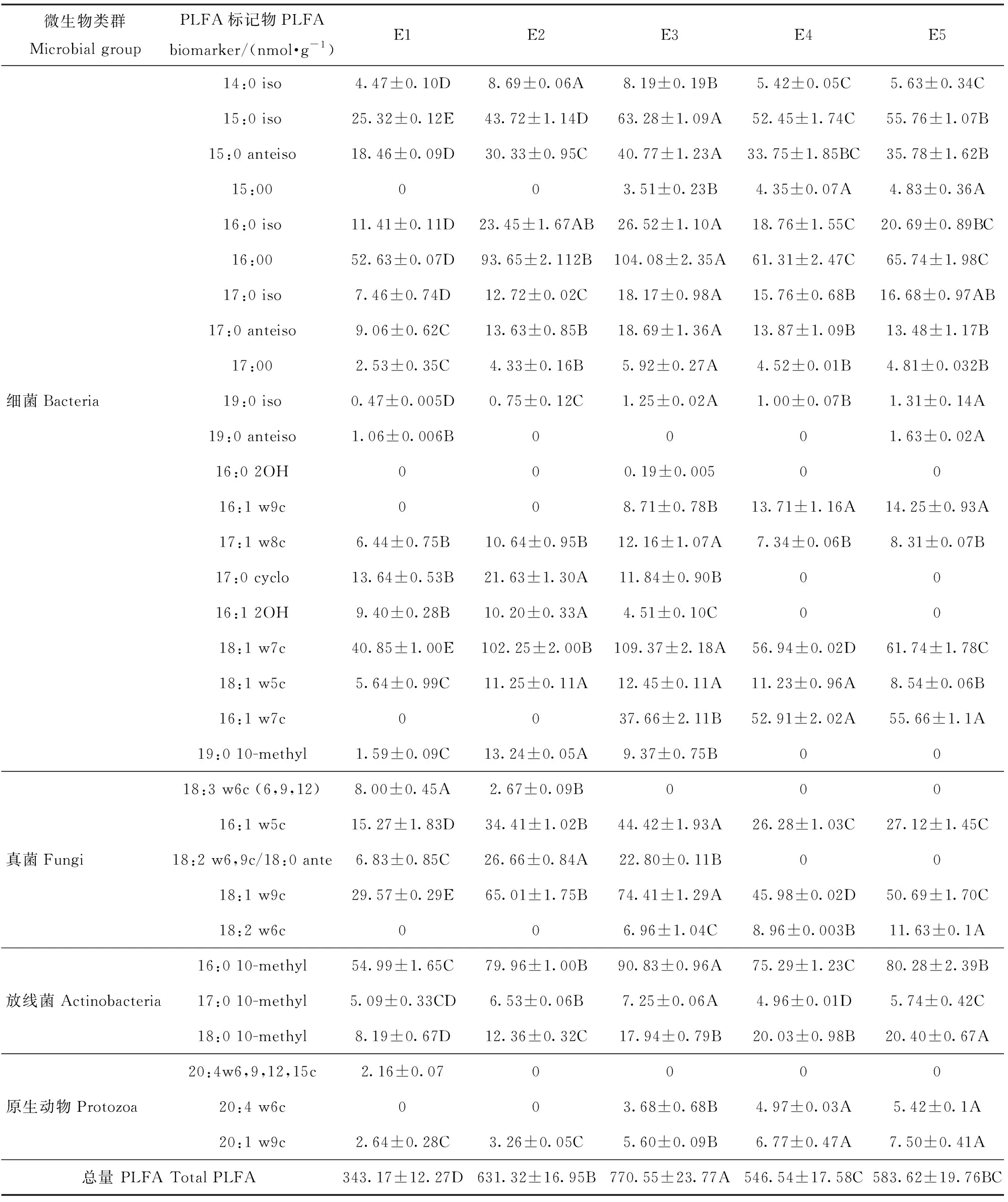
表4 不同海拔植被带0~40 cm土壤微生物PLFA类型及质量摩尔浓度Tab.4 PLFA types and contents of soil microorganisms in 0-40 cm soil layer under different vegetation zones along an altitudinal gradient
通过对不同海拔植被带土壤中优势微生物PLFA进行分析,在E1、E2和E3土壤中PLFA质量摩尔浓度处于前5位的是15:0 iso、16:00、18:1 w7c、18:1 w9c和16:0 10-methyl,且其总和分别占PLFA总量的59.3%、60.9%和57.4%;E4和E5土壤中PLFA质量摩尔浓度较高的是16:0 10-methyl、16:00、18:1 w7c、16:1 w7c和15:0 iso,均占PLFA总量的54.7%。总体而言,5个海拔土壤中微生物PLFA标记物质量摩尔浓度较高的类型是15:0 iso、16:00、18:1 w7c、18:1 w9c和16:0 10-methyl,表明这些PLFA所代表的微生物(以细菌为主)在该地区土壤中起主要作用。
3.3 土壤微生物各类群PLFA分布特征
除原生动物,0~40 cm土层土壤各类群PLFA质量摩尔浓度随着海拔的升高均呈先升高后降低(E3>E2>E4>E5>E1)的趋势(图1)。随着土层深度增加,E1、E2和E3土壤微生物各类群PLFA质量摩尔浓度呈递减的趋势,而E4和E5呈增加的趋势。5个海拔下,细菌在土壤微生物群落中比例最大,均>60.23%;原生动物比例最小,均<2.87%。细菌、真菌、放线菌、G+和G-的PLFA质量摩尔浓度变化范围分别为210.75~496.64、59.52~148.60、68.28~148.60、133.21~290.15和77.54~206.50 nmol/g,其峰值均出现在E3样地0~10 cm土层中。原生动物标记物在E1样地20~40 cm土层和E2样地10~30 cm土层中均未检测到(图1e),最大值(6.40±0.61) nmol/g出现在E3样地0~10 cm土层。不同海拔下,细菌/真菌比值变化波动较小,范围为3.10~4.32,无显著变化(图1f)。革兰氏阳性菌/革兰氏阴性菌(G+/G-)的比值均>1,随海拔亦无显著变化;除E5外,其余样地中两者间的比值均随土层深度增加而增大,土层间差异不显著(P>0.05)(图1h)。多因素方差分析结果表明,土层深度、海拔及其交互作用显著影响PLFA总量、细菌、真菌、放线菌、原生动物、G+和G-(P<0.01)。此外,细菌/真菌(B/F)和G+/G-也受海拔的显著影响。
3.4 土壤微生物群落主成分分析
主成分分析表明(图2),与土壤微生物群落相关的2个主成分累计贡献率达到93.08%,第1主成分(PC1)能够解释变异量57.35%,第2主成分(PC2)能够解释变异量的35.73%。不同海拔下的土壤微生物群落分布在排序空间的不同位置:E1土壤位于主成分1负端,主成分2正端;E2土壤位于主成分1正、负2端,主成分2正端;E3土壤位于主成分1正端,主成分2正端;E4土壤位于主成分1正端,主成分2负端;E5土壤位于主成分1正端,主成分2负端;样地间距离表示其相互关系,距离越远差异越大。进一步将主成分得分系数与各微生物类群PLFA进行相关分析(表5),31个微生物PLFA中有27个与主成分1显著相关,其中17:1 w8c、16:1 w7c、16:1 w5c和20:1 w9c不相关,而17:0 cyclo、19:0 10-methyl和18:0 10-methyl呈显著负相关,其余的各微生物类群PLFA间均为显著正相关;与主成分2显著相关的有18个微生物PLFA,其中10个为显著正相关(P<0.05),分别是14:0iso、16:00、17:1 w8c、17:0 cyclo、16:1 2OH、16:1 w9c、16:1 w7c、16:1 w5c、18:2w6,9c/18:0 ante和16:0 10-methyl;8个为显著负相关(P<0.05),分别为15:00、17:0iso、16:02OH、18:1 w5c、17:0 10-methyl、20:4w6,9,12,15c、20:4 w6c和20:1 w9c。
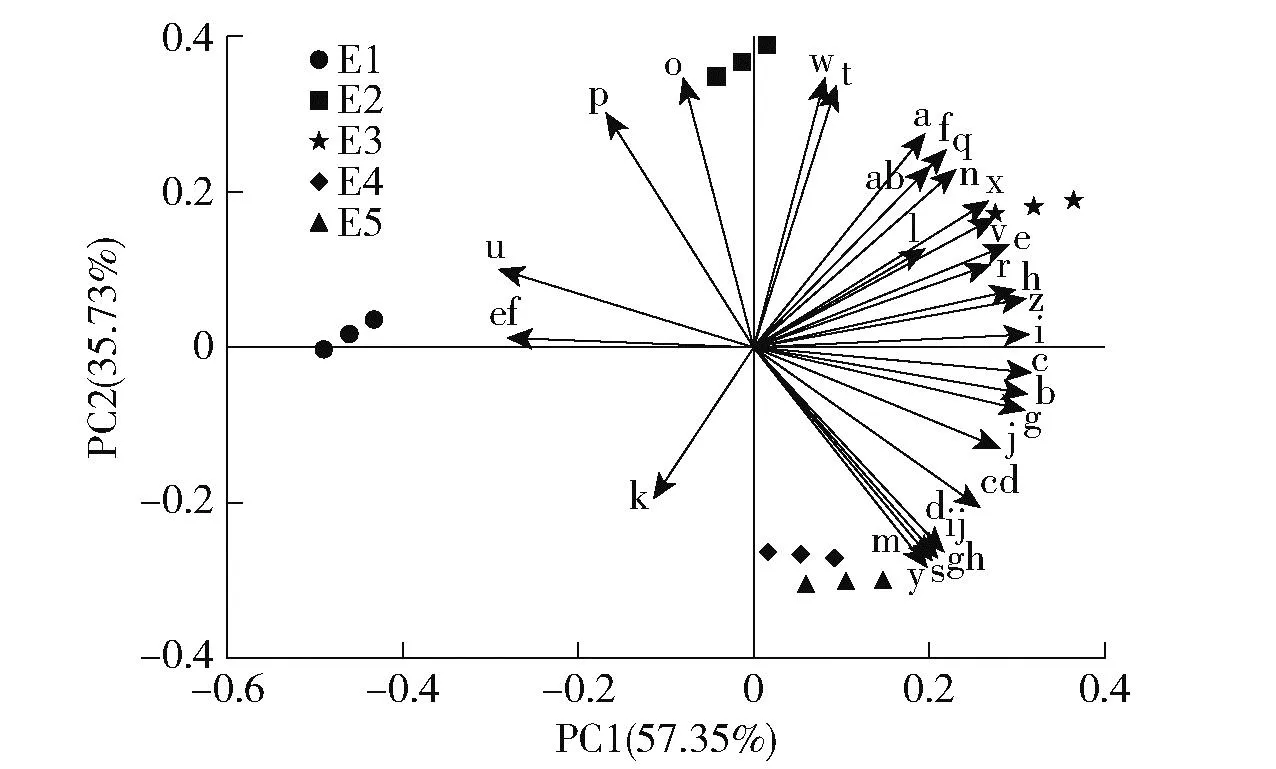
a: 14:0 iso ; b: 14:0 iso; c: 15:0 anteiso; d: 15:00; e: 16:0 iso; f: 16:00; g: 17:0 iso; h: 17:0 anteiso; i: 17:00;j: 19:0 iso; k: 19:0 anteiso; l: 16:0 2OH; m: 16:1 w9c; n: 17:1 w8c; o: 17:0 cyclo; p: 16:1 2OH; q: 18:1 w7c; r: 18:1 w5c; s: 16:1 w7c; t: 19:0 10-methyl; u: 18:3 w6c (6,9,12) ; v: 16:1 w5c; w: 18:2 w6,9c/18:0 ante; x: 18:1 w9c;y: 18:2 w6c; z: 16:0 10-methyl; ab: 17:0 10-methyl; cd: 18:0 10-methyl; ef: 20:4 w6,9,12,15c; gh: 20:4 w6c; ij: 20:1 w9c图2 不同海拔植被带土壤微生物PLFA主成分分析Fig.2 Principal component analysis of soil microbial PLFAs under different vegetation zones along an altitudinal gradient
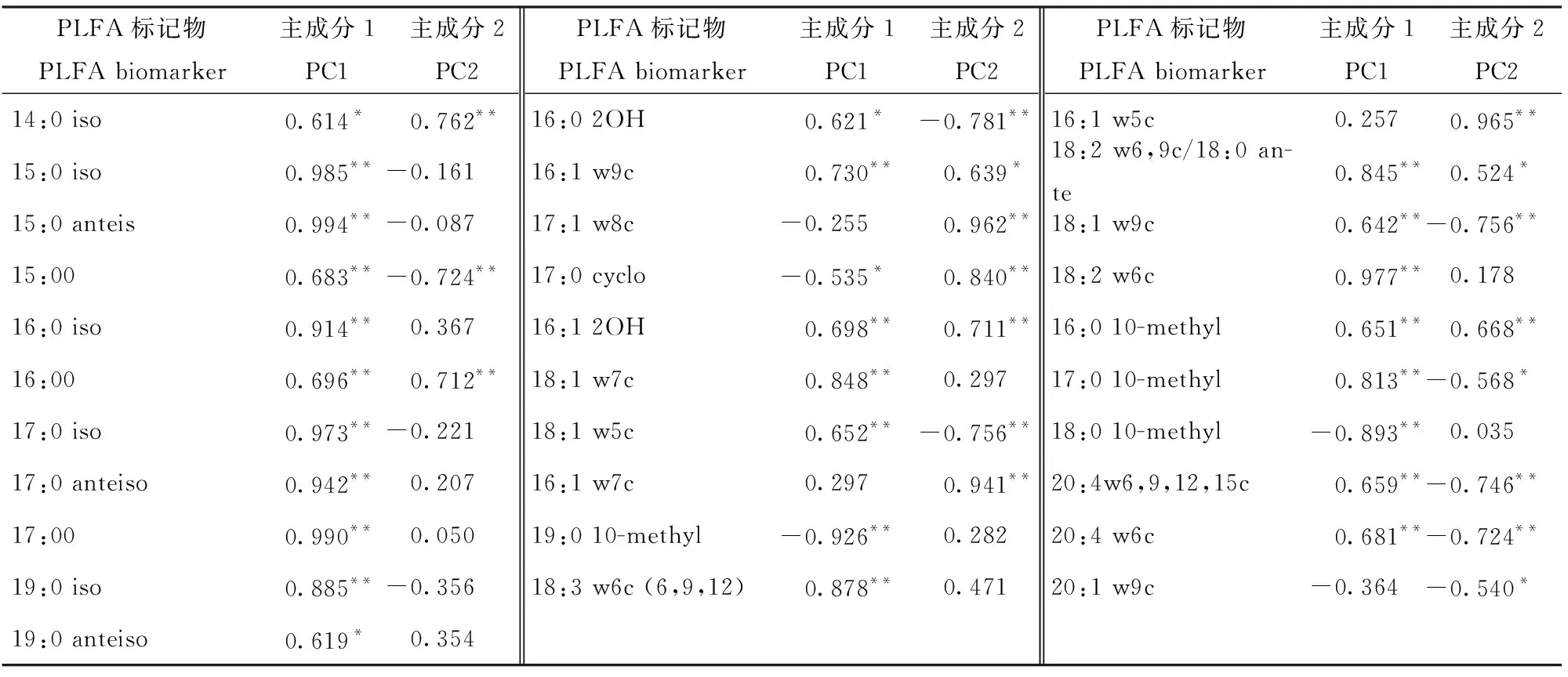
表5 主成分得分系数与土壤微生物PLFA的相关性Tab.5 Correlation between PCA score coefficient and soil microbial PLFA
3.5 土壤微生物群落与土壤理化性质的相关性
此研究中冗余分析表明:第1和第2排序轴特征值分别为0.330 8和0.018 7,解释量分别为89.45%和5.04%,共解释94.49%。说明第1、2排序轴能够很好地反映土壤微生物与土壤因子之间的关系,且主要由第1排序轴决定(图3)。PLFA总量、细菌、真菌、放线菌、原生动物、G+、G-与pH、黏粒和粉粒呈显著或极显著负相关关系;与土壤含水率、砂粒、TC和TN和C/N呈显著(P<0.05)或极显著(P<0.01)正相关关系。细菌/真菌、G+/G-与pH、黏粒和粉粒呈正相关关系,且pH与G+/G-具有极显著相关性(P<0.01),土壤微生物群落与土壤理化性质的相关系数详见表6。与土壤含水率、砂粒、TC、TN和C/N呈负相关关系。对土壤微生物影响较大的土壤因子有土壤含水率、TC和TN,其中土壤含水率影响最大(图3)。

虚线为微生物群落,实线为土壤理化性质。Dotted lines represent microbial communities and solid lines represent soil physical and chemical properties.图3 土壤微生物群落结构与土壤理化性质的RDA分析Fig.3 RDA analysis of soil microbial community structure and soil physic-chemical properties
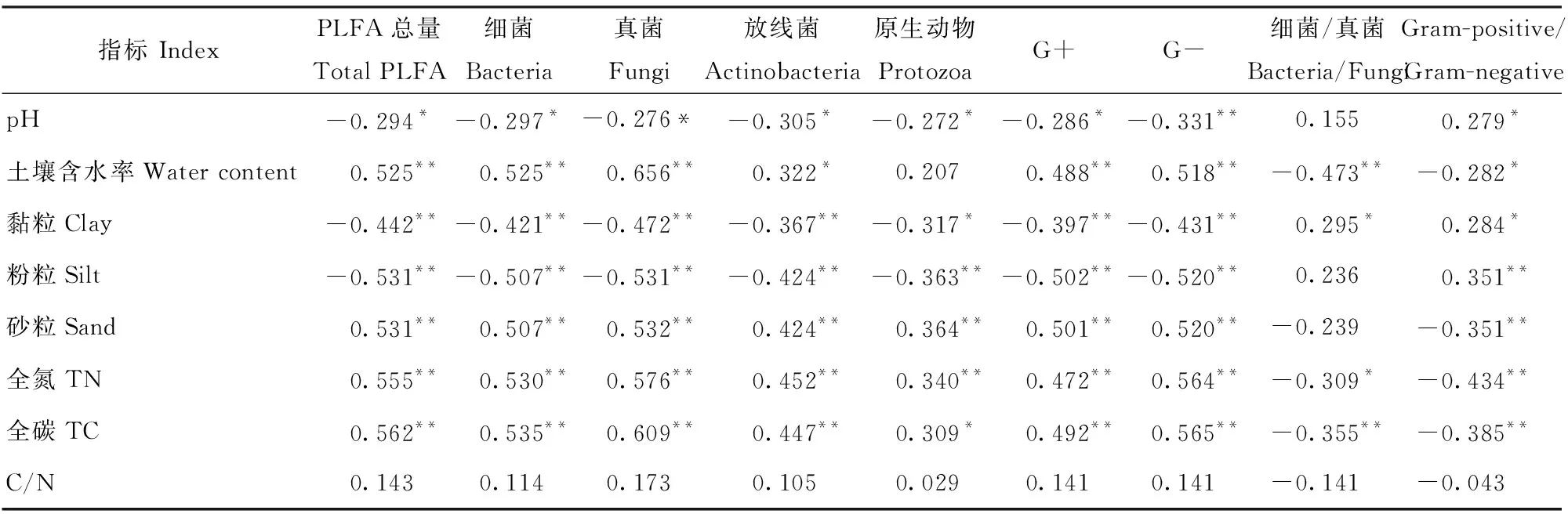
表6 土壤微生物各菌群与土壤理化因子间的Pearson相关系数Tab.6 Pearson correlation coefficient between soil microorganism groups and soil physical-chemical properties
4 讨论
不同地区与类型土壤中可检测到的PLFA种类与数量存在着较大差异。吴则焰等[3]对武夷山海拔500~2 100 m不同植被带土壤微生物的PLFA分析时检测到25种。杜雅仙等[12]研究宁夏荒漠草原海拔1 369~1 390 m不同植物群落微斑块内土壤微生物区系特征时检测到28种PLFA标记物。而本研究中共检测出31种PLFA标记物,表明该区土壤微生物PLFA种类较为丰富。造成此差异的主要因素可能是由于不同地区不同海拔所引起的植被类型和土壤养分的时空异质性。
目前,关于海拔变化对土壤微生物群落多样性影响规律的研究结果不一致[13-15],然而,规律不同但其影响因素较为相似。一方面主要归因于随海拔变化的植被类型和土壤因子,另一方面是随着海拔升高温度降低,影响土壤微生物活性。本研究中E3土壤中PLFA标记物种类最多且质量摩尔浓度最大(表4)。随海拔的升高,细菌、真菌和放线菌PLFA质量摩尔浓度在祁连圆柏林(E1、E2和E3)中均呈逐渐增加趋势,在林草过渡带和草甸(E4和E5)中呈逐渐降低趋势(图1)。土壤微生物群落多样性在祁连圆柏林中随海拔升高而升高的根本原因,可能是海拔引起植被变化,导致土壤养分状况存在差异,直接影响土壤微生物活动,改变其群落多样性。笔者野外采样时发现E3样地地上植被最丰富,且土壤水分和养分充足,有利于微生物活动。因此,导致此区域检测到的土壤微生物各类群PLFA标记物数量与种类最多。厉桂香等[16]研究表明,森林土壤中存在着丰富的纤维资源,而草甸群落植物多样性低,凋落物类型简单,因此草甸土壤可供微生物利用的资源较少;从森林到草甸,随海拔上升温度下降,低温导致土壤微生物活动减弱。吴建国等[17]研究也发现森林中土壤微生物活性比高寒草甸高,地处较高海拔而温度较低的高寒草甸不利于微生物的活动。因此,E4、E5中土壤微生物各类群PLFA含量随海拔升高逐渐降低。一方面可能是由于海拔升高引起温度降低,使得微生物活动受限,另一方面则可能是由于海拔升高引起植被类型变化,进而植物群落通过凋落物输入等过程影响土壤理化性质。
随土层深度增加,E1、E2和E3中土壤微生物各类群PLFA质量摩尔浓度呈递减趋势(图1)。分析发现,在E1、E2和E3中土壤TC和TN含量随土层深度增加亦呈递减趋势(表3),且土壤微生物各类群与土壤TC、TN均存在显著或极显著正相关关系(P<0.05)。由此可以说明,E1、E2和E3土壤表层中积累的有机物质(枯枝落叶、腐殖质等),为其土壤微生物的生长和繁育提供丰富的养分条件;还有研究表明,植物根系的生长能够提高表层土壤的通气和水热状况,进而为表层土壤微生物的生命活动提供良好的环境条件[18]。而E4和E5中呈增加趋势,可能是随着海拔的升高,植被覆盖度逐渐降低,表层土壤裸露在空气中,使其受风蚀影响较为严重;同时表层土壤温度还会受到气温变化的影响,导致表层土壤温度变化剧烈,不利于土壤微生物的生长和繁育[19]。
土壤微生物群落结构受到不同海拔条件下植被类型和土壤因子差异的影响。有研究表明,土壤因子对微生物群落多样性的贡献量大于植被类型[20]。结果表明,土壤含水率随海拔升高呈先升高后降低的趋势,与土壤微生物多样性呈显著正相关关系,土壤含水率增加土壤微生物的活性,这有利于增加土壤微生物群落多样性[21]。RDA分析结果表明该区域内土壤含水率是影响土壤微生物群落的主导因子,揭示了海拔导致的土壤含水量差异性分布是影响土壤微生物多样性的主要因子[13]。同时,微生物生长活动需要适宜的土壤pH值范围,超出或低于此范围都会抑制微生物活动[22]。笔者发现,pH值与土壤微生物各类群PLFA质量摩尔浓度呈显著负相关关系。土壤微生物在进行生长代谢过程中需要一定量的氮,氮含量的增加会提高微生物分解有机质的速率[23],这与笔者发现的土壤微生物各类群PLFA质量摩尔浓度与土壤TN呈正相关的结果相一致,表明TN是影响土壤微生物生长活动的重要因素[4]。有研究表明,G-对水分变化非常敏感,在土壤养分充足的环境中生长较快,G+在资源受限的土壤中占优势[24]。这与本研究中G+/G-比值与含水率显著负相关、与TC和TN呈极显著负相关关系的结果一致。细菌/真菌的大小可准确判断土壤生态系统的稳定性和两个种群的相对丰富程度[25],二者比值越小,生态系统越稳定。本研究中比值变化幅度较小,可能是土壤生态系统较稳定,未受到显著影响。
5 结论
随着海拔的升高,植被类型由林地过渡为草甸,祁连山区土壤微生物PLFA总量、细菌、真菌和放线菌含量均呈先增加后降低趋势,峰值出现在祁连圆柏林E3样地。祁连圆柏林土壤表层凋落物丰富,水养条件更有利于微生物的生命活动;林草过渡带与草甸植被带表层易受风蚀,使土壤深层比表层更适合微生物活动。本研究利用PLFA标记法分析祁连圆柏林、林草过渡带与高山草甸中土壤微生物群落多样性随海拔变化的规律,后续可以综合运用多种微生物研究方法,将有助于进一步揭示祁连山区海拔对植被-土壤-微生物生态系统的影响规律。

