贵州北盘江喀斯特地区兰科植物叶片生态化学计量学特征及影响因素*
吴天柔,安明态,王琨,田力
(1.贵州大学 林学院,贵州 贵阳 550025;2.贵州大学 生物多样性与自然保护研究中心,贵州 贵阳 550025)
生态化学计量学(Ecological Stoichiometry)是研究整个生态系统中能量和多重元素平衡的科学,是分析碳(C)、氮(N)、磷(P)等多重化学元素质量平衡对生态交互作用影响的一种理论[1],为探究植物功能性状间协调变化等生态问题提供了有效方法,成为近年来生态学研究的热点之一[2]。C、N、P元素是保证植物生长最基本的营养单位,是植物体糖类、蛋白质、遗传物质等生物大分子的主要合成成分,参与植物各项生理生化过程[3],三者之间存在密切的协调关系,对植物生长发育过程的调控、生态系统结构和功能起到至关重要的作用[4-5]。叶片是植物感应环境最活跃且最敏感的器官,也是植物进行光合作用的主要场所,植物叶片元素含量及其化学计量可表征植物当前营养与受限状态,以及植物对环境变化的适应机制,被认为是植物生长速率和养分利用效率的有效指标[6]。不同植物适应不同环境条件时,外在形态与内部生理生态过程表现出不同的协调与权衡关系,但在适应相似生境时会存在趋同进化现象,物种从环境中获取营养元素的方式也会影响植物叶片生态化学计量学特征[7]。不同生活型植物生存策略不同,其养分吸收和利用方式也存在显著差异[8-10]。因此,探究不同生活型植物叶片生态化学计量学特征差异及其与环境间的关系,了解植物对养分的保存能力、利用策略及其对环境的适应策略具有重要意义。随着植物叶片生态化学计量学的迅速发展,尤其是以C、N、P含量间的平衡关系研究成果较多,主要集中在叶片元素含量特征及其环境驱动[11-13]、不同生长阶段和季节性变化下的元素分析[14]、不同功能类群之间的差异[15]及不同器官元素含量及其协调关系分析[16]。关于兰科植物叶片生态化学计量学特征在不同生活型上的差异变化及其与环境关系研究较少,仍需进一步研究。
兰科植物(Orchidaceae)是被子植物中物种最丰富的科之一,具有极高的观赏价值和药用价值,对生境条件变化较敏感,在生态系统中拥有不可替代的生态指示作用[17]。由于其观赏价值或药用价值遭受人类过度采挖,野外种群分布数量较少,大多被列入《濒危野生动植物国际贸易公约》(CITES)附录中[18],极具开展研究和保护的必要性。贵州北盘江地处我国东南季风和西南季风的重要交汇区,是我国亚热带常绿阔叶林东、西两地带重要交替地带之一,该区域喀斯特地貌极度发育,连片面积最大,生态环境复杂[19]。境内分布兰科植物极为丰富,共249种,占据贵州省兰科植物总数的72.59%[20],区系地位十分重要,是深入研究喀斯特植物叶片化学计量特征的理想区域。
鉴于此,本研究以贵州省北盘江流域喀斯特地区16种地生型和附生型较典型的兰科植物为研究对象,通过分析叶片化学计量特征及其与环境因子间的关系,明确北盘江喀斯特生境下不同生活型兰科植物间生态化学计量学特征、权衡关系模式及环境驱动作用。旨在丰富喀斯特地区兰科植物叶片生态化学计量学在喀斯特森林生态系统中植物元素状况与环境适应性评价中的应用,为喀斯特地区“旗舰”种群兰科植物保护提供参考依据。
1 材料与方法
1.1 研究区概况
北盘江位于云贵高原的斜坡地带,是珠江流域西江水系的一级支流,在贵州黔西南望谟县和册亨县交界的双江口与南盘江汇入红水河,处于我国东南季风与西南季风交汇处,热量条件好,降水十分丰富,年平均降雨量约900~1 300 mm[21]。该地区喀斯特地貌典型发育,是贵州省喀斯特地貌最为发育的岩石地层单元,生境异质性高、植物生存条件较为严酷、生境脆弱,是喀斯特环境最显著的特征。其中,该区下游望谟、册亨一带划入了“全国35个生物多样性保护优先区”之一的“桂西黔南石灰岩地区生物多样性保护优先区”[22]。
1.2 实验材料
选取北盘江流域喀斯特地区较为典型的地生和附生型兰科植物共16种为实验材料(表1),因腐生兰没有叶片,所以不将其考虑在实验样本中。
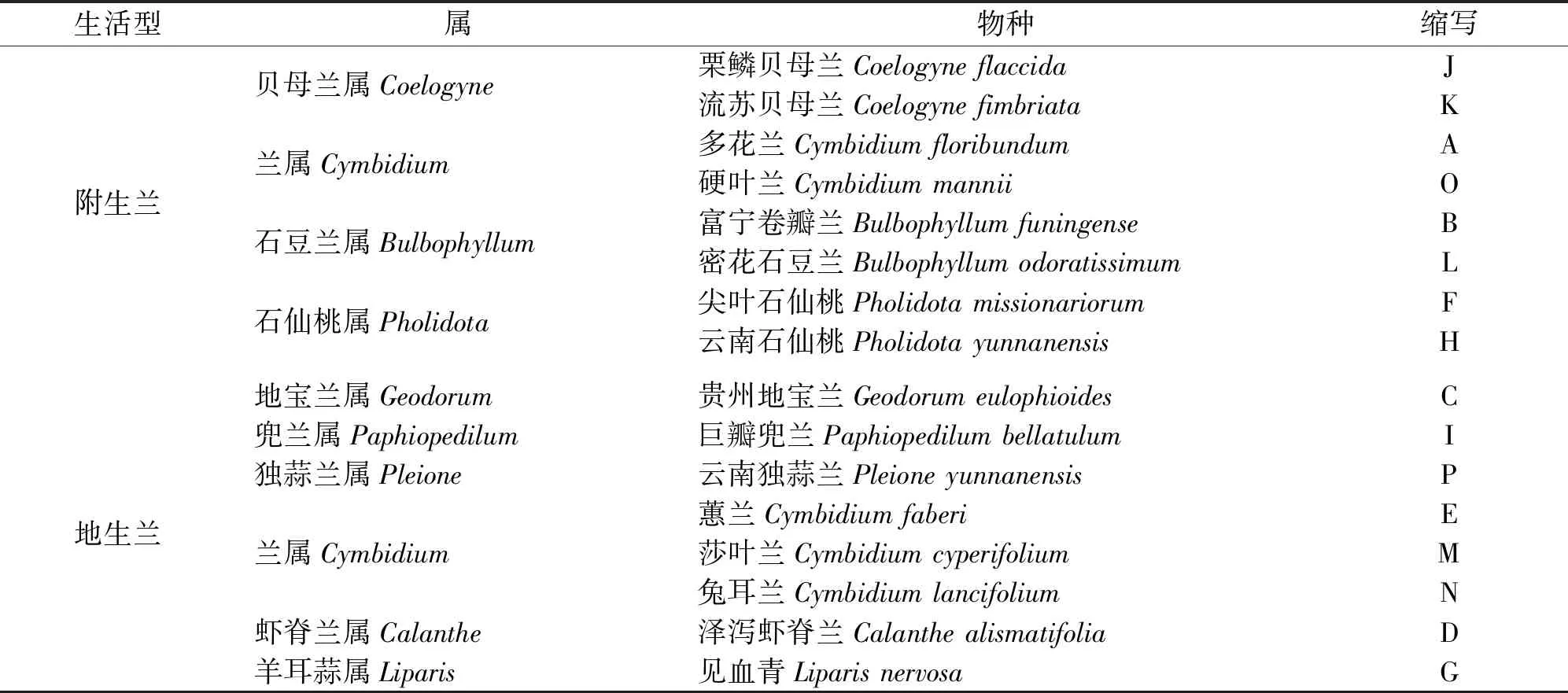
表1 贵州北盘江喀斯特地区16种兰科植物基本信息Tab.1 Basic information of 16 orchids in Beipan River basin of Guizhou
1.3 样品采集与处理
实验于2022年7月至11月,根据典型原则,在研究区选取兰科植物生长良好且生境较为相似区域,随机布设22个5 m×5 m的草本样方,选择3株标准植株,采集长势良好且健康的新鲜叶片3~10片后混合装袋,做好标记带回实验室进行实验分析。样方调查包括生境信息如:海拔(AL)、坡度(SL)、坡向(AS)、坡位(SP)等地形因子和经纬度。
将野外采集样品放在105 ℃下10 min杀菌,再置于80 ℃烘箱中烘干水分至恒温状态粉碎过筛。采用重铬酸钾外加热法测定植物样品C含量,凯氏定氮法测定N含量,微波炉消解法消解粉碎叶片后,利用等离子体发射光谱仪(IRIS Intrepid ⅡXSP)测定叶片P含量[23],每个物种样品数据取平均值为代表。
1.4 数据处理
植物叶片C、N、P含量均采用质量含量mg/g,C/N、C/P、N/P均为质量比。所有数据利用SPSS 26软件处理,采用单因素方差分析(One-way ANOVA)比较叶片元素C、N、P含量及化学计量比C/N、C/P、N/P在不同种、生活型间的差异性,Duncan’s多重比较法检验差异显著性(P<0.05)。通过R 3.6.3语言分析化学元素和计量比的相关性,及叶片化学计量特征与环境因子进行冗余分析(Redundancy analysis,RDA)。研究区内的19个气候因子数据来源于WorldClim数据集[24],通过ArcGIS 10.2软件将样地物种经纬度与气候因子数据对应,掩膜提取后得到对应数据。
2 结果与分析
2.1 元素含量及化学计量比总体特征
由图1可知,兰科植物叶片化学计量种间差异较大。叶片C、N、P含量的变化范围分别为398.94~497.42 mg/g、8.41~35.49 mg/g 、0.35~2.56 mg/g;C/N、C/P、N/P的种间变化范围为12.99~55.11、183~1386、10.8~29.87。植物叶片C(464.8±26.72)mg/g、N(16.47±7.36)mg/g、P(1.01±0.46)mg/g含量以及C/N(32.63±10.95)、C/P(555.84±285.00)、N/P(17.22±495)化学计量比在种水平上均表现出显著的差异性(P<0.05)。各物种间C、N、P含量的变异系数(CV)变化范围相近,分别为0.63%~27.18%、0.35%~74.27%、0.31%~20.87%。化学计量整体CV表现为C/P>N/P>C/N。

图1 贵州北盘江兰科植物叶片生态化学计量特征

图2 贵州北盘江不同生活型兰科植物叶片生态化学计量对比
2.2 不同生活型植物叶片化学元素含量特征
附生和地生兰2种不同生活型植物叶片C含量的变化范围分别为391.89~509.39 mg/g、399.04~498.14 mg/g;N含量的变化范围分别为8.28~16.9 mg/g、12.04~35.63 mg/g;P含量的变化范围分别为0.34~1.62 mg/g、0.66~2.57 mg/g。不同生活型兰科植物叶片元素平均含量存在显著差异性(P<0.05),其中叶片C含量表现为附生兰(471.09±28.06)mg/g>地生兰(459.83±25.65)mg/g,两者间的差异性不显著(P>0.05),地生兰叶片N(19.61±8.03)mg/g和P(1.18±0.47)mg/g均显著高于附生型植物(11.92±2.14)mg/g、(0.75±0.32)mg/g。附生兰和地生兰叶片C/N的平均值分别为(40.91±8.04)、(26.89±9.03);C/P的平均值分别为(730.46±367.84)、(443.76±149.46)。由此可知,附生兰叶片元素化学计量比C/N、C/P显著大于地生兰(P<0.05),二者化学计量比主要受高C和低N和P影响;N/P的平均值分别为(17.86±6.34)、(17±4),两种生活型兰科植物间无显著差异。
2.3 不同生活型叶性状间的相关性
相关性检验结果显示,附生兰(图3 a)叶片C与N、P呈负相关;N与P呈显著正相关(P<0.05),与C/N呈极显著负相关(P<0.001);P与C/N、N/P呈显著负相关,与C/P呈极显著负相关(P<0.01);C/P与N/P呈极显著正相关。地生兰(图3 b)叶片N与P呈显著正相关,与C/N为极显著负相关(P<0.001),与C/P为显著负相关;P与C/N、C/P存在极显著(P<0.01)的负相关;C/N与C/P呈极显著正相关。整体分析发现,不同生活型兰科植物叶片元素含量间的相关关系呈相似特征,均表现为C与N、P含量呈负相关,N、P含量间呈正相关,C/N、C/P、N/P含量两两正相关的相关关系,但附生兰比地生兰在元素含量协调与权衡关系上更为密切。
2.4 植物叶片化学元素含量对环境因素的响应
将环境因子作相关性分析,去除共线性较大的因子后与叶片生态化学计量进行冗余分析(RDA),附生兰RDA结果(图4 a)显示,轴1和轴2共同解释了61.96%的变量,TAR、PDQ、PWQ对兰科植物叶片生态化学计量的解释率较高,分别为-72.14%、-70.21%、68.23%,对叶片生态化学计量的影响达到了极显著的水平(P<0.01)。地生兰RDA结果(图4 b)显示,轴1和轴2共同解释了49.56%的变量,AL、AS、SP对兰科植物叶片生态化学计量的解释率较高,分别为49.94%、-41.26%、36.39%,AL、AS和对叶片生态化学计量的影响达到了极显著的水平(P<0.01)。说明北盘江喀斯特地区环境因子对兰科植物影响程度不同,且对不同生活型兰科植物的主要影响因子不同:附生兰主要受气候因子的影响较大,而地生兰受地形因子的影响。
3 讨论与结论
3.1 兰科植物叶片生态化学计量特征
叶片C、N、P元素是植物生长发育过程中所必须的生长元素,其含量与化学计量比特征能反映植物的元素平衡和养分利用状况[25]。N和P是植物合成大分子物质的原材料,二者在叶片生理生化过程(光合速率、呼吸速率及生产力越强、生长速率-生产力关系)中扮演重要角色[26]。N与P之间常表现出强烈的耦合关系[27],被广泛应用于植物-生态系统养分限制模型的估算中。C作为植物干物质最核心的元素,其与N、P之间的计量比(C/N、C/P)反映植物吸收营养元素时同化C的能力,在一定程度上可反映植物的营养利用的效率[28]。本研究结果表明,研究区兰科植物叶片C、N、P含量分别为(464.8±26.72)mg/g、(16.47±7.36)mg/g、(1.01±0.46)mg/g,相较于全球陆生植物叶片均值水平,C含量与全球叶片C(464±32.1)mg/g含量均值相一致[29],N和P含量均低于全球陆生植物叶片N(20.6±12.2)mg/g、P(1.99±1.49)mg/g含量平均水平[30];相较于全国陆生植物叶片均值水平,研究区兰科植物叶片C、N、P含量均低于全国陆生植物叶片C(480.1 mg/g)、N(18.6 mg/g)、P(1.21 mg/g)含量均值水平[31]。说明贵州北盘江流域喀斯特地区兰科植物叶片N、P含量较低,总体呈“N和P相对缺乏”的养分格局。研究结果梁月明与王轶浩等[32-33]研究同处于亚热带地区的结论存在差异,与Von Oheimb等[34]研究“低纬度地区的植物更容易呈P缺乏的养分特征”的结果存在相似的缺P特征。研究区P含量偏低的养分格局可能与叶片P元素主要受土壤P元素含量主导,而我国大部分地区土壤P含量均低于全球平均水平的原因有关[35]。俞月凤和李金华等[36-37]研究中发现,喀斯特地貌土壤存在缺P元素的现象,该原因可能是导致研究区植物叶片P含量也较低的主要因素之一。N与P含量常在植物叶片中存在密切的耦合关系[27],受P元素限制,可能影响了植物对N元素的吸收与利用,因此也表现出N元素匮乏状态。
不同生活型植物因生长环境条件与生态位的差异而采取不同的生长和养分利用策略[38]。叶片C/N、C/P代表植物吸收N、P元素时能同化C元素的能力,反映了植物的生长速率和养分的利用效率,同时也能有效反映竞争和防御策略之间的平衡[39]。N、P含量较高,而C/N、C/P较低时,植物生长速率越快,采取竞争策略;反之生长越缓慢,采取强有力的防御策略[40]。本研究中,附生兰C/N、C/P均值远高于全球陆生植物叶片均值[41],说明其有较强的C同化力,N、P含量较低,对环境资源获取能力较弱,主要受生境P元素的限制,生长速率较慢。为维持自身生存,采取的是防御策略,这是植物适应养分贫瘠生境的一种选择适应策略,地生兰C/N、C/P较小而N、P含量较高,采取的是竞争倾向策略[42],这可能与地生兰生境条件较好,共生物种丰富,通过营养生态位的分化实现多物种共存有关[43]。此结果一方面论证了不同生活型植物由于在生活史、形态及生理等方面存在差异,对养分有不同的利用策略;另一方面也反映了相同生境条件下,不同物种对养分利用及外界环境适应与进化方面的趋同性[44]。
3.2 不同生活型兰科植物叶片生态化学计量相关性分析
植物生理过程的正常代谢需要各元素间按一定比例关系吸收利用并保持相对的平衡关系,元素在植物体内的供应过程受限或生境条件变化都会影响这种平衡[45]。本研究样品均采自北盘江喀斯特地区,不同生活型物种叶片内的养分分配模式不同,因此元素含量关系就更加突出了不同生活型植物对元素选择吸收与利用的内在协调属性。本研究相关性分析结果表明,不同生活型兰科植物叶片元素含量间的相关关系大体相一致,C、N、P含量及其化学计量比之间存在明显的耦合关系,体现了叶片属性之间的经济策略[46]。C元素均与N、P含量呈负相关,N、P含量间呈正相关关系,是高等陆生植物C、N等计量关系的普遍规律[39,47]。C/N、C/P、N/P含量间两两呈正相关,植物在吸收营养元素时具有一定的比例关系,说明两种生活型兰科植物对元素的利用效率的权衡策略相似,但地生兰C与P和C/P与N/P含量间的相关关系较弱,附生兰C与P间的负相关关系呈显著水平(P<0.05),C/P与N/P含量间的正相关关系呈极显著水平(P<0.001),附生兰植物体内元素的吸收与利用过程中相互协调关系更加密切,可能与附生兰生境养分供应有限且不稳定的原因有关,需要植物生长过程中协调各元素间的关系形成高效的养分资源利用策略,提高生长率与存活率。地生兰C/N与C/P之间存在极显著正相关(P<0.01),附生兰C/P、N/P之间存在极显著正相关(P<0.001),两者之间存在差异,说明植物对养分的吸收和利用是一个极其复杂的过程,即使是同一片区域物种在相似生境下,不同生活型物种间由于生活史和形态、生理等生物学特性不同,对养分需求及利用过程中的权衡关系存在差异,体现植物适应不同环境条件选择的不同适应策略。
3.3 影响不同生活型兰科植物性状特征的环境因素
在长期的进化过程中,植物逐渐发展出强大的生理生化调节能力(可塑性)来适应环境因素的波动[48]。不同生活型植物由于不同的功能性状与生活策略,具有不同的生化结构和特定的生理代谢机制,同一地区内相似的地形与气候条件对不同生活型植物叶片养分含量影响也存在显著差异[49]。本研究冗余分析结果表明:海拔、坡度和坡向主导地生兰的生态化学计量变化,说明研究区地生兰生长主要受地形因素的调控。海拔与空间位置等地形特征,加以二者之间的交互作用和植被类型变化及差异,直接对植物生成的土壤养分及化学计量有显著影响[50-51]。地生兰以林下或低坡位土层较厚生境为主,相较于附生兰,其生存环境养分分配更优越。土壤作为植物吸收养分的载体及相关生理生化反应的主要场所[15],地形因子对土壤分配格局具有重要影响,因此地形因子对地生兰植物叶片各元素的利用与循环具有重大影响[52-53]。附生兰主要受环境中气候因子(气温年较差、最湿季度降雨量和最暖季度降雨量)的影响。综合分析,贵州北盘江喀斯特地区附生型兰科植物的生长受到温度和降水的共同影响,可以用“温度-植物生理假说”(“temperature-plant physiological hypothesis”)[41]的观点来解释贵州北盘江喀斯特地区附生兰植物叶片元素含量与温度和降水之间的关系,即植物的生长代谢速率受温度调控,低温对植物生理过程有抑制作用。同时,温度还影响土壤微生物的活性,间接影响其对土壤元素的矿化速率,改变元素的可利用性,从而影响植物叶片元素的含量[54]。本研究中附生兰以没有土壤的石面、峭壁及树木枝干等独特生境为主,大部分根系裸露于空气或腐殖质层中,植物对养分的吸收主要来源于空气或腐殖质的分解,同时也依赖土壤和根际微生物的元素供应,因此受气候、温度和降雨等条件影响较大。

