以双下肢无力麻木为首发表现的主动脉夹层1例并文献复习
张永志,李艳敏,马晓雯,顾 平
(河北医科大学第一医院 首都医科大学宣武医院河北医院 a.神经内科,河北省脑老化与认知神经科学实验室,河北省神经医学技术创新中心; b.超声科, 河北 石家庄 050051)
主动脉夹层(aortic dissection,AD)为主动脉壁内膜损伤后,血液通过内膜的破口进入主动脉壁中膜,而形成夹层血肿,也称为主动脉内膜分离[1]。AD是一种严重危害人类健康的危急病症之一,其发病率及死亡率均很高。最新研究发现,急性夹层发病率为4.4例/年/10万人[2],在中国,其发病率可达到5例/年/10万人[3],对于急性AD,如果未经治疗,患者死亡率估计最初为每小时1%,第3天为50%,第2周结束时为80%[3]。由于病情严重,预后差,迫切需要紧急有效的治疗。现报道1例以双下肢无力麻木为首发表现的AD诊治经过,为临床诊治提供参考。
1 临床资料
1.1病史 患者男,32岁,身高183 cm,体重130 kg,BMI 38.8,因双下肢麻木无力1 h于2022年5月29日就诊于本院急诊。患者入院前1 h于骑自行车时突然出现双下肢麻木无力,症状先出现于左下肢,后迅速进展至右下肢,呈进行性加重,于10分钟内双下肢力量完全消失,伴大汗,无大小便失禁,无发热、头痛、头晕、失语,无胸闷、胸痛、腰背部疼痛、心悸等其他伴随症状。既往高血压病史,血压最高达180/110 mmHg(1 mmHg=0.133 kPa),平素口服药物治疗(具体不详),未规律监测血压;否认糖尿病、心脏病病史;长期从事体力劳动,吸烟12年(20支/d),否认酗酒史。高血压家族史;个人史无特殊。
1.2体格检查 体温36.3 ℃ ,脉搏90次/min,呼吸20次/min,卧位血压225/110 mmHg;内科心肺查体未见明显异常,腹软,脐周部位有压痛,无反跳痛及肌紧张,神经系统查体:意识清楚,言语流利,高级神经活动正常,颅神经查体未见异常;双上肢肌力Ⅴ级、肌张力正常,双下肢肌力0级、肌张力降低;双上肢共济运动和感觉系统正常,双侧膝反射和踝反射未引出,T12平面以下深浅感觉消失,双侧病理征阴性。
1.3实验室检查 血常规:白细胞计数15.5×109/L[(3.50~9.50)×109/L],中性粒细胞绝对值8.3×109/L[(1.80~6.30)×109/L],中性粒细胞百分数53.7%(40%~75%);血清尿酸471.8 μmol/L(208~428 μmol/L),肌酐92.2 μmol/L(57.0~97.0 μmol/L);凝血功能试验:凝血酶原时间10.4 s(9.4~12.5 s),国际标准化比值0.94,纤维蛋白原3.61 g/L(2.38~4.98 g/L),血浆D-二聚体4.32 mg/L(0~0.55 mg/L)。心脏彩色超声:AD;主动脉瓣轻度返流;二尖瓣轻度返流;左室舒张功能轻度减低,见图1。主动脉CT血管成像:AD(Starnfor A型),左肾动脉、肠系膜下动脉、腹主动脉远端、两侧髂内动脉及两侧髂外动脉近端未见造影剂充盈;左肾灌注减低;心包积液/血;右肾囊肿;双侧肾上腺增粗,见图2。诊断为AD(Starnfor A型),遂予以持续泵入乌拉地尔、艾司洛尔降压治疗,并建议患者进一步行手术治疗,患者及患者家属拒绝。后保守治疗入住心脏外科重症监护室,于2022年5月30日复查肝肾功能:尿酸1466.7 μmol/L,肌酐354.4 μmol/L,丙氨酸氨基转移酶622.6 U/L(9.0~50.0 U/L),天门冬氨酸氨基转移酶819.5 U/L(15.0~40.0 U/L),肌酸激酶44164.0 U/L(50.0~310.0 U/L),乳酸脱氢酶2980.0 U/L(120.0~250.0 U/L)。患者当天因多器官功能衰竭死亡。
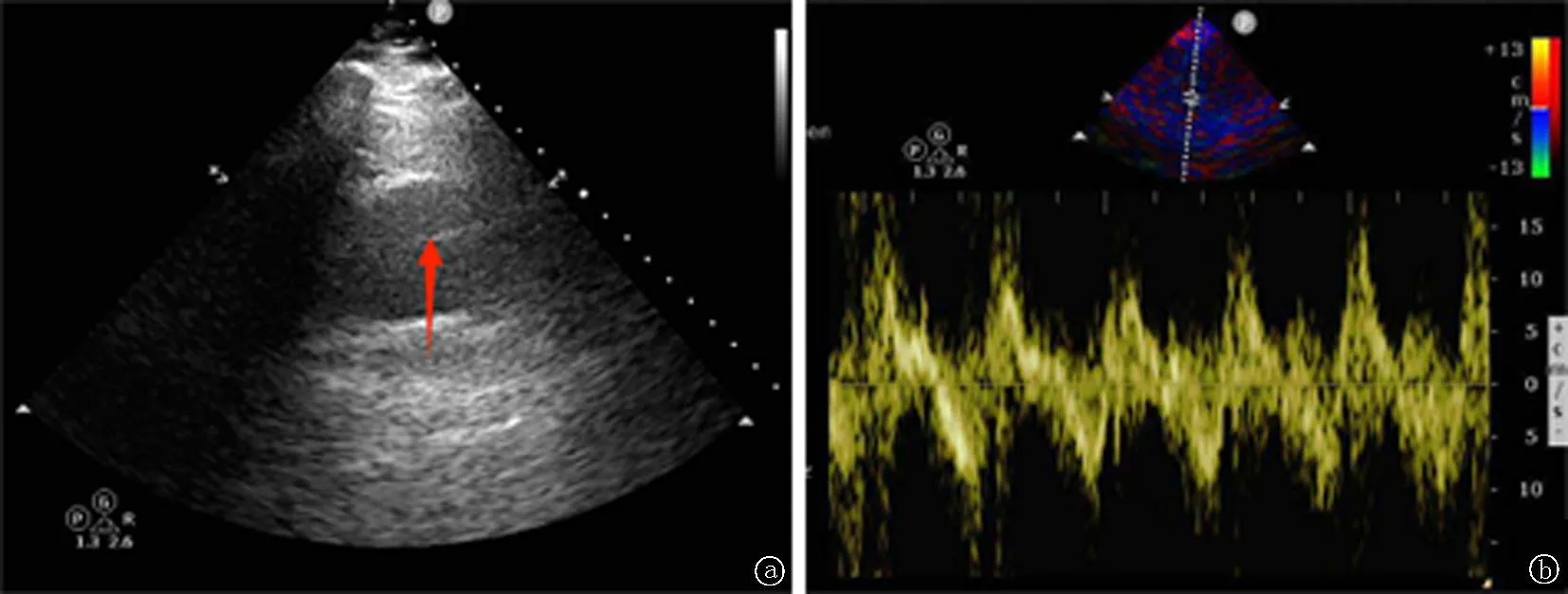
图1 心脏彩色超声示主动脉窦部内径约41 mm,升主动脉内径约48 mm,升主动脉管腔内可见剥脱的带状回声内膜(红色尖头所指为夹层回声信号)

图2 主动脉(胸主动脉+上腹动脉+下腹动脉+髂动脉)CT血管造影成像示AD Standford A型(红色尖头所指为夹层) a.主动脉CT血管重建成像;b~d.矢状位。其中主动脉弓部(b)、升主动脉及降主动脉(c)、升主动脉(d)可见“双腔改变”
2 讨 论
对于AD,目前最常用的为斯坦福分类体系,如果夹层累及升主动脉,则为Stanford A型;如果近无名动脉的升主动脉不参与此过程,则称之为Stanford B型[4]。根据出现症状的时间,夹层分为急性(< 14 d)、亚急性(15~92 d)或慢性(>90 d)[5]。其中急性A型AD占所有AD的58%~62%,其病死率为73%,院前死亡率高达49%[6]。
AD最常见危险因素包括男性、年龄、高血压、吸烟、动脉瘤、先天性疾病、炎症性疾病等[7],其中高血压为AD发病的最主要的危险因素[1, 3]。本文患者为男性,BMI值高,既往有高血压病史和吸烟史等明确危险因素,实验室检查显示血清尿酸水平升高,而高尿酸可能同时参与了AD的发病机制[8]。既往研究认为,对于女性患者,BMI与AD死亡率呈线性负相关[9],而最新研究发现,男性BMI和主动脉疾病存在正性相关,且在吸烟患者中,无论男女,BMI均与主动脉疾病死亡率呈正相关或倾向于正相关[10]。其机制可能为高BMI相关炎症可引起主动脉壁变性,即可导致主动脉中膜和外膜弹性蛋白断裂或胶原蛋白降解,导致主动脉内壁退化,进而内膜撕裂,形成主动脉扩张、夹层[8]。
急性AD的临床表现因缺血部位和是否存在血流动力学不稳定而存在差异,其典型表现为急性、严重、撕裂性胸痛或背痛,也可表现为剧烈性或尖锐性刺痛[2]。除胸背痛外,急性AD的主要神经系统症状是大脑或脊髓缺血、晕厥和下肢疼痛导致的局灶性神经功能缺损。研究结果显示,18.6%的A型急性AD患者以中枢神经系统症状为首发症状[11],其中大约1 %的急性A型AD以脊髓缺血症状发病[12]。Sandhu等[13]回顾了1999-2014年间诊治的978例急性AD,其中仅28例(2.9%)急性AD患者表现为孤立性脊髓损伤(截瘫/瘫痪,无其他灌注不良症状)。因患者家属拒绝行腰髓影像学检查及手术治疗,考虑本例患者其截瘫原因为腹主动脉内膜撕裂至胸12水平影响腰动脉,从而波及脊髓前动脉,导致脊髓横断性缺血损伤[14]。本例患者发病时未诉疼痛,荟萃分析发现,伴有神经症状的患者在夹层开始时出现疼痛的比率为47.8%,远低于在普通AD病例中出现疼痛的比率(95%)[12],因此影像学对于明确诊断是必要的。但对于没有典型症状的患者,有时很难判断是否应该进行增强CT。
本例患者诊断明确,病情危重,在临床中更应重视诊断与鉴别诊断。为了早期、快速地发现AD,美国心脏病学会和美国心脏协会胸主动脉疾病患者诊断和管理指南提出了基于诱发条件、疼痛特征和临床检查的AD检测风险评分系统[15]。虽然该系统对急性AD的检测具有95.7%的高灵敏度[16],但其特异度较低(39.8%)[17]。在这种临床需求的背景下,D-二聚体作为急性AD的生物标志物的有效性得到了广泛的研究,且对AD有鉴别诊断意义[18]。欧洲心脏病学会指南推荐D -二聚体升高作为急性主动脉综合征诊断的Ⅱa指标[19]。研究显示D-二聚体升高对AD的诊断有较高的特异度[20],将0.5 μg/ml作为临界值,D-二聚体的敏感度在95%~98%,特异度为40%~60%[21]。而经胸超声心动图对于Stanford A型AD诊断的敏感度和特异度分别为77%~80%和93%~96%,而CTA对于AD诊断总体敏感度和特异度为96%[18]。因此,对急性AD的诊断需要综合的方法。本文患者血浆D-二聚体水平明显升高(4.32 mg/L),结合心脏彩色超声及主动脉CT血管成像,虽诊断及时且明确,但患者及家属拒绝手术治疗。后AD进一步加重,考虑其并发脏器灌注不良综合征[22],分析原因为AD分支血管累及腹腔干动脉或双肾动脉,导致急性肝肾功能衰竭,代谢紊乱;AD分支血管累及主动脉根部,使主动脉瓣关闭不全导致急性心功能衰竭,最终因患者及其家属放弃手术治疗导致多器官功能衰竭而死亡。
随着医疗条件的提高,目前对AD的临床诊断相对容易。对于急性AD的治疗,无论是A型还是B型,确诊后的首要治疗是通过药物控制患者心率和血压。药物治疗的原则是减轻主动脉剪应力,从而减少假腔的传播[23]。目前,指南推荐首选β受体阻滞剂以控制心率达到目标值(60~80次/min),并将患者收缩压降至100~120 mmHg[24],从而减少主动脉壁的压力[6]。尽管将血压和心率控制在阈值范围内,仅药物治疗的患者死亡率在发病后仍以1%~2%每小时的速度增加,在两天内可达30~68%,在发病两周内达到49~73%[25],考虑其靶器官并发症的几率随时间变化而明显增加,且其中远期疗效存在不确定性,因此学术界对夹层药物治疗的心率和血压控制目标存在较大争议[26]。虽然严格心率控制策略对于B型夹层似乎能从中获益[26],但在选择治疗时应根据临床情况个体化,以尽量减少并发症的发生。且药物治疗不能代替手术,因此,手术是AD患者的推荐治疗方案[6]。目前对于Stanford A型AD,国内外指南推荐首选外科手术治疗[19, 26]。虽然术后早期死亡率仍高达9%~25%,但如果不进行手术,前48 小时内病死率为50%[27]。目前国内Stanford A型AD的手术死亡占3.1%~15.5%,急性期手术死亡和并发症发生率更高[24],且术后早期可合并感染、出血、脏器功能不全、神经系统疾病等并发症。但与内科治疗相比,术后远期疗效明显更好。但无论是采取药物保守治疗或外科手术治疗,AD患者均需要长期乃至终身进行规律的随访。并建议所有患有Stanford A型AD患者的一级亲属都应接受经胸超声心动图检查,以排除主动脉根部或升主动脉瘤的存在;以及对于怀疑有遗传性胸主动脉疾病的患者,建议行遗传评估,如果在患者身上发现了致病变体,那么应该对家庭成员进行级联检测[23]。基因测试和家庭咨询可能会帮助患者及时采取预防性干预措施,防止疾病的发生。

