纺锤状磁性碳酸钙复合材料的制备及其表征
焦妍惠, 季军荣, 韦德恩, 陶兴颖, 廖丹葵, 童张法, 李立硕*
(1.广西大学 化学化工学院, 广西 南宁 530004;2.崇左南方水泥有限公司广西钙基材料协同创新中心, 广西 南宁 530004)
0 引言
“碳达峰”指的是在某一个时间点上,二氧化碳排放总量不再增长,达到峰值,此后开始下降;“碳中和”是指社会经济活动的温室气体排放和温室气体吸收基本相当,温室气体净排放为零[1]。工业上利用碳酸化法制备轻质碳酸钙可以有效将空气中的二氧化碳进行利用,达到节能环保的目的。碳酸钙常见的形貌有球状、针状、立方状等[2],温度、添加剂等因素将影响制备的碳酸钙的形貌。不同形貌的碳酸钙在工业上具有不同的用途:针状以及链状碳酸钙的链具有易断性,形成高活性位点,引起橡胶粒子联结,增强其补强作用,有利于提高材料的韧性以及耐磨性,因此广泛应用于塑料橡胶等行业[3];球状碳酸钙具有流动性好、吸收效率高等优点,其中微细、高纯球形碳酸钙在涂料、造纸以及电子陶瓷等领域得到了广泛应用[4-8]。中空微球碳酸钙具有独特的结构以及表面特征,因此在化学催化以及运送药物胶囊等领域有着重要的地位[9-11]。Fe3O4纳米粒子是一种最常见的磁性纳米材料,因具有毒性低、化学稳定性好、磁饱和强度大、粒径分布范围广等优点,可广泛应用于催化、磁性分离、药物载体、生物诊断等[12-14]。目前,人们常采用沉淀法、热分解法、气相化学法、微乳液法等制备纳米粒子[15-16]。由于Fe3O4纳米粒子具有巨大的表面能,容易自发团聚,因此需要进一步表面修饰以提高其稳定性,实现材料的功能化[17]。
由于Fe3O4具有良好的分离操作和检测性能,常被用于医药和环保领域中[18],国内外学者进行了广泛研究。Zhang等[19]采用共沉淀法制备了磁性层状分层碳酸钙 (MLH-CaCO3) 、磁性立方体形碳酸钙 (MCS-CaCO3) 材料,用于去除Pb(Ⅱ)。MLH-CaCO3具有独特的微观结构和较多的吸附位点,是一种优于MCS-CaCO3的吸附剂。磁性CaCO3吸附剂可以为工业废水处理设施提供一个有前途的选择,包括电池车间、玻璃制造厂、矿物加工厂和石油化工厂。Sergeeva等[20]制备了含有Fe3O4磁铁矿纳米颗粒和模型蛋白溶菌酶的复合多层涂层碳酸钙多晶材料,研究了复合多晶材料的结构和球霰石到方解石的再结晶动力学,采用共沉淀法制备了具有典型的树莓状形状的复合CaCO3-Fe3O4-蛋白钒石,增强了活性表面以获得更高的负载能力,同时将蛋白质和Fe3O4磁铁矿纳米颗粒包封到碳酸钙球霰石中,可以为设计具有外部操作的多功能载体提供新的方法。Lin等[21]使用CaCO3-Fe3O4空心微球作为牺牲硬模板,利用水热法制备具有空心结构的磁性羟基磷灰石[Ca10(PO4)6(OH)2, HAp]微球,该微球具有分级介孔结构,并进一步研究了不同pH溶液中的磁性、体外生物相容性、载药和释放特性。中空结构碳酸钙复合材料在环保、药物负载等方面有良好的应用前景,将Fe3O4纳米粒子负载到中空结构的微纳米CaCO3使其具有一定的磁性,可便于对其进行后续的分离操作和靶向运输,是一个值得进一步研究的领域,且制备磁性Fe3O4纳米粒子负载中空结构碳酸钙复合材料尚未见大量报道。
本文中利用高压碳酸化反应,以EDTA-2Na作为晶型控制剂,成功制备了具有中空结构的CaCO3,并在其上负载磁性Fe3O4,制备得到磁性中空碳酸钙复合材料CaCO3-Fe3O4,并对此材料进行了相关的性能表征。
1 材料和方法
1.1 试剂
氧化钙(CaO)(工业级,广西华纳新材料股份有限公司);纳米磁性四氧化三铁(Fe3O4)分散液(化学纯,中国上海阿拉丁试剂有限公司);乙二胺四乙酸二钠(EDTA-2Na)(化学纯,中国上海阿拉丁试剂有限公司);无水乙醇(分析纯,广东光华科技股份有限公司);二氧化碳(CO2)(工业纯,南宁空分气体有限公司);去离子水(实验室自制)。
1.2 空纺锤状碳酸钙的制备
称取适量的CaO溶于去离子水中,在水浴锅中加热到80 ℃并保持恒温,搅拌2 h,静置消化24 h,经孔径为0.074 mm标准筛网除去杂质,随后进行调浓,并将浆液移入高压微型反应釜中,将一定量的EDTA-2Na加入反应釜中并密封,设置搅拌装置的转速以及加热装置的温度,当温度达到反应所需温度时,打开相应的阀门通入CO2气体,使得反应釜内的压力升至1.5 MPa,反应结束后关闭反应釜中的加热及搅拌装置,自然冷却至室温。分别采用去离子水以及无水乙醇将产品洗涤3次后放入真空干燥箱中,在80 ℃环境下干燥12 h。磁性CaCO3的制备步骤与上述过程相同,只是在加料时加入计量好的磁性Fe3O4分散液、乙二醇,实验反应流程如图1所示。
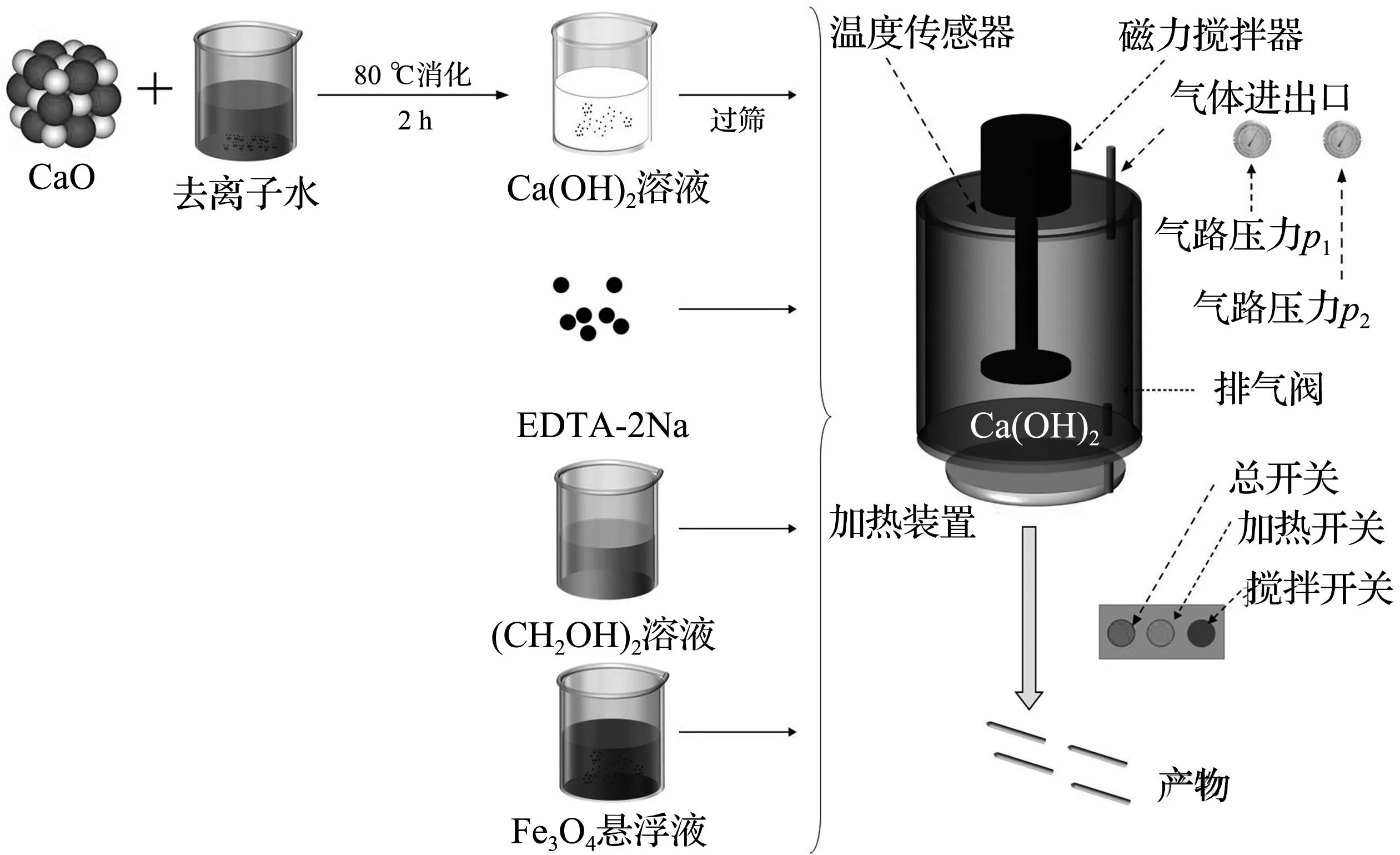
图1 实验的工艺流程Fig.1 Experimental apparatus diagram
1.3 样品表征
采用扫描电子显微镜(SEM, S-3400N型,日本日立高新技术公司)对材料的表面形态进行表征分析。采用X射线衍射仪(XRD, Rigaku D/MAX 2500V型,日本理学公司)对材料的晶体结构和化学组成进行表征分析。采用振动样品磁强计(VSM, 7410型,美国湖滨温公司)测试材料的磁化强度。采用透射电子显微镜(TEM, FEI TECNAI G2 F30型,美国赛默飞世尔科技公司)对材料的晶格结构进行表征分析。采用X射线光电子能谱分析仪(XPS, K-Alpha型,美国赛默飞世尔科技公司)分析材料表面元素组成和化学价态。
2 结果与讨论
2.1 SEM分析
2.1.1 反应时间对CaCO3的影响
不同反应时间制得CaCO3的SEM图像如图2所示。当反应时间为2 h,所得到的产物分散度较好,形貌均一;当反应时间为1、3 h时,所得到的产物分散度较差,形貌不均一。

(a) 1 h (b) 2 h (c) 3 h
2.1.2 EDTA-2Na的添加量对CaCO3的影响
不同EDTA-2Na添加量条件制得CaCO3的SEM图像如图3所示。由图3可见:在反应体系中EDTA-2Na的添加量为Ca(OH)2质量的6%时,生成的产物为细小的类纺锤状的碳酸钙;当其添加量为Ca(OH)2质量的8%时,生成的产物为细小的、较为分散的纺锤状碳酸钙;当其添加量为Ca(OH)2质量的10%时,生成的产物类纺锤状,但是分布较为密集且均一性较差;当其添加量为Ca(OH)2质量的12%时,生成的产物无定形,且分散度、均一性明显降低。

图3 不同EDTA-2Na添加量条件制备的CaCO3的SEM图像Fig.3 SEM images of calcium carbonate prepared with different dosage of EDTA-2Na
2.1.3 反应温度对CaCO3的影响
不同反应温度制得CaCO3的SEM图像如图4所示。在加入EDTA-2Na后,CaCO3的形貌会受反应温度的影响:当反应温度为30 ℃时,CaCO3的形貌为纺锤状[图4(a)];当反应温度为40 ℃时,CaCO3的形貌为菜花状[图4(b)];当反应温度为60 ℃时,CaCO3的形貌为类菜花状[图4(c)];当反应温度为80 ℃时,CaCO3的形貌为棒状[图4(d)];当反应温度为100 ℃时,CaCO3的形貌为不规则的中空棒状并掺杂少量的立方状[图4(e)];当反应温度为120 ℃时,CaCO3的形貌为纺锤状[图4(f)],且可通过破碎的CaCO3看出其中空特性;当反应温度为140 ℃时,CaCO3的形貌为类立方状[图4(g)]。根据上述观察可知,CaCO3的形貌受温度的影响较大,中空纺锤状CaCO3在低温条件下无法形成,同时适当地提高反应温度有利于形成微纳米分级结构中空纺锤状CaCO3,但温度过高会引起颗粒势能增加,易碰撞并生长,趋向于形成立方状颗粒,并对EDTA-2Na的活性有一定的影响。

图4 不同反应温度制备的CaCO3的SEM图像Fig.4 SEM images of calcium carbonate prepared at different reaction temperatures
2.1.4 CaCO3-Fe3O4的形貌
Fe3O4与CaCO3的不同物质的量比制备的CaCO3-Fe3O4的SEM图像如图5所示。由图5(a)—(e)可见,小的颗粒物质即为磁性Fe3O4,还有一部分磁性Fe3O4颗粒因超声被振掉,零散分布在周围,且磁性纳米CaCO3-Fe3O4复合材料的长度约为1 μm,材料形貌大多为纺锤形,少量为类方形。通过比较图5(a)-(e)可见,Fe3O4分布在碳酸钙表面,磁性Fe3O4加入量越大,表面颗粒越多,且Fe3O4与CaCO3物质的量比越大,该现象越明显。随着Fe3O4加入量的增加,复合样品的表面变得更加粗糙,与Fe3O4-CaCO3物质的量比为1∶60获得的样品[图5(b)]相比,Fe3O4与CaCO3物质的量比为1∶10制得的材料[图5(e)]具有更加粗糙的表面,同时孔隙与粗糙的表面为Fe3O4的附着提供了大量的位点。
2.2 TEM分析
Fe3O4与CaCO3物质的量比为1∶10制备的CaCO3-Fe3O4的TEM图像如图6所示。由图6(a)、(b)可见,CaCO3为纺锤状,颗粒长度为1~2 μm,直径约为500 nm,有凹凸位点且有中空结构,该结构有效地使Fe3O4负载均匀,Fe3O4纳米颗粒分散均匀,表面光滑,呈球状,粒径为9~15 nm,图像中0.300 9 nm的晶格间距可定位到Fe3O4的(211)平面[图6(c)]。

(a) 标尺0.5 μm的TEM图像 (b) 标尺200 nm的TEM图像 (c) 复合材料的晶格条纹
2.3 SEM-EDS分析
Fe3O4与CaCO3物质的量比为1∶10制备的CaCO3-Fe3O4的SEM-EDS图谱如图7所示。经SEM-EDS分析得到该复合材料的Ca、C、O、Fe的质量分数分别为20.74%、18.82%、54.18%、6.26%,说明复合材料中有较多Fe的掺杂。

图7 Fe3O4与CaCO3物质的量比为1∶10制备的CaCO3-Fe3O4的SEM-EDS图谱Fig.7 SEM-EDS images of CaCO3-Fe3O4 composite materials with molar ratio of magnetic ferric oxide to calcium carbonate of 1∶10
2.4 XRD分析
CaCO3-Fe3O4的XRD谱图如图8所示。其中S1、S2、S3、S4、S5分别对应Fe3O4与CaCO3物质的量比为1∶120、1∶60、1∶30、1∶20、1∶10。由图8可见,CaCO3的衍射略有宽化现象,说明粉体中含有细颗粒[22]。Fe3O4的最强衍射峰的位置在2θ为35.45°,由于与CaCO3(110)晶面衍射(35.9°)位置相近,并且Fe3O4为纳米颗粒,衍射峰强度较弱,因此Fe3O4的衍射峰并不明显。X射线衍射谱中,CaCO3-Fe3O4在2θ为26°和39°的2个峰与碳酸钙相匹配,2θ为18.3°、37.1°、57.1°等特征峰与反尖晶石Fe3O4的(111)、(222)、(511)晶面一致,而CaCO3的晶面消失[23]。衍射角2θ为20°~30°区域内的衍射峰与Fe3O4的衍射峰相符,说明复合材料中的Fe3O4可能在CaCO3表面形成包裹层[24],这个包裹层在材料洗涤过程中并未被乙醇去除,表明Fe3O4不是简单地与CaCO3混合。

图8 CaCO3-Fe3O4的XRD谱图Fig.8 XRD patterns of magnetic ferric oxide-calcium carbonate composites
2.5 VSM分析
CaCO3-Fe3O4的VSM谱图如图9所示。由图9可得,当外加磁场的强度变为0时,样品的磁化强度也变为0,且样品中无剩磁,并且在整个外加磁场的变化过程中(-20 000~20 000 Oe)没有明显的磁滞回环,证明合成的样品都具有顺磁性。在室温下,在-20 000~20 000 Oe磁场中,样品S1、S2、…、S5的饱和磁化强度分别为0.86、2.06、3.33、5.49、9.78 emu/g。通过比较可得出,S5的饱和磁化强度最大。Fe3O4与CaCO3的物质的量比越大,样品的饱和磁化强度越大;Fe3O4与CaCO3的物质的量比越小,Fe3O4在复合材料中的比例也随之减小,磁饱和强度值也会随之减小。用强磁铁增加磁场后,CaCO3-Fe3O4被吸引到样品瓶壁上,并达到从水中分离的目的。这些结果表明,磁性纳米Fe3O4粒子的引入赋予了复合样品的磁性能,并且可以通过增加磁性纳米Fe3O4粒子的加入量来增强其超顺磁性。
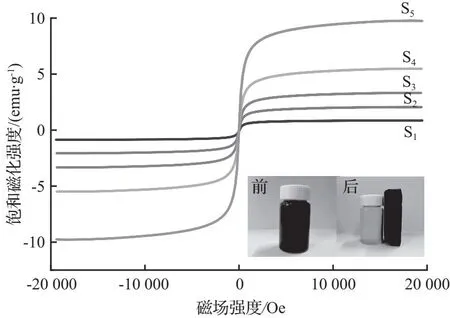
图9 CaCO3-Fe3O4的VSM谱图 Fig.9 VSM diagram of magnetic ferric oxide calcium carbonate composites
2.6 XPS分析
CaCO3-Fe3O4的XPS谱图如图10所示。
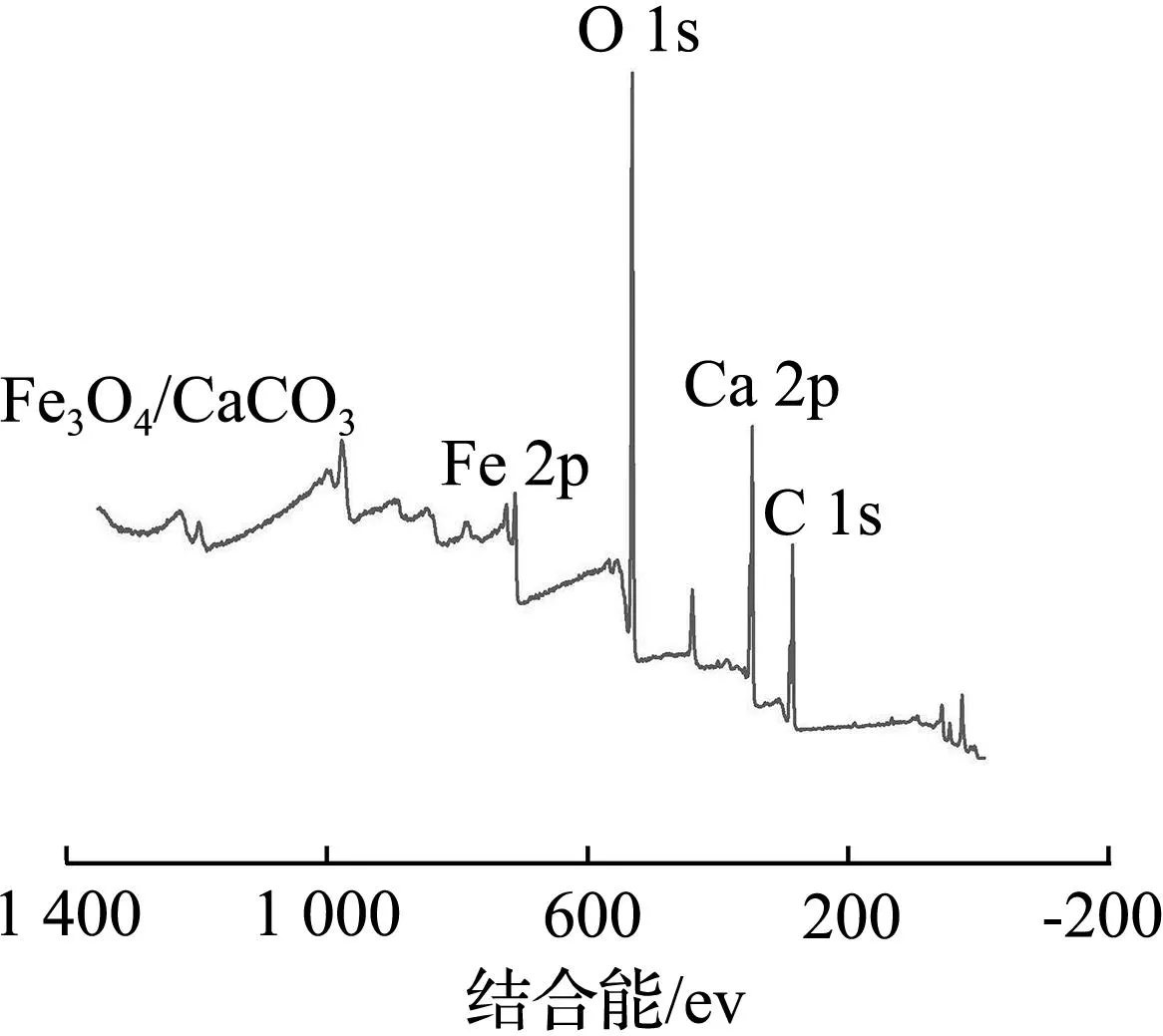
(a) Fe3O4-CaCO3的全XPS谱图
在Fe3O4-CaCO3的全XPS谱图中发现了Fe 2p、O 1s、Ca 2p、C 1s的特征峰[图10(a)]。由图10(b)可知,通过查找谱库,CaCO3的Ca 2p1/2的结合能分别为351.1、351.27 eV,Ca 2p3/2的结合能分别为345.9、346.7、346.8、347、347.4、347.7、347.9、348.1、348.3、348.6 eV[25]。而添加Fe3O4的Ca 2p1/2的结合能分别为346.70、347.32 eV,Ca 2p3/2的结合能分别为350.28、350.88 eV,均有所改变,推测引起这种位移的原因是Fe3O4与CaCO3表面发生键合,生成了Fe—O—Ca键,进一步证实了产物为CaCO3-Fe3O4[26]。由图10(c)可知,CaCO3-Fe3O4的C 1s谱中有2个不同的峰,较弱的一个峰是作为定标的碳原子对应的,结合能为284.8 eV,较强的峰为CaCO3中所含C的峰,其值为289.40 eV。由图10(d)可知,CaCO3-Fe3O4的Fe 2p3/2峰在710.48、713.15、718.89 eV形成3个峰,分别对应Fe2+、Fe3+和Fe3+卫星,Fe 2p XPS谱在710.48、723.88 eV处有2个峰,分别对应于Fe 2p2/3、Fe 2p1/2。此外,在719.08 eV处的峰是Fe属的卫星峰。通过XPS检测到CaCO3-Fe3O4中Fe的质量分数为4.01%,高于其他复合材料。由图10(e)可知,CaCO3-Fe3O4的O 1s谱中有3个不同的峰,较弱的峰为Fe3O4中的Fe—O的结合能产生的峰,其值为529.70 eV,中间的峰为CaCO3中C—O键的结合能产生的峰,其值为531.40 eV,O 1s中最强的峰,其值为533.48 eV,有可能是由于价电子的转移而导致的势能发生变化[27]。由于钙元素(1)的电负性小于铁元素的(1.83),所以Ca的价电子向Fe—O键的方向偏移,钙的外层电子密度降低,使钙的屏蔽效应也随之减小,结合能增加,因此,认为是因Fe—O—Ca键的生成而导致结合能的增加,进一步证实了CaCO3-Fe3O4不是单纯的堆砌,而是有化学键的结合[28]。
3 结论
① 以EDTA-2Na作为晶型控制剂,通过调控反应物与晶型控制剂的浓度,在温度120 ℃、压力2 MPa的反应条件下,利用高压反应釜以CO2、Ca(OH)2为原料进行碳酸化反应,制备了微纳米分级结构中空纺锤碳酸钙。
② 以EDTA-2Na作为晶型控制剂,通过调控反应物与晶型控制剂的浓度,加入Fe3O4分散液,乙二醇作为分散剂,在相同反应条件下,利用高压反应釜以CO2、Ca(OH)2为原料进行碳酸化反应,制备了饱和磁化强度为9.78 emu/g、长度约为1 μm的磁性纳米Fe3O4负载纺锤状CaCO3复合材料。
③ XPS分析结果表明,Fe3O4与CaCO3的结合并非简单的物理结合,而是生成了Fe—O—Ca键,通过化学键结合在一起,Fe3O4的强磁化率可应用于CaCO3对重金属离子废水的高效吸附分离。

