MRI集成序列在强直性脊柱炎骶髂关节病变活动性评估中的诊断价值
田兆荣,张莉萍,田博,池淑红,王晶,徐奋玲,王志军,龚瑞*
作者单位:1.宁夏医科大学总医院放射科,银川 750001;2.宁夏医科大学总医院风湿科,银川 750001;3.宁夏石嘴山市第三人民医院放射科,石嘴山 750002;4.宁夏医科大学,银川 750001
0 前言
强直性脊柱炎(ankylosing spondylitis, AS)是一种血清阴性的慢性炎症性风湿性疾病,好发于青壮年,主要累及中轴骨骼(骶髂关节和脊柱)[1],通常以骶髂关节炎为首发,后期可发展为脊柱僵硬强直。有研究表明AS活动性的频繁出现是预后不良的危险因素,因此,早期监测AS 的活动性,及早有效治疗能阻断炎症的进展从而防止关节骨性结构的破坏[2-3],提高患者的生活质量,减少致残率。迄今还没有衡量AS 疾病活动性的“金标准”[4]。目前,AS 疾病活动性的临床评估主要依赖于红细胞沉降率(erythrocyte sedimentation rate, ESR)、C反应蛋白(C-reactive protein, CRP)水平和半定量Bath强直性脊柱炎疾病活动指数(Bath Ankylosing Spondylitis Disease Activity Index, BASDAI)评分[5],但是存在较大的变异性。因此,寻求一种快速无创的方法评估AS活动性对于早期治疗至关重要。
骶髂关节炎是AS最重要的临床表现[6],其病理改变为关节软骨侵蚀和骨髓水肿。MRI 对活动性骶髂关节炎骨髓水肿的诊断具有较高的特异性和敏感性[7]。目前,用于检测AS骶髂关节炎活动性的定量技术较多,如T2 mapping、弥散加权成像(diffusion weighted imaing, DWI)和动态对比增强(dynamic contrast enhanced, DCE)等。然而,T2 mapping 因扫描时间长、可重复性差仍未广泛应用;DWI 的表观弥散系数(apparent diffusion coefficient,ADC)虽对AS 骶髂关节活动性具有一定价值[8],但漏诊率较高且不能单独用于临床诊断;DCE 需应用对比剂而不被患者普遍接受。MRI 集成(magnetic resonanceimage compilation, MAGiC)是一种非侵入性的定量技术,一次扫描可获得多组对比图像和定 量 图 像,计 算 出T1、T2、质 子 密 度(proton density, PD)值[9],实现了差异化组织成分定量,获得基于人体组织成分的量化信息,能可视化AS 骶髂关节活动性和结构性病变[10-11]。MAGiC 序列已应用于中枢神经系统、乳腺和前列腺方面[12-13],但在骨肌系统的应用较少,国内还没有利用MAGiC序列评估骶髂关节炎活动性的报道。本研究首次利用MAGiC 参数定量评估AS 骶髂关节活动性,为临床及早诊疗提供量化指标;并评价MAGiC 序列定量参数与BASDAI 和加拿大脊柱关节炎研究联盟(SPARCC)评分的相关性。
1 材料与方法
1.1 一般资料
本研究遵守《赫尔辛基宣言》原则,经过宁夏医科大学总医院医学科研伦理审查委员会批准,免除受试者知情同意,批准号:2020-657。回顾性分析宁夏医科大学总医院2021年1月至2023年6月的AS患者病例及同期健康体检者的临床及影像资料。病例组纳入标准:(1)符合AS[12]诊断标准且行MRI 检查的患者;(2)在MRI检查前1周接受ESR、CRP和人类白细胞抗原(human leucocyte antigen, HLA)-B27检测。病例组排除标准:(1)有基础疾病者(如骶髂关节外伤、手术史,严重感染或身体其他部位的恶性肿瘤);(2)MRI 检查前接受相关免疫治疗者;(3)图像信噪比差不能进行数据分析。根据ASDAS评分和CRP将患者分为活动组和非活动组,非活动组ASDAS-CRP<1.3;活动组ASDAS-CRP≥1.3[14]。对照组为健康体检者。对照组纳入标准:(1)无AS 家族史;(2)无下腰痛史;(3)血沉、CRP 等实验室检测结果无异常,HLA-B27 阴性。对照组排除标准:有骶髂关节基础疾病者。
1.2 磁共振检查
采用GE SIGNA Architect 3.0 T 扫描仪(美国通用电气医疗公司,芝加哥,美国)和32 通道体相控阵线圈。所有受试者均取仰卧位,头先进。定位时线圈中心与两侧髂前上棘的连线中点重合。所有序列均在平行于骶骨平面的斜冠状面扫描获得。扫描序列包括T1WI、脂肪抑制T2WI(fat-saturated T2WI, FS-T2WI)和MAGiC。T1WI序列参数:TR 415 ms,TE Min Full,FOV 280 mm×280 mm,NEX 2,层 厚4 mm,层间距1 mm,矩阵320×256;FS-T2WI 序列参数:TR 3671 ms,TE 59.7 ms,FOV 280 mm×280 mm,NEX 2,层厚4 mm,层间距1 mm,矩阵288×224;MAGiC序列参数:TR 4000 ms,TE 18.5 ms,FOV 280 mm×280 mm,NEX 1,层厚4 mm,矩阵384×256。
1.3 BASDAI评分
两名风湿科医师(一名有5年工作经验的主治医师,另一名有15 年工作经验的副主任医师)采用BASDAI 评分法分别对患者过去一周的症状进行评估,以两名医师评分平均值作为最终BASDAI 评分结果。BASDAI 评价内容包括疲乏、外周关节痛、脊柱痛、局部压痛、晨僵程度、晨僵时间等6 个问题组成,让患者回答过去1周的症状。前5个问题用10 cm视觉模拟评分法(visual analogue scale, VAS)完成,最高得10 分,最后1 个问题根据晨僵时间长短进行评分。晨僵时间为无、30、60、90 和120 分钟以上,分别得0、2.5、5、7.5 和10 分。总评分为各项的平均得分,但第5和第6个问题均为晨僵,故先把这2项的得分相加除2 而得出平均分,再作为1 项与前4 项结合而得出平均分。BASDAI 总分最高为60 分,转换为BASDAI总分0~10分,转换公式:0.2×[疲乏评分+外周关节痛评分+脊柱痛评分+局部压痛评分+(晨僵程度评分+晨僵时间评分)/2],得分越高,病情越活动,一般>4分提示病情活动。
1.4 SPARCC评分
两名有骨骼肌肉系统MRI 经验的医生(一名有5年工作经验的主治医师,另一名有15年工作经验的副主任医师)在不知道分组结果的情况下,以双盲方式独立对图像进行评分。两名医生评分的平均值作为最终得分。骶髂关节采用斜冠状位FS-T2WI 序列扫描[15],共12 层,中间6 层进行评分。将每层骶髂关节两侧分为4 个象限(每层两侧共8 个区域,6 层共48个区域)。评分标准:该区域有骨髓水肿为1分,无骨髓水肿为0 分,总分最高48 分;水肿严重程度,当一侧骶髂关节同一层的骨髓水肿信号强度接近或高于同层面的静脉信号强度时,评分为1 分,水肿严重程度的最高总评分为12分;水肿深度,一侧骶髂关节病变深度每增加1 cm 评分加1 分,最大水肿深度总评分为12 分。三者得分之和为SPARCC 得分,SPARCC得分最高为72分。
1.5 图像后处理及数据测量
上述两名医师在不知道分组结果的情况下,分别以双盲的方式读取图像,于GE 主机MAGiC 软件包重建T1 mapping、T2 mapping 和PD 定量图以及相应MAGiC T1WI 及(short time inversion recovery,STIR)图像。并在MAGiC定量图像上手动勾画感兴趣区域(region of interest, ROI)。每名医师在每幅图像上勾画出三个ROI 进行测量,并计算其平均值,将两名医师的平均值作为最终的测量结果。在勾画ROI 时,应该避开血管,皮质骨,囊变及骨质硬化区。活动组ROI 大小根据病变范围进行调整,尽可能在水肿面积最大的层面选择ROI。如果同一患者出现多个病灶,则测量所有病灶,取平均值。非活动组和健康对照组,分别测量两侧骶髂关节的骶侧和髂侧软骨下骨髓T1、T2 和PD 值。每侧分为上、下两区,骶髂关节两侧共8 个区。取平均值作为最终结果。
1.6 统计学分析
所有数据采用SPSS 22.0 软件进行统计分析。采用组内相关系数(intra-class correlation coefficient, ICC)评价2 名医师测量值的一致性,ICC 值大于0.80 认为测量结果一致性较好。计量资料采用Kolmogorov-Smirnov 进行正态性检验,符合正态分布的用均值±标准差()表示,不符合正态分布的用中位数(四分位数间距)表示。采用单因素方差分析比较活动组、非活动组和健康组的T1、T2和PD 值。采用受试者工作特征(receiver operating characteristic, ROC)曲线分析T1、T2 和PD 值对AS骶髂关节活动性的诊断效果。使用Spearman相关分析检验活动组T1、T2、PD 值与BASDAI 和SPARCC 评分的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 入组受试者的一般资料比较和MRI特征
共 纳 入78 例AS 患 者,男40 例,女38 例,年 龄14~45 岁(24.80±7.30)岁,病程6 个月~6 年。其中:活动组40例,非活动组38例。健康志愿者35例,男17 例,女18 例,年龄18~44(26.80±7.10)岁。三组间年龄、性别差异无统计学意义(P>0.05)(表1)。

表1 健康对照组、AS活动组和非活动组基本资料比较Tab.1 Comparison of clinical characteristics between active and inactive groups and control group
活动组患者均在骶髂关节MRI上出现不同程度、不同大小的软骨下骨髓水肿,部分病变表现为双侧骶髂关节软骨下骨髓水肿。非活动组病变多表现为骶髂关节软骨下骨质破坏,部分病变表现为骶髂关节骨质硬化或脂肪沉积。(图1~3)
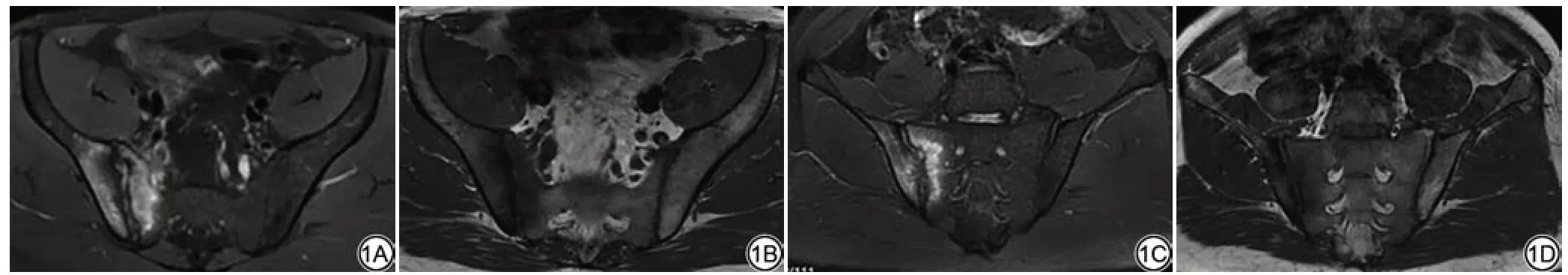
图1 男,32 岁,AS 患者活动期。1A:轴位FS-T2WI 序列示右侧骶髂关节软骨面下骨髓呈高信号;1B:T1WI 轴位示右侧骶髂关节软骨面下低信号;1C:斜冠状位FS-T2WI 序列示右侧骶髂关节软骨面下骨髓呈高信号;1D:T1WI斜冠状位示右侧骶髂关节软骨面下骨髓低信号。Fig.1 A 32-year-old male with ankylosing spondylitis is active.1A: T2WI axial fat suppression sequences shows the sub facial bone marrow of the right sacroiliac articular cartilage shows high signal; 1B: T1WI axial position shows low signal below the surface of the right sacroiliac articular cartilage; 1C: Oblique coronal FS-T2WI sequence shows a high signal in the subfacial bone marrow of the right sacroiliac joint cartilage; 1D: The oblique coronal position of T1WI shows low bone marrow signal below the surface of the cartilage of the right sacroiliac joint.
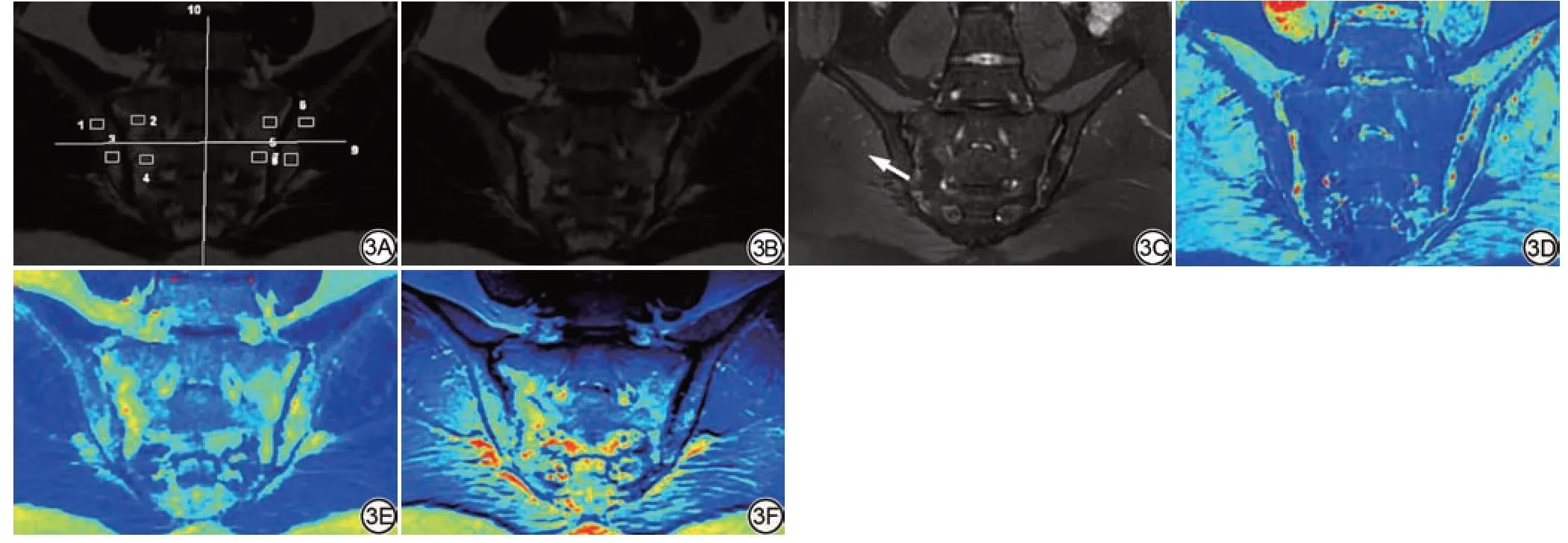
图3 男,35岁,AS 患者活动期与非活动期并存。3A:双侧骶髂关节分区及ROI勾画示意图;3B:T1WI斜冠状位示双侧骶髂关节软骨下骨髓脂肪沉积呈明显高信号;3C:FS-T2WI斜冠状位示双侧骶髂关节软骨下骨髓呈低信号,左侧骶髂关节髂骨面见斑片状高信号区(箭),提示活动性;3D:T1 mapping伪彩图示双侧骶髂关节软骨下骨髓T1值约730 ms;3E:T2 mapping伪彩图示双侧骶髂关节软骨面下骨髓T2值约93 ms,其中左侧骶髂关节髂骨面T2值约112 ms;3F:PD mapping伪彩图示双侧骶髂关节软骨面下骨髓脂肪沉积及左侧骶髂关节髂骨面骨髓水肿。AS:强直性脊柱炎;FS:脂肪抑制;ROI:感兴趣区;PD:质子密度。Fig.3 A 35-year-old man with ankylosing spondylitis with both active and inactive phases.3A: Bilateral sacroiliac joint zoning and ROI sketch; 3B: The oblique coronal position of T1WI shows significantly high signal of subchondral bone marrow fat deposition in both sacroiliac joints; 3C:The oblique coronal position of FS-T2WI shows low signal in the subchondral bone marrow of both sacroiliac joints, patchy high signal area on the iliac surface of the left sacroiliac joint (arrow), cue activity; 3D: Pseudo-color T1 mapping shows that the T1 value of subchondral bone marrow in bilateral sacroiliac joint is about 730 ms; 3E:Pseudo-color T2 mapping shows that the T2 value of subfacial bone marrow in bilateral sacroiliac joint cartilage is about 93 ms.The T2 value of the iliac surface of the left sacroiliac joint is about 112 ms; 3F: Pseudocolor PD mapping shows bone marrow fat deposition under the cartilage surface of the sacroiliac joint on both sides and bone marrow edema on the iliac surface of the left sacroiliac joint.AS: ankylosing spondylitis; FS: fat-saturated; ROI: region of interest; PD: proton density.
2.2 观察者间测量值可重复性分析
活动组、非活动组和健康对照组间T1、T2 和PD值的观察者间一致性较好(表2)。
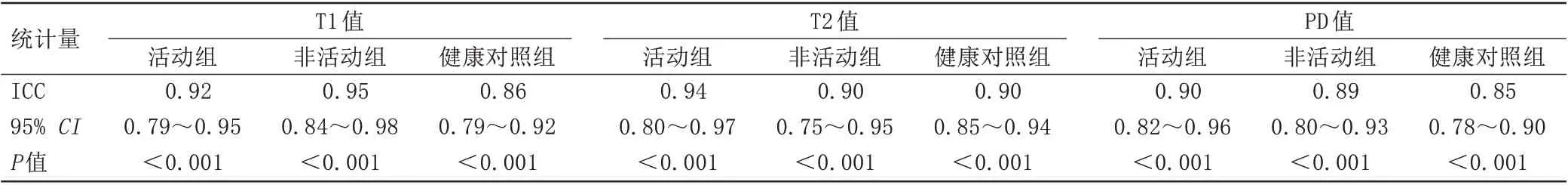
表2 观察者间测量AS活动组、非活动组和健康对照组间T1、T2及PD值一致性检验Tab.2 ICC values of T1, T2, and PD between active and inactive groups and control groups measurements by observers
2.3 组间MAGiC定量参数比较
AS活动组骶髂关节软骨下骨髓T1值低于非活动组和健康对照组;AS 活动组骶髂关节软骨下骨髓T2 值高于非活动期组和健康对照组;AS 活动组骶髂关节软骨下骨髓PD 值高于非活动组和健康对照组,差异均有统计学意义(P<0.001),详见表3、图4。

图4 强直性脊柱炎患者活动组、非活动组和健康对照组间MRI 集成序列定量参数T1、T2、质子密度(PD)值比较的箱形图。Fig.4 Boxplots for comparison of the average T1、T2 value and proton density (PD) value among the three groups.
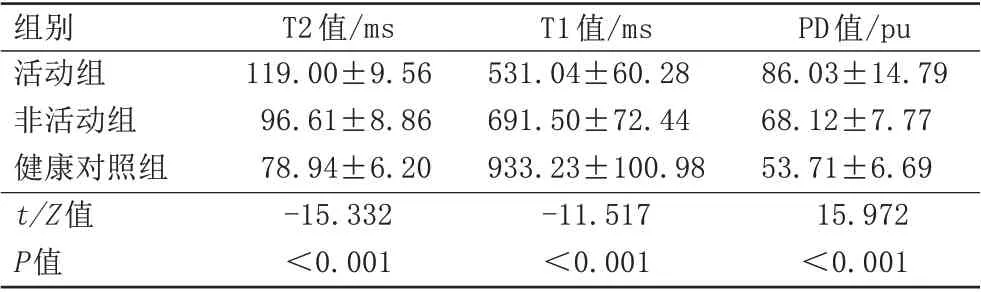
表3 AS活动组、非活动组及健康对照组间MAGiC定量参数比较Tab.3 Comparisons of different MAGiC parameters in active and inactive groups and control groups
2.4 MAGiC定量参数诊断效能
ROC 曲线分析结果表明(图5),MAGiC 定量参数T1、T2、PD 值诊断AS 患者骶髂关节病变活动性的曲线下面积(area under the curve, AUC)分别为0.965(95%CI:0.949~0.991)、0.981(95%CI:0.970~0.998)、0.840(95%CI:0.842~0.923);敏感 度 分 别 为0.888(95%CI:0.819~0.937)、0.952(95%CI:0.898~0.928)、0.704(95%CI:0.616~0.782);特 异 度 分 别 为0.985(95%CI:0.946~0.998)、0.969(95%CI:0.924~0.992)、0.932(95%CI:0.959~0.998)。
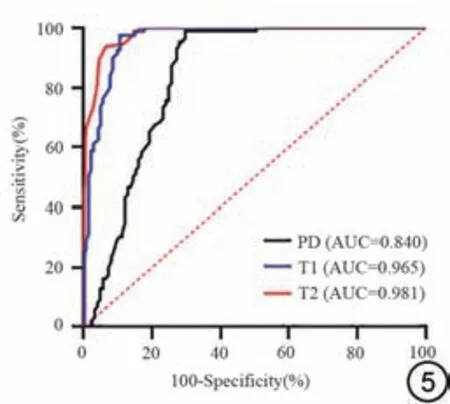
图5 MRI 集成序列定量参数评估强直性脊柱炎活动期的受试者工作特征曲线。PD:质子密度;AUC:曲线下面积。Fig.5 Receiver operating characteristic curves of the T1、T2 and PD values for differentiating between the active and inactive groups.PD: proton density; AUC: area under the curve.
2.5 MAGiC 定量参数与BASDAI 和SPARCC 评分的相关性
活动组AS 骶髂关节软骨下骨髓的T1、T2、PD 值与BASDAI 评分呈高度相关(r=-0.771、0.914、0.846,P均<0.001);与SPARCC评分呈高度相关(r=-0.924、0.915、0.938,P均<0.001)(图6)。
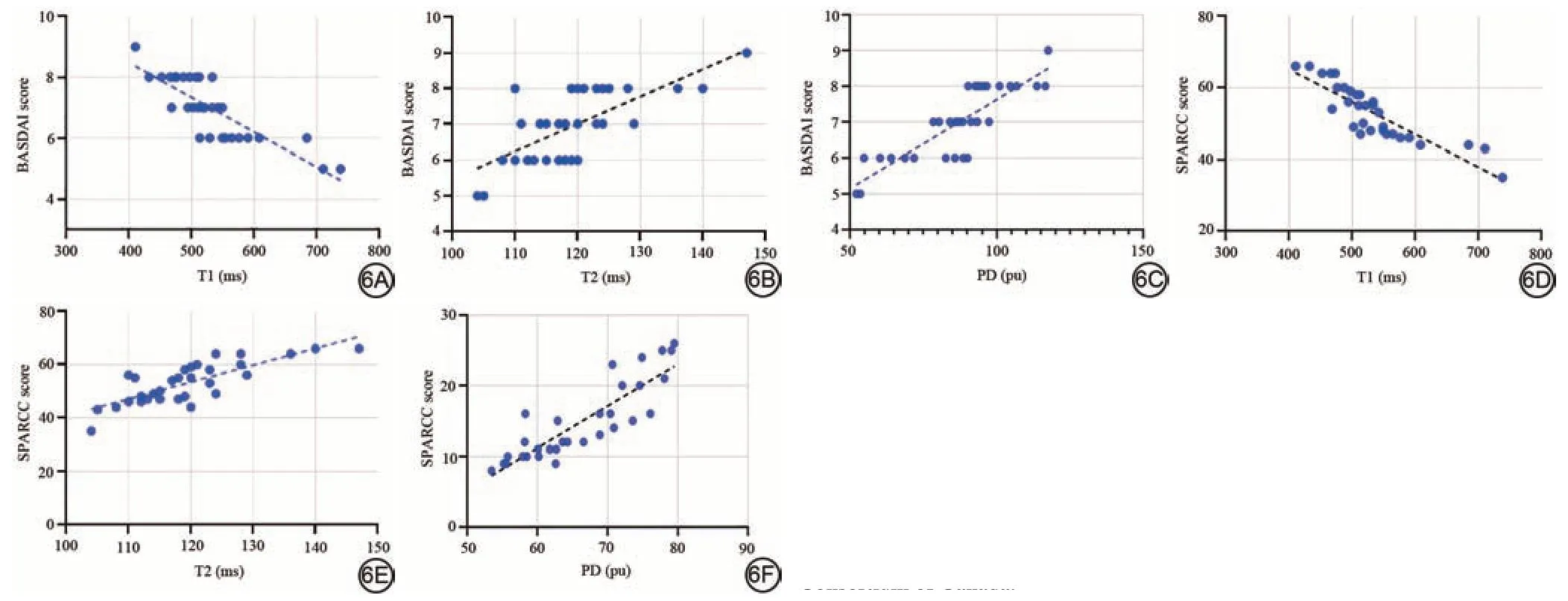
图6 强直性脊柱炎患者活动期骶髂关节软骨下骨髓T1、T2、PD 值与BASDAI评分和SPARCC评分的相关性。PD:质子密度;BASDAI:Bath强直性脊柱炎疾病活动指数;SPARCC:加拿大脊柱关节炎研究联盟。Fig.6 Correlation of T1 values, T2 values and PD values of the AS patients with the BASDAI scores and SPARCC scores.BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; SPARCC: Spondyloarthritis Research Consortium of Canada.
3 讨论
本研究主要采用MAGiC 定量参数对AS 患者骶髂关节病变进行定量分析,结果显示MAGiC 定量参数T1、T2 和PD 值能鉴别骶髂关节炎的活动性与非活动性,验证了使用MAGiC 定量参数评估AS 患者活动性和非活动性骶髂关节炎的可行性,且MAGiC定量参数与临床评分评估疾病活动性之间存在显著相关。本研究评估了MAGiC 序列作为一种新的定量成像方法检测和定量评估骶髂关节病变的潜力。在国内首次利用MAGiC 序列定量评估AS 骶髂关节炎活动性,进而为临床及早有效治疗提供影像学依据。
3.1 AS患者活动组、非活动组与健康对照组间MAGiC定量参数比较
AS 引起的骶髂关节炎病理改变较为复杂,当患者处于活动期时,炎症细胞的浸润和骨髓血管翳的侵入导致炎症因子被激活,血清和血液从毛细血管向骨髓腔的灌注量增加,相应微血管结构遭到破坏,毛细血管通透性增加导致骨髓水肿[16-18]。有研究证明[19-20]骨髓水肿是骨质破坏的标志,并且能反映炎症的活动性。然而常规MRI 序列只能从宏观水含量的角度诊断骨髓水肿[21],对于骶髂关节炎症活动期的微观变化无法量化,存在局限性。本研究MAGiC序列以先定量后成像的优势,通过监测骶髂关节软骨下骨髓T1、T2和PD值的变化间接评估AS骶髂关节病变的微观改变。
本研究结果显示,AS 活动组骶髂关节软骨下骨髓的T1 值低于非活动组和健康对照组。MAGiC 序列中T1 mapping反映组织中水和细胞外基质分子间慢频率的相互作用,T1 mapping 中的T1 值是组织大分子浓度、结合水及组织含水量的生物标志物,不受胶原排列方向的影响,既往用于对心肌组织水肿和纤维化程度进行定量[22]。本研究结果证明T1 值能对骶髂关节软骨下骨髓水肿程度进行定量,通过检测组织中水分子的微小变化,定量评估AS 骶髂关节软骨下骨髓水肿程度,可反映骨髓内在的特性和水含量的变化[23-24]。T1 值在骨髓水肿的诊断效能中具有很好的敏感性和特异性,与俞顺[25]等的研究相近。另外,本结果发现AS 活动组骶髂关节软骨下骨髓的T2 值和PD 值均高于非活动组和健康对照组,即活动组软骨下骨髓水分子的含量和运动量均高于非活动组。AS 骶髂关节炎活动期是由于病变组织血管过多、灌注过多及水外渗作用等导致骨组织水分过多而出现的异常MRI 信号,MAGiC 序列中T2 mapping 可以检测水分子、胶原含量和组织各向异性的变化,T2 值能定量反映组织中含水量的变化,是评价早期关节软骨变性的敏感参数。而PD mapping可以反映组织中的游离水含量[26]。AS 活动组骶髂关节软骨下骨髓T2值和PD值升高一方面可能是骨髓[27]中单核细胞和淋巴细胞炎性渗出增多所致,另一方面可能与骶髂关节炎存在的标志性特征信号强度有关,信号越强,越有可能反映活跃的炎症[28]。有研究[29]证实AS是始于软骨-骨交界面(软骨下骨髓)的炎症,这些病变被认为与软骨—骨交界处潜在的病理生理过程有关。本研究结果也表明,AS 骶髂关节相应部位的软骨可能存在损伤。从本研究结果看,AS 非活动组骶髂关节软骨下骨髓T2、PD值高于健康对照组,这是因为在AS 的非活动期,急性炎症消退后,骨髓水肿减少,骨髓脂肪含量开始增加。两种行为的综合作用最终表现为非活动组T2 值和PD 值高于健康对照组。骶髂关节炎症消退后骨髓脂肪含量的增加反映了AS[30-31]发展的关键阶段。我们的结果从影像学的角度也反映了这种病理改变,因此MAGiC定量参数是临床评估AS严重程度的重要定量指标。
3.2 MAGiC 定量参数对AS 患者骶髂关节活动性的诊断效能评估
本研究采用ROC 曲线评估MAGiC 定量参数T1、T2、PD 值在区分AS 骶髂关节活动组与非活动组方面的诊断效能。结果显示,T1、T2、PD 值在鉴别AS 骶髂关节炎活动性的诊断效能均较高,其中T2 值的诊断效能最高,这可能是因为MAGiC 序列中T2 mapping受周围组织环境的影响较小,其T2 值能客观反映骨髓水肿区的水含量和运动情况。T1 mapping的T1值较为独立,不依赖于参考组织的信号强度,也不受胶原排列方向的影响,直观反映骶髂关节软骨下骨髓内的结合水以及组织的含水量,因此也表现出了较高的诊断效能。而PD 值诊断效能相对较低,究其原因可能是PD mapping 中的PD 值反映的是组织中的游离水含量,容易受外界环境以及骶髂关节炎骨髓水肿程度和炎症因子浸润程度的影响,因此其敏感性略低。
3.3 AS 患者活动组MAGiC 定量参数与BASDAI 和SPARCC评分的相关性分析
SPARCC 评分系统是一种用于评估骶髂关节炎活动的MRI 评分系统。BRADBURY 等[32]和MORBÉE 等[33]表明SPARCC 评分系统在评估AS 患者的疾病活动性或治疗反应时可以提供重要信息。BASDAI 是GARRETT等[34]提出的一种评估AS 患者病情的量表,该指标具有较高的可靠性和敏感度,能全面反映AS 患者的病情。本研究显示T2 值和PD 值与AS 的影像评分(SPARCC 评分)和临床评分(BASDAI)均有较强的正相关,这与以往的研究结果相近[35-36]。因此,MAGiC序列定量参数可以作为评价AS骶髂关节病变活动性的影像学指标;影像定量指标与临床密切相关,这有助于监测AS患者的临床反应。
3.4 本研究的局限性
本研究有以下局限性。首先,由于大多数AS 病例的临床诊断没有活检支持,缺乏作为对照的组织病理学结果;其次,MAGiC 序列在骶髂关节软骨下骨侵蚀和软骨破坏的应用有限,在未来的研究中,我们将对MAGiC序列进行优化,进一步扩大样本量。
4 结论
综上所述,MAGiC序列定量参数可定量评估AS的活动性,能提供有效量化指标,尤其是T2值可以作为骶髂关节炎活动性的生物学标志物,为临床诊断提供影像学依据。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:龚瑞设计本研究的方案,对稿件重要内容进行了修改;田兆荣起草和撰写稿件,获取、分析和解释本研究的数据;张莉萍、田博、池淑红,王晶、徐奋玲、王志军获取、分析或解释本研究的数据,对稿件重要内容进行了修改;田兆荣获得了宁夏回族自治区重点研发计划基金资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

