藏族药甘青青兰不同花色花朵的代谢组学分析△
赵翔,赛曼*,张艳鹏,于晓锐,王勇,兰世超,申振,段亚玲
1.西藏自治区藏医院 生药研究所,西藏 拉萨 850000;2.道地药材国家重点实验室,北京 100700;3.西南林业大学 园林园艺学院,云南 昆明 650224;4.贵州大学 精细化工研究开发中心,贵州 贵阳 550025;5.贵州师范学院 生物科学学院,贵州 贵阳 550018;6.贵州省分析测试研究院,贵州 贵阳 550014
甘青青兰Dracocephalum tanguticumMaxim.属唇形科(Lamiaceae)青兰属(DracocephalumL.)多年生草本植物[1],俗名则羊古、陇塞青兰、唐古特青兰,分布于西藏、青海、四川和甘肃等地[2],喜干燥环境,主要生长在海拔1900~4000 m 的河谷岸、田野、草滩或林边等[2-9]。据记载,甘青青兰味甘、苦,可清胆热、止血、愈疮、燥黄水[10],阴阳两坡均生,花及叶皆兰色[11],藏族医常用其地上部分入药,在民间亦将其作为香料使用[12],具有抗氧化、保护心脏、抑菌、抗炎、抗病毒等功效,常用于治疗胃炎、气管炎、黄疸性肝炎、头晕、神疲、关节炎及疖疮等[2,13-17]。
资料显示,甘青青兰(原变种)、矮生变种及灰毛变种仅存在1 种花色,其花冠为紫蓝色至暗紫蓝色,并未发现其他颜色[1]。但经实地考察发现,除了记载的正常花色紫蓝色外,还存在粉色花,且2 种花色差异明显,目测可辨。颜色出现差异主要源于其代谢产物,如黄酮苷,是紫蓝色和粉色的颜色来源,黄酮类结构含有重要的生色基团,生色基团与黄酮苷元耦合产生颜色的差异[18-19]。同时,中药药效与其代谢产物有密切关系[20-22]。近年来,在甘青青兰有效成分提取及其功效研究方面已取得显著进展[1,4,7,9,22-33],然而关于其花色与生药药性的相关性研究尚未见报道。
代谢组学主要分为靶向代谢组学和非靶向代谢组学[34-35]。目前非靶向代谢组学的应用比较普遍,可以全面分析生物体内代谢物种类,但是其存在准确度、特异性缺乏等缺点。靶向代谢组学利用前期建立的各种代谢物数据库并结合多种代谢通路,对目标代谢物进行定量分析,准确度高、特异性强,能够弥补非靶向代谢组学的不足[36-38]。代谢组学提供的众多的潜在生物标志物及其代谢网络为表征“传统药物的成分巨系统”作用于“机体巨系统”的有效性和作用机制提供了一个可能的思路。因此开展甘青青兰不同花色花朵的比较代谢组学研究有重要意义。本研究以2 种不同花色的甘青青兰为材料,利用非靶向代谢组学分析不同花色花朵中代谢物的差异,并对差异代谢通路进行富集,初步明确形成不同花色的原因及产生花色差异的代谢物和通路。
1 材料
1.1 样品
甘青青兰样品于2022 年8 月采自西藏自治区濒危藏药材人工种植研究基地(E91°15'6.19″,N29°37'14.55″),采集同一范围内植株(50 m×50 m),保证其生境的相似性,减少环境因素影响。随机选取2019 年种植的6 株处于盛花期、生长状况基本一致的甘青青兰植株,采集花朵,清理灰尘及杂质,将处理完成的洁净样品依据颜色分开,用锡箔纸封装标记,迅速置于液氮中,处理时间30 min。处理完成后的样品放置于-80 ℃超低温冰箱,备用。转运过程中采用足量干冰以保持恒定温度,以避免样品产生剧烈物质变化。
对样品颜色进行定性比较,第1 组颜色鉴定为紫蓝色,编号为Z1~Z3;第2 组颜色确定为粉色,编号为F1~F3。所有样品经西藏自治区藏医院达娃顿珠副主任药师鉴定为甘青青兰Dracocephalum tanguticumMaxim.的花。
1.2 仪器与试剂
SQP型电子天平 [赛多利斯科学仪器(北京)有限公司];SG9200HDT 型超声波清洗器(上海冠特超声仪器有限公司);DW-86L829BPT型医用低温保存箱(青岛海尔生物医疗股份有限公司);BL-200SM300L 型防爆冰箱(广东安菲环保科技有限公司);Tissuelyser-24L 型高通量组织研磨仪(上海净信实业发展有限公司);5430R 型高速冷冻离心机(艾本德中国有限公司);超高效液相色谱联用四极杆-静电场轨道阱高分辨质谱(UPLC-Q-Exactive-MS/MS)仪 [赛默飞世尔科技(中国)有限公司];甲醇、乙腈、甲酸均购自美国Fisher Chemical 公司;屈臣氏超纯水;2-氯-苯丙氨酸(上海源叶生物科技有限公司,纯度≥98%,批号:J15J7E9147)。
2 方法
2.1 样品制备
精确称取样品100 mg,放置于2 mL 离心管中,液氮预冷,高通量组织研磨仪研磨,研磨充分后,加入提取液 [甲醇-乙腈-水(2∶2∶1)],含有内标物质2-氯-苯丙氨酸(0.1 mg·mL-1)。随后进行涡旋、振荡,超声处理。4 ℃、12 000 r·min-1离心15 min(离心半径为10 cm),取上清液,过0.22 μm 滤膜,置于2 mL 棕色液相进样瓶中,通过UPLC-QExactive-MS/MS 进行分析。所有样品提取物在分析期间均保存在4 ℃条件下,同时,将所有样本的提取液等比例混合作为质量控制(QC)样本,每6 个检测样本插入1个QC 样本进行检测,以监测仪器分析的稳定性。
2.2 UPLC-Q-Exactive-MS/MS分析条件
色谱条件:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~11.0 min,95%~5%A;11.0~12.0 min,5%A;12.0~12.1 min,5%~95%A;12.1~15.0 min,95%A);流速为0.4 mL·min-1;进样量为5 μL;柱温为40 ℃。
质谱条件:电喷雾离子源(ESI),正、负离子模式,扫描质量范围为m/z70~1050,ESI 加热温度为500 ℃,离子源Gas1 和Gas2 压力分别为50、50 psi(1 psi≈6.895 kPa),Curtain Gas 压力为30 psi,离子喷雾电压浮动(ISVF)在负离子模式下为-3 kV,在正离子模式下为3 kV,MS/MS 去簇电压为80 V,碰撞能量(CE)为20~60 eV。
2.3 代谢物鉴定
经UPLC-Q-Exactive-MS/MS 检测后,将原始数据导入代谢组学处理软件Progenesis QI v2.0.5542进行基线过滤、峰识别、积分、tR校正、峰对齐,最终得到1 个tR、m/z和峰强度的数据矩阵。保留至少1 组样品中非零值80%以上的变量;对原始数据进行缺失值填充值(原始矩阵中最小值填补空缺值);对总峰进行归一化处理,并删除QC 样本RSD≥30%的变量;对数据进行对数转换得到最终用于后续分析的数据矩阵。利用精确的质谱、质谱片段谱和同位素比值差在人体代谢组数据库(HMDB,https://hmdb.ca)中进行搜索鉴定。
2.4 统计分析
采用主成分分析(PCA)观察各样品之间的总体分布和组间的离散程度,推测组内样本的相似性和组间样本的差异性。采用正交偏最小二乘法-判别分析(OPLS-DA)区分各组间代谢轮廓的总体差异,根据P值(P<0.01)和log2FC(FC 为差异倍数)值筛选组间的差异代谢物。
2.5 差异代谢物通路分析
将差异代谢物注释到京都基因与基因组百科全书(KEGG,http://www.genome.jp/kegg/)、人类代谢组数据库(HMDB,https://hmdb.ca)和小分子通路数据库(SMPDB,http://smpdb.ca/),获得代谢物在数据库的注释信息,利用MetaboAnalyst(https://www.metaboanalyst.ca)进行差异代谢物的代谢途径和富集情况表征,并统计其在数据库的注释情况。
3 结果与分析
3.1 颜色差异
花朵颜色是植物重要且基础的理化特征之一,对植物的生长发育起到重要作用,对于植物的生殖生长、抵御外界环境胁迫、引诱害虫天敌均具有重要作用。根据颜色比对分析,可以看出甘青青兰花朵颜色存在显著差异(图1),通过植物照片可以看出,两者之间除了花朵颜色差异外,花瓣形状和大小、苞片和轮伞花序及形成的间断穗状花序类型基本无差异。

图1 不同颜色的甘青青兰花
3.2 代谢物的鉴定
甘青青兰样本检测完成的数据经Progenesis QI软件分析处理,并经过HMDB 数据库进行搜库鉴定分析,在正、负离子模式下共鉴定得到560 个代谢物。基于HMDB 分析,甘青青兰中的代谢物主要包括脂类和类脂类223 个、含氧有机物77 个、苯丙素和聚酮76 个、有机杂环化合物74 个、有机酸及其衍生物59 个、苯环衍生物31 个、含氮有机物10 个、核苷/核苷酸和类似物4 个、木脂素/新木脂素及相关化合物4 个、烃类衍生物1 个、生物碱及其衍生物1 个。样本中占比最高的为脂类和类脂类(39.82%),其次为含氧有机物类(10.54%)、苯丙素和聚酮类、有机杂环化合物,其他包括有机酸及其衍生物、苯环衍生物及含氮有机物等占比较少。
通过对化合物进行具体分析发现,在紫蓝色花中含量排名前10 位的化合物为刺槐素-7-[芹糖基-(1→6) -葡萄糖苷] {acacetin-7-[apiosyl-(1→6) -glucoside],图2}、L-2-氨基-3-亚甲基己酸(L-2-amino-3-methylenehexanoic acid)、药芹二糖苷B(graveobioside B)、L-组氨醇(L-histidinol)、棕榈酸(palmitic acid)、N1,N10-二香豆酰基亚精胺(N1,N10-dicoumaroylspermidine,图2)、芹菜苷(apiin)、苯基膦酸(phenylphosphonic acid)、鹿花菌素(gyromitrin)、xi-10-羟基十八烷酸(xi-10-hydroxyoctadecanoic acid)。在粉色花中含量前10 位的化合物为N1,N10-二香豆酰基亚精胺、刺槐素-7-[ 芹糖基-(1→6) -葡萄糖苷]、药芹二糖苷B(graveobioside B)、L-2-氨基-3-亚甲基己酸、羟基洋艾烯内酯(hydroxypelenolide)、L-组氨醇、黄麻脂肪酸F(corchorifatty acid F)、棕榈酸、蓖麻油酸(ricinoleic acid)和日当药黄素(swertiajaponin)。

图2 不同颜色甘青青兰花中代表性化合物化学结构
不同花色花朵样本中共有的化合物为刺槐素-7-[芹糖基-(1→6)-葡萄糖苷]、L-2-氨基-3-亚甲基己酸、药芹二糖苷B、L-组氨醇、棕榈酸和N1,N10-二香豆酰基亚精胺。
3.3 代谢物的相关性分析
为了了解不同颜色甘青青兰样品之间代谢物的变异程度,依据不同样本间代谢物表达情况对样本进行PCA,结果见图3。紫蓝色花和粉色花的代谢数据矩阵见图3A。经过Hotelling 的T2分析,确定所有样本均分布在95%置信区间内(图3B)。在PCA图的6 个主成分解释了总方差值的94.05%,而第1个主成分方差贡献率高达50.28%,可对不同花色花朵样本进行区分(图3C)。在PCA图中,2个分析组和QC 组分离良好,且样本之间分离度很好,表明这些组之间的代谢存在显著差异(图3A)。此外,QC样本的不同生物学重复样品紧密聚集在一起,表明分析过程中系统稳定性好、分析可靠性高。图3D系统评价了各组内代谢物的成分和含量分布,紫蓝色花组和粉色花组组内显示出明显的组聚类趋势,组间个体代谢物分布的显著差异表明紫蓝色花和粉色花之间存在显著的生物学差异。本研究中应用的仪器分析稳定可靠,得到的代谢物数据矩阵可用于后续分析。

图3 不同颜色甘青青兰花中代谢物的PCA得分
3.4 甘青青兰代谢物的OPLS-DA
依据前述结果对所得数据模型进行OPLS-DA,使用OPLS-DA 可以使样本之间的微小差异最大化,以利于筛选差异代谢物。在OPLS-DA 中(图4),R2和模型预测能力(Q2)越接近1,模型拟合精度越高,反之亦然。根据图4 可知,左侧的R2和Q2的模拟值小于右上角的原始模型,表明原始模型是有效和可靠的,且未过度拟合。由这些结果表明,OPLS-DA 模型具有很好的预测能力,可用于进一步筛选差异代谢物。
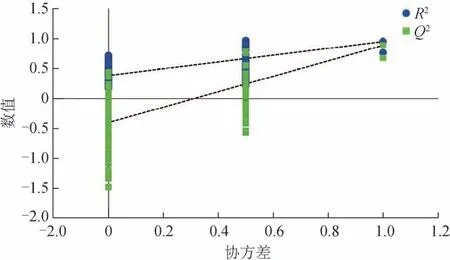
图4 不同颜色甘青青兰花中代谢物的OPLS-DA置换检验
3.5 甘青青兰显著性差异代谢物的分析
甘青青兰不同花色代谢组学样本相关性热图和差异代谢物火山图见图5。对不同颜色花朵的甘青青兰样本检测所得的560 个代谢物进行相关性热图表征。图5A 中每个色条表示2 个样本之间的相关性,不同颜色代表样本间相关系数的相对大小,聚类长度表示样本间相对距离的远近,同一聚类树上的样本相似性更接近。依据样本相关性聚类热图可以看出,紫蓝色花组和粉色花组之间代谢物积累模式存在明显变化,但组内无差异无统计学意义(图5A)。根据火山图(图5B)对560 个代谢物进行差异分析和表征,上调代谢物为120个,下调代谢物为59个,其余差异无统计学意义。

图5 不同颜色甘青青兰花中代谢物聚类热图和差异代谢物火山图
3.6 甘青青兰差异代谢物代谢途径和富集分析
对紫蓝色花和粉色花甘青青兰样品鉴定出的179 个差异代谢物进行进一步筛选分析,设置筛选条件为变量重要性投影(VIP)值>1,且P<0.01,数据经Progenesis QI 处理,并经过HMDB 数据库搜库鉴定分析,共筛选出33个差异代谢物(图6)。这些差异代谢物中上调代谢物20 个,下调代谢物13个。
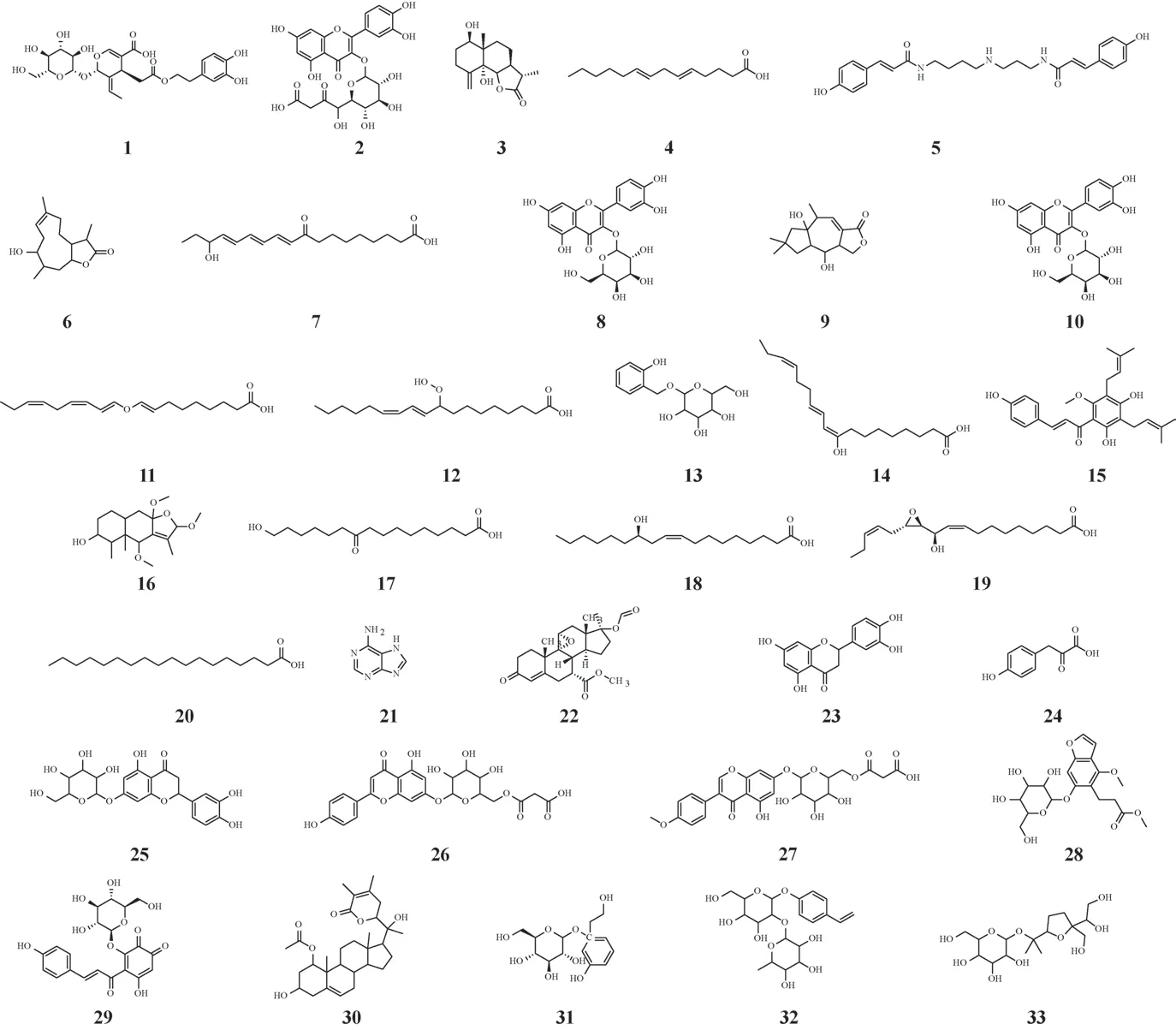
图6 不同颜色甘青青兰花中33个差异代谢物
将33 个差异代谢成分进行KEGG 通路富集分析,其主要富集到苯丙氨酸、酪氨酸和色氨酸的生物合成;泛醌和其他萜类化合物-醌生物合成;不饱和脂肪酸的生物合成;酪氨酸代谢;嘌呤代谢5 条代谢通路(图7A)。通路富集主要与氨基酸苯丙氨酸、酪氨酸和色氨酸有关,这三者与色素生成有关[39]。其中,酪氨酸酶是色素细胞中黑色素生物合成的关键和限速酶[40],苯丙氨酸在体内可以在苯丙氨酸羟基酶的催化下转化为酪氨酸。并且,苯丙氨酸、酪氨酸和色氨酸属于结构和化学特征相似的芳香族氨基酸,表明这3 个氨基酸之间可能存在代谢上的交互作用。证明了紫蓝色花与粉色花甘青青兰样本相比,其色素相关代谢通路存在差异,佐证了颜色差异的来源。同时,差异通路富集到含有不饱和结构和共轭结构,推测这些代谢物可能与花色颜色差异有关[41-42]。

图7 不同颜色甘青青兰花中差异代谢物的代谢通路富集
基于SMPDB 药物途径代谢物数据库,将33 个代谢物进行注释和富集(图7B)分析,其主要富集到依普利酮作用途径、双硫仑作用途径、巯嘌呤作用途径、硫鸟嘌呤作用途径、硫唑嘌呤作用途径。依普利酮作用途径和双硫仑作用途径富集率较高,表明其花色差异可能与功效[43]存在一定关联。
4 讨论与结论
本研究采用UPLC-Q-Exactive-MS/MS 结合PCA和OPLS-DA 等统计分析方法,对甘青青兰不同花色的次生代谢产物进行了分析比较。研究结果表明,6个甘青青兰样品在正、负2 个离子模式下共定性得到560 个代谢物,归为11 类,其中脂类和类脂类分子最为丰富。紫蓝色花和粉色花中相对含量最高的代谢物分别为刺槐素-7-[芹糖基-(1→6)-葡萄糖苷] 和N1,N10-二香豆酰基亚精胺。其共有成分棕榈酸是一种饱和脂肪酸,是血液中含量最高的游离脂肪酸[44],通过激活蛋白磷酸酶2A(PP2A)减少内皮型一氧化氮合成酶(eNOS)Ser1177磷酸化、降低eNOS活性及细胞内NO含量[45]。芹菜苷是芹菜中芹菜素的主要存在形式之一,具有缓解结肠炎的效果[46]。紫蓝色花和粉色花的代谢物存在显著差异,从2 种不同颜色的花中共鉴定出差异代谢物33 个,与粉色花相比,紫蓝色花中共有20个代谢物上调,13个代谢物下调。KEGG 通路分析发现差异代谢物被富集到缩醛磷脂合成、苯丙氨酸和酪氨酸代谢、长链饱和脂肪酸的线粒体β-氧化、酪氨酸代谢、嘌呤代谢5 个代谢通路中,相关通路富集到的差异成分[39,42]与其不饱和结构[41]可能与颜色差异有关。基于SMPDB 药物途径代谢物数据库进行注释和富集,其主要富集到依普利酮、双硫仑、巯嘌呤、硫鸟嘌呤、硫唑嘌呤等作用途径,依普利酮作用途径富集率最高。依普利酮是盐皮质激素受体(MR)拮抗剂,可有效降低高血压等心血管疾病[43]。这也说明了紫蓝色花和粉色花的甘青青兰存在一定的功效差异,后期可通过进一步实验验证。

