皱叶山姜组织培养技术研究
邓小果何柔静李贵雨
(1.海南开放大学农业农村学院,海南 海口 570208;2.中国热带农业科学院海口实验站,海南 海口 571101)
皱叶山姜(Alpinia rugosa S.J.Chen &Z.Y.Chen)是姜科山姜属新种,皱叶山姜产自海南吊罗山,生长在阴暗潮湿的山谷森林;海拔600~800m。皱叶山姜假茎0.5~1.2m,叶舌皮质,双叶,长约1cm,具长硬毛;叶柄1~5cm,短柔毛;叶片长圆,叶面无毛,背面密被短柔毛,极具皱纹,基部深心形重叠。总状花序直立,密花,有9~20朵花,蒴果椭圆形。自1990年引种到华南植物园后,国内的西双版纳植物园和国外夏威夷自华南植物园引种。夏威夷已将皱叶山姜繁殖应用。该植物以其叶皱缩,具有极高的园艺观赏性,是姜科新型园艺观赏作物。
植物组织培养广泛应用于植物脱毒和快速繁殖[1-5]、倍性育种[6-8]、种质资源保存[9]等研究。皱叶山姜可采用分株繁殖的方式进行种苗繁殖,此方法虽能保持母体的性状,但繁殖系数较低。目前关于皱叶山姜组织培养方面的研究尚未有报道。本研究以皱叶山姜吸芽为试验材料,探讨了1/2MS、MS基本培养基、激素及其浓度对芽的诱导、增殖及生根培养的影响,筛选出最佳培养基,建立了皱叶山姜组织培养技术,不仅为其快速繁殖、工厂化生产提供技术基础,还有利于保持母株的优良性状。
1 材料与方法
1.1 材料
试验材料为皱叶山姜健壮吸芽。
1.2 方法
1.2.1 外植体的采取及处理
在晴朗天气的10:00左右,选择健壮的母株,取约10cm大小一致的吸芽作为外植体,切下来的吸芽用自来水洗掉其上面的泥土,然后用解剖刀将其叶鞘拨除,后用自来水冲洗5min,置于超净工作台上,准备消毒。
1.2.2 外植体的灭菌
将处理好的吸芽置于超净工作台上,用沾有75%的棉花擦拭处理好的吸芽,放入75%的酒精中轻轻摇动10s,用无菌水浸洗1~2次。接着,将吸芽放入0.1%升汞溶液中消毒8min,再用无菌水浸洗3~4次。
1.2.3 诱导培养
将经过消毒好的吸芽,接种于诱导培养基中。设置1/2 MS、MS为基本培养基,在2种培养基中分别加入不同浓度的6-BA,6-BA浓度分别为0mg·L-1、1.0mg·L-1、2.0mg·L-1、3.0mg·L-1、4.0mg·L-1。30d后统计诱导发芽率。
发芽率(%)=发芽数/(接种数-污染数)×100%
1.2.4 增殖培养
将经诱导培养后形成的芽,接种于诱导培养基中,以1/2 MS为基本培养基,添加不同浓度的6-BA和TDZ组合,6-BA浓度为1.0mg·L-1、2.0mg·L-1,TDZ浓度为0mg·L-1、1.0mg·L-1、2.0mg·L-1、3.0mg·L-1、4.0mg·L-1。30d后统计增殖系数。
增殖系数=产生芽数/接种芽数
1.2.5 生根培养
丛生芽经过数次继代增殖之后,可进行壮苗生根。当丛生苗上有4片叶子并且苗高为3cm时,将丛生苗分株后,转接到生根培养基中,基本培养基为1/2 MS,在培养基中加入NAA浓度分别0.1mg·L-1、0.2mg·L-1、0.3mg·L-1、0.4mg·L-1。30d后统计生根率。
生根率(%)=生根株数/接种株数×100%
1.2.6 培养条件
本试验配置的诱导、增殖及生根培养基均加入30g·L-1蔗糖和7.5g·L-1卡拉胶,pH值为5.8,在121℃、1.1kg·cm-2的高温高压下灭菌22min。培养室光照强度为1000~1200lx;温度26℃左右。
2 结果与分析
2.1 1/2 MS、MS基本培养基及不同6-BA浓度对丛生芽诱导的影响
将接种在诱导培养基中吸芽放置培养室中进行7d的暗培养,后给予光照培养。培养4周后,观察不同处理的生长情况。结果见表1,在1/2 MS培养基中,6-BA浓度在1.0~3.0mg·L-1,随着浓度的增加,发芽率越高,当6-BA浓度为4.0mg·L-1时,发芽率反而下降。在同一6-BA浓度下,相比MS培养基,1/2MS培养基比MS培养基发芽率均高。当培养基为1/2MS,6-BA的浓度为3.0mg·L-1,发芽率最高为82.61%,丛生芽长势好。综上所述,最适宜皱叶山姜芽诱导培养基为1/2 MS加6-BA 3.0mg·L-1加TDZ 2.0mg·L-1加NAA 0.1mg·L-1。
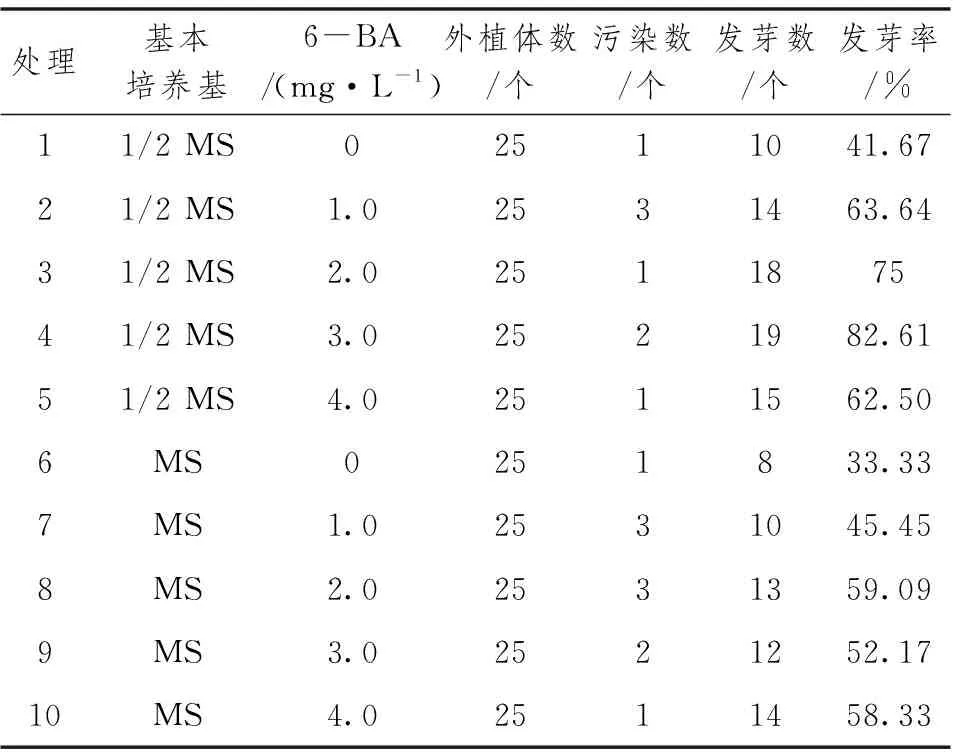
表1 1/2 MS、MS培养基及6-BA浓度对丛生芽诱导的影响
2.2 增殖培养
用诱导形成的丛生芽转接到增殖培养基上。在转接时,要将新长出的叶片切掉,注意切时不要伤到生长点,将丛生芽转接到增殖培养基上,30d后观察芽增殖情况。
从表2可以看出,不同浓度6-BA和TDZ组合,对皱叶山姜组培增殖系数均有影响。在没有添加任何激素的培养基上,芽的增殖系数最低为1.12,芽长势弱,褐化较严重;当6-BA为1.0mg·L-1,丛生芽的增殖系数随着TDZ浓度增加而增加,增殖系数最高为2.88;当6-BA为2.0mg·L-1时,TDZ浓度在0~2.0mg·L-1,增殖系数随着TDZ浓度增加而增加,当TDZ浓度在3.0~4.0mg·L-1时,增殖系数反而下降。当6-BA浓度为2.0mg·L-1、TDZ浓度在2.0mg·L-1时,丛生芽增殖系为4.04,丛生芽生长健壮。综上所述,最适的增殖培养基为1/2 MS加6-BA 2.0mg·L-1加TDZ 2.0mg·l-1加NAA 0.1mg·l-1。
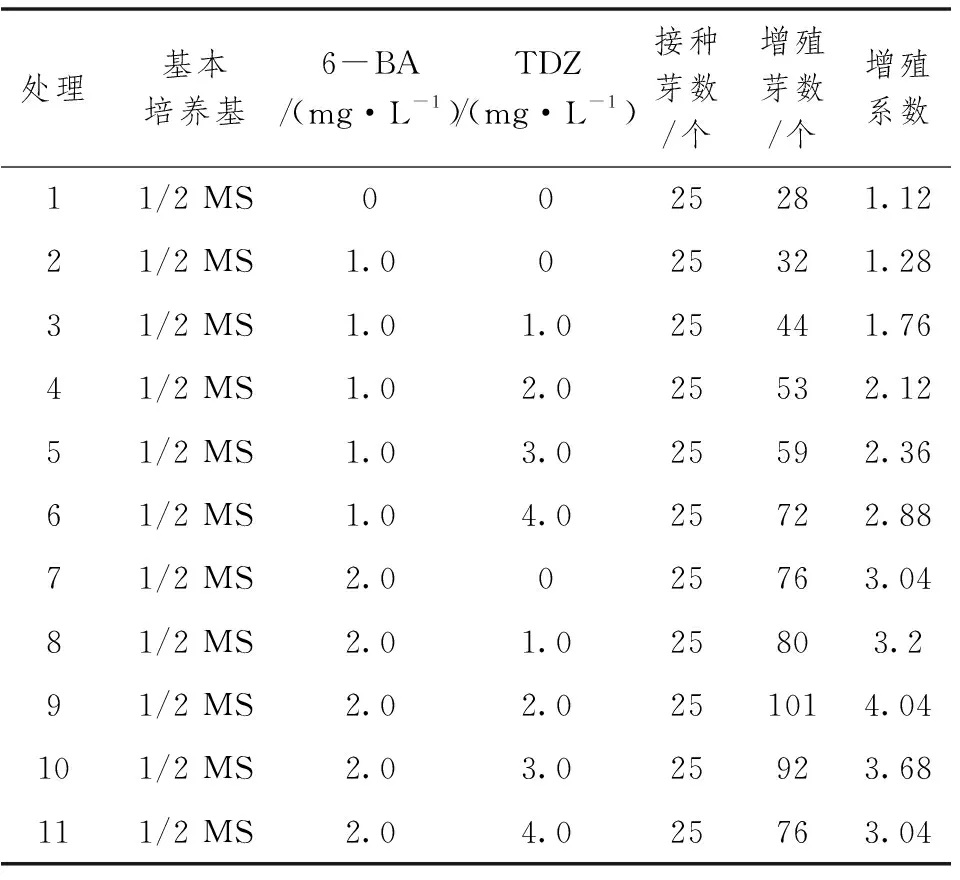
表2 激素浓度配比对丛生芽增殖的影响
2.3 生根培养
当丛生苗长有3~4片叶子,并且高为3cm时,转接到生根培养基上进行培养,在转接时,要将丛生的小苗一株株分开,已长出的根系切掉。小苗培养30d后,统计生根率及根系生长情况。结果见表3,当培养基中没有添加NAA时,植株生根率为86%,为所有培养基中生根率最低。当NAA浓度为0.1mg·L-1时,生根率达到99%,植株长势健壮,根多且粗。当NAA浓度为0.2mg·L-1时,生根率反而下降,且NAA浓度越高,生根率反而下降。综上所述,最佳生根培养基为1/2 MS加NAA 0.1mg·L-1。

图1 丛生芽 图2 生根小苗
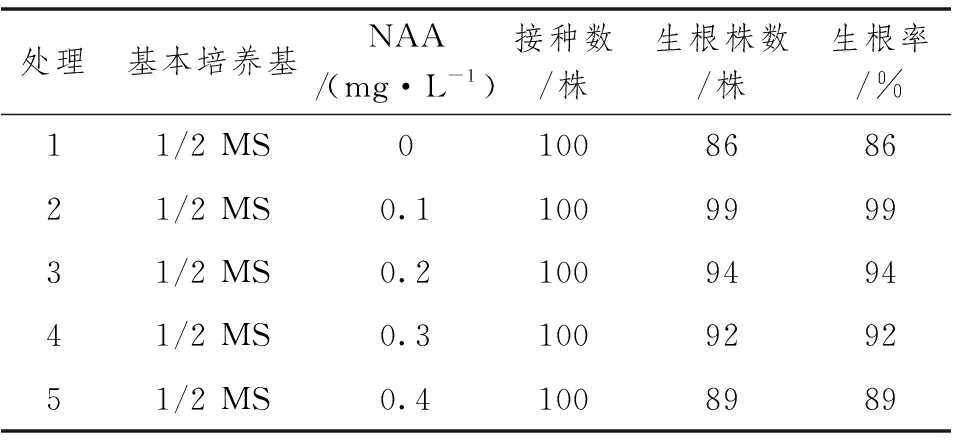
表3 NAA的浓度对皱叶山姜的影响
3 讨论与结论
植物组织培养和快繁技术已应用于姜科花卉及姜科药用植物种苗的快繁中[10-13]。不同物种在组织培养过程中,对基本培养基的要求也不同。组织培养最常用的基本培养基是MS和1/2 MS,两者的区别在于大量元素含量,在配置培养基时,1/2 MS是将MS大量元素减半,其他元素不变。本研究选用MS和1/2 MS培养基作为皱叶山姜芽诱导的基本培养。试验表明,在同一添加植物生长调节剂的条件下,1/2 MS培养基诱导效果比MS培养基诱导效果好。
植物生长调节剂是指具有激素活性的人工合成的化学物质,已被广泛应用于农业、林业及园艺作物,并获得了显著效果,其在组织培养中起着关键的作用。为了促进植物体的快速生长,在培养基中加入植物生长调节剂,诱导培养是组织培养成功的关键,增殖培养是获得更多植株的基础,生根培养是提高植株移栽成活率的重要因素。本试验在1/2 MS培养基中加入6-BA 3.0mg·L-1、TDZ 2.0mg·L-1和NAA 0.1mg·L-1对诱导皱叶山姜吸芽产生丛生芽时效果最好;6-BA 2.0mg·L-1、TDZ 2.0mg·L-1浓度最适合丛生芽增殖生长,TDZ浓度过高或过低则不利于皱叶山姜丛生芽增殖;NAA浓度对皱叶山姜生根有很大的影响,不添加NAA和高浓度的NAA生根率较低,本试验中NAA浓度为0.1mg·L-1时生根率最高,根系生长健壮。
以皱叶山姜吸芽为外植体,通过研究1/2 MS、MS基本培养基、激素及其浓度对芽的诱导、增殖及生根培养的影响,筛选出最佳培养基,最佳诱导培养基为1/2 MS加6-BA 3.0mg·L-1加TDZ 2.0mg·L-1加NAA 0.1mg·L-1,增殖培养基为1/2 MS加6-BA 2.0mg·L-1加TDZ 2.0mg·L-1,生根培养基为1/2 MS加NAA 0.1mg·L-1。

