油料作物种子中神经酸含量提升研究进展

摘要 神经酸(NA)是一种超长链单不饱和脂肪酸,为大脑神经纤维髓鞘的核心成分,具有修复受损大脑神经纤维、促进神经细胞再生等功能。因此,NA 受到越来越多的研究和关注。目前NA 主要依赖于从天然物种中提取,难以满足市场需要,限制其进一步发展和应用。近年来,随着基因工程以及合成生物学的发展,通过多基因策略,在现有物种中构建NA 代谢路径,可经济且可持续地获得NA,以满足营养、制药和化学工业等领域的需求。本文综述了NA 的生物功能、生物来源、合成途径,并比较了基因工程生产NA 各底盘的优劣,进一步探讨了十字花科油料作物底盘生产富含NA 种子油的影响因素,以期为将来通过转基因技术和分子育种调控NA 的生产,获得可再生的NA 资源提供一定的思路和策略。
关键词 神经酸; 基因工程; 底盘; 转基因; 分子育种; 十字花科油料作物; 种子油
中图分类号 Q819∶S565 文献标识码 A 文章编号 1000-2421(2024)02-0064-11
神经酸(nervonic acid,NA)学名为15-二十四碳烯酸(C24∶1),最初在鲨鱼大脑中分离得到,故又名鲨油酸[1]。其分子式为C24H46O2,相对分子质量为366.6,纯品在常温状态下为白色针状固体,溶于醇,不溶于水,是一种ω-9 型长链单不饱和脂肪酸[2]。在人体中主要以三酰甘油(triacylglycerol,TAG)的形式储存[3]。研究表明,NA 与人体多种疾病有关,而人体无法合成NA,必须从食物中获取。探究NA 及其衍生物的生理功能、来源及合成途径等对现代基因工程规模化生产NA 具有重要价值。本文对NA的生物功能、生物来源、合成途径及基因工程生产NA 的研究进展进行综述,以期为将来通过转基因技术和分子育种调控NA 的生产、获得可再生的NA 资源提供一定的思路和策略。
1 NA的相关功能
NA 是一种天然的生物活性脂肪酸,最早以神经鞘脂(nervonic sphingolipids,SLs)形式被发现。早在1972 年,英国神经学家就发现NA 具有修复鲨鱼受伤脑组织的作用[4]。NA 及其衍生物存在于人体多数组织中,大脑、肝脏及肾脏中较为丰富[5]。NA 及其衍生物以自由状态或通过酰胺键与鞘氨醇碱结合形成神经酰胺、鞘脂[6]等物质参与众多生物过程[7-8]。Phung 等[9]系统总结了NA 功能及相关机制,主要包括细胞结构、信号传导、抗炎、脂质动员4 个相互关联的功能。人体缺乏NA 会引起神经系统发育异常、脱髓鞘疾病、神经退行性疾病、心脑血管疾病、免疫缺陷疾病、肿瘤及抑郁症等多种疾病,机体摄入NA 可以协调作用多个靶点,共同缓解机体症状(表1)。
NA 及其衍生物在工业上也有广泛应用,作为生产塑料、化妆品、树脂、尼龙、表面活性剂、生物燃料和润滑剂等产品的原料[32]。相较于其他工业原料,绿色及具可持续特性的NA 及其衍生物,更具有应用和推广价值。
随着社会环境的改变以及人口老龄化程度的加深,我国患心脑血管疾病、神经退行性疾病、癌症以及抑郁症的人数不断攀升。由于这类疾病无特效药,病程极长,治疗及康复过程将占用大量公共资源,成为经济和社会发展的阻碍。我国植物神经酸研究起步较晚,近年来才展现出急起直追之势。国内的研究主要聚焦于工业化提取[33]、自然资源元宝枫(Acer truncatum Bunge )籽油的工业化生产以及微藻品种的发掘等基础研究。市场上售卖的NA 产品主要有国牡元宝枫籽油、汉林牌脑忆康胶囊和寿堂牌纳福希胶囊等,品类少且价格贵。我国亟需开发新型NA 资源,加速深层研究,更好地服务大众。
2 NA的生物来源
2.1 动物来源
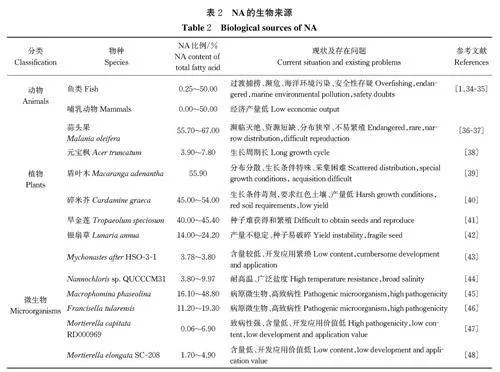
发达国家最早从鲨鱼脑中提取NA[1],但国际组织明令禁止捕获鲨鱼。近年来,在大西洋鳕、大马哈鱼以及红鲑等鱼类中发现NA 及其衍生物,但由于人类过渡捕捞和海洋环境污染,这些鱼类资源的可持续性和安全性受到威胁,限制其作为NA 来源进一步开发利用[34-35]。在其他哺乳动物的大脑中也含有神经酸,但其经济产量较低,尚未得到大规模开发应用(表 2)。
2.2 植物来源
一些植物的果实和种子油中含有丰富的NA。截至目前,在13 科31 个属的38 种植物中发现NA[49-50],包含木本及草本两大类,其中应用较广及NA 含量较高[NA 占总脂肪酸(FA)19% 及以上]植物见表 2。
木本植株较长的生长周期在很大程度上限制其利用,故只有NA 含量高的物种才具有开发利用价值。广东和云南特有物种蒜头果果仁中含有55.7%~67% 的NA,为国家二级保护植物,无法作为NA 的主要来源[36]。元宝枫果油中含有6% 的NA,不断优化的提取技术将终产品NA 含量提高到47% 左右[37-38]。盾叶木(Macaranga adenantha)NA含量高,但分布零散[39]。故我国特有物种元宝枫凭借其较为丰富的资源,成为目前提取NA 的主要自然植物资源[37-39]。
含NA 的草本植物十字花科居多,十字花科植物较木本植物生长周期短,繁殖继代快,具有先天的开发利用优势[35]。碎米荠(Cardamine graeca)NA 含量最高,但其苛刻的生长条件限制其大规模扩繁种植[40]。智利独有的多年生草本植物旱金莲(Tropae⁃olum speciosum),其种子油NA 占总FA 的40.0%~45.4%,但种子较难获得和繁殖[41]。银扇草(Lunariaannua)是2年生草本油料作物,其种子油NA 含量相对较低且产量不稳定,无法规模化收获,同时其高达50% 的芥酸(erucic acid,EA)无法满足NA 油的相关应用要求[42]。
2.3 微生物来源
在现有报道中,天然微生物的NA 含量和滴度相对较低(表 2)。早在1986 年,Nichols 等[51]就在硅藻Nitzshia cylindrus 中发现了低含量的NA;近年来,Yuan 等[43]在华东地区发现绿色微藻Mychonastes af⁃ter HSO-3-1(M. HSO-3-1)中含NA,且具有极低的EA 含量和较高的亚麻酸(C18∶3)含量。Saadaoui等[44]在波斯湾分离得到1 株耐高温和广泛盐度的Nannochloris sp.QUCCCM31,其NA 含量占总脂质的9.97%。
除微藻外,少数真菌和细菌也具有合成NA 的能力。植物病原丝状真菌Macrophomina phaseolina 和细菌Francisella tularensis 可产生较高含量的NA,但较高的感染性限制其应用[45-46]。有学者鉴定,油丝状真菌Mortierella capitata RD000969 和Mortierellaelongata SC-208 可分别积累占总脂肪酸6.94% 及4.9% 的NA,但经发酵优化后,NA 滴度只能达186.3和123.7 mg/L,达不到工业应用程度[47-48]。
由于天然物种中动物资源的单一性和稀缺性,植物资源的长周期性和难获得性,微生物资源的低NA 含量,致使从自然资源中获取NA 无法满足市场需求,需进一步改造和筛选新的NA 来源。
3 NA的生物合成途径
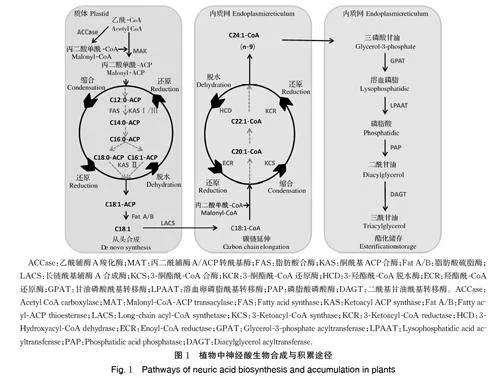
NA 作为超长链脂肪酸再加上其单不饱和的特性,其生物合成主要划分为3 步[3]:在质体脂肪酸合酶复合体作用下,乙酰-CoA 从头延伸生成软脂酸-ACP 或硬脂酸-ACP;去饱和形成油酸(oleic acid,C18∶1);在内质网脂肪酸延伸酶复合体作用下经缩合、还原、脱水、还原循环3 次延伸生成NA[52-54](图 1)。该复合体包括3-酮酯酰-CoA 合酶(3-keto‐acyl-CoA synthase,KCS)、3-酮酯酰-CoA 还原酶(3-ketoacyl-CoA reductase,KCR)、3-羟酯酰-CoA 脱水酶(3-hydroxyacyl-CoA dehydrase,HCD)和羟酯酰-CoA还原酶(enoyl-CoA reductase,ECR),其中KCS 是碳链延伸过程的限速酶,结合囊的性状和大小赋予严格的底物及组织特异性,决定最终产物的碳链长度[55]。
合成的NA 经酰基转移酶作用以甘油三酯(triglycerides,TAGs)的形式储存[54-56](图1)。值得注意的是,NA 在哺乳动物母乳中主要结合于三磷酸甘油(G3P)的sn-2 位,而在植物中主要结合sn-1 和sn-3 位[57]。
4 基因工程生产NA现状及前景
有学者利用顺-13-二十二碳烯基甲酯化学合成NA,但存在产率较低、副产物较多、制备过程资源消耗高,污染严重等问题[58];随着基因工程以及合成生物学技术的蓬勃发展、NA 合成和组装相关基因的确定,基因工程生产NA 凭借其规模大、耗时短、资源浪费少,吸引了各国科学家的加入。
4.1 底盘选择
由于微生物具有增殖周期短、产量高、条件限制少、遗传转化便捷等特点,科学家最早开发微生物底盘来生产NA。微藻和酵母在改造项目中占据高位[59-60]。有学者在酵母中异源表达菌株Mychonas⁃tes HSO-3-1 的KCS 基因[61]以及Lunaria annua 的KCS 基因(LaKCS)[62],转基因品系中产生 NA。夏俊杰[63]利用酿酒酵母构建了高产NA 工程菌,使得NA 产量高达到1.37%。Zhang 等[64]在Saccharomy⁃ces cerevisiae 中共表达Crambe hispanica 的ChFAE1和Lunaria annua 的 LaKCS,使得转基因株系产生5% 的NA。Wang 等[65]在产油酵母Yarrowia lipo⁃lytica 中构建出植物与非植物相结合的NA 合成通路:增加C18∶0 作为非植物途径前体的供应,同时删除了β-氧化途径;利用 NA 特异性Malania oleifera的MoLpaat 替换其内源LPAAT,并增加了辅助因子的供应,最终获得NA 含量为23.44% 菌株。
科学家在利用植物底盘生成NA 的尝试主要集中在十字花科。Huai 等[52]利用拟南芥(Arabidopsisthaliana)中单拷贝的AtKCR、AtHCD 和AtECR 组合LaKCS,辅助种子特异性启动子,在亚麻荠(Cam⁃elina sativa)中异源表达,研究了所有延长酶组分的组合效应。在AtKCR、AtHCD 以及AtECR 单独结合LaKCS 构成的3 个双基因共表达系,以及AtK⁃CR、AtHCD 和LaKCS 结合的三基因共表达系中,NA 均没有进一步增加,再次证明KCS 基因在NA 延长过程中限速酶的重要地位。Guo 等[62]将LaKCS基因转移至拟南芥以及高EA 埃塞俄比亚芥(Brassi⁃ca carinata)中表达,结果显示转基因系NA 含量较野生型分别增加30 和10 倍,转基因埃塞俄比亚芥中NA 含量更是高达30%。Taylor 等[66]在埃塞俄比亚芥中表达Cardamine graeca 的 KCS 基因(CgKCS),使得NA 比例增加到42.2%。高的NA 比例、较高的种子油含量(38%)和田间种子产量(167~200 kg/667 m2)使其成为目前所有NA 种子源中表现最好的品种[35]。
外源基因的转入可使微生物产生NA,但难免会遇到大型生物发酵设备持续的资金投入问题;相较微生物,选择繁殖快、产量高的十字花科植物生产NA,除前期开发株系需一定资本投入外,后期应用只需根据需求调整种植面积即可。
4.2 可利用基因资源
NA 天然物种蒜头果[54,67]、文冠果[68]、元宝枫[69]基因组测序的完成及KCS 基因家族的鉴定和分类,为基因的选择提供了保障。目前鉴定出的拟南芥、蒜头果、文冠果、元宝枫KCS 基因家族成员分别有FAE-like、KCS-like、FDH-like 和CER 等4 个亚族。元宝枫线粒体[70]、叶绿体[71]基因组测序的完成,进一步拓宽了可利用基因的范围。有学者将产油酵母、拟南芥、碎米芥和蒜头果的酰基转移酶序列进行比对,并对酰基转移酶编码基因进行了鉴定[54]。异源酰基转移酶在植物中表达可提高超长链脂肪酸(very long-chain fatty acids, VLCFA)在TAG 中的组装效率以及含油量[72-74]。可利用基因资源的不断丰富,促进基因工程生产NA 的进一步发展。
4.3 生产NA的植物代谢工程前景
前人已验证在植物中异源表达重组KCS 能够显著改变十字花科VLCFA 的含量。利用植物代谢工程生产NA 的研究思路还可进一步拓展,包括:提高某种超长链脂肪酸底物含量、提高脂肪酸组装效率以及含油量等[75]。同时综合考虑最终NA 产品所需的便捷性、经济性和可持续性,可优选产量大、可持续、易应用的植物种子油为NA 载体。借助前人改造十字花科生产NA 的经验,采取将KCS 基因以及TAGs 生物合成相关基因相结合的多基因策略,进一步开发十字花科油料作物生产NA 种子油有望实现既得利益最大化。以下探讨影响十字花科油料作物种子油中NA 含量的主要因素。
1)KCS 基因的选择 。KCS 作为NA 生物合成过程中的限速酶,具有严格的底物以及组织特异性,决定转基因作物中NA 的最终含量。元宝枫Chr4.2307.KCS、Chr4.2308.KCS、Chr4.2311.KCS 在NA 生成关键时期显著上调[76];蒜头果MoKCS11对二十碳烯具有显著底物偏好性[77],FAE-like 基因Maole004215.T1在野生酵母中表达产生C22∶0/C22∶1和C24∶0/C24∶1 等4 种新的脂肪酸[78]。
将不同的KCS 进行组合,构成代谢链,调动不同底物转化成NA;或选择底物充足的转化底盘,提高底物转化率,以突破单基因调控NA 含量增加的有限性。值得注意的是,目前普遍认为摄入EA 过多,会引起心脏疾病[79-80]。转基因植物种子中EA 含量与该品种的利用价值呈负相关,增加NA 的同时降低EA 的含量,也是未来改造的目标之一。
2)提高NA 的存储能力。不同十字花科油料作物含油量及NA 比例均有所不同,只有含油量超过10% 且NA 比例高的油料作物才具有开发利用价值[35]。故在未来改造过程中不仅要提高NA 含量还要兼顾作物含油量的提高。TAG 是种子油中的主要成分,将KCS 基因与提高TAG 含量的相关基因共表达,有助于培育高价值新品种。
①促进NA 积累。在经典的肯尼迪途径(Kennedypathway)中,GPAT、LPAAT 和DGAT 催化G3P主链上连续的酰化反应生成TAG[81-82]。在烟草以及马铃薯块茎中,利用强组成型病毒启动子CaMV-35S 表达DGAT1,导致TAG 增加,并且对植物生长没有显著的负面影响[83-84]。植物内源性酰基转移酶只能将NA 并入且不能同时并入TAG 的sn-1 或sn-3位,sn-2 位通常由16C 和18C 脂肪酸占据[50,61],限制了NA 在植物中的含量。Zou 等[72]在高EA 油菜中表达酵母的LPAAT 基因SLC1-1,将TAG sn-2 位置上的芥酸酰比例提高到41%[73]。由此推断,TAGsn-2 位结合NA 的能力和偏好也可以通过异源表达相关的基因来调节。Wang 等[69]将来自Malania"oleifera 的MoLPAAT 在Yarrowia lipolytica 中进行表达,发现其可替换内源LPAAT 发挥功能,并表现出对包括NA 在内的超长链单不饱和脂肪酸的偏好性,使得转基因菌株NA 含量增加到17.10%。此外,Ma 等[75]通过元宝枫的加权基因共表达网络分析验证了转录因子MYB 以及bZIP 在NA 合成过程中的调控作用。
筛选DGAT 基因增加TAGs 含量,同时应用对NA 具有偏好性的内源或外源LPAAT 提高TAGsn-1、sn-2 以及sn-3 位点结合NA 的能力,辅助转录因子对NA 合成的调控,进一步设计NA 代谢路径,能够最大限度地增加NA 积累量。
②减少NA 降解。在植物中合成的脂肪酸主要通过过氧化物酶体的β-氧化途径分解代谢。Goepfert等[85]在利用拟南芥探究脂肪酸降解β-氧化途径时,发现β-氧化阻断突变体表现为TAG 分解的减少和长链酰基CoA 的积累。Xue 等[86]在利用Y. lipo⁃lytica 生产二十碳五烯酸(EPA)时发现,PEX10 基因突变会损伤过氧化物酶体的形态和完整性,原菌株β-氧化途径缺陷,导致酶体对VLCFAs 的降解能力减弱,EPA 滴度较原菌株提高2 倍。Wang 等[65]将该菌株PEX10 敲除,截断脂肪酸β-氧化降解途径,最终NA 积累量达到亲本菌株的29 倍。另有学者发现删除β-氧化途径可显著增加总脂质含量[87]。参考和拓展脂肪酸降解途径删除或截断策略,可以最大程度地减少NA 的降解。
增加NA 积累,减少NA 氧化降解,提高NA 结合效率,逐级递进式增加植物转基因品系中NA 的含量。
3)基因表达情况。
①特异性启动子应用。特异性启动子表达目的基因,实现目的基因在目标组织中的高活性而在其他组织中低活性,以减少潜在的负面影响。利用种子特异性启动子表达具有底物特异性的KCS 相关基因是生产NA 种子油的一个有效策略。种子特异性napin 启动子、种子特异性大豆glycinin-1 启动子以及大豆优速启动子均被验证能驱动KCS 基因在相应受体内表达,并增加NA 的含量[52,62,78]。
②基因拷贝数。除依托某特异性或强启动子提高基因转录表达水平外,还需考虑基因在物种内的拷贝数。Guo 等[62]发现在转入LaKCS 的转基因品系中,NA 含量与LaKCS 的拷贝数呈正相关,多拷贝株系中转录物强度更高。因此在选定基因基础上增加拷贝数,或许可以最大化提高终产物含量。
③最优基因组合。在选定目标基因的基础上,还需要考虑基因间的相互作用:相关基因结合构成的代谢链是否会产生不必要的中间产物,该产物是否对终产物的合成有负面影响,在终产物提取及利用过程中是否需要花费大量人力物力来去除,以及相关基因的表达是否影响作物自身正常生长发育。在先前的研究中,就有在拟南芥中表达LaKCS 基因,产生7.6%NA 的同时产生13.8% 的EA,而目前认为较高的EA 含量可能对人体具有负面作用,例如可能引发心脏问题[79-80] 。因此,在后续的研究中应该斟酌该基因的使用或结合新的KCS 基因将EA 进一步利用转化为NA。
因此,未来在转基因改造过程中,要尽可能规避以上风险问题,并最大化利用特异启动子及基因自身特性,寻找最适配基因组合,增加基因拷贝数,构成NA 代谢链,缩减时间及资金成本。
4)受体选择。NA 最终的得率除由NA 比例和种子的含油量决定外,还由底盘品种的产量和抗逆性等综合指标共同决定。目前的研究主要关注提高NA 比例,甚少考虑受体自身性状对NA 获得的影响。
①受体农艺特性。NA 的最终产量由作物产量、含油量以及NA 比例共同决定。我国主要的油料作物有大豆、油菜、花生、葵花籽等,NA 在这些主要栽培油料作物中含量极低或无。其中油菜是我国第一大油料作物,属于十字花科芸苔属,年播种面积700hm2 以上,年产油达520 万t,占国产植物油总量的47%,且年产量与消费量逐年增长[88]。油菜品种的多样性、较高的含油量、较短生长周期以及高产抗逆的农艺性状,再加上成熟的遗传转化体系可为植物代谢工程生产NA 提供最基础、稳妥的保障[35]。
②受体底物含量。富含 NA 的油通常混有大量EA,考虑到 EA 对健康的影响,市场急需高 NA 低EA 的油。EA 作为NA 的直接前体物质,以高EA 油菜品种为受体,有望提高合成NA 的效率并降低EA含量,平衡营养和安全。但目前如何将尽可能多的EA 转化成NA 缺乏丰富的分子机理研究以及实验证据支持。有学者曾尝试在高EA 甘蓝型油菜表达Cg⁃KCS,但产量不容乐观,仅为1 500 kg/hm2[78]。另有学者在产油酵母Y. lipolytica 中构建NA 合成双通路:在植物途径的基础上,增加C18∶0 作为非植物途径的NA 前体[68]。今后的研究应汲取已有经验,发挥不同油菜品种的潜在价值,促进不同脂肪酸底物转化为NA,实现营养、安全双平衡。
5)生长环境与人工选择的影响。生物体的性状受到基因以及环境的共同作用。种植的时间、地理位置、水文条件等影响种子的出苗情况;生长过程中的施肥状况、人为活动、水源灌溉周期、病虫害等影响作物的生长状况[35];收获时期的收种方式、收种时间、收种后的储存方法等影响种系的实际收获率,最终综合影响作物的产量、含油量以及脂肪酸的含量。
在保持适宜且一致的种植模式和收种方法的同时,辅之准确的人工选择,对含有优良目标性状的种系进行选择归类,逐步优化作物的目标性状。在Guo等[62]的研究中,表达LaKCS 的转基因埃塞俄比亚芥经过2 代筛选后,最佳NA 含量达到30%,达T1代转基因株系NA 含量的2 倍。逐代选择含油量及NA 含量高且EA 含量低、产量和抗逆性与野生型没有显著差异的目标植株,可使NA 最终产量最大化。
5 结语与展望
NA 及其衍生物在人体内广泛分布。作为神经纤维髓鞘的核心成分,NA 具有修复受损大脑神经纤维、促进神经细胞再生的功能;作为膜结构的重要成分,NA 能够调节胆固醇分布,维持体内膜平衡;作为储存脂质,NA 可优先分解氧化,提供能量,支持人体生命活动。缺乏NA 会导致多种疾病。NA 及其衍生物的酯化形式可作为药物成分和膳食补充剂的原料,以生物递质、前药、奶粉、食用油、饮料、口服乳剂和胶囊等形式应用于日常生活和医疗保健。
我国NA 目前主要有2 种来源。一种是通过蒜头果、元宝枫等植物直接提取,但可利用植物生长周期长、繁殖速度慢、采集收种困难。另一种是通过基因工程改造现有物种合成NA,但以微生物为底盘生产NA,难以避免大量养殖微藻所带来的环境污染,且提纯设备和工艺复杂,需要持续的资金支持;而以植物为底盘生产NA,目前已表现出较为理想的NA产量,且在生产体系成熟后,种植面积为唯一限制因素。相较而言,植物基因工程生产NA 具有更高的应用潜力。
在先前的研究中主要聚焦脂肪酸延长步骤中限速酶基因KCS 的表达调控,忽略了NA 在内的油脂合成是一个多基因协同作用的复杂的代谢过程,NA 的最终得率由作物本身产量、含油量和NA 比例等多因素共同决定。本文对已有研究进展进行分析比较,将植物基因工程生产NA 的改造重点放在十字花科油料作物油菜上,希望借助其成熟的研究体系,以及高产抗逆,高含油量、易遗传转化等优质农艺性状,在保障产量的基础上再根据VLCFA 合成规律,采取多基因策略,组合包括调动EA 在内的各底物转化为NA 的KCS 基因,负责提高含油量和将NA 组装到TAG 各个位置上的相关基因;同时借助种子特异性启动子,将易应用的种子油作为最终的NA 载体。以期为将来通过转基因技术和分子育种调控NA 的生产,获得可再生的NA 资源提供一定的思路和策略,让NA 更好地惠及大众、造福人类。
参考文献References
[1] TSUJIMOTO M.On new fatty acids in shark liver oil[J].The
journal of the Society of Chemical Industry, Japan, 1925, 28
(8):835-842.
[2] MERRILL A H,SCHMELZ E M,WANG E,et al. Importance
of sphingolipids and inhibitors of sphingolipid metabolism
as components of animal diets[J]. The journal of nutrition,
1997,127(5):830-833.
[3] BATES P D,DURRETT T P,OHLROGGE J B,et al.Analysis
of acyl fluxes through multiple pathways of triacylglycerol
synthesis in developing soybean embryos[J].Plant physiology,
2009,150(1):55-72.
[4] SINCLAIR A J,CRAWFORD M A.The incorporation of linolenic
acid and docosahexaenoic acid into liver and brain lipids
of developing rats[J].FEBS letters,1972,26(1/2):127-129.
[5] MARTÍNEZ M,MOUGAN I. Fatty acid composition of human
brain phospholipids during normal development[J].Journal
of neurochemistry,1998,71(6):2528-2533.
[6] SASSA T,KIHARA A.Metabolism of very long-chain fatty
acids:genes and pathophysiology[J]. Biomolecules amp; therapeutics,
2014,22(2):83-92.
[7] POULOS A. Very long chain fatty acids in higher animals:a
review[J].Lipids,1995,30(1):1-14.
[8] KIKAS P,CHALIKIAS G,TZIAKAS D.Cardiovascular implications
of sphingomyelin presence in biological membranes
[J].European cardiology,2018,13(1):42-45.
[9] PHUNG N V,RONG F,XIA W Y,et al.Nervonic acid and
its sphingolipids:biological functions and potential food applications
[J/OL].Critical reviews in food science and nutrition,
2023,4:2203753[2023-10-10]. https://doi. org/10.1080/
10408398.2023.2203753.
[10] GROTHEER M,ROSENKE M,WU H,et al.White matter
myelination during early infancy is linked to spatial gradients
and myelin content at birth[J/OL]. Nat Commun, 2022,13
(1):997[2023-10-10]. https://doi. org/10.1038/s41467-
022-28326-4.
[11] YU J H,YUAN T L,ZHANG X H,et al. Quantification of
nervonic acid in human milk in the first 30 days of lactation:influence
of lactation stages and comparison with infant formulae
[J/OL].Nutrients,2019,11(8):1892[2023-10-10].https://
doi.org/10.3390/nu11081892.
[12] BATHELT J,SCERIF G,NOBRE A C,et al. Whole-brain
white matter organization,intelligence,and educational attainment
[J]. Trends in neuroscience and education,2019,15:
38-47.
[13] RUBINOV M,SPORNS O. Complex network measures of
brain connectivity:uses and interpretations[J]. NeuroImage,
2010,52(3):1059-1069.
[14] COUPLAND K,LANGLEY N A. Use of nervonic acid and
long chain fatty acids for the treatment of demyelinating disorders:
US5194448[P].1993-03-16.
[15] MANNI M M,SOT J,ARRETXE E,et al.The fatty acids of
sphingomyelins and ceramides in mammalian tissues and cultured
cells:Biophysical and physiological implications[J].
Chemistry and physics of lipids,2018,217:29-34.
[16] LEWKOWICZ N,PIĄTEK P,NAMIECIŃSKA M,et al.
Naturally occurring nervonic acid ester improves myelin synthesis
by human oligodendrocytes[J/OL].Cells,2019,8(8):
786[2023-10-10].https://doi.org/10.3390/cells8080786.
[17] KAGEYAMA Y,DEGUCHI Y,HATTORI K,et al.Nervonic
acid level in cerebrospinal fluid is a candidate biomarker for
depressive and manic symptoms:a pilot study[J/OL]. Brain
and behavior,2021,11(4):e02075[2023-10-10].https://doi.
org/10.1002/brb3.2075.
[18] KAGEYAMA Y,KASAHARA T,NAKAMURA T,et al.
Plasma nervonic acid is a potential biomarker for major depressive
disorder:a pilot study[J]. International journal of neuropsychopharmacology,
2018,21(3):207-215.
[19] BLANCHARD J W,AKAY L A,DAVILA-VELDERRAIN
J,et al.APOE4 impairs myelination via cholesterol dysregulation
in oligodendrocytes[J]. Nature,2022,611(7937):
769-779.
[20] HUYNH K,LIM W L F,GILES C,et al.Concordant peripheral
lipidome signatures in two large clinical studies of Alzheimer’s
disease[J/OL].Nature communications,2020,11:
5698 [2023-10-10]. https://doi. org/10.1038/s41467-020-
19473-7.
[21] 胡丹东,崔玉娟,张继. 神经酸对帕金森病小鼠运动障碍的改
善及保护作用[J]. 中国药理学通报,2021,37(11):1524-
1529.HU D D,CUI Y J,ZHANG J.Amelioration and protection
of nervonic acid on motor disorder in mice with Parkinson’s
disease[J]. Chinese pharmacological bulletin,2021,37(11):
1524-1529( in Chinese with English abstract).
[22] GULBINS E.Regulation of death receptor signaling and apoptosis
by ceramide[J].Pharmacological research,2003,47(5):
393-399.
[23] SISKIND L J. Mitochondrial ceramide and the induction of
apoptosis[J]. Journal of bioenergetics and biomembranes,
2005,37(3):143-153.
[24] YAMANE M,MORIYA S,KOKUBA H.Visualization of ceramide
channels in lysosomes following endogenous palmitoylceramide
accumulation as an initial step in the induction of necrosis
[J]. Biochemistry and biophysics reports,2017,11:
174-181.
[25] ZHANG X W,SAKAMOTO W,CANALS D,et al. Ceramide
synthase 2-C24:1-ceramide axis limits the metastatic
potential of ovarian cancer cells[J/OL].FASEB journal:official
publication of the Federation of American Societies for Experimental
Biology,2021,35(2):e21287[2023-10-10].
https://doi.org/10.1096/fj.202001504RR.
[26] WANG X Q,LIANG T Y,MAO Y,et al. Nervonic acid improves
liver inflammation in a mouse model of Parkinson’s disease
by inhibiting proinflammatory signaling pathways and regulating
metabolic pathways[J/OL]. Phytomedicine,2023,117:
154911 [2023-10-10]. https://doi. org/10.1016/j. phymed.
2023.154911.
[27] KASAI N,MIZUSHINA Y,SUGAWARA F,et al.Three-dimensional
structural model analysis of the binding site of an inhibitor,
nervonic acid,of both DNA polymerase beta and HIV-
1 reverse transcriptase[J]. Journal of biochemistry,2002,132
(5):819-828.
[28] LIVINGSTONE K M,LOVEGROVE J A,GIVENS D I.
The impact of substituting SFA in dairy products with MUFA
or PUFA on CVD risk:evidence from human intervention
studies[J].Nutrition research reviews,2012,25(2):193-206.
[29] CONSOLE L,SCALISE M,GIANGREGORIO N,et al.
The link between the mitochondrial fatty acid oxidation derangement
and kidney injury[J/OL].Frontiers in physiology,
2020, 11: 794 [2023-10-10]. https://doi. org/10.3389/
fphys.2020.00794.
[30] KHAWAJA Y,SCRANO L A,BUFO S,et al. A new equation
for calculating the number of ATP molecules generated
from fatty acids[J]. World journal of pharmaceutical sciences,
2015,4(7):175-185.
[31] LEONARDINI A,LAVIOLA L,PERRINI S,et al. Crosstalk
between PPAR gamma and insulin signaling and modulation
of insulin sensitivity[J/OL].PPAR research,2009,2009:
818945[2023-10-10].https://doi.org/10.1155/2009/818945.
staner and Tephrosia vogelii hook. f. seed oils[J]. European
journal of medicinal plants,2014,4(7):844-853.
[35] LIU F,WANG P D,XIONG X J,et al.A review of nervonic
acid production in plants:prospects for the genetic engineering
of high nervonic acid cultivars plants[J/OL].Frontiers in plant
science,2021,12:626625[2023-10-10]. https://doi. org/
10.3389/fpls.2021.626625.
[36] 欧乞鍼. 一个重要脂肪酸cis-tetracos-15-enoic 的新存在:蒜
头果油[J]. 云南植物研究,1981,3(2):181-184.OU Q Z.A
new presence of important fatty acid (cis-tetracos-15-enoic)
-oil of malania olefera Chun et Lee[J].Acta botanica Yunnanica,
1981,3(2):181-184( in Chinese with English abstract).
[37] 王性炎,樊金栓,王姝清. 中国含神经酸植物开发利用研究
[J]. 中国油脂,2006,31(3):69-71.WANG X Y,FAN J S,
WANG S Q. Development situation and outlook of nervonic
acid plants in China[J].China oils and fats,2006,31(3):69-71
(in Chinese with English abstract).
[38] 史宣明,陈燕,张骊,等. 从元宝枫油中提取神经酸并制备生
物柴油的技术研究[J]. 中国油脂,2013,38(2):61-65.SHI X
M,CHEN Y,ZHANG L,et al. Preparation of nervonic acid
and biodiesel from Acer truncatum Bunge seed oil[J]. China
oils and fats,2013,38(2):61-65 (in Chinese with English abstract).
[39] 马柏林,梁淑芳,赵德义,等. 含神经酸植物的研究[J]. 西北
植物学报,2004,24(12):2362-2365.MA B L,LIANG S F,
ZHAO D Y,et al.Study on plants containing nervonic acid[J].
Acta botanica boreali-occidentalia sinica,2004,24(12):2362-
2365( in Chinese with English abstract).
[40] JART A. The fatty acid composition of various cruciferous
seeds[J]. Journal of the American Oil Chemists’ Society,
1978,55(12):873-875.
[41] LITCHFIELD C. Tropaeolum speciosum seed fat:a rich
source of cis-15-tetracosenoic andcis-17-hexacosenoic acids
[J].Lipids,1970,5(1):144-146.
[42] MASTEBROEK H D,MARVIN H J P. Breeding prospects
of Lunaria annua L[J].Industrial crops and products,2000,11
(2/3):139-143.
[43] YUAN C,LIU J H,FAN Y,et al.Mychonastes afer HSO-3-1
as a potential new source of biodiesel[J/OL]. Biotechnology
for biofuels,2011,4(1):47[2023-10-10]. https://doi. org/
10.1186/1754-6834-4-47.
[44] SAADAOUI I,AL GHAZAL G,BOUNNIT T,et al. Evidence
of thermo and halotolerant Nannochloris isolate suitable
for biodiesel production in Qatar Culture Collection of Cyanobacteria
and Microalgae[J].Algal research,2016,14:39-47.
[45] WASSEF M K,AMMON V,WYLLIE T D.Polar lipids of‐
Macrophomina phaseolina[J].Lipids,1975,10(3):185-190.
[46] JANTZEN E,BERDAL B P,OMLAND T.Cellular fatty acid
composition of Francisella tularensis[J]. Journal of clinical
microbiology,1979,10(6):928-930.
[47] UMEMOTO H,SAWADA K,KURATA A,et al.Fermentative
production of nervonic acid by Mortierella capitata
RD000969[J].Journal of oleo science,2014,63(7):671-679.
[48] CHAUDHURI S,GHOSH S,BHATTACHARYYA D K,
et al. Effect of mustard meal on the production of arachidonic
acid by Mortierella elongata SC-208[J].Journal of the American
oil chemists’ society,1998,75(8):1053-1055.
[49] FAN Y,MENG H M,HU G R,et al.Biosynthesis of nervonic
acid and perspectives for its production by microalgae and other
microorganisms[J]. Applied microbiology and biotechnology,
2018,102(7):3027-3035.
[50] MA B,LIANG S,ZHAO D,et al.Study on plants containing
nervonic acid[J]. Agricultural and food sciences,environmental
science,2004,24:2362-2365.
[51] NICHOLS P D,PALMISANO A C,SMITH G A,et al.Lipids
of the Antarctic Sea ice diatom Nitzschia cylindrus[J].Phytochemistry,
1986,25(7):1649-1653.
[52] HUAI D X,ZHANG Y Y,ZHANG C Y,et al.Combinatorial effects
of fatty acid elongase enzymes on nervonic acid production
in Camelina sativa[J/OL]. PLoS One,2015,10(6):e0131755
[2023-10-10].https://doi.org/10.1371/journal.pone.0131755.
[53] YANG T Q,YU Q,XU W,et al.Transcriptome analysis reveals
crucial genes involved in the biosynthesis of nervonic acid
in woody Malania oleifera oilseeds[J/OL].BMC plant biology,
2018,18 (1) :247 [2023-10-10]. https://doi. org/
10.1186/s12870-018-1463-6.
[54] FAN Y,GAO G,XUE Y,et al.Research progress on plant nervonic
acid[J].Current biotechnology,2022,12(5):664-672.
[55] JOUBÈS J,RAFFAELE S,BOURDENX B,et al.The VLCFA
elongase gene family in Arabidopsis thaliana:phylogenetic
analysis,3D modelling and expression profiling[J].Plant
molecular biology,2008,67(5):547-566.
[56] KENNEDY E P,WEISS S B.The function of cytidine coenzymes
in the biosynthesis of phospholipides[J].The journal of
biological chemistry,1956,222(1):193-214.
[57] SCARTH R,TANG J H. Modification of Brassica oil using
conventional and transgenic approaches[J].Crop science,2006,
46(3):1225-1236.
[58] 雷泽,付正启,温晓江,等. 一种神经酸的化学合成方法:
CN103396304A[P].2013-11-20.LEI Z,FU Z Q,WEN X J,
et al. Nervonic acid chemosynthesis method:CN103396304A
[P].2013-11-20(in Chinese).
[59] MICHALAK I,CHOJNACKA K. Algae as production systems
of bioactive compounds[J].Engineering in life sciences,
2015,15(2):160-176.
[60] YUAN C,ZHENG Y L,ZHANG W L,et al.Lipid accumulation
and anti-rotifer robustness of microalgal strains isolated
from Eastern China[J].Journal of applied phycology,2017,29
(6):2789-2800.
[61] FAN Y,YUAN C,JIN Y,et al.Characterization of 3-ketoac‐
yl-coA synthase in a nervonic acid producing oleaginous microalgae
Mychonastes afer[J].Algal research,2018,31:225-231.
[62] GUO Y M,MIETKIEWSKA E,FRANCIS T,et al.Increase
in nervonic acid content in transformed yeast and transgenic
plants by introduction of a Lunaria annua L. 3-ketoacyl-CoA
synthase(KCS) gene[J]. Plant molecular biology,2009,69
(5):565-575.
[63] 夏俊杰. 高产神经酸工程菌的构建及发酵条件的优化[D]. 北
京:北京化工大学,2020.XIA J J.Construction and optimization
of fermentation conditions for high-yielding engineered
nervonic acid bacteria[D].Beijing:Beijing University of Chemical
Technology,2020( in Chinese with English abstract).
[64] ZHANG Y,YANG C,XIA J J,et al.Overproducing nervonic
acid by synergism of fatty acid elongases in engineered Saccha⁃
romyces cerevisiae [J]. Process biochemistry,2022,122:
341-346.
[65] WANG K F,LIN L,WEI P,et al.Combining orthogonal plant and
non-plant fatty acid biosynthesis pathways for efficient production
of microbial oil enriched in nervonic acid in Yarrowia lipolyt⁃
ica[J/OL].Bioresource technology,2023,378:129012[2023-10-
10].https://doi.org/10.1016/j.biortech.2023.129012.
[66] TAYLOR D C,FRANCIS T,GUO Y M,et al. Molecular
cloning and characterization of a KCS gene from Cardamine
graeca and its heterologous expression in Brassica oilseeds to
engineer high nervonic acid oils for potential medical and industrial
use[J].Plant biotechnology journal,2009,7(9):925-938.
[67] YANG T Q,ZHANG R G,TIAN X L,et al. The chromosome-
level genome assembly and genes involved in biosynthesis
of nervonic acid of Malania oleifera[J/OL].Scientific data,
2023,10:298[2023-10-10].https://doi.org/10.1038/s41597-
023-02218-8.
[68] LIANG Q,LIU J N,FANG H C,et al.Genomic and transcriptomic
analyses provide insights into valuable fatty acid biosynthesis
and environmental adaptation of yellowhorn[J/OL].
Frontiers in plant science,2022,13:991197[2023-10-10].
https://doi.org/10.3389/fpls.2022.991197.
[69] WANG R K,LIU P,FAN J S,et al. Comparative transcriptome
analysis two genotypes of Acer truncatum Bunge seeds
reveals candidate genes that influences seed VLCFAs accumulation
[J/OL].Scientific reports,2018,8:15504[2023-10-10].
https://doi.org/10.1038/s41598-018-33999-3.
[70] MA Q Y,WANG Y X,LI S S,et al.Assembly and comparative
analysis of the first complete mitochondrial genome of Ac⁃
er truncatum Bunge:a woody oil-tree species producing nervonic
acid[J/OL].BMC plant biology,2022,22(1):29[2023-
10-10].https://doi.org/10.1186/s12870-021-03416-5.
[71] MA Q Y,WANG Y N,ZHU L,et al.Characterization of the complete
chloroplast genome of Acer truncatum bunge( Sapindales:
Aceraceae):a new woody oil tree species producing nervonic acid
[J/OL]. BioMed research international,2019,2019:7417239
[2023-10-10].https://doi.org/10.1155/2019/7417239.
[72] ZOU J,KATAVIC V,GIBLIN E M,et al. Modification of
seed oil content and acyl composition in the Brassicaceae by
expression of a yeast Sn-2 acyltransferase gene[J].The plant
cell,1997,9(6):909-923.
[73] KATAVIC V,FRIESEN W,BARTON D L,et al.Improving
erucic acid content in rapeseed through biotechnology:what
can the Arabidopsis FAE1 and the yeast SLC1-1 genes contribute
[J].Crop science,2001,41(3):739-747.
[74] TAYLOR D C,KATAVIC V,ZOU J T,et al.Field testing
of transgenic rapeseed cv.Hero transformed with a yeast Sn-2
acyltransferase results in increased oil content,erucic acid content
and seed yield[J]. Molecular breeding,2002,8(4):
317-322.
[75] TAYLOR D C,SMITH M A,FOBERT P,et al.Metabolic
engineering of higher plants to produce bio-industrial oils
[M]//Comprehensive Biotechnology. Amsterdam:Elsevier,
2011:67-85.
[76] MA Q Y,SUN T L,LI S S,et al. The Acer truncatum genome
provides insights into nervonic acid biosynthesis[J].The
Plant journal,2020,104(3):662-678.
[77] LI Z W,MA S J,SONG H,et al.A 3-ketoacyl-CoA synthase
11 (KCS11) homolog from Malania oleifera synthesizes nervonic
acid in plants rich in 11Z-eicosenoic acid[J].Tree physiology,
2021,41(2):331-342.
[78] DAI H,ZHANG Y Y,JIN P,et al.Identification of KCS gene
family and functional analysis of FAE-like genes from Malan⁃
ia oleifera[J].Oil crop science,2021,6(1):35-40.
[79] HEIJENSKJÖLD L,ERNSTER L.Studies of the mode of action
of erucic acid on heart metabolism[J].Acta medica scandinavica.
supplementum,1975,585:75-83.
[80] DAS S,ROSCOE T J,DELSENY M,et al.Cloning and molecular
characterization of the fatty acid elongase 1 (FAE 1)
gene from high and low erucic acid lines of Brassica campestris
and Brassica oleracea[J]. Plant science,2002,162(2):
245-250.
[81] WESELAKE R J,TAYLOR D C,RAHMAN M H,et al.Increasing
the flow of carbon into seed oil[J].Biotechnology advances,
2009,27(6):866-878.
[82] KENNEDY E P.Biosynthesis of complex lipids[J].J Clin Invest,
1961,40(6):925-932.
[83] VANHERCKE T,EL TAHCHY A,LIU Q,et al.Metabolic
engineering of biomass for high energy density:oilseed-like triacylglycerol
yields from plant leaves[J]. Plant biotechnology
journal,2014,12(2):231-239.
[84] LIU Q,GUO Q G,AKBAR S,et al.Genetic enhancement of
oil content in potato tuber( Solanum tuberosum L.) through an
integrated metabolic engineering strategy[J].Plant biotechnology
journal,2017,15(1):56-67.
[85] GOEPFERT S,POIRIER Y.β-Oxidation in fatty acid degra‐
dation and beyond[J].Current opinion in plant biology,2007,
10(3):245-251.
[86] XUE Z X,SHARPE P L,HONG S P,et al. Production of
omega-3 eicosapentaenoic acid by metabolic engineering of
Yarrowia lipolytica[J]. Nature biotechnology,2013,31(8):
734-740.
[87] WANG K F,SHI T Q,WANG J P,et al.Engineering the lipid
and fatty acid metabolism in Yarrowia lipolytica for sustainable
production of high oleic oils[J]. ACS synthetic biology,
2022,11(4):1542-1554.
[88] 何平,王会,罗莉霞,等. 油菜品种登记现状分析[J]. 中国种
业,2021(8):26-29.HE P,WANG H,LUO L X,et al.Analysis
on current situation of oilseed rape variety registration[J].
China seed industry,2021(8):26-29( in Chinese)
[32] DODOS G S,KARONIS D,ZANNIKOS F,et al.Renewable
fuels and lubricants from Lunaria annua l[J].Industrial crops
and products,2015,75:43-50.
[33] 候镜德,袁晓悟,胡伟,等. 金属盐沉淀法分离神经酸[J]. 生
物技术,1996,6(1):39-41.HOU J D,YUAN X W,HU W,et
al.Separation of nervonic acid by metal salt precipitation method
[J].Biotechnology,1996,6(1):39-41(in Chinese).
[34] BAVHURE B. Fatty acid composition of Lebrunia bushiae
(责任编辑:张志钰)

