矮牵牛PhSPL9b基因的克隆及功能分析


关键词 矮牵牛; PhSPL9b; 超量表达; 开花; 转录激活特性
中图分类号 S681.9 文献标识码 A 文章编号 1000-2421(2024)03-0240-09
开花是高等植物从营养生长到生殖生长状态的转变,这一过程决定植物能否成功繁殖子代[1-2]。植物的开花受多种外界因素和内部因素的综合调控,这些调控途径既可以单独发挥作用,也存在大量的交叉整合,通过基因之间的相互促进和抑制,形成自我调控、正向反馈调控、负向反馈调控等不同的调控模式,最终绘制出一个复杂而严谨的基因调控网络。近年来,研究人员已经在许多植物中开展开花相关基因的研究,如改变园艺植物的开花时间或延长整个花期,解决杂交育种过程中花期不遇等问题[2]。此外,开花基因会影响植物的花序结构,而花序结构对粮食、经济作物的产量具有重要的调控作用[3]。因此,研究开花基因在植物中的作用,对园艺作物与经济作物的产量提高及观赏植物的花期调控都具有重要的指导意义。
SPL(SQUAMOSA-promoter binding proteinlike)是植物中特异的一类转录因子,在植物营养生长和生殖生长过程中发挥着重要作用[4-7]。近年来,SPL 家族基因的功能在许多植物中被广泛报道,其中SPL9 亚家族成员的功能研究较多且深入。如在拟南芥中,过表达AtSPL9 和AtSPL15,影响花芽发育和开花[6],此外,SPL9 响应生长素信号并抑制拟南芥侧根的发育[4]。Xie 等[8]发现AtSPL9 和AtSPL15与光信号转导所必需的转录因子FHY3(FAR-REDELONGATED HYPOCOTYL 3)和FAR1(FARRED-IMPAIRED RESPONSE 1),以及独脚金内酯信号通路关键抑制因子SMXL6/SMXL7/SMXL8(SUPPRESSOR OF MORE AXILLARYGROWTH2-LIKE)相互作用,并利于BRC1(BRANCHED 1)的转录激活,最终促进拟南芥分枝。Yu 等[9]发现SPL9 可直接靶向TCL1(TRICHOMELESS1)和TRY(TRIPTYCHON)调控拟南芥表皮毛的发育。Cui 等[10]研究表明miR156/157可直接调控SPL9,进而负调节花青素的积累。此外,SPL9 可直接调控CBF2(C-REPEAT BINDINGFACTOR 2)提高植物的抗寒性[11]。在水稻中,IPA1(ideal plant architecture 1)数量性状位点关联的OsSPL14(AtSPL9/15 的同源蛋白)通过改变水稻株型最终影响水稻的产量[12];在大豆中,GmSPL9d(AtSPL9/15 的同源蛋白)与WUS(WUSCHEL)互作协调调控大豆的分枝结构,最终影响大豆的产量[13]。
矮牵牛(Petunia hybrida)为茄科碧冬茄属的一、二年生草本花卉,花色绚丽、株型丰富、花期长,被誉为“花坛之王”。目前对矮牵牛的研究主要集中在花器官发育方面[14-16],而对开花分子机理的研究极为有限。Morel 等[17]发现矮牵牛AP1/SQUA 亚家族的4 个成员PFG、FBP26、FBP29 和euAP1 都能调控开花,但作用程度存在差异;Preston 等[18]研究发现PhSBP1(PhSPL3)和PhSBP2(PhSPL4c)不同程度地促进矮牵牛成花转换,且PhSBP1 加速叶片的萌发。课题组前期研究发现miR156/157 靶向部分PhSPLs 基因调控矮牵牛和拟南芥开花[19-20],但具体是通过靶向哪个或者哪些PhSPLs 基因调控开花尚不明确。因此,为了深入研究PhSPL9b 转录因子在矮牵牛成花转换中的作用,本研究克隆了PhSPL9b基因,对其基因结构和转录激活特性进行分析,构建相关载体分别转化矮牵牛和拟南芥,以期揭示PhSPL9b 在矮牵牛成花转换中的作用。
1 材料与方法
1.1 试验材料
以矮牵牛W115 株系(Petunia hybrida var.Mitchel diploid)和野生型(Col-0 生态型)拟南芥(Arabidopsis thaliana)为试验材料。矮牵牛种植于华中农业大学花卉基地温室,常规管理。拟南芥种植于光照培养箱(光照强度2 000 lx、16 h 光照/8 h 黑暗,温度21~22 ℃,湿度75%)。
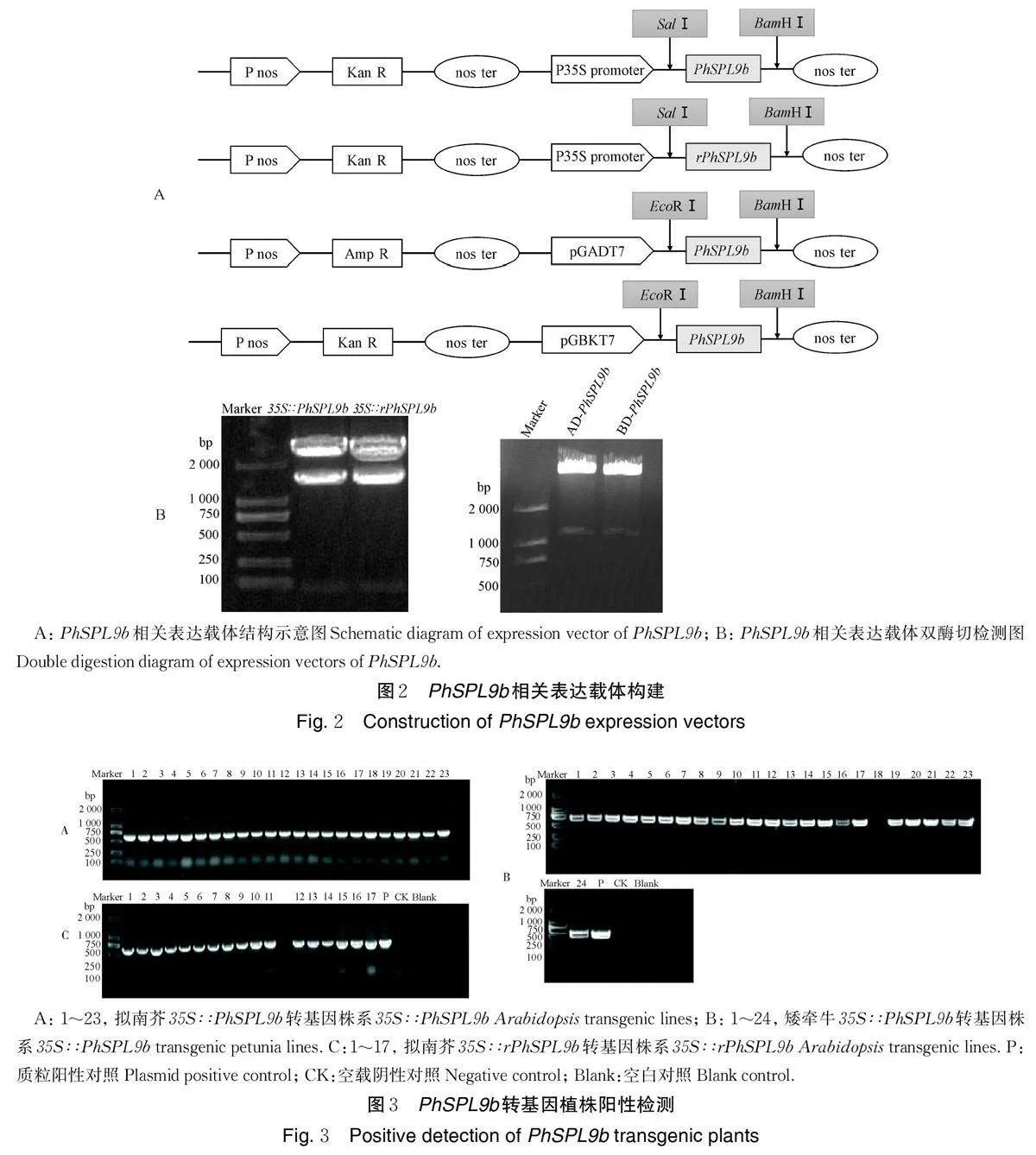
1.2 PhSPL9b 相关表达载体的构建
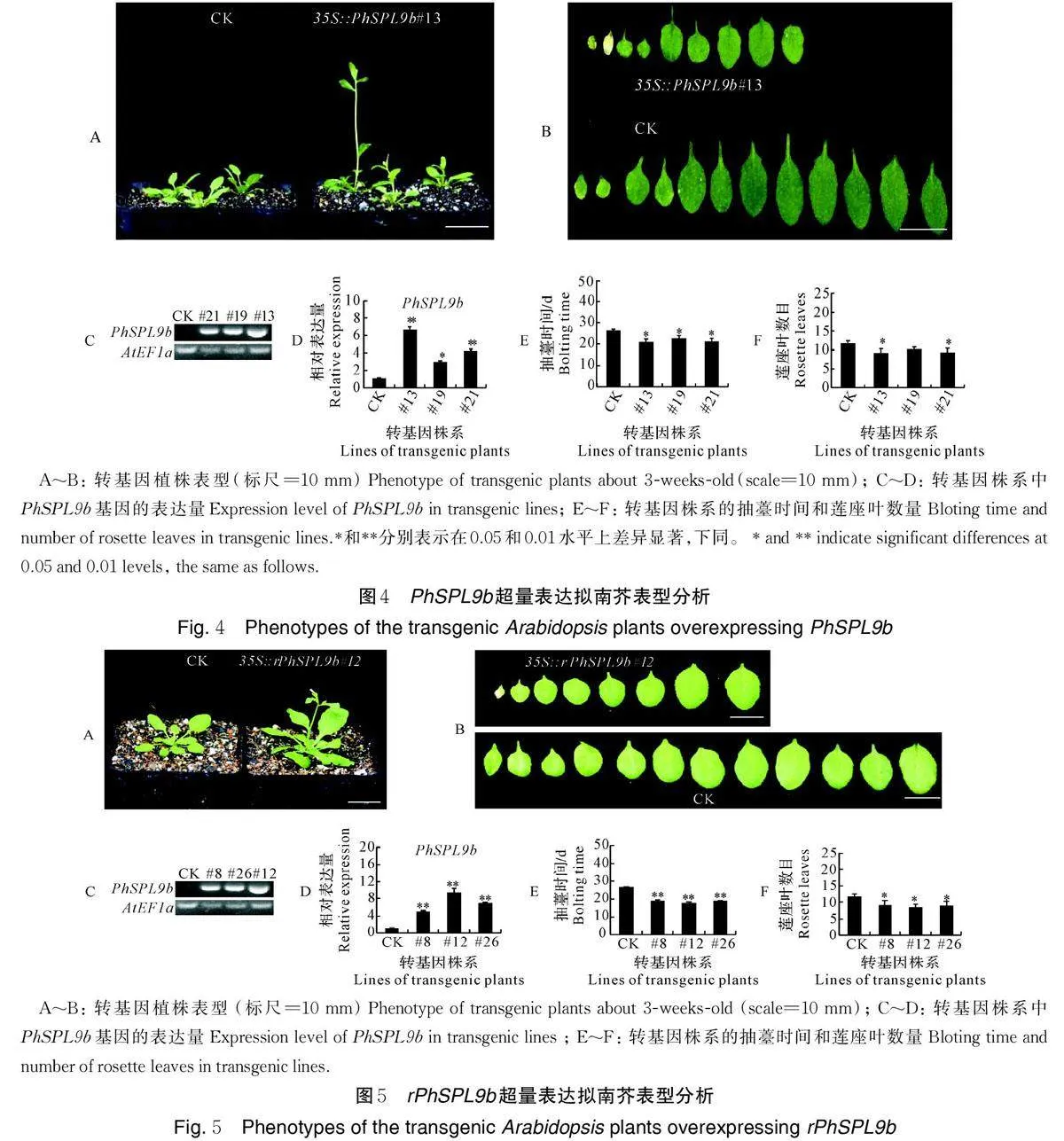
根据矮牵牛基因组和转录组数据鉴定的PhSPLs 基因[19],设计并合成特异引物,以矮牵牛不同组织部位的混样cDNA 为模板,用高保真酶扩增并克隆PhSPL9b基因。PCR反应条件为98 ℃ 2 min;32~35 循环:98 ℃ 10 s,55~60 ℃ 15 s,72 ℃ 1 min;总延伸72 ℃ 10 min,保温4 ℃ 10 min。测序无误后,使用Sal Ⅰ 和BamH Ⅰ 分别双酶切含有PhSPL9b 的pMD18-T 和植物表达载体pCAMBIA2300,用T4DNA 连接酶将目的基因连接到植物表达载体,构建35S∶∶PhSPL9b 表达载体。同时,利用重叠延伸PCR 法将PhSPL9b 的miR156/157 靶位点进行点突变,由GGTGCTCTCTCTCTTCTGTCA 突变成GGAGCGCTATCACTGCTTTCC,构建35S∶∶rPhSPL9b 表达载体,具体操作和PCR 反应条件同上。
以35S∶∶PhSPL9b 质粒为模板,设计并合成含EcoR Ⅰ 和BamH Ⅰ 酶切位点的特异引物克隆PhSPL9b基因。测序无误后,使用EcoRⅠ和BamHⅠ分别双酶切含有PhSPL9b 的pMD18-T 与酵母表达载体pGADT7 和pGBKT7,用T4 DNA 连接酶将双酶切后的表达载体与目的基因连接,构建pGADT7-PhSPL9b 和pGBKT7-PhSPL9b 表达载体。
所有构建的质粒都通过PCR 检测筛选及双酶切进行验证。所用引物见表1。
1.3 遗传转化及转基因植株的鉴定
将PhSPL9b 和rPhSPL9b 基因表达载体质粒分别电转化至GV3101 和AGL0 农杆菌,通过花序侵染法和叶盘转化法分别转化拟南芥和矮牵牛,最终获得转基因植株,具体操作方法参照Zhou 等[19-20]。获得转化株系后,利用2×CTAB 法提取转化植株叶片DNA,用特异引物35S-F 和PhSPL9b-R(short)进行PCR 检测,筛选转基因阳性株系。
1.4 转基因植株表型鉴定
在拟南芥转基因株系中,根据转基因植株的表型,每个载体各选择3 个符合3∶1 分离比的T2代转基因株系,将其后代在长日照植物光照培养箱中培养。当植株抽薹1 cm 高时,统计分析每个株系35 株转基因植株(T3代)的表型,如开花时间、莲座叶数目和茎生叶数目。
在矮牵牛转基因株系中,每个载体各选择3 株表达量不同的T0代转基因植株,将其后代在长日照条件下种植。经PCR 鉴定后,每个转基因株系各统计25 株转基因植株(T1 代)的表型,如开花时间、植株高度、叶片长宽比、叶片节间距、花朵直径和分枝数。
1.5 转基因植株PhSPL9b基因表达量分析
在拟南芥中,选取同一时期CK(空载pCAMBIA2300转化Col-0)未开花时的幼苗和T3代35S∶∶PhSPL9b 和35S∶∶rPhSPL9b 抽薹的转基因植株;在矮牵牛中,选取同一时期CK 未开花时的顶芽和T2代35S∶∶PhSPL9b 已分化出花序的顶芽,分别通过RT-PCR 和qRT-PCR 检测PhSPL9b 在不同转基因株系中的表达情况。每个株系3 个生物学重复。qRT-PCR 的反应体系为10 μL:1 μL 稀释10 倍的反转录产物(cDNA),5.0 μL 2×SYBR Mixture,0.2 μL上游特异引物和0.2 μL 下游特异引物(10 μmol/L),0.2 μL ROX,3.4 μL ddH2O。反应程序为:95 ℃预变性2 min,95 ℃变性5 s,55 ℃退火34 s,40 次循环,以拟南芥AtEF1α 和矮牵牛PhEF1α 作为内参基因[21]。
1.6 矮牵牛PhSPL9b 转录激活特性分析
将pGBKT7-PhSPL9b 和pGADT7、pGADT7-PhSPL9b 和pGBKT7、pGBKT7-53 和pGADT7-T(阳性对照)及pGBKT7-Lam 和pGADT7-T(阴性对照)组合分别转化酵母菌株AH109,经SD/−Trp/−Leu 筛选及阳性检测后,再在SD/−Trp/−Leu/−His/−Ade 筛选。将各组合的阳性菌落在SD/− Trp/− Leu 液体培养基中30 ℃ 220 r/min 孵育24 h,稀释后使其OD600=1,菌液经3500 r/min 室温离心4 min 后弃上清,用ddH2O 重悬菌体,吸打混匀后将菌液稀释成5 个浓度梯度,即101、100、10‒1、10‒2和10‒3,每个浓度梯度的菌液各取6 μL 点于SD/−Trp/−Leu/−His/−Ade/X- α-gal(16 ng/μL)固体培养基,30 ℃遮光倒置孵育3~5 d,检测PhSPL9b的转录激活特性。
2 结果与分析
2.1 PhSPL9b的基因结构
序列分析结果显示,PhSPL9b 基因编码区长度为1 125 bp,编码374 个氨基酸。与矮牵牛基因组数据[22]比对发现,PhSPL9b 含有3 个外显子,2 个内含子(图1)。
2.2 PhSPL9b 表达载体的构建
经PCR 扩增、测序、双酶切、连接等步骤,完成植物表达载体35S∶∶PhSPL9b 和35S∶∶rPhSPL9b、酵母表达载体pGADT7-PhSPL9b 和pGBKT7-PhSPL9b 的构建(图2A)。双酶切验证结果表明,所有载体均构建成功(图2B)。
2.3 PhSPL9b 转基因植株表型鉴定
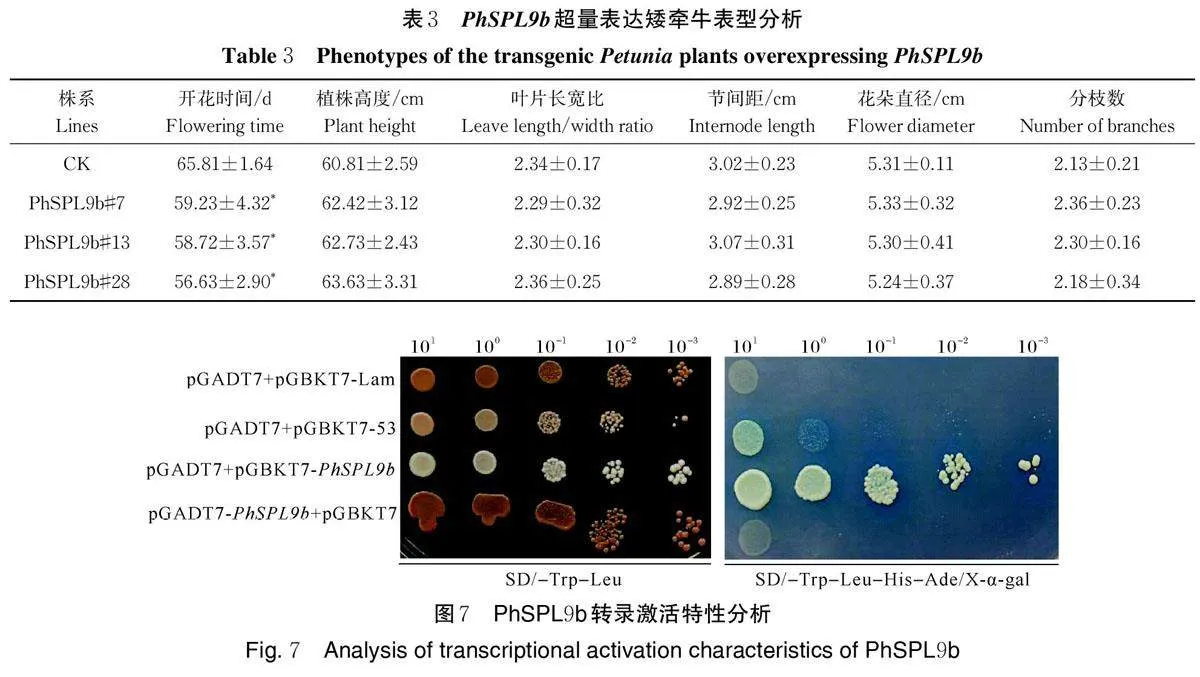
将35S∶∶PhSPL9b 和35S∶∶rPhSPL9b 载体分别电转化至农杆菌GV3101 和AGL0,通过花序侵染法转化拟南芥和叶盘法转化矮牵牛。经Kan 筛选和PCR 检测,获得42 个拟南芥35S∶∶PhSPL9b 转基因株系(图3A)和34 个矮牵牛转基因株系(图3B);获得39 个拟南芥35S∶∶rPhSPL9b 转基因株系(图3C),但未能获得矮牵牛转化株系。
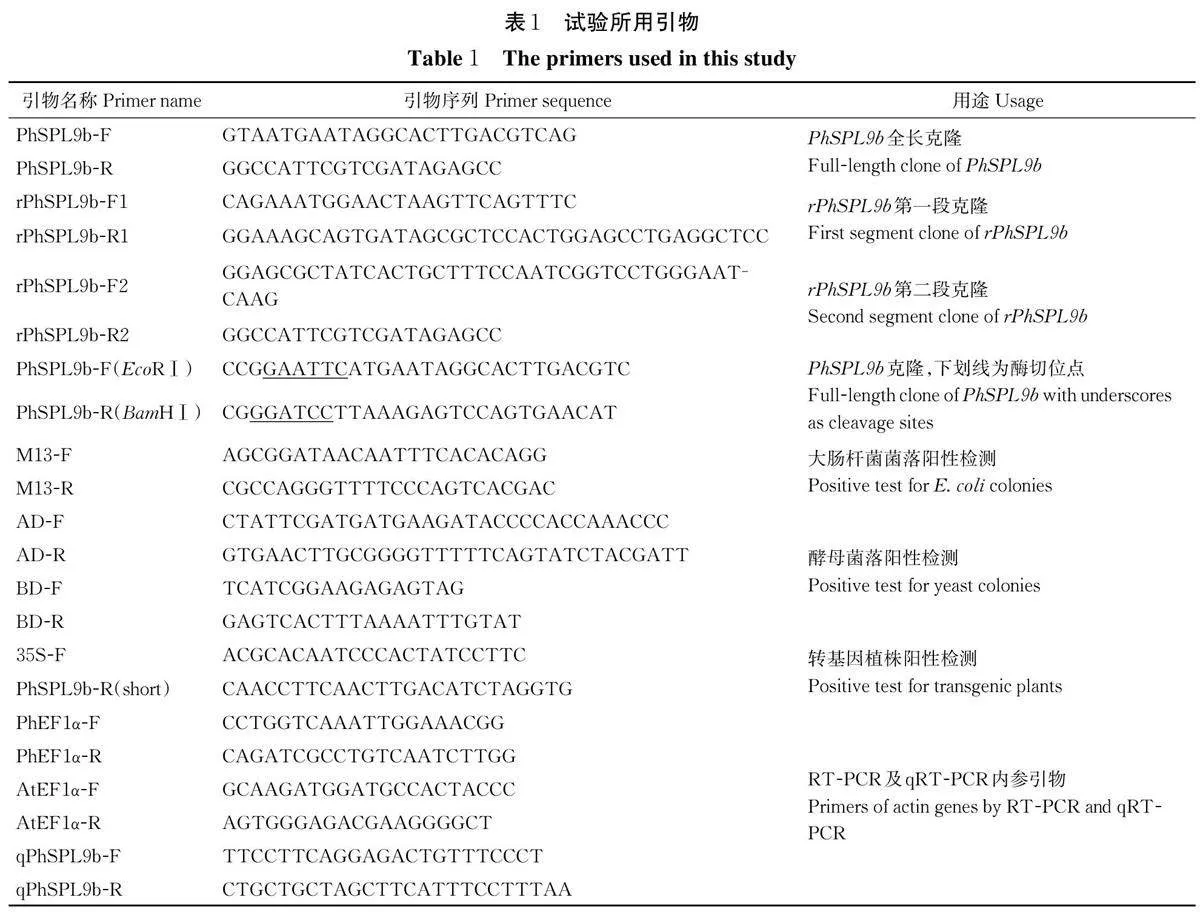
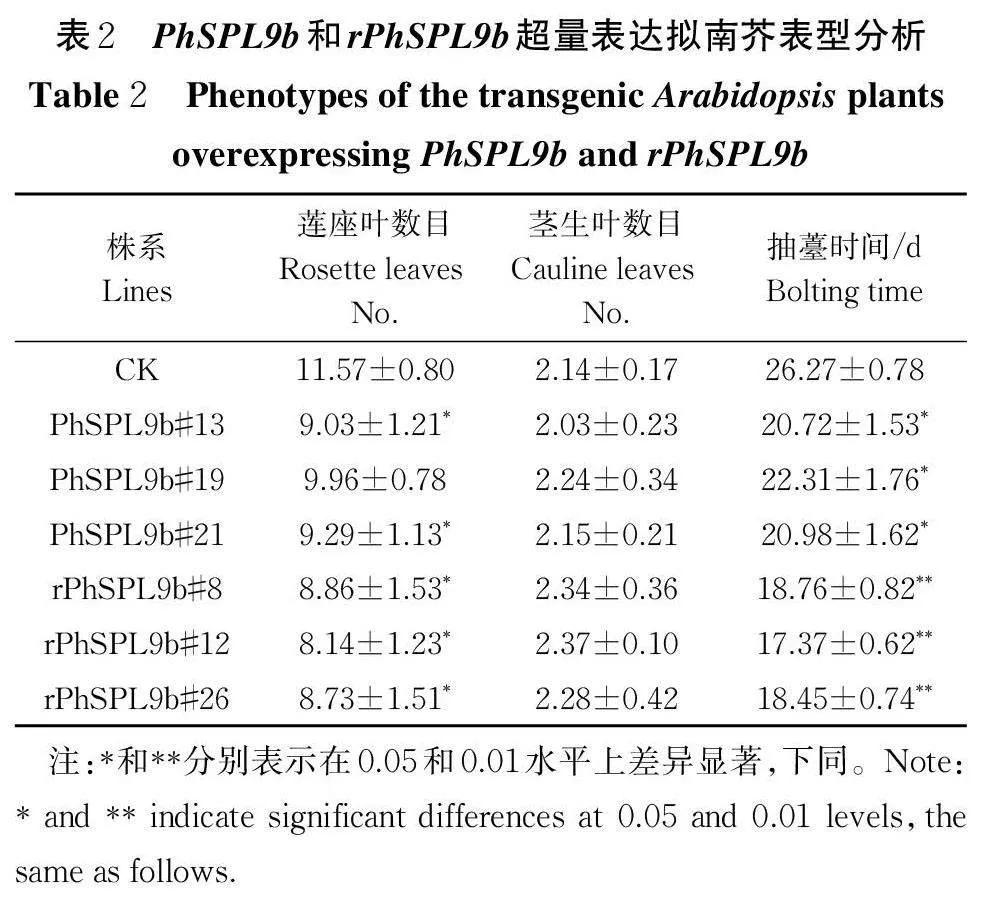
表型统计发现,在拟南芥转基因植株中,36 株35S∶∶PhSPL9b 转基因T1 代植株和29 株35S∶∶rPhSPL9b 转基因T1 代植株表现出早花表型,其中35S∶∶PhSPL9b 转基因植株的平均提前开花时间为4.9 d,35S∶∶rPhSPL9b 转基因植株的平均提前开花时间为8.1 d。如图4 和表2 所示,35S∶∶PhSPL9b 转基因株系#13、#19 和#21 株系有明显的早花表型,同时莲座叶数目显著减少,其中#13 株系开花时间提前5.6 d,#19 株系开花时间提前4.0 d,#21 株系开花时间提前5.3 d。35S∶∶rPhSPL9b 转基因株系中,#8、#12 和#26 株系有明显的早花表型,且莲座叶数目也显著减少(图5 和表2),但茎生叶数目与CK 相比无显著差异,其中#8 株系开花时间提前7.5 d,#12 株系开花时间提前8.9 d,#26 株系开花时间提前7.8 d。RT-PCR 和qRT-PCR 结果显示,与CK 相比,拟南芥转基因株系中PhSPL9b 的表达量均被上调,且表达量越高,早花表型越明显。由此可见,PhSPL9b和rPhSPL9b 超量表达后,均可促进拟南芥开花,且35S∶∶ rPhSPL9b 转基因株系的表型比35S∶∶PhSPL9b 转基因株系更明显。
在矮牵牛转基因植株中,27 株T0 代35S∶∶PhSPL9b 转基因植株的开花时间较CK 提前,开花时间平均提前7.6 d。如图6 和表3 所示,转基因株系#7、#13 和#28 有明显的早花表型,但株高、叶片长宽比、分枝数、叶片节间距和花朵直径与CK 均没有显著性差异。其中#28 株系早花表型最显著,开花时间提前9.2 d,#7 株系开花时间提前6.6 d,#13 株系开花时间提前7.1 d。RT-PCR 和qRT-PCR 结果显示,PhSPL9b 的表达量在转基因植株中显著高于CK(图6)。
2.4 矮牵牛PhSPL9b 的转录激活特性分析
将质粒组合pGBKT7-PhSPL9b+pGADT7、pGADT7-PhSPL9b+pGBKT7、pGBKT7-53+pGADT7-T ( 阳性对照) 及pGBKT7-Lam+pGADT7-T(阴性对照)分别转化到酵母菌株AH109,结果发现,阳性对照pGBKT7-53+pGADT7-T 和pGBKT7-PhSPL9b+pGADT7 共转后的酵母单菌落在SD/―Trp/―Leu 和SD/―Trp/―Leu/―His/―Ade 上正常生长,并在SD/―Trp/―Leu/―His/―Ade/X-α-gal 上发生显色反应(蓝色),而pGADT7-PhSPL9b+pGBKT7 和pGBKT7-Lam+pGADT7-T(阴性对照)共转后的酵母单菌落在SD/―Trp/―Leu 上正常生长,但在SD/―Trp/―Leu/―His/―Ade 不能正常生长,也不能在SD/―Trp/―Leu/―His/―Ade/X-α-gal 上发生显色反应(图7)。因此,推断PhSPL9b 是一个转录激活子,可通过激活下游基因的表达而发挥其功能。
3 讨论
开花是观赏植物的重要性状,决定着观赏植物的品质和经济价值[23],研究开花基因在植物中的功能,并应用到实际育种中,具有重要的现实意义。SPL 是植物特异的转录因子家族,在高等植物成花转换及生长发育过程中扮演着重要角色。近年来,关于SPL 基因功能的研究在模式植物如拟南芥、水稻和番茄中成果颇丰,但在矮牵牛中关于SPL 功能的研究相对较少。在拟南芥、水稻和番茄等植物中研究发现,SPL 基因家族成员根据其系统进化关系均分为8 个亚家族[6, 24]。笔者所在课题组前期研究发现,矮牵牛SPL 基因家族成员也被分为8 个亚家族,且同一亚家族成员具有相似的基因结构[19],推测同一亚家族成员中矮牵牛PhSPLs 和拟南芥AtSPLs可能具有相似的功能;同时,课题组研究发现miR156/157 靶向部分PhSPLs 调控矮牵牛和拟南芥开花[19-20],但具体是通过靶向哪个或者哪些PhSPLs基因调控开花尚不明确。
本研究构建35S∶∶PhSPL9b 和35S∶∶rPhSPL9b超量表达载体并转化矮牵牛和拟南芥,结果显示PhSPL9b 和rPhSPL9b 超量表达拟南芥后,转基因植株的开花时间显著提前,莲座叶数目减少;35S∶∶PhSPL9b 矮牵牛转基因植株的开花时间与对照相比也显著提前,这表明PhSPL9b 对开花时间具有重要的调控作用。Xu 等[6]研究发现,AtSPL9 和AtSPL15在拟南芥中超量表达后,促使拟南芥提前开花。在本研究中,PhSPL9b 也促进拟南芥和矮牵牛开花,这表明其功能具有保守性。本研究未获得矮牵牛35S∶∶rPhSPL9 转基因植株,表明矮牵牛中不同基因的转化效率不同,而转化效率和目标基因有关的报道在其他植物中也较常见,如李姝璇[25]发现不同基因在大豆中的转化效率有显著差异。
基因表达分析研究结果表明,转基因植株的表达量和表型强弱密切相关,且rPhSPL9b 作用更显著。Xu 等[6]研究发现将AtSPL9 对应的miR156/157的靶位点突变后,miR156/157 不能准确地与rAt⁃SPL9 靶位点进行互补配对,从而不能识别该靶位点,无法进行AtSPL9 转录产物的切割,最终导致At⁃SPL9 表达量剧增,显著性地促进拟南芥开花[6],因此推测,PhSPL9b 靶位点突变后,miR156/157 不能对其转录本进行切割,导致PhSPL9b 表达量剧增,最终显著性地促进拟南芥开花。
转录因子能发挥有效调控的必要前提是具有转录活性[26]。本研究通过转录激活试验分析发现PhSPL9b 是一个转录激活子,同时PhSPL9b 在矮牵牛和拟南芥中超量表达均表现出早花表型,这表明PhSPL9b 可能是通过转录激活下游基因而调控矮牵牛和拟南芥开花。但PhSPL9b 是如何调控拟南芥和矮牵牛开花的?其下游靶基因是什么?这些相关的分子调控机制还有待进一步研究。
(责任编辑:葛晓霞)
——矮牵牛

