玉米ZmEREB46基因调控耐渍性功能探究


关键词 玉米; 渍水胁迫; 乙烯响应因子; ZmEREB46; 转基因拟南芥
中图分类号 S513.103.4 文献标识码 A 文章编号 1000-2421(2024)03-0139-09
我国玉米产区主要集中在东北和华北,降水时期多在玉米苗期到开花期,此阶段玉米对涝渍胁迫最为敏感,极易造成生长发育受阻,影响后期产量形成,每年因暴雨和洪水造成大面积涝渍灾害,产量和经济损失巨大。因此,鉴定和发掘玉米渍水胁迫抗性基因,探究其生物学功能及其在涝渍胁迫中的分子机制,对玉米分子育种具有重要意义。
玉米、小麦、大麦、大豆、棉花等旱地作物常面临着渍水带胁迫[1]。植物为适应土壤环境的改变,增强在逆境条件下的生存能力,在自身形态学和细胞学水平上会发生适应性改变;同时通过代谢途径的改变来降低涝渍引发的缺氧、渗透胁迫、光合气体扩散受阻、微生物有毒物质累积等方面带来的损害[2]。植物可以通过形成径向氧屏障、通气组织、不定根以及茎或枝条的伸长、叶片表面形成气膜等方式适应低氧环境。
AP2/ERF 家族相关蛋白依据AP2 domain 的数量和结构分为3 个亚类: APETALA2(2 个AP2 域)、RAV(与abscisic acid insensitive 3/ Viviparous 1,ABI 3/VPI 相关)和ERF(ethylene-responsive factor)[3]。ERF 亚家族成员能与顺式作用元件GCCbox(AGCCGCC)或脱水响应元件(DRE, A/GCCGAC)结合对下游基因的表达进行调控[4]。拟南芥ERF 成员RAP2.2 和RAP2.12 还可与5'-AAACCA(G/C)(G/C)(G/C)GC-3'缺氧响应启动子元件(hypoxia-responsive promoter element, HRPE)相结合,启动缺氧响应基因(hypoxia-responsive genes,HRGs)的表达[5]。
Xu 等[6]利用水稻耐淹系IR40931-26 和不耐淹系PI543851,在第9 号染色体定位到耐淹QTL,命名为Submergence-1(Sub1)。该位点有3 个基因簇,都是类乙烯响应因子,分别被命名为Sub1A、Sub1B 和Sub1C,其中Sub1B 和Sub1C 广泛存在于常规自交系中,而Sub1A 仅在部分自交系中存在。SUB1A 有2种单倍型,分别为SUB1A-1、SUB1A-2,只有SUB1A-1 能提高水稻的耐渍性[7], SUB1A-1 通过多种途径调控淹水胁迫。不同亚家族的ERF 转录因子在SUB1A-1 介导的调控网络中也发挥着不同的作用[8]。Hattori 等[9]利用非深水水稻品种Taichung65(T65)和深水水稻品种C9285 作为亲本进行QTL定位,通过图位克隆方法获得SNORKEL1 和SNORKEL2 基因,它们在淹水胁迫下诱导水稻叶片和节间长度增加,调控深水稻在淹水胁迫下的逃逸策略。水稻中OsEBP89 负调控水稻种子在淹没胁迫下的发芽能力,该基因的表达会抑制脯氨酸的积累,并降低ROS 的清除能力[10]。水稻OsEREBP1 基因参与茉莉酸和脱落酸信号传导途径,其超表达植株在受到淹水胁迫后,与耐淹相关的PR 基因、转录因子、ADH 等基因表达显著上调,进而提高植株耐淹性[11]。六倍体小麦(Triticum aestivum L.)中TaER⁃FVII.1 在耐渍材料和渍水敏感材料中表达模式有差异,且TaERFVII.1 沉默株系受到渍水胁迫后耐渍响应基因的表达受到抑制[12]。玉米第七亚家族乙烯响应因子ZmEREB180 基因通过影响内源激素生长素和乙烯的合成调控渍水胁迫下不定根的发育,并通过调控ROS 的水平增强渍水胁迫下植株的抗性[13]。
AP2/EREBP 类家族成员是植物逆境胁迫相关的重要基因,然而玉米中参与耐渍的AP2/EREBP类基因鲜有报道。前期研究结合QTL 定位、转录组分析和生物信息学等方法在玉米5.04 bin 耐渍主效QTL 区间内,定位、鉴定了1 个关键耐渍候选基因ZmEREB46[14]。本研究通过对ZmEREB46 进行重测序及表达分析,对其功能变异位点进行鉴定,并在模式植物拟南芥中初步探索ZmEREB46 参与耐渍胁迫的功能,旨在为鉴定和发掘玉米渍水胁迫抗性基因奠定基础。
1 材料与方法
1.1 试验材料
玉米自交系A3237 与A3239 由华中农业大学玉米研究团队邱法展课题组自育,A3237 耐渍性强,A3239 涝渍敏感。
本研究所用的拟南芥(Arabidopsis thaliana L.)材料为哥伦比亚生态型(Columbia)。
1.2 质粒和菌株
拟南芥过表达载体以pC1300st 为骨架,经部分片段替换改造而成,含有潮霉素及卡那霉素抗性筛选标记基因。农杆菌转化菌株为GV3101 和玉米原生质体瞬时表达载体pM999,笔者所在实验室保存。
大肠杆菌转化感受态DH5α 以及农杆菌转化感受态EHA105 购买自上海唯地生物技术有限公司。
1.3 ZmEREB46 基因克隆
ZmEREB46 是ERF 第五亚家族基因,根据B73参考基因组序列,利用在线网站Primer3Plus(http://www. bioinformatics. nl/cgi-bin/primer3plus/primer3plus.cgi)设计引物,以B73、A3237 和A3239 的基因组DNA 以及cDNA 为模板,克隆ZmEREB46基因。
1.4 荧光素酶活性鉴定
载体构建和玉米原生质体转化步骤参照文献[15]进行。用酶标仪(TECAN,美国)测定荧光素酶F-LUC(firefly luciferase)和R-LUC(renilla luciferase)的荧光信号值,计算DF-LUC/DR-LUC 值(启动子活性)。
1.5 ZmEREB46 进化关系分析
通过NCBI 查询ZmEREB46 在各个物种中已报道的同源基因,将相应的氨基酸序列全长整理为Fasta 格式,导入MEGA-X 进化树构建软件,采用默认程序通过Clustal W 进行序列比对,用邻近法(neighbor joining, NJ)构建进化树(bootstrap 1 000 次重复)。
1.6 ZmEREB46 亚细胞定位
所用载体由CaMV 35S 组成型表达强启动子、多克隆酶切位点、绿色荧光蛋白(EGFP)、氨苄抗性核酸序列组成,共定位核Marker 基因为拟南芥中的核基因AtHY5,Marker 蛋白与红色荧光蛋白(RFP)融合。首先,构建ZmEREB46 亚细胞定位载体,基因扩增引物为PM999EREB46-F:ACTCTAGCAGATCTATCGATTCTAGAATGACAGAGA‐ATCTCCACTCCA; PM999EREB46-R:TCTTCTCCTTTGCCCATGGCTCTAGAGAT ‐GATGAAGCGACCTTGGT,载体检测引物:PM999-F: TCCACTGACGTAAGGGATGACGCA;PM999-R: GCATGGCGCTCTTGAAGAAGTCGT。以B73 cDNA 为模板,克隆ZmEREB46,胶回收产物。载体目的基因插入酶切位点选用XbaⅠ(TCTAGA)。同源重组试剂盒采用诺唯赞公司ClonExpressII/One Step Clone Kit。将ZmEREB46 亚细胞定位载体、核Marker 通过PEG/Ca2+介导法共转入玉米原生质体中,通过共聚焦显微镜(Leica,德国)观察荧光信号。
1.7 ZmEREB46 基因表达模式分析
玉米自交系A3237、A3239 幼苗生长到2 叶1 心(包括子叶)时进行渍水处理(水面没过玉米茎部生长点),于处理后不同时间段取根与叶组织(每5 株混样)用锡纸包裹后迅速放入液氮,提取总RNA,采用诺唯赞公司试剂盒HiScript Ⅲ1st Strand cDNA SynthesisKit (+gDNA wiper)反转录,cDNA 稀释5 倍后作为模板。实时荧光定量PCR反应用酶为北京艾德莱公司生产的2×Sybr Green qPCR Mix,所用引物GM46-Qpcr-F:CAATCCAAAGAAGCAGCACA,GM46-Qpcr-R:GTGGGACTTCTCAGGGTCAA;ZmActin-F: AATGACGCAGATTATGTTTGAAAC,ZmActin-R: TGTGAGGATCTTCATTAGGTGGT。
1.8 载体构建及农杆菌转化
设计带pC1300st 载体同源臂的引物,以B73 cDNA为模板,扩增目的基因ZmEREB46。胶回收后获得带有同源臂的目的片段。酶切载体质粒,获得线性化pC1300st 载体,将目的基因与载体同源重组,以pC1300st-F/R 为引物,通过菌落PCR 鉴定检测携带目的基因的阳性克隆,通过测序验证目的基因序列正确性后提取质粒。通过电转法转入GV3101 农杆菌感受态中,阳性农杆菌菌液与50% 灭菌甘油体积比1∶1 混合,-80 ℃保存菌种。
1.9 花序侵染法转化拟南芥
通过拟南芥花序侵染的方法[16],将ZmEREB46在拟南芥中异位超量表达,获得T0代超表达种子。
1.10 拟南芥超表达材料筛选及鉴定
取适量拟南芥种子于离心管内,用75% 乙醇消毒1 min,用10% 次氯酸钠表面消毒3 次,用灭菌水清洗5 次。将消毒后的种子均匀地涂抹在潮霉素抗性1/2 MS 培养皿(MS 2.215 g/L、30 g/L 蔗糖、10 g 琼脂粉、NaOH 调pH 到5.6~5.8)上,于超净台风干,覆盖后用封口膜封口,培养室放置10 d 初步筛选出阳性苗。挑选阳性苗转移到1/2 无抗MS 培养皿上培养2~3 d,移栽,盖膜培养2 d 后揭膜,注意保持土壤湿润。待植株抽薹后,取适量叶片提取RNA,用引物扩增目的基因,根据条带亮度的强弱初步判断基因的表达水平。
1.11 转基因拟南芥淹水表型鉴定
1)材料种植。将营养土与蛭石以质量比2∶1 混合后加水至土壤湿润(捏后出水不滴落),在10 cm×10 cm 方盆里均匀洒落几十颗种子盖膜培养,3~4 d出苗后揭膜,培养10 d 左右,将幼苗移栽到7 cm×7 cm 方盆中,每盆4 株,移苗后盆外浇水盖膜保持土表湿润,1 d 后揭膜。每周浇水2 次,施1 次速溶复合肥,移栽后约20 d 植株达到处理要求。
2)淹水处理。种植2 个超表达材料OE1、OE2,加水淹没植株(水面距离植株10 cm),置于23 ℃培养箱暗培养。
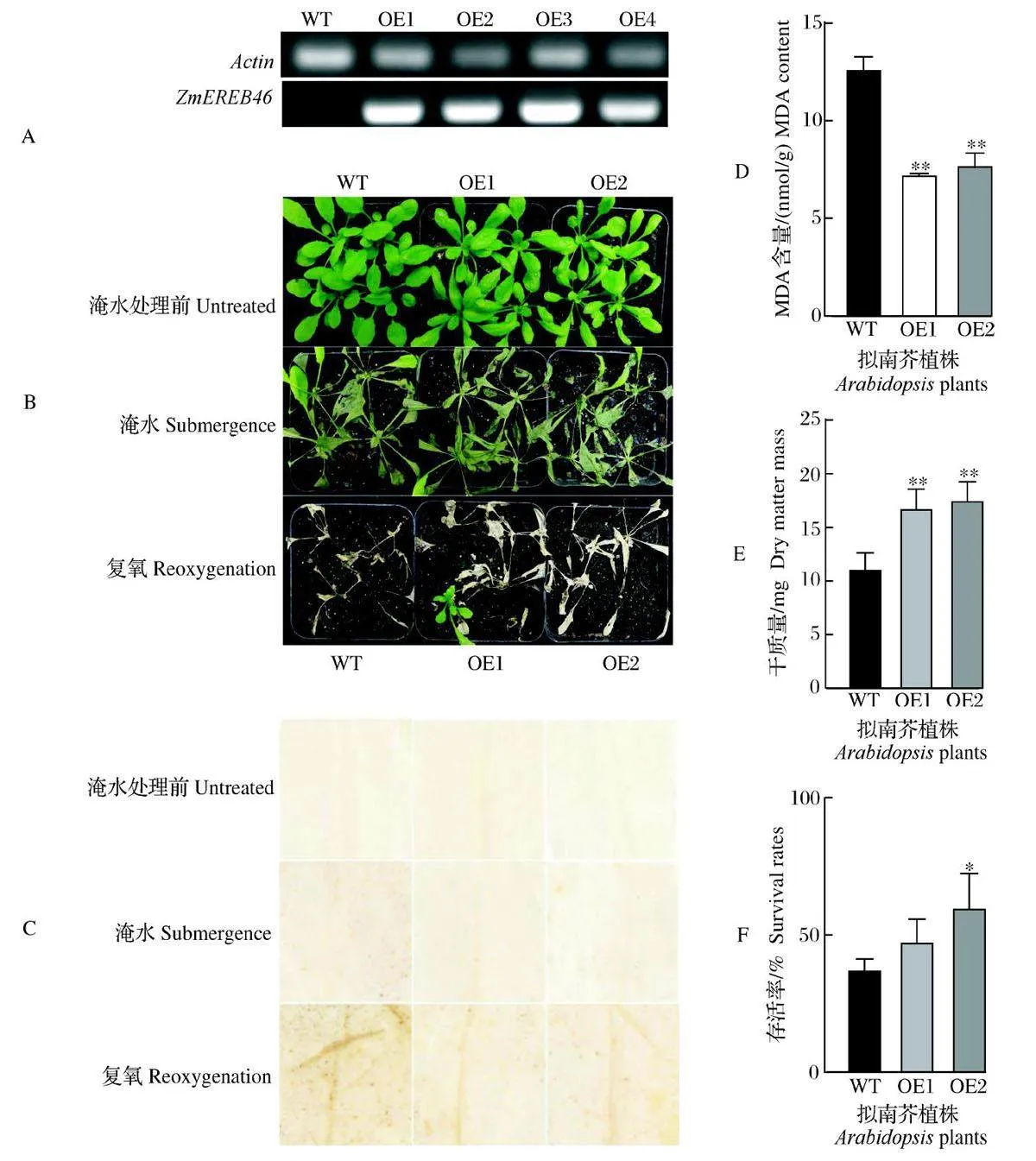
3)存活率统计。将淹水处理48 h 后的盆栽取出,置于23 ℃恒温光照培养室复氧培养,10 d 后统计植株存活情况,长出新叶即算植株存活。
4)拟南芥地上部莲座部分干质量测定。将淹水处理48 h 后的拟南芥取出,完整取下地上部分莲座部分,清洗干净叶片上附着的泥土,用吸水纸吸干水分,用硫酸纸袋包裹,放于65 ℃烘箱烘干24 h 后,测定拟南芥地上部莲座部分干质量。
5)DAB 染色。DAB 染色液质量浓度为1 mg/mL,pH 调至3.8,在配好的DAB 染色液中加入0.5 μL/mL 吐温20。取新鲜处理后的叶片放入染色液中浸没,在黑暗环境下静置5~10 h,使染色充分。将叶片转移到无水乙醇中煮沸脱色,脱色后的叶片为棕黄色,通过颜色深浅和染色面积判断H2O2含量。
6)MDA 含量的测定。参照文献[16]进行。
2 结果与分析
2.1 ZmEREB46 基因结构和启动子顺式元件分析
以玉米自交系B73 的基因组DNA 及cDNA 为模板,克隆ZmEREB46 的基因组序列。结果显示,基因序列全长为1 087 bp,编码区序列长度642 bp,含有2个外显子和1 个内含子。进一步利用高世代玉米重组自交系A3237 和A3239 对ZmEREB46 进行重测序,结果显示,在基因编码区(起始密码子下游556 bp处)存在1 个SNP 位点变异(G/A),导致第186 位氨基酸由丙氨酸(A3239)变为苏氨酸(A3237);同时,ZmEREB46 在A3239 中起始密码子上游2 kb 的位置相对于A3237 中存在1 个911 bp 的大片段插入(图1A)。
对ZmEREB46 启动子2 kb 序列进行顺式调控元件分析,结果显示,基因启动子序列含有厌氧响应元件(ARE、GC-motif、G-box)、干旱响应元件(MBS)以及多个激素(GA、ABA、MeJA、IAA)相关响应元件。同时,在A3239 中ZmEREB46 启动子序列中插入部分有3 个G-box、1 个脱落酸响应元件和1 个生长素响应元件,新增2 个GA 响应元件P-box(图1B)。表明激素调节和逆境胁迫相关的顺式调控元件可能使ZmEREB46 受逆境胁迫诱导表达并参与逆境胁迫调控。
2.2 ZmEREB46在A3237和A3239中的启动子活性分析
为鉴定大片段插入对ZmEREB46 表达的影响,分别克隆了2 个自交系A3237 与A3239 中ZmEREB46 的启动子片段,构建了由花椰菜花叶病毒的最小启动子(mpCaMV)驱动的LUC 表达载体,并比较LUC 在玉米叶肉原生质体中的活性(图 2A)。
结果显示,A3237 中ZmEREB46 启动子活性约为A3239 中活性的2.5 倍(图2 B)。推测ZmEREB46启动子区域911 bp 片段的变异可能是导致ZmEREB46 在A3237 和A3239 中表达差异的主要原因。
2.3 ZmEREB46 进化关系分析
进化树分析结果(图3)显示,ZmEREB46 与水稻OsWR1 基因同源性最高,OsWR1 能通过调节水稻叶片蜡质合成来增强抗旱性[17]。推测ZmEREB46可能通过调控植物叶片蜡质合成参与渍水抗性。
2.4 ZmEREB46 亚细胞定位
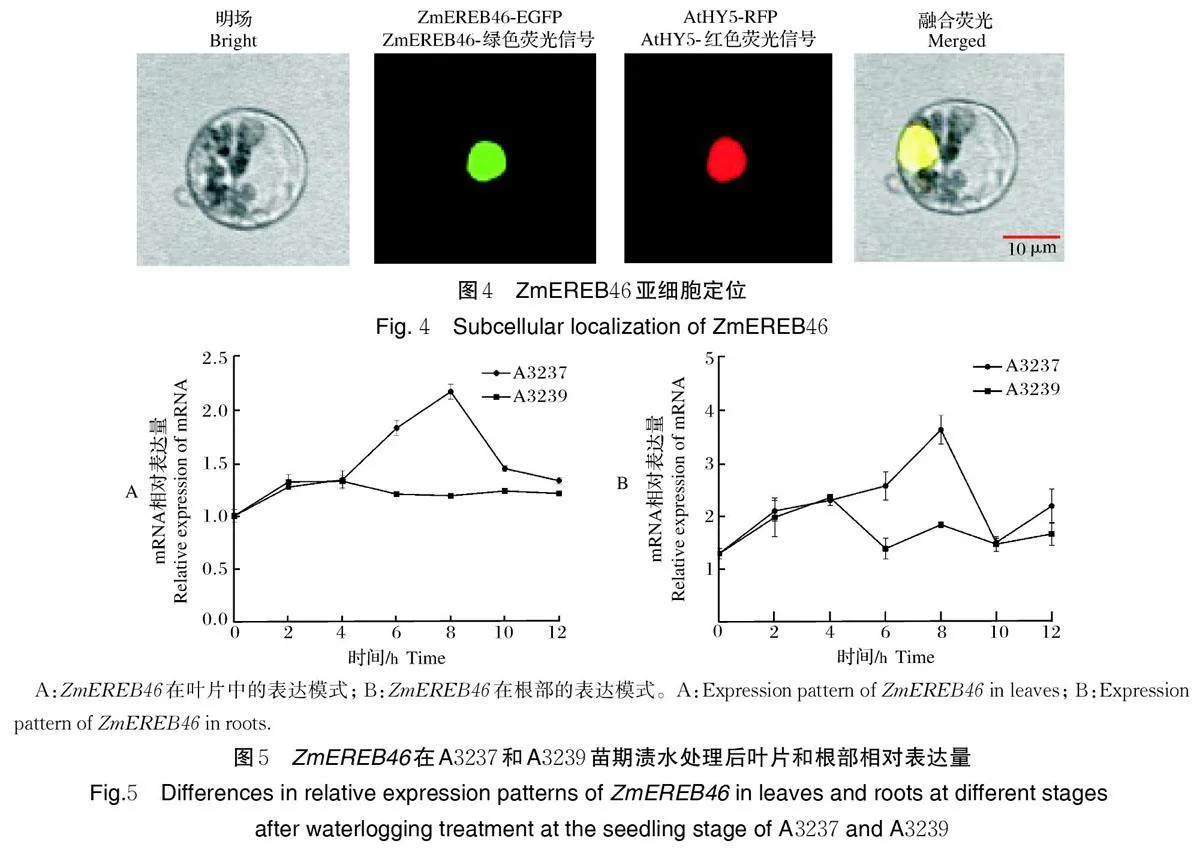
将ZmEREB46 报告载体35S ∷ ZmEREB46-EGFP(ZmEREB46-EGFP)和连有细胞核marker基因AtHY5 的报告载体35S ∷ AtHY5-RFP(AtHY5-RFP)转化到玉米原生质体中共表达,在共聚焦显微镜下观察,绿光荧光和红光荧光共定位于细胞核,表明ZmEREB46 蛋白定位在细胞核中(图4)。
2.5 ZmEREB46 苗期渍水表达模式分析
利用qRT-PCR 对ZmEREB46 在A3237、A3239苗期渍水处理0、2、4、6、8、10、12 h 后叶片和根系中的表达量进行分析(图5)。结果显示,渍水处理0、2、4 h 后,ZmEREB46 在A3237 和A3239 中表达水平无明显差异;渍水处理6 h 后,ZmEREB46 在A3237 根和叶中表达量迅速上升,在8 h 表达量达到峰值,是同一时期A3239 中表达量的2 倍,渍水处理4~12 h期间ZmEREB46 在A3239 中表达量无显著变化。ZmEREB46 的表达差异可能是造成A3237 和A3239苗期耐渍性差异的原因。
2.6 ZmEREB46 拟南芥超表达材料创制及功能分析
对ZmEREB46 超表达材料经过2 代筛选获得的纯合阳性植株((图6A)进行淹水表型实验。结果显示,在正常生长条件下,与野生型(WT)植株相比,超表达ZmEREB46 的拟南芥植株在苗期生长状态没有显著差异(图6B),进一步将培养20~ 22 d 的拟南芥野生型及超表达植株在黑暗条件下淹水处理,对淹水0、24 h以及处理24 h后复氧6 h植株取叶片进行DAB染色处理,通过脱色后超表达植株叶片颜色深浅判断H2O2 含量。ZmEREB46 超量表达植株在淹水处理24 h 后叶片H2O2 含量显著低于WT(野生型);复氧6 h 后ZmEREB46 OE 植株叶片H2O2 含量显著低于WT(图6C)。淹水处理24 h 后,ZmEREB46 超表达植株淹水处理24 h后莲座叶中MDA 含量都显著低于WT(图6D)。淹水处理48 h 后复氧培养10 d,ZmEREB46 超表达植株的干质量及存活率均显著高于WT(图6E、F),表明ZmEREB46 基因能在一定程度上提高转基因拟南芥的耐淹性。
3讨论
ZmEREB46 具有典型的AP2/EREBP 结构域,属于AP2/EREBP 类基因家族。AP2/EREBP 类基因家族是植物逆境胁迫相关的重要基因。玉米中,ZmEREB180 除了能促进植株不定根的生成外,还能通过增强植株抗氧化剂的生成来提高玉米渍水胁迫下的生存能力[13]。水稻中,E3 泛素连接酶OsHOS1靶向OsEREBP1 和OsEREBP2 进行降解,从而影响植物根部的生长[18]。OsERF60/OsEBP89 敲除植株在受到干旱胁迫后ROS 清除能力显著提升,该基因被证实是水稻抗旱性负向调控基因[10]。与OsEBP89 相反,OsERF62 可通过提高植株ROS 的清除能力来提高水稻的抗旱性[19]。OsERF67 和OsERF66 能提高水稻耐淹性,它们的表达受基因SUB1A 的调控[20]。ZmEREB46 在拟南芥异位表达表现出的耐渍性特征暗示它作为AP2/EREBP 类家族基因参与植物渍水胁迫抗性。同时,超表达ZmEREB46 拟南芥植株正常生长状态下的叶片较野生型呈现叶片表面光亮、表面凹凸不平、叶片向下卷曲等表型,这与水稻耐淹相关基因SUB1A 和SUB1C 的拟南芥超表达植株叶片表型相似[21]。ZmEREB46 的同源基因在番茄[22]、小麦[23]、大麦[24]、胡杨[25]、黄瓜[26]中均有报道,与蜡质以及脂质合成相关,对植物的抗旱性、气孔发育、次生壁形成、果皮成分有影响。研究表明蜡质能提高植物叶片疏水性,提高植株在水下的光合作用能力,从而增强植株耐淹性[27]。表明超表达ZmEREB46 拟南芥植株叶片表型可能是叶片蜡质成分或蜡质分布的改变引起,ZmEREB46 转录因子可能通过调控下游蜡质合成基因的表达影响植株耐渍性。
在转录因子的启动子序列中,包含有多种不同类型的顺式作用元件,针对转录因子的启动子序列进行分析,对阐明其分子作用机制具有重要意义。玉米中,作为ERF 家族成员的ZmERF5 被鉴定为一个受到渍水胁迫诱导的基因,在耐渍自交系HZ32 以及渍水敏感自交系Mo17 中对其启动子进行测序分析,发现其启动子序列中含有多个厌氧响应顺式元件和激素响应元件[28]。玉米锌指蛋白基因zmzf 作为涝渍胁迫响应基因,其启动子序列在渍水敏感自交系Mo17 中含有多个顺式作用元件,包括2 个GCmotif、5 个厌氧响应顺式元件(AREs)、1 个GT-motif和4 个G-box 元件,表现出对厌氧条件的响应[29]。在耐渍自交系HZ32 中,zmzf 启动子有195 bp 的片段缺失,导致其缺失3 个AREs,在淹水胁迫的条件下不能启动zmzf 基因的表达[29]。在植物中,AREs、GC-motif、GT-motif 以及G-box 等是参与厌氧胁迫反应的重要顺式作用元件,其中AREs 是玉米adh 基因厌氧表达所必需的调控元件[30]。ZmEREB46 基因启动子具有丰富的顺式作用元件,包括与厌氧胁迫响应相关的ARE、GC-motif、MYB、G-Box 和W-Box 等元件,还有赤霉素、生长素、脱落酸等激素响应元件,它们的存在暗示着ZmEREB46 基因可能参与多种激素调控的渍水响应途径并发挥重要作用。
转座因子(transposable element, TEs)是基因组DNA 序列中的可移动因子。转座子在植物的适应性进化和表型变异中发挥重要作用,包括产生等位基因多样性、诱导结构变异和调控基因表达[31-32]。Vgt1 是位于开花时间抑制因子ZmRap2.7上游约70kb处的1 个顺式调控元件,1 个微型反向重复TE(MITE)的插入与玉米开花时间的变化表现出高度相关性[33]。在玉米驯化基因tb1 的上游插入1 个逆转录转座子增加了玉米的顶端优势[34-35]。本研究中,ZmEREB46 在A3237中起始密码子上游2 kb 的位置相对于A3239 中存在1 个911bp的插入,对这段序列进行分析,发现是gypsy 类反转录转座子(gypsy-type LTR retrotransposon)。由于ZmEREB46 在A3237、A3239 中第186 位氨基酸的改变并不在重要的功能域上,并且A3237中ZmEREB46启动子活性约为A3239 中ZmEREB46 启动子活性的2.5倍,推测ZmEREB46 在A3237 和A3239中启动子区域911bp 的差异可能是导致基因表达差异进而影响A3237和A3239 耐渍差异的原因。在后续研究中,针对该插入位点设计特异性引物有望作为玉米耐渍性遗传改良的重要功能标记。
(责任编辑:张志钰)

