配施荧光假单胞菌对采煤区复垦土壤化学及生物学特性的影响



摘要:为探讨无机肥、有机肥配施荧光假单胞菌对采煤区复垦土壤化学生物学特性的影响,以复垦5 a 的土壤为研究对象,设置单施无机肥(CF)、荧光假单胞菌剂配施无机肥(CFB)、单施有机肥(M)、荧光假单胞菌剂配施有机肥(MB)、不施肥(CK)共5 个处理。结果表明,MB 处理较M 处理有机质、碱解氮、有效磷、微生物量碳氮含量显著增加了5.57%~21.30%,碱性磷酸酶、脲酶、转化酶活性显著增加了15.44%~18.68%;而CFB 处理较CF 处理仅碱解氮含量、脲酶活性分别显著增加了4.77%、12.62%,表明荧光假单胞菌可以在一定程度上提高复垦土壤化学生物指标。复垦土壤的优势菌门为放线菌门、变形菌门、绿弯菌门、芽单胞菌门、拟杆菌门,优势菌属为节杆菌属、芽生球菌属、KD4-96、芽单胞菌属、鞘氨醇单胞菌属、类诺卡氏菌属、Vicinamibacterales、Vicinamibactera⁃ceae、JG30-KF-CM45。施加荧光假单胞菌对复垦土壤细菌多样性指数和优势菌门、菌属组成无显著影响,但可在一定程度上改变细菌属水平相对丰度。冗余分析结果表明,有机质、碱解氮对复垦土壤细菌群落的影响程度较高,脲酶、碱性磷酸酶、转化酶对复垦土壤细菌群落的影响程度较低。主成分分析表明,与M 处理相比,MB 处理的综合得分增加了2.92;与CF 处理相比,CFB 处理的综合得分增加了1.82。综上,荧光假单胞菌的施用有利于采煤复垦区土壤的熟化,且荧光假单胞菌与有机肥配施效果优于荧光假单胞菌与无机肥配施。
关键词:荧光假单胞菌;采煤复垦区;土壤化学特性;土壤生物学特性
中图分类号:TD88 文献标识码:A 文章编号:1002‒2481(2024)04‒0001‒08
我国作为世界上最大的煤炭生产国和消费国,截至2020 年底,煤炭资源查明储量为1.73 万亿t,占世界储量的13.3%,预计2024 年全国煤炭产量将维持在47.0 亿t 左右[1-2]。由于大量的煤炭开采对农田造成了严重的损毁,仅山西一省因采煤而损毁的农田面积就超过10 万hm2。在对这些农田复垦过程中由于施工工艺等原因,造成了复垦土壤养分流失、孔隙比例失调,微生物数量锐减等[3-4]。
目前,我国主要采取施用有机肥、无机肥的方式来熟化采煤复垦区土壤,对有机肥、无机肥施用下复垦土壤物理、化学特性的变化规律已进行了较为详尽的研究[5-6],但对包括细菌群落在内的土壤生物学特性研究较少。细菌作为土壤微生物的重要组成部分,直接参与了土壤生态系统的物质循环和能量流动,在维持和改善土壤肥力等方面发挥着至关重要的作用[7]。因此,土壤生物学特性亦是采煤区复垦成功与否的关键指标。由于有机肥、无机肥缺少微生物等生物活体物质,导致物质能量转化缓慢,复垦土壤生物学特性恢复时间较长[8-9]。
微生物复垦技术不仅可以利用微生物的接种优势活化土壤养分、改良土壤生态环境等[10],而且在保证土壤化学特性快速增加的同时可加快土壤细菌群落等土壤生物学特性恢复和重建。荧光假单胞菌作为一种重要的植物根际促生细菌,具有营养需求简单、繁殖快、竞争定殖力强等特点[11]。在采煤复垦区的研究已表明,单施荧光假单胞菌可以活化土壤磷素,促进玉米生长[12]。荧光假单胞菌与硝态氮、铵态氮肥配施可以提高复垦土壤溶解性总氮、铵态氮量[13],与有机肥配施可以提高复垦土壤微生物量碳、氮含量和酶活性[14]。这些研究表明,荧光假单胞菌在采煤区复垦土壤熟化方面具有极大的应用潜力。
目前,针对荧光假单胞菌应用于复垦土壤的研究多集中在土壤化学特性方面,关于其对复垦土壤细菌丰富度、多样性等生物学特性的影响以及化学生物学特性间的相互关系还未见报道。本研究以山西省屯兰煤矿填埋区复垦5 a 的土壤为对象,分析配施荧光假单胞菌对复垦土壤化学及生物学特性的影响,以揭示复垦土壤化学与生物学特性间的关系,进而为荧光假单胞菌在采煤复垦区的应用及复垦土壤的快速熟化提供理论依据和技术支撑。
1 材料和方法
1.1 试验地概况
试验地位于山西省古交市以南6 km 的屯兰煤矿废弃物(风化煤、煤泥、煤矸石)填埋区,属于暖温带半湿润大陆性季风气候。年平均气温9.50 ℃,年平均降水量475.00 mm。2012 年煤矿废弃物堆置填埋完成后,取附近山体土壤覆盖煤矿废弃物,覆土类型为石灰性褐土,覆土厚度约1.00 m。同时采用混匀、翻耕等方式,使试验地土壤具有相似的化学性质:pH 值为8.53,有机质含量为3.45 g/kg,全氮含量为0.19 g/kg,全磷含量为0.25 g/kg,全钾含量为11.97 g/kg,碱解氮含量为9.58 mg/kg,有效磷含量为2.51 mg/kg,速效钾含量为55.46 mg/kg。本次试验于2016 年开始。
1.2 供试材料
供试作物为玉米(大丰30)。供试菌种为2 株于2014 年分离自山西省农田土壤的荧光假单胞菌(P. fluorescens),编号为N64-1、N137-1,由北京美吉桑格生物医药科技有限公司鉴定(2015),现保存于山西农业大学资源环境学院微生物实验室。经检测,N64-1、N137-1 均具有固氮解磷能力(固氮量分别为4.54、4.44 mg/L(半微量开氏法),D/d 值分别为1.39、1.57(平板溶磷圈法)),在0~40 ℃ ,pH值为6~9,呈现较好的生长态势,可利用葡萄糖、麦芽糖、乳糖、蔗糖、甘露醇等多种碳源,且2 株菌间无拮抗作用。将2 株菌分别接种至LB 液体培养基,在28 ℃条件下,150 r/min 摇床培养至活菌数为1.0×108 cfu/mL,然后等体积混合制成荧光假单胞菌剂。供试肥料为尿素(N 46%)、过磷酸钙(P2O516%)、氯化钾(K2O 60%)、腐熟鸡粪(N 1.45%、P2O5 1.14%、K2O 0.85%)。
1.3 试验设计
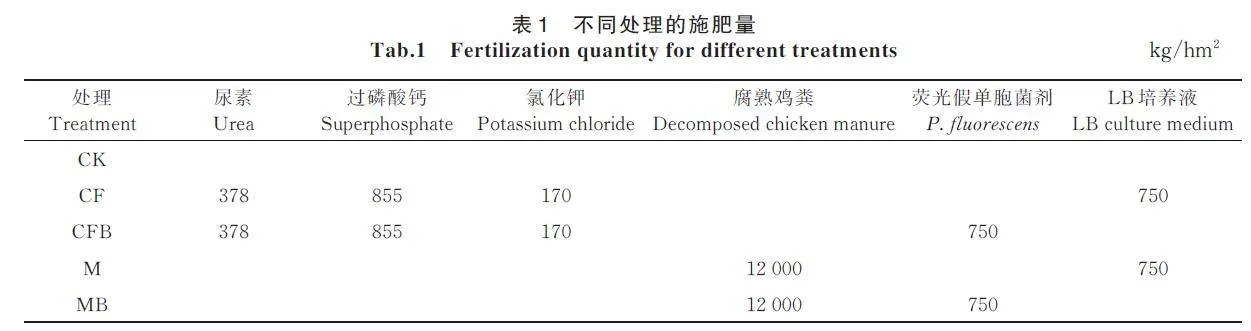
以等量施肥为原则(约周边正常农田施肥量的1.5 倍),共设5 个处理:单施无机肥(CF)、荧光假单胞菌剂配施无机肥(CFB)、单施有机肥(M)、荧光假单胞菌剂配施有机肥(MB)、不施肥(CK)。每个处理重复3 次,小区面积为100 m2。各施肥处理均在播种前一天,将肥料以旋耕播撒方式作为底肥一次性施入,施肥量如表1 所示。玉米拔节期除草1 次,玉米生育期均未进行灌溉。播种密度为6.0 万株/hm2。
1.4 样品采集及指标测定
土壤样品于2020 年玉米收获后采集,为试验第5 年土壤样品。按照农化分析样品的要求进行采集,采样深度0~20 cm,将土壤样品分为3 份。一份4 ℃保存,用于测定土壤微生物量碳氮(采样后12 h 完成),一份-80 ℃保存,用于高通量测序,一份经风干后,研磨过1.00 mm 筛,用于其余土壤化学特性和生物学特性测定。
土壤pH 值采用电极法(水∶土=2.5∶1)测定,有机质(SOM)采用重铬酸钾容量法(外加热)测定,碱解氮(AN)采用碱解扩散法测定,有效磷(AP)采用0.5 mol/L 碳酸氢钠法测定,速效钾(AK)采用醋酸铵浸提-火焰光度法测定[15],微生物量碳(MBC)、微生物量氮(MBN)含量采用氯仿熏蒸-浸提法测定[16],过氧化氢酶(Catalase)活性采用容量法测定,脲酶(Urease)活性采用苯酚-次氯酸钠比色法测定,碱性磷酸酶(Phosphatase)活性采用磷酸苯二钠比色法测定,转化酶(Invertase)活性采用3,5-二硝基水杨酸比色法测定[17]。
土壤DNA 提取及高通量测序。称取0.25 g 土壤样本,按照Power soil DNA isolation kit(MoBioLaboratories,USA)试剂盒说明,提取土壤总DNA,并采用Nano Drop ND-2000(Thermo Fisher Scientific,USA)微量分光光度仪定量并检测纯度。提取的DNA 存储于-80 ℃ 冰箱,用于后续的高通量测序分析。16S V3+V4 区PCR 扩增正向引物为341F:5'-CCTACGGGNBGCASCAG-3',反向引物为806R:5'-GACTACNVGGGTATCTAATCC-3'。PCR反应体系总体积为25 μL。PCR 反应条件:94 ℃预变性2 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,共30 个循环;最后72 ℃延伸5 min。产物利用1% 琼脂糖凝胶电泳检测。将PCR 的凝胶电泳产物委托广州基迪奥生物科技有限公司使用Illumina MiSeq 测序平台测序。
1.5 数据处理
采用SPSS 25.0 软件进行数据统计分析,采用Origin 2021 处理数据并制图,单因素方差分析检验处理间差异,差异性显著水平为Plt;0.05。数据均为3 次重复后的平均值,表中数据为平均值±标准差。
2 结果与分析
2.1 荧光假单胞菌对复垦土壤化学特性的影响
不同施肥处理下复垦土壤化学特性分析结果如表2 所示。从表2 可以看出,有机质、碱解氮、有效磷含量最高的施肥处理均为MB 处理,且MB 处理与CF、CFB、M 处理相比差异达显著水平(Plt;0.05)。M 处理速效钾含量最高,但只与CF、CFB 处理差异达显著水平(Plt;0.05)。各施肥处理的pH 值相似。CFB处理与CF 处理相比仅碱解氮含量显著增加了4.75%(Plt;0.05)。MB 处理与M 处理相比,有机质、碱解氮、有效磷含量分别显著增加了7.82%、14.29%、15.91%(Plt;0.05)。
2.2 荧光假单胞菌对复垦土壤生物学特性的影响
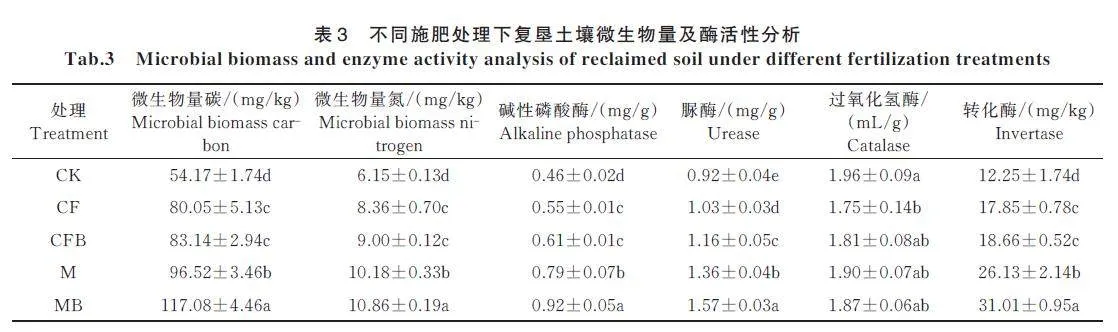
2.2.1 荧光假单胞菌对复垦土壤微生物量及酶活性的影响
由表3可知,MB 处理与CF、CFB、M 处理相比,微生物量碳含量分别显著增加了46.26%、40.82% 和21.30%,微生物量氮含量分别显著增加了29.90%、20.67% 和6.68%,碱性磷酸酶活性分别显著增加了67.27%、50.82% 和16.46%,脲酶活性分别显著增加了52.43%、35.34% 和15.44%,转化酶活性分别显著增加了73.73%、66.18% 和18.68%(Plt;0.05)。各施肥处理间的过氧化氢酶活性无显著差异。CFB 处理与CF 处理相比,仅脲酶活性显著增加了12.62%(Plt;0.05)。
2.2.2 荧光假单胞菌对土壤细菌群落的影响
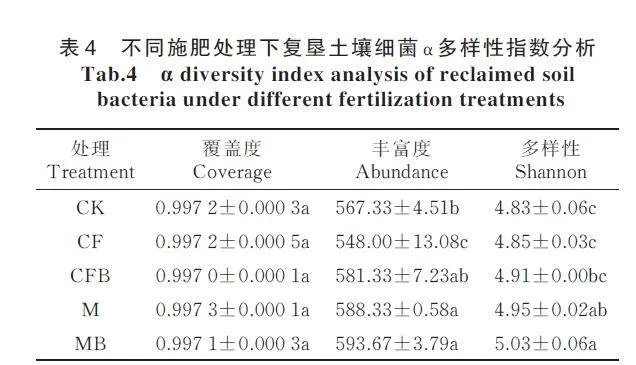
从表4 可以看出,土壤样品的覆盖度均高于99.70%,且各处理间覆盖度无显著性差异,表明测序深度可以满足分析要求。土壤细菌丰富度指数大小表现为MBgt;Mgt;CFBgt;CKgt;CF,其中,CF 处理较CK显著降低了3.53%(Plt;0.05);MB、M、CFB 处理较CK 增加了2.47%~4.64%,且MB、M 处理与CK 相比差异达显著水平(Plt;0.05)。多样性指数的大小顺序为MBgt;Mgt;CFBgt;CFgt;CK,其中,MB、M 处理较CK 多样性指数分别显著增加了4.14%、2.48%。CFB 处理与CF 处理相比,多样性指数无显著性差异。MB 处理的丰富度指数、多样性指数与M 处理相比均未达显著性水平。
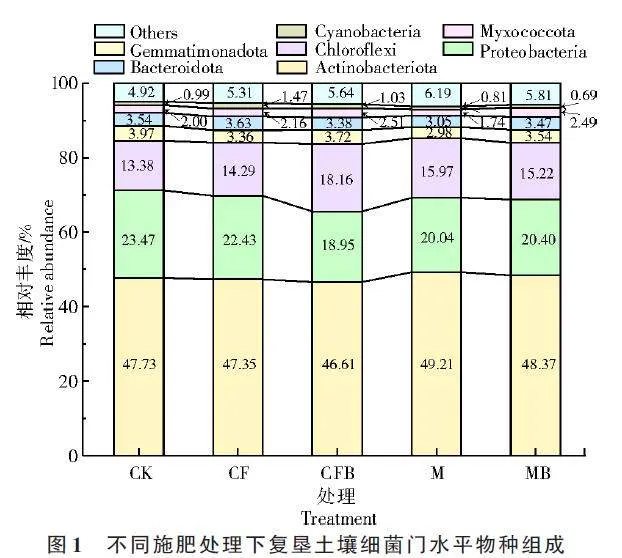
由图1 可知,复垦土壤的优势菌门均为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadota)和拟杆菌门(Bacteroidota)(相对丰度≥3%),占比超过总细菌群落的90.82%。CFB 处理较CF处理放线菌门、变形菌门、拟杆菌门相对丰度分别降低了0.74%、3.48%、0.25%,绿弯菌门、芽单胞菌门分别增加了3.87%、0.36%。MB 处理与M 处理相比,放线菌门、绿弯菌门相对丰度分别降低了0.85%、0.75%,变形菌门、芽单胞菌门、拟杆菌门相对丰度分别增加了0.36%、0.56%、0.42%。
如图2 所示,在属水平上,节杆菌属(Arthro⁃bacter)、芽生球菌属(Blastococcus)、KD4-96、芽单胞菌属(Gemmatimonadaceae)、鞘氨醇单胞菌属(Sphingomonas)、类诺卡氏菌属(Nocardioides)、Vicinamibacterales、Vicinamibacteraceae、JG30-KFCM45为优势菌属(相对丰度≥2%)。从聚类分析发现,CF、M 处理聚为一簇,CFB、MB 处理聚为一簇,CK 处理单独为一簇。
2.3 复垦土壤特性因子与细菌群落的关系
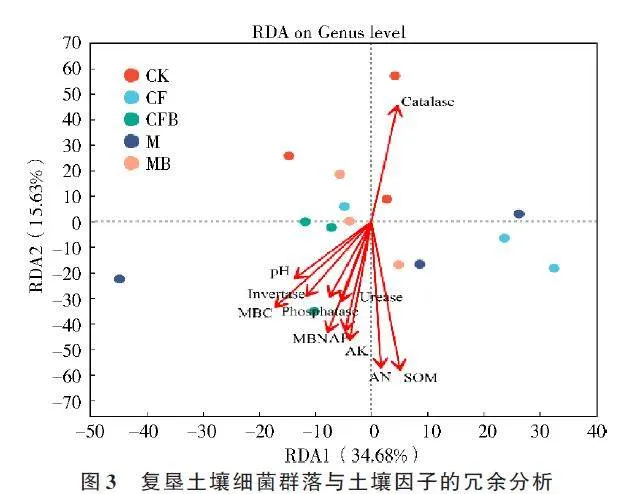
对复垦土壤特性因子与细菌群落进行RDA 分析,结果如图3所示,RDA1解释总变异量的34.68%,RDA2 解释总变异量的15.63%,二者共同解释了细菌群落变异量的50.31%。在属水平上,有机质、碱解氮对细菌群落的影响程度较高,pH 值、脲酶、碱性磷酸酶、转化酶对细菌群落的影响程度较低。
2.4 复垦土壤化学及生物学特性的主成分分析
为进一步直观了解荧光假单胞菌对复垦土壤化学及生物学特性的影响,对土壤有机质等因子进行主成分分析。根据特征值gt;1,提取出2 个主成分。第1 主成分(PC1)的特征值为8.74,方差贡献率为79.49%,第2 主成分(PC2)的特征值为1.60,方差贡献率为14.57%,二者共解释了方差变量94.06% 的变异,可以代表系统内的所有信息。施肥处理及CK 在2 个主成分上的得分如图4 所示,各处理的综合得分大小依次为MBgt;Mgt;CFBgt;CFgt;CK。其中,MB 处理综合得分较M 处理提高了1.78,CFB 处理综合得分较CF 处理提高了0.50,表明荧光假单胞菌与有机肥配施对复垦土壤特性的影响高于荧光假单胞菌与无机肥配施。
3 结论与讨论
荧光假单胞菌作为一种重要的植物根系促生菌,已被证明,其在农业生产、复垦土壤熟化方面具有巨大的应用潜力。与大多数微生物菌剂类似,以荧光假单胞菌菌种制成的菌剂也存在稳定性差的缺点,尤其是养分贫瘠的复垦土壤环境更不利于其生存[18],因此,本研究采用荧光假单胞菌与无机肥、有机肥结合施用的方式[19-20],增加其在复垦土壤中的定殖时间,用以保持肥效的稳定。研究结果表明,各施肥处理较不施肥处理显著提高了复垦土壤的有机质、碱解氮、有效磷、速效钾、微生物量碳氮含量及碱性磷酸酶、脲酶、转化酶活性,其中荧光假单胞菌与有机肥配施效果最佳,这与大多数研究结果一致[21]。本研究还发现,复垦土壤pH 值、过氧化氢酶活性并无显著变化,这是由于荧光假单胞菌配施的无机肥、有机肥均呈碱性,无机肥、有机肥中含有的OH-会与荧光假单胞菌等土壤微生物分泌的有机酸以及呼吸产生的CO2 在土壤溶液中溶解形成的H+发生酸碱中和反应[22];过氧化氢酶的辅基则是遭到了无机肥、有机肥中阴离子的封阻[23]。这与袁玲等[24]的研究结果相一致。不同处理在2 个主成分上的综合得分结果进一步表明,荧光假单胞菌与有机肥配施对复垦土壤熟化的效果优于荧光假单胞菌与无机肥配施。这是由于无机肥仅能为荧光假单胞菌提供氮源、碳源及少量无机盐,而有机肥可以通过增加土壤有机胶体,把土壤颗粒胶结起来使其变成稳定的团粒结构,提高了复垦土壤保肥能力[25],持续不断提供荧光假单胞菌生长所需的碳源、氮源、无机盐、生长因子等营养要素,使复垦土壤中微生物数量有了显著提高,改善了土壤微生物区系,增强了土壤生物和生化活性,直接增加了微生物量和酶的分泌[23]。同时荧光假单胞菌生长繁殖又促进了有机养分的释放,形成良性循环,从而加速了复垦土壤的熟化。
已有研究表明,矿区经过煤炭资源开采等严重扰动后,细菌群落多样性呈现降低的趋势[26],但随着外源微生物肥料的加入提高了土壤养分含量、微生物代谢功能和利用碳源的能力,以及复垦年限增加导致的土壤微生物生存环境不断改善,致使土壤细菌的多样性、丰富度呈现提高的趋势。本研究结果还表明,复垦土壤的优势菌门均为放线菌门、变形菌门、绿弯菌门、芽单胞菌门和拟杆菌门。这是由于放线菌门等具有相当大的生理、形态和代谢多样性,能够在恶劣的环境条件下生存,是复垦土壤中数量最多、代谢多样性最丰富的细菌门[27]。其中,绿弯菌门含有绿色色素,与作物地上部生物量呈显著正相关关系[28],荧光假单胞菌可以通过影响作物生长来促进绿弯菌门繁殖和生长。芽单胞菌门因其具有特殊的生理结构,可以适应复垦土壤恶劣环境,是典型的旱地优势菌门[29]。但作为农田土壤中的第二大细菌类群的酸杆菌门,因其主要生存在酸性土壤环境中[30],而本试验土壤呈碱性,因此使酸杆菌门丧失了在复垦土壤中优势菌门的地位。相较于菌门水平,荧光假单胞菌对细菌种群分布的影响更突出地表现在属水平上。本研究聚类分析发现,CF、M 处理聚为一簇,CFB、MB 处理聚为一簇,荧光假单胞菌的施用使Vicinamibacterales、Vicinamibacteraceae、JG30-KF-CM45 的相对丰度增加。孟会生等[31]研究结果表明,微生物菌肥与有机肥配施会使对土壤熟化有利的诺卡氏菌属等细菌群落明显增加,因此,推测Vicinamibacterales、Vicinamibacteraceae、JG30-KF-CM45 中是含有某些有利于土壤熟化的细菌,但其正确性还需进一步研究验证。土壤细菌作为地表下数量巨大的生命形式,广泛参与了土壤氧化、硝化、氨化等土壤发生发育全过程,土壤又反作用于其活性、群落结构和功能状态[32]。本研究结果表明,土壤化学特性指标对细菌群落的影响程度高于土壤生物学特性指标。这是由于有机质、碱解氮等通过提供养分的方式,直接提高了土壤细菌的数量、活性[33],而脲酶、碱性磷酸酶等主要取决于土壤微生物的数量、活性。张洋等[34]研究发现,养分含量贫瘠的土壤具有相似的生物细菌群落,该结论也印证了土壤化学特性是影响细菌群落的重要因子[35]。
不同施肥处理对复垦土壤化学及生物学特性的影响由强到弱依次为荧光假单胞菌配施有机肥gt;单施有机肥gt;荧光假单胞菌配施无机肥施gt;单施化肥。其中,荧光假单胞菌配施有机肥较其他施肥处理土壤有机质、碱解氮、有效磷含量显著增加了7.82%~52.41%,微生物量碳氮含量显著增加了6.68%~46.26%,碱性磷酸酶、脲酶、转化酶活性显著提高了15.44%~73.73%。配施荧光假单胞菌对复垦土壤细菌多样性指数无显著影响,在菌门水平上,各处理优势菌门均为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadota)和拟杆菌门(Bacteroidota)(相对丰度≥3%)。在菌属水平上,荧光假单胞菌可以改变土壤细菌的聚类结果。相较于菌门水平,荧光假单胞菌对细菌种群分布的影响更突出地表现在菌属水平上。有机质、碱解氮等土壤化学特性对细菌群落的影响程度明显高于脲酶、碱性磷酸酶、转化酶等土壤生物学特性。
参考文献:
[1] WANG G F,LI S J,ZHANG J H,et al. Ensuring the safety ofcoal industry to lay the cornerstone of energy security[J]. ChinaCoal,2022,48(7):1-9.
[2] 戴宝华,王德亮,曹勇,等. 2023 年中国能源行业回顾及2024年展望[J]. 当代石油石化,2024,32(1):1-7.
DAI B H,WANG D L,CAO Y,et al. China's energy industry:2023 review and 2024 prospect[J] Petroleum amp; PetrochemicalToday,2024,32(1):1-7.
[3] JING Z R,WANG J M,ZHU Y C,et al. Effects of land subsidenceresulted from coal mining on soil nutrient distributions in a loess area of China[J]. Journal of Cleaner Production,2018,177:350-361.
[4] 尚锦,刘慧颢,刘赛赛,等. 煤矸石充填复垦耕地重金属污染风险研判[J]. 河南农业科学,2023,52(12):69-76.
SHANG J,LIU H H,LIU S S,et al. Risk assessment of heavymetal pollution in reclaimed farmland with coal gangue filling[J].Journal of Henan Agricultural Sciences,2023,52(12):69-76.
[5] 谢钧宇,张慧芳,罗云琪,等. 连续7 年施有机肥和化肥提高复垦土壤上玉米产量的驱动因子[J/OL]. 农业工程学报,1-11[2024-05-16]. http://kns.cnki.net/kcms/detail/11.2047.S.20240126.1904.036.html.
XIE J Y,ZHANG H F,LUO Y Q,et al. Driving factors of improvingmaize yields in the reclaimed soils by seven years of appliedorganic manure and chemical fertilizer[J/OL]. Transactionsof the Chinese Society of Agricultural Engineering,1-11[2024-05-16]. http://kns.cnki.net/kcms/detail/11.2047.S.20240126.1904.036.html.
[6] 王怡宁,郝鲜俊,高文俊,等. 有机肥对矿区复垦土壤团聚体活性有机碳含量的影响[J]. 山西农业科学,2023,51(11):1299-1306.
WANG Y N,HAO X J,GAO W J,et al. Effect of organic fertilizeron the active organic carbon of soil agglomerates in reclaimedmine sites[J]. Journal of Shanxi Agricultural Sciences,2023,51(11):1299-1306.
[7] 梁晓霞. 芦芽山亚高山草甸土壤微生物群落特征及其驱动因子研究[D]. 太原:山西大学,2023.
LIANG X X. Study on characteristics and driving factors of soilmicrobial community in subalpine meadows of Luya mountain[D]. Taiyuan:Shanxi University,2023.
[8] 奚振邦,王寓群,杨佩珍. 中国现代农业发展中的有机肥问题[J]. 中国农业科学,2004,(12):1874-1878.
XI Z B,WANG Y Q,YANG P Z. The issue on organic manurein developing modern agriculture in China[J]. Scientia AgriculturaSinica,2004,(12):1874-1878.
[9] 李建华. 长期施肥下采煤塌陷区复垦土壤有机碳及微生物特性研究[D]. 太原:山西大学,2020.
LI J H. Study on soil organic carbon and microbial characteristicsof reclaimed coal mining subsidence area under long-termfertilization[D]. Taiyuan:Shanxi University,2020.
[10] 孟瑶,徐凤花,孟庆有,等. 中国微生物肥料研究及应用进展[J]. 中国农学通报,2008,(6):276-283.
MENG Y,XU F H,MENG Q Y,et al. Current application statusand prospect of microbiological fertilizer in China[J]. ChineseAgricultural Science Bulletin,2008,(6):276-283.
[11] 金杰人,鲁凯珩,肖明. 荧光假单胞菌的应用与展望[J]. 上海师范大学学报(自然科学版),2019,48(5):526-535.
JIN J R,LU K H,XIAO M. Application and prospect of Pseu⁃domonas fluorescens[J]. Journal of Shanghai Normal University(Natural Sciences),2019,48(5):526-535.
[12] 王向英,武欣,张杰,等. 解磷菌在复垦土壤中的定殖及促生效果研究[J]. 东北农业大学学报,2021,52(7):40-47.
WANG X Y,WU X,ZHANG J,et al. Colonization ofphosphate-solubilizing bacteria in reclaimed soil and the growthpromoting effects on maize[J]. Journal of Northeast AgriculturalUniversity,2021,52(7):40-47.
[13] 王帅兵,孟会生,武欣,等. 不同形态氮肥配施固氮菌对复垦土壤酶活性及氮素形态的影响[J]. 灌溉排水学报,2022,41(11):45-49,77.
WANG S B,MENG H S,WU X,et al. Efficacy of nitrogenfixingbacteria combined with different nitrogen fertilizers in im ‐proving enzymatic activity and nitrogen in reclaimed soil[J].Journal of Irrigation and Drainage,2022,41(11):45-49,77.
[14] 焦金铖,安晓虎,王妍茏,等. 不同有机腐熟物与荧光假单胞菌配施对复垦土壤氮素形态和酶活性的影响[J]. 南京农业大学学报,2024,47(2):298-305.
JIAO J C,AN X H,WANG Y L,et al. Effect of different organicrotten materials and Pseudomonas fluorescens applicationon nitrogen morphology and enzyme activities of reclaimed soil[J]. Journal of Nanjing Agricultural University,2024,47(2):298-305.
[15] 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.BAO S D. Soil agrochemical analysis[M]. Beijing:China AgriculturalPress,2000.
[16] 许光辉,郑洪元. 土壤微生物分析方法手册[M]. 北京:农业出版社,1986.
XU G H,ZHENG H Y. Analyzing methods manual of soil microorganism[M]. Beijing:Agricultural Publishing Press,1986.
[17] 关松荫. 土壤酶及其研究法[M]. 北京:中国农业出版社.1986.GUAN S Y. Soil enzyme and its research methods[M]. Beijing:China Agricultural Press,1986.
[18] 梁利宝,许剑敏,张小红. 菌肥与有机无机肥配施对北方石灰性土壤物理性质的影响[J]. 灌溉排水学报,2014,33(6):105-108.
LIANG L B,XU J M,ZHANG X H. Effect of microbial fertilizerand organic chemical fertilizer on physical properties of calcareouscinnamon soil in north of China[J]. Journal of Irrigationand Drainage,2014,33(6):105-108.
[19] ZHOU L X,LIU W,DUAN H J,et al. Improved effects ofcombined application of nitrogen-fixing bacteria Azotobacterbeijerinckii and microalgae Chlorella pyrenoidosa on wheatgrowth and saline-alkali soil quality[J]. Chemosphere,2023,313,137409.
[20] WANG K N,HOU J J,ZHANG S D,et al. Preparation of anew biochar-based microbial fertilizer:nutrient release patternsand synergistic mechanisms to improve soil fertility[J]. Scienceof The Total Environment,2023,860,160478.
[21] 董泽鹏,薛世通,董琦,等. 有机无机培肥对复垦土壤肥力和水稻产量的影响[J]. 山西农业科学,2019,47(8):1366-1370.
DONG Z P,XUE S T,DONG Q,et al. Effects of organicinorganicfertilization on reclaimed soil fertility and rice yield[J]. Journal of Shanxi Agricultural Sciences,2019,47(8):1366-1370.
[22] PHILIPPOT L,CHENU C,KAPPLER A,et al. The interplaybetween microbial communities and soil properties[J]. NatureReviews Microbiology,2023,22:226-239.
[23] 秦俊梅 王改玲. 不同培肥对煤矿区复垦土壤酶活性及微生物量碳、氮的影响[J]. 水土保持学报,2014,28(6):206-210.
QIN J M,WANG G L. Influence of different fertilizers uponcarbon and nitrogen of microbial biomass and soil enzyme activityof reclaimed soil in the coal mine area[J]. Journal of Soil andWater Conservation,2014,28(6):206-210.
[24] 袁玲,杨邦俊,郑兰君,等. 长期施肥对土壤酶活性和氮磷养分的影响[J]. 植物营养与肥料学报,1997,(4):300-306.
YUAN L,YANG B J,ZHENG L J,et al. Effects of long-termfertilization on enzymatic activities and transformation of nitrogenand phosphorus in soil[J]. Plant Nutrition and Fertilizer Science,1997,(4):300-306.
[25] 孙瑞莲,赵秉强,朱鲁生,等. 长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用[J]. 植物营养与肥料学报,2003,9(4):406-410.
SUN R L,ZHAO B Q,ZHU L S,et al. Effects of long-termfertilization on soil enzyme activities and its role in adjustingcontrolling soil fertility[J]. Plant Nutrition and Fertilizer Science,2003,9(4):406-410.
[26] 李金融,侯湖平,王琛,等. 基于高通量测序的复垦土壤细菌多样性研究[J]. 环境科学与技术,2018,41(12):148-157.
LI J R,HOU H P,WANG C,et al. Soil bacteria diversity ofreclaimed soil based on high throughput sequencing[J].EnvironmentalScience amp; Technology,2018,41(12):148-157.
[27] RAMPELOTTO P H,FERREIRA A S,BARBOZA A D M,et al. Changes in diversity,abundance,and structure of soil bacterialcommunities in brazilian savanna under different land usesystems[J]. Microbial Ecology,2013,66(3):593-607.
[28] PODOSOKORSKAYA O A,KADNIKOV V V,GAVRILOVS N,et al. Characterization of Melioribacter roseus gen. nov.,sp. Nov.,a novel facultatively anaerobic thermophilic cellulolyticbacterium from the class Ignavibacteria,and a proposal ofa novel bacterial phylum Ignavibacteriae[J]. EnvironmentalMicrobiology,2013,15(6):1759-1771.
[29] 张世文,蔡慧珍,张燕海,等. 煤矿区土壤细菌群落结构及其对不同复垦模式的响应[J]. 煤炭科学技术,2024,52(2):338-349.
ZHANG S W,CAI H Z,ZHANG Y H,et al. Soil bacterialcommunity structure and its response to different reclamationmodes in coal mining area[J]. Coal Science and Technology,2024,52(2):338-349.
[30] WANG Y,LIU Z Y,HAO X Y,et al. Biodiversity of the beneficialsoil-borne fungi steered by Trichoderma-amended biofertilizersstimulates plant production[J]. Biofilms and Microbiomes,2023,9,46.
[31] 孟会生,洪坚平,杨毅,等. 配施磷细菌肥对复垦土壤细菌多样性及磷有效性的影响[J]. 应用生态学报,2016,27(9):3016-3022.
MENG H S,HONG J P,YANG Y,et al. Effect of applyingphosphorus bacteria fertilizer on bacterial diversity and phosphorusavailability in reclaimed soil[J]. Chinese Journal of AppliedEcology,2016,27(9):3016-3022.
[32] 张清霞,吴小刚,张力群,等. 荧光假单胞菌2P24 调控基因突变体定殖能力和生防效果分析[J]. 中国生物防治,2008,24(1):40-46.
ZHANG Q X,WU X G,ZHANG L Q,et al. Analysis of colonizationand biocontrol ability of Pseudomonas fluorescens2P24 regulatory system mutants[J]. Chinese Journal of BiologicalControl,2008,24(1):40-46.
[33] 毕银丽,胡晶晶,刘京. 煤矿微生物复垦区灌木林下土壤养分的空间异质性[J]. 煤炭学报,2020,45(8):2908-2917.
BI Y L,HU J J,LIU J. Spatial heterogeneity of soil nutrientsunder shrubbery in micro-reclamation demonstration base incoal mine areas of China[J]. Journal of China Coal Society,2020,45(8):2908-2917.
[34] 张洋. 不同施肥条件下黄瓜连作土壤微生物多样性分析[D].扬州:扬州大学,2016.
ZHANG Y. Analysis of soil microbial diversity in cucumbercontinuous cropping under different fertilization conditions[D].Yangzhou:Yangzhou University,2016.
[35] 梁雪丽,梁晓霞,毛晓雅,等. 芦芽山鬼箭锦鸡儿灌丛不同深度土壤细菌群落分布格局及其影响因素[J]. 应用生态学报,2024,35(2):381-389.
LIANG X L,LIANG X X,MAO X Y,et al. Distribution patternand influencing factors of bacterial communities in differentsoil depths of Caragana jubata shurb in Luya mountain,China[J]. Chinese Journal of Applied Ecology,2024,35(2):381-389.
基金项目:国家自然科学基金重点项目(U1710255)

