紫红笛鲷幼鱼环境耐受能力研究





摘 要:为研究紫红笛鲷(Lutjanus argentimaculatus)对水温、盐度、溶解氧、氨氮和亚硝酸盐等环境因子的耐受能力,选取平均体质量(9.7±1.5)g、体长(7.3±0.3)cm的紫红笛鲷幼鱼,采用渐变式方法探索紫红笛鲷对温度、盐度及低溶解氧的耐受能力,并设置不同浓度梯度,以探究紫红笛鲷对氨氮及亚硝酸盐的半致死浓度。结果显示,紫红笛鲷适宜的水温范围为16.0~35.0 ℃,临界下限水温为13.5 ℃、临界上限水温为 40.6 ℃;当盐度在12.00~67.68时,紫红笛鲷活动正常,其极限耐受盐度为73.13±0.18;紫红笛鲷幼鱼的窒息临界点为(1.88±0.08)mg/L,DO 50为(0.60±0.03)mg/L,DO 100为(0.34±0.03)mg/L;在氨氮胁迫和亚硝酸盐胁迫下,紫红笛鲷幼鱼24、48、72、96 h的半致死浓度分别为170.30、126.62、95.05、64.90 mg/L和289.92、214.22、132.02、77.78 mg/L,氨氮安全浓度为6.49 mg/L,亚硝酸盐安全浓度为7.78 mg/L。
关键词:紫红笛鲷;环境耐受;氨氮胁迫;亚硝酸盐胁迫;温度;溶解氧;盐度
紫红笛鲷(Lutjanus argentimaculatus)隶属于鲈形目(Perciformes)、笛鲷科(Lutjanidae)、笛鲷属(Lutjanus),俗称红友、红油等,分布于印度洋、太平洋中部和西部 [1],在我国主要分布于台湾省及南部沿海城市。紫红笛鲷口味极佳,且具有生长速度快、养殖周期短、不易生病等优点,是华南地区重要的养殖品种 [2]。
鱼类的养殖环境对鱼的生存、生长发育起着至关重要的作用。其中水体温度、盐度、溶解氧、亚硝酸盐及氨氮等环境因子直接影响着鱼类的生长活动 [3-5]。当水体中亚硝酸盐浓度过高时,可影响鱼类血液运输氧的功能,严重时可致鱼死亡 [6]。而温度、盐度、溶解氧则直接影响着鱼类的生长存活。目前,已有许多关于鱼类环境影响因子的研究报道,如龙胆石斑鱼(Epinephelus lanceolatus) [7]对水温、盐度和溶解氧的耐受范围较广,适宜水温为20.0~35.0 ℃、适宜盐度为11.0~40.0;氨氮对大黄鱼(Larimichthys crocea) [8]的安全浓度为1.25 mg/L,亚硝态盐对大黄鱼的安全浓度为5.01 mg/L;澳洲鳗鲡(Anguilla australis) [9]对亚硝酸盐的耐受能力与其体质量呈正相关,其适温范围为14~29 ℃;大口黑鲈(Micropterus salmoides) [10]在受氨氮胁迫96 h时,其半致死浓度(LC 50)为63.34 mg/L。但有关环境因子对紫红笛鲷影响的研究尚未见报道。
为研究紫红笛鲷对温度、盐度、低氧、氨氮、亚硝酸盐等常见环境因子的耐受能力,探究其适宜的耐受范围,本试验采用渐变式方法探索紫红笛鲷对温度、盐度及低溶解氧的耐受能力,并设置不同浓度梯度进行了氨氮和亚硝酸盐胁迫试验,以期为紫红笛鲷的适宜养殖环境提供理论依据。
1 材料和方法
1.1 试验材料
试验鱼为中国水产科学研究院南海水产研究所深圳试验基地抗风浪网箱养殖的紫红笛鲷幼鱼,由深圳市龙岐庄实业发展有限公司提供。于2021年8月5日,将试验鱼转至室内循环水精养系统中驯养1周,待其状态稳定后,挑选大小一致、活力好且体表无伤的个体进行试验。试验用鱼平均体质量(9.7±1.5) g,体长(7.3±0.3) cm。
1.2 试验方法
本试验中,除特别标明外,水体各指标如下:水温(30.8±1.0) ℃,盐度32.5±1.0,pH为8.0±0.1,溶解氧(6.0±0.5) mg/L。试验前充分曝气12 h,试验过程中保持正常充气。所有试验均在15 cm×15 cm×40 cm(长×宽×高)的玻璃缸中进行。每个试验(梯度)均设置3个平行组和1个对照组,每缸投放试验鱼10尾。试验期间不 投饲。
1.2.1 温度胁迫
温度胁迫试验设3个平行组(A组、B组和C组),使用加热棒或冰水调温,每次升高或降低 1.0 "℃,时长间隔为0.5 h。当试验鱼出现侧翻时,恒定水温1 h,若恒温期内试验鱼恢复正常状态,则继续升高或降低水温,若恒温期内试验鱼不能恢复,即为临界水温值;之后每次升高或降低0.5 ℃,恒定0.5 h后再次进行调温。将试验鱼活动出现异常时的水温作为适宜温度临界值,当50%试验鱼出现死亡时的水温作为温度致死临界值 [11]。试验鱼活动异常表现为过度活跃、活力减弱,甚至在底部不动 [7]。对照组水温保持在( 31.0±0.5)℃。试验期间不换水。
1.2.2 盐度胁迫
盐度胁迫试验设3个平行组(A组、B组和C组),使用海盐或淡水调节盐度,每0.5 h升高或降低盐度1.0。当试验鱼出现侧翻时,恒定盐度 1 h,若恒定期内试验鱼恢复正常,将继续升高或降低盐度,若恒定期内试验鱼不能恢复正常,此时的盐度即为临界盐度值;之后每0.5 h升高或降低盐度1.0。试验鱼活动出现异常时的盐度为适宜盐度临界值。对照组水体盐度稳定在32.5± 1.0。试验期间不换水。
1.2.3 低氧胁迫
低氧胁迫试验组使用透明胶带和保鲜膜将玻璃缸进行封口处理,以隔绝外界空气;对照组则正常充氧。试验开始时测量初始溶解氧(DO0)。当观察到试验鱼活动开始出现异常时,立即检测溶解氧,此时的水体溶解氧即为窒息临界点;50%的试验鱼侧翻或死亡时的溶解氧定为窒息点(DO 50);全部试验鱼侧翻或死亡时的溶解氧含量定为极限低氧耐受值(DO 100)。试验期间不换水。
1.2.4 氨氮胁迫和亚硝酸盐胁迫
根据预试验结果,氨氮胁迫试验设置50、70、90、120和150 mg/L共5个浓度梯度,亚硝酸盐胁迫试验设置50、100、150、200、250 mg/L共5个浓度梯度。对照组使用正常海水,氨氮、亚硝酸盐基本为0。试验开始后,分别记录各试验组24、48、72、96 h时幼鱼的死亡数量。为防止试验鱼正常生长活动造成水体污染而对试验结果产生影响,每隔24 h更换现配的试验用水。
1.3 数据分析
试验数据经初步整理后,使用EXCEL 2016和SPSS 26.0软件进行处理,并进行单因素方差分析(one-way ANOVA),设P<0.05为差异显著。对氨氮和亚硝酸盐胁迫试验结果进行皮尔逊拟合优度检验和平行检验,并进行Probit回归分析。
安全质量浓度(SC) [12]计算公式为:
SC=0.1×LC 50(1)
式(1)中,LC 50为96 h的半致死质量浓度(mg/L)。
2 结果
2.1 温度胁迫
高温胁迫:当水温升至36.0 ℃时,紫红笛鲷幼鱼活动变得异常,并开始出现死亡;当水温升高至39.0~40.0 ℃时,试验鱼在玻璃缸内活动加剧,上下窜动;当水温在40.6 ℃时,试验鱼活动猛烈,并出现死鱼;水温继续升至40.9 ℃时,试验鱼的活动能力逐渐减弱,且不断出现死鱼,直至全部死亡(见表1)。
低温胁迫:当水温下降至15.0 ℃时,试验鱼体色变黑,活力大大减弱,渐渐沉于玻璃缸底部,只有轻微游动迹象;继续降低水温至14.5 ℃时,试验鱼开始静止不动;当温度降低为14.0 ℃时,试验鱼开始出现侧翻,但无死亡;当温度继续降至13.5 ℃时,试验鱼活动突然变得激烈,上下窜动,30 min后,试验鱼开始沉于缸底,并且有部分鱼侧翻;继续降低水温至12.5 ℃时,试验鱼开始出现死亡;当温度降至11.0 ℃时,试验鱼全部死亡(见表1)。
试验结果显示,紫红笛鲷适宜水温为16.0~35.0 ℃,临界温度为13.5 ℃和40.6 ℃。对照组鱼在试验过程中均活动正常。
2.2 盐度胁迫
紫红笛鲷对盐度的耐受性试验结果见表2。
当盐度为12.00~67.68时,紫红笛鲷幼鱼活动正常。逐渐升高水体盐度至73.13±0.18时,试验鱼的体色开始变黑;继续升高盐度至74.20±0.07时,试验鱼活动开始减缓,维持此盐度10 min后,试验鱼开始出现乱窜现象,20 min后半数鱼死亡,43 min后全部死亡。在低盐度胁迫试验中,逐渐降低水体盐度至12.00时,紫红笛鲷幼鱼仍活动正常,在不断降低盐度的过程中,发现试验鱼仍可存活,且活力并无减退。随后,直接使用淡水(本试验最低盐度0.16±0.08)进行胁迫,试验鱼活动只轻微有所减弱。试验结果表明,紫红笛鲷幼鱼对淡水环境具有极强的适应能力;对高盐度海水同样具有较强的耐受能力。
2.3 低氧胁迫
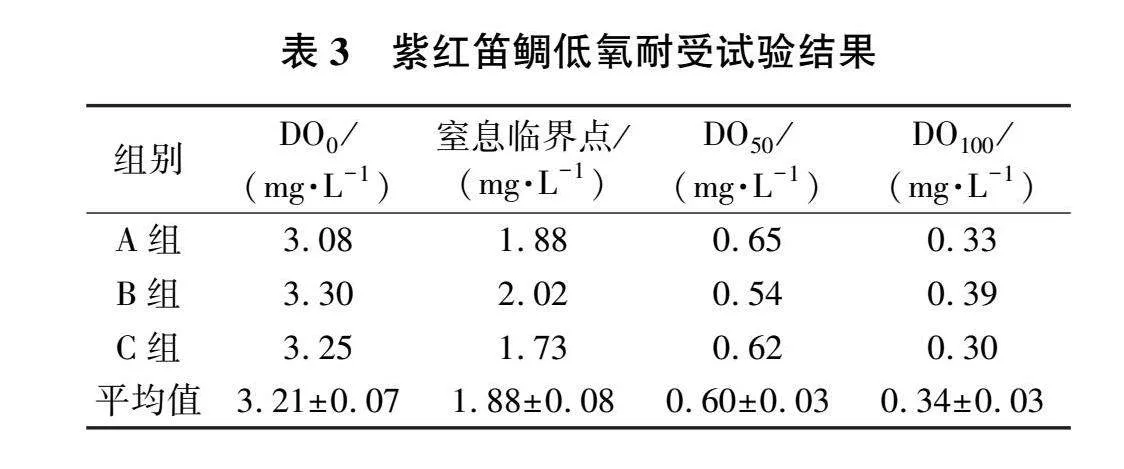
紫红笛鲷对低氧的耐受试验结果见表3。当水体溶解氧降低至(1.88±0.08)mg/L时,试验鱼开始出现异常,此时的溶解氧含量即为窒息临界点;当水体溶解氧继续降低,试验鱼出现半数死亡,此时的溶氧量为窒息点,即DO 50为(0.60± 0.03)mg/L;当水体溶解氧降低至(0.34± 0.03)mg/L时,试验鱼全部死亡,即DO 100为( 0.34± 0.03)mg/L。对照组鱼在试验过程中均活动 正常。
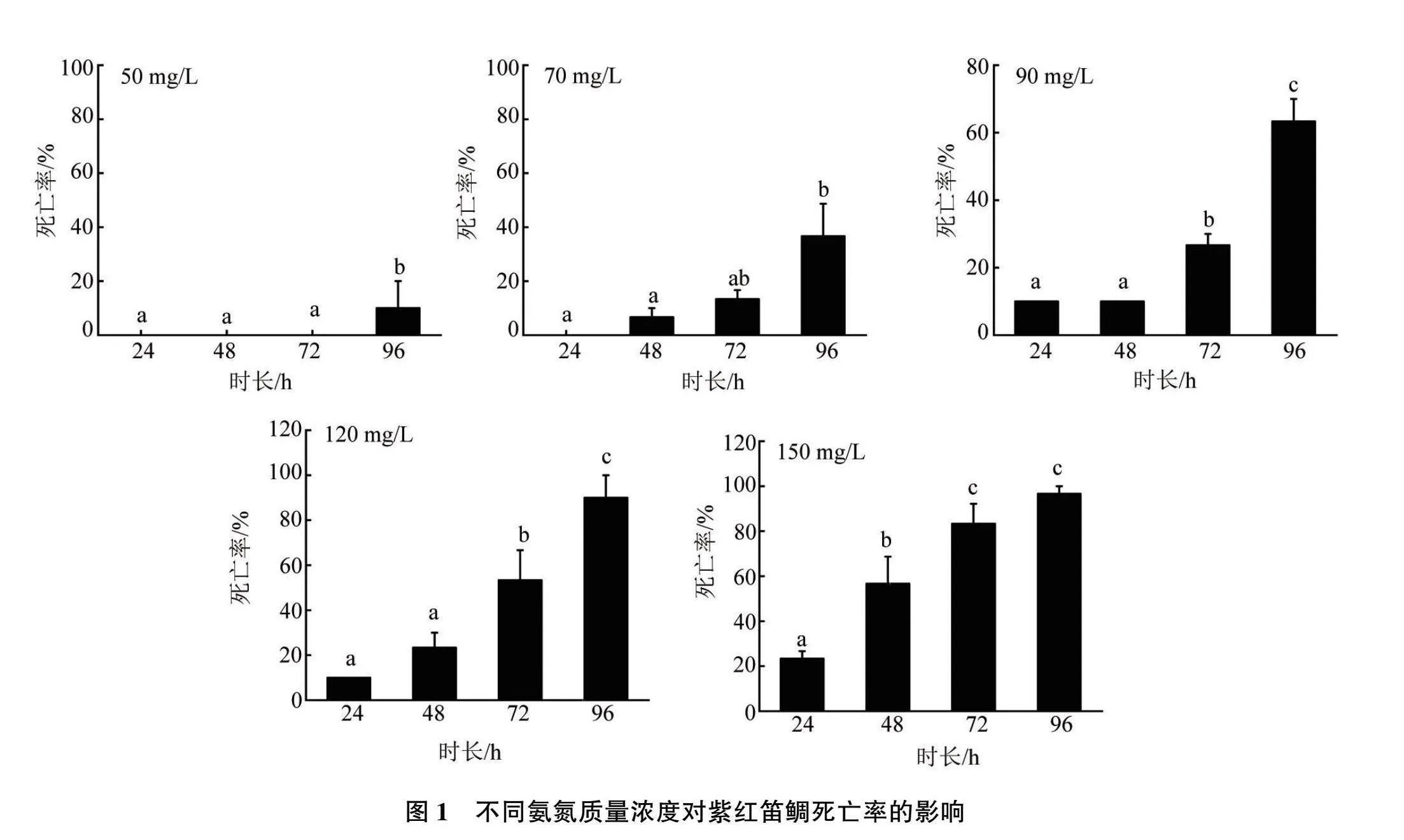
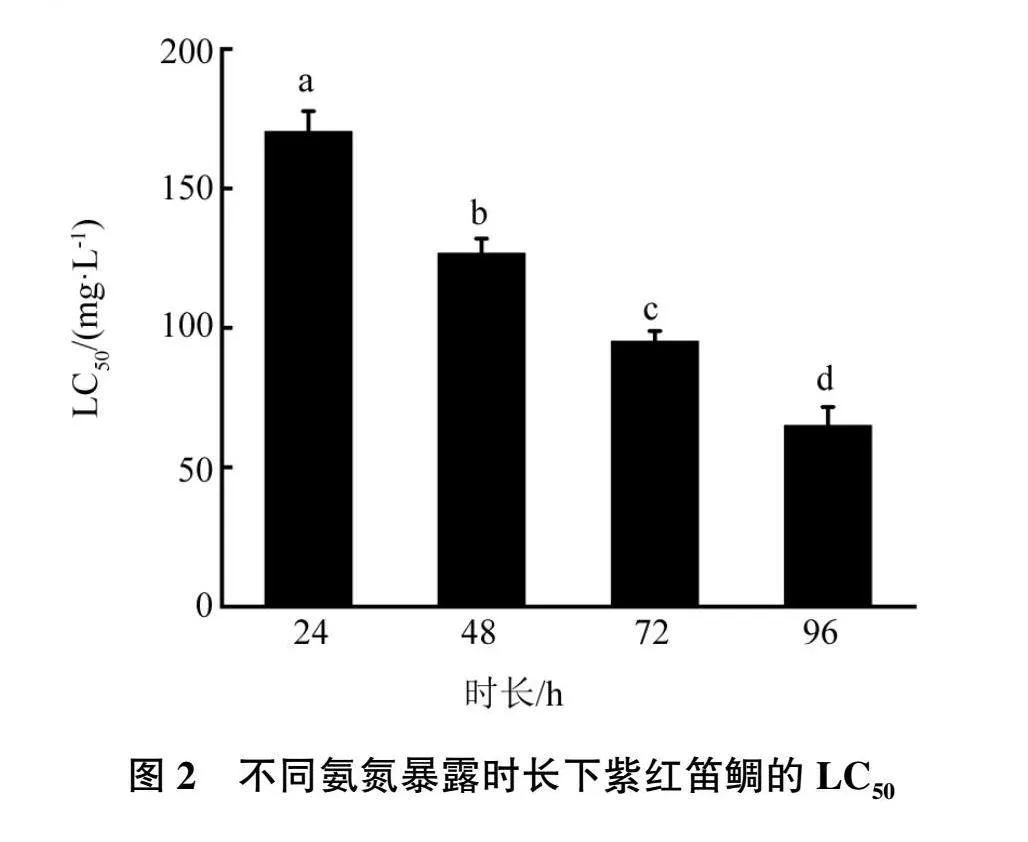
2.4 氨氮胁迫
不同浓度氨氮胁迫下紫红笛鲷的死亡率结果见图1。当氨氮质量浓度在150 mg/L以下时,同一浓度下,随着氨氮暴露时间的增加,紫红笛鲷的死亡率也逐渐升高;同一暴露时长下,随着氨氮浓度的增高,紫红笛鲷的死亡率也逐渐升高;反之 亦然。
使用SPSS 26.0软件进行皮尔逊拟合优度检验,显著性P=0.861gt;0.05,说明试验数据拟合度较好。平行检验显著性P=0.487gt;0.05,说明不同氨氮暴露时长下的回归方程具有相同的斜率。
对试验数据使用SPSS 26.0软件进行Probit回归分析,结果见表4。得出不同氨氮暴露时长下的LC 50,并整理得出毒力回归方程(见表5)。
使用SPSS 26.0软件进行one-way ANOVA分析(见图2)。在96 h内,氨氮暴露时长每增加24 h,其半致死质量浓度均有显著性降低(P<0.05)。
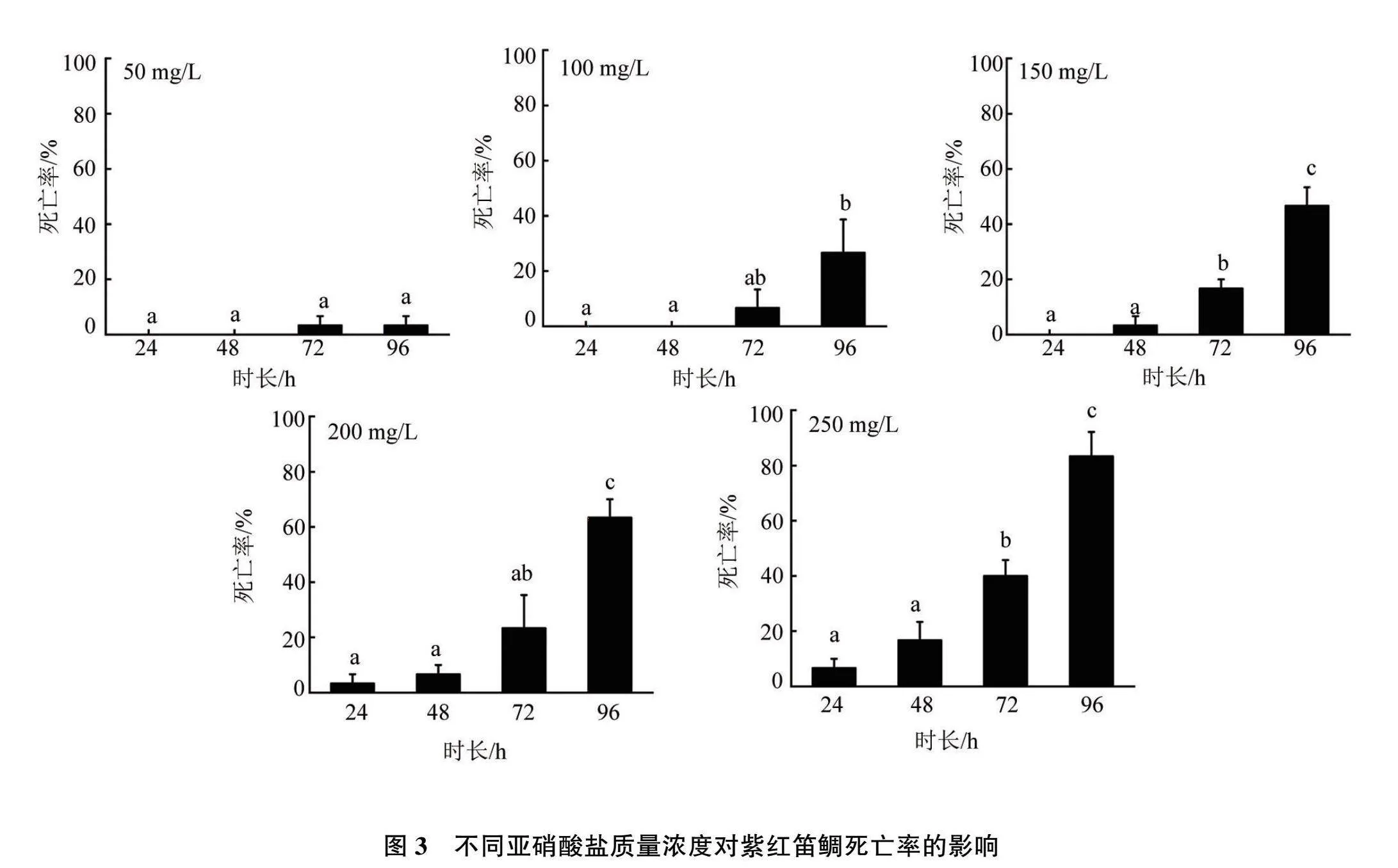
2.5 亚硝酸盐胁迫
不同浓度亚硝酸盐胁迫下紫红笛鲷的死亡率结果见图3。当亚硝酸盐浓度在250 mg/L以下时,同一浓度下,随着亚硝酸盐暴露时间的增加,紫红笛鲷的死亡率也逐渐升高;同一暴露时长下,亚硝酸盐浓度越高,紫红笛鲷死亡率也随之升高,反之亦然。
使用SPSS 26.0进行皮尔逊拟合优度检验,显著性P=0.977gt;0.05,说明试验数据拟合度较好。平行检验显著性P=0.694gt;0.05,说明不同亚硝酸盐暴露时长下的回归方程具有相同的 斜率。
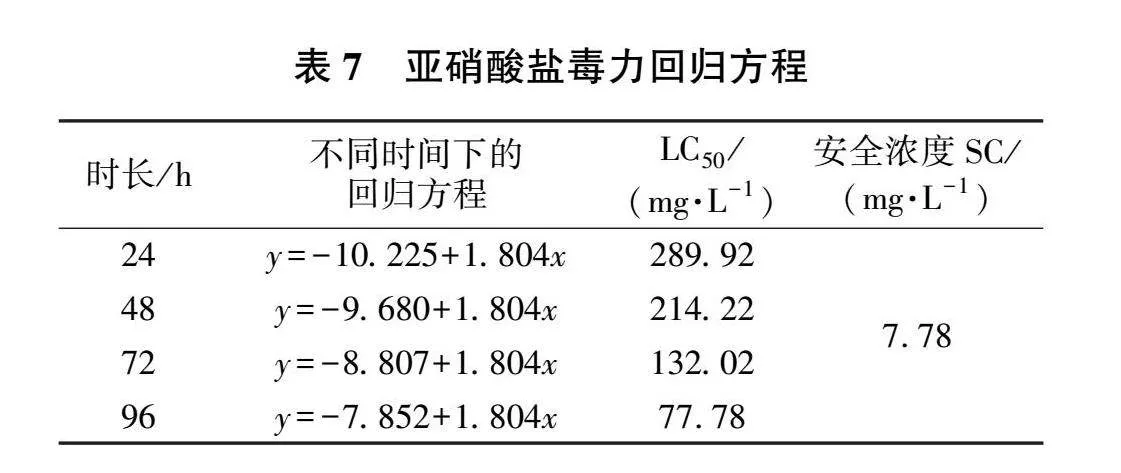
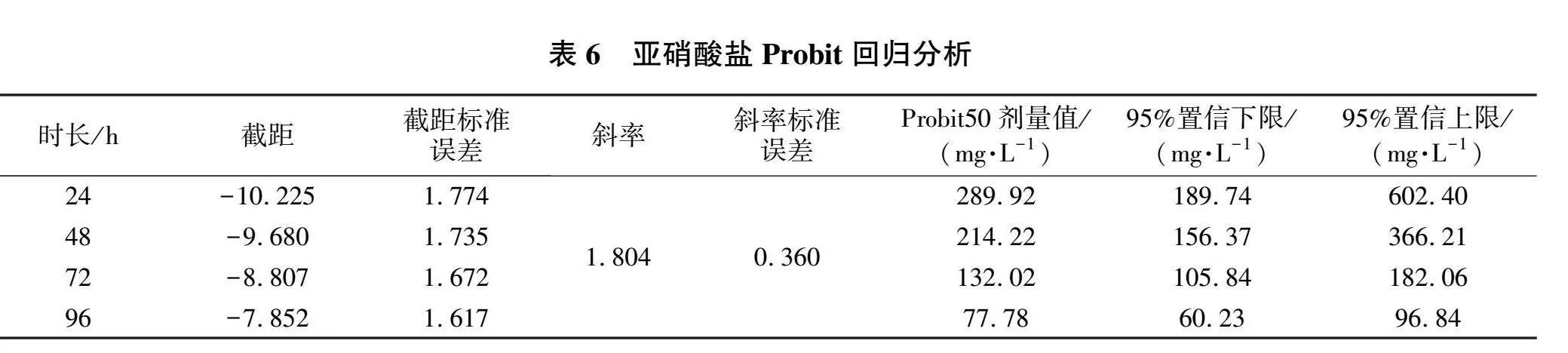
使用SPSS 26.0软件对试验数据进行Probit回归分析(见表6),得出不同亚硝酸盐暴露时长下的LC 50,并整理得出毒力回归方程(见表7)。
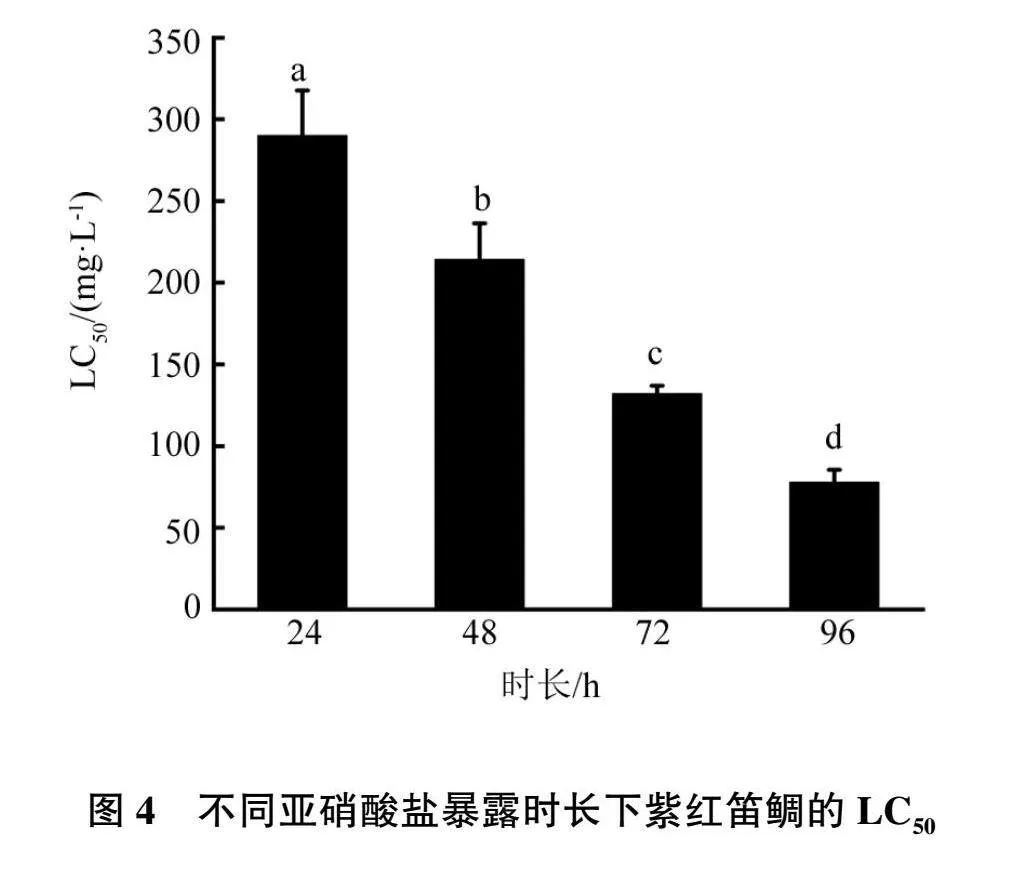
使用SPSS 26.0进行one-way ANOVA分析(见图4)。结果显示,在96 h内,亚硝酸盐暴露时长每增加24 h,其半致死质量浓度均有显著性降低(P<0.05)。
3 讨论
3.1 温度对紫红笛鲷的影响
温度与抗氧化能力及代谢功能密切相关,鱼类对温度比较敏感,若昼夜温差过大,容易引起鱼类应激而导致死亡,低温可降低机体能量代谢酶活性,降低代谢速率,温度的变化可影响鱼体的免疫功能 [13]。本试验结果显示,紫红笛鲷幼鱼的适宜水温为(16.0~35.0) ℃,临界温度为13.5 ℃和40.6 ℃。相较于光唇裂腹鱼(Schizothorax lissolabiatus) [14]和拉萨裂腹鱼(Schizothorax waltoni) [15],紫红笛鲷的临界高温较高,与珍珠龙胆石斑(Epinephelus fuscoguttatus♀×E. lanceolatus♂) [7]相似,而略高于白氏文昌鱼(Branchiostoma belcheri) [16]和花鲈(Lateolabrax maculatus) [17]。
3.2 盐度对紫红笛鲷的影响
水体盐度的变化会引起渗透压的改变,鱼类通过调节自身的渗透压及改变抗氧化酶活性来适应外界的盐度变化 [18]。紫红笛鲷在盐度为12.00~67.68的范围内可正常活动,其极限耐受盐度为72.86。本试验中,将紫红笛鲷置于淡水(盐度为0.16±0.08)中24 h仍可存活。目前,已有多种鱼类耐盐能力的研究报道,如黄姑鱼(Nibea albiflora) [19]对盐度的耐受范围为2~45;大黄鱼幼鱼 [20]在盐度低于2时,其死亡率明显降低;银鲳仔鱼(Pampus argenteus) [21]对外界环境盐度的变化较为敏感,其最适盐度耐受范围为15.54~ 24.90。相较之下,紫红笛鲷幼鱼对盐度的适应范围非常广,尤其对低盐具有极强的耐受能力,可作为潜在的淡水驯养养殖品种。
3.2 低氧胁迫对紫红笛鲷的影响
水体溶解氧是影响鱼类的生存生长的关键因素之一。不同鱼类对低溶解氧的耐受能力也不一样。本试验中,当水体溶解氧逐渐降低时,紫红笛鲷先是活动加剧、呼吸加快以获得更多的氧气,随后鳃部扇动,呼吸开始减弱,并逐渐沉至水底。研究表明,鱼类对低氧的耐受能力与鱼的体质量相关,其体质量越大,低氧耐受能力越强 [22]。紫红笛鲷的窒息临界点为(1.88±0.08)mg/L,DO 50为(0.60±0.03)mg/L,DO 100为(0.34±0.03)mg/L。同为幼鱼,珍珠龙胆石斑 [体质量(121.4~ 277.5)g]的窒息临界点为0.70 mg/L [7],棕点石斑鱼(Epinephelus fuscoguttatus)[体质量(33.06±4.66)g]和金虎石斑鱼(Epinephelus fuscoguttatus♀×E. lanceolatus♂[体质量(34.26±3.85)g]的窒息点分别为0.22 mg/L和0.24 mg/L [23],相比之下,紫红笛鲷对低溶解氧的耐受能力较差。因此,在紫红笛鲷养殖过程中要保证水体溶解氧高于( 1.88±0.08) mg/L。
3.3 氨氮、亚硝酸盐胁迫对紫红笛鲷的影响
养殖水体中的氨氮主要来自工业废水和生活污水、养殖水产动物蛋白质代谢产物的排泄和粪便残饵这些含氮有机物的氨化作用 [24-25]。养殖水体中的亚硝酸盐主要来自于投喂的饲料、鱼类排泄物及分泌物、水生生物的尸体及养殖中使用的肥料等 [26]。氨氮对鱼类具有极强的毒性,可破坏鱼鳃及体表黏膜,影响鱼类的输氧系统,对其神经系统也有一定的影响;亚硝酸盐也是通过影响鱼类的输氧系统,氧化血红蛋白,降低其运输氧的能力,最终使鱼缺氧甚至导致死亡 [27]。
在氨氮和亚硝酸盐胁迫下,在一定范围内,同一浓度下,暴露时间越长,紫红笛鲷死亡率也越高;而同一暴露时长下,氨氮或亚硝酸盐的浓度越高,紫红笛鲷死亡率也越高。本试验结果,氨氮和亚硝酸盐的安全浓度分别为6.49和 7.78 mg/L。
吕景才等 [28]研究发现,鲤(Cyprinus carpio)、鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)、草鱼(Ctenopharyngodon idella)的亚硝酸盐安全浓度分别为3.09、2.04、1.99、0.35 mg/L;陈思 [29]研究发现,斜带石斑鱼(Epinephelus "coioides)对氨氮的安全浓度为3.34 mg/L,亚硝酸盐的安全浓度为9.04 mg/L。与上述结果相比,紫红笛鲷对亚硝酸盐的安全浓度和对氨氮的安全浓度都较高,说明紫红笛鲷具有较强的环境耐受 能力。
4 结论
紫红笛鲷属于热带和亚热带近海底层鱼类,其适应的温度范围较广,但其幼鱼对低温(临界低温为13 ℃)较为敏感,在繁殖季节应注意对水体采取保温或加温等措施。本试验研究发现,紫红笛鲷可以在盐度低于67.68的水体条件下正常活动,且对低盐环境具有很强的耐受力,说明紫红笛鲷适宜生长的盐度范围广,在常见的海水、咸淡水区域均可进行养殖,这一特点对紫红笛鲷的养殖推广具有非常大的优势,且目前已有养殖户对紫红笛鲷进行淡水驯化养殖的报道 [30-31]。但紫红笛鲷幼鱼耐低氧的能力较弱,在幼苗培养过程中应注意保证充足的水体溶解氧。虽然紫红笛鲷幼鱼对氨氮和亚硝酸盐具有较强的耐受能力,但养殖过程中也应避免水体污染,注意合理投喂饲料,避免产生过多的残饲剩饵,并应勤换水,及时除去水体中的粪便残饵,应注意监测水体状况,保持水体中氨氮及亚硝酸盐处于安全浓度之下。
参考文献
[1]黄小林,杨洁,戴超,等.丁香酚对紫红笛鲷幼鱼的麻醉效果[J].中国渔业质量与标准,2020,10(2):51-58.
[2]牛文涛,蔡泽平.大亚湾紫红笛鲷野生群体遗传多样性的RAPD分析[J].海洋通报,2006,25(2):87-92.
[3]邵彦翔.石斑鱼对温度胁迫的耐受性研究[D].大连:大连海洋大学,2016.
[4]冉凤霞,金文杰,黄屾,等.盐度变化对鱼类影响的研究进展[J].西北农林科技大学学报(自然科学版),2020,48(8):10-18.
[5]孙俊霄,韩广坤,刘娅,等.杂交黄颡鱼与普通黄颡鱼幼鱼生长性能及耐低氧能力的比较[J].水生生物学报,2019,43(6):1271-1279.
[6]管士成.环境因素对鱼类生长速度的影响[J].养殖技术顾问,2013(10):229.
[7]林国文.珍珠龙胆石斑鱼对水温、盐度和低溶解氧耐受能力的初步研究[J].渔业研究,2020,42(5):481-485.
[8]阮成旭,袁重桂,吴德峰,等.氨氮和亚硝态氮对大黄鱼幼鱼的急性毒性效应[J].福州大学学报(自然科学版),2014,42(2):333-336.
[9]魏金生,江兴龙,王泽旭,等.澳洲鳗鲡(Anguilla australis)不同生长阶段的生物学耐受性特征及其演变趋势[J].海洋与湖沼,2021,52(4):983-993.
[10]郑洪武,杨斯琪,孙颖,等.急性氨氮胁迫对大口黑鲈幼鱼ACP、CAT和MDA的影响[J].浙江海洋大学学报(自然科学版),2020,39(1):27-33.
[11]CURRIE R J,BENNETT W A,BEITINGER T L.Critical thermal minima and maxima of three freshwater game-fish species acclimated to constant temperatures[J].Environmental Biology of "Fishes,1998,51(2):187-200.
[12]SPRAGUE J B.Measurement of pollutant toxicity to fish—III[J].Water Research,1971,5(6):245-266.
[13]胡玲红,王映,王化敏,等.不同温度胁迫对青鳉鳃凋亡的影响[J].大连海洋大学学报,2021,36(6):929-936.
[14]金方彭,李光华,高海涛,等.光唇裂腹鱼幼鱼对温度、盐度、pH的耐受性试验[J].水产科技情报,2016,43(6):303-307.
[15]何林强,王万良,曾本和,等.不同规格拉萨裂腹鱼温度耐受性研究[J].水生生物学报,2020,44(6):1230-1238.
[16]方琦,周仁杰,钟指挥.白氏文昌鱼幼鱼对海水温度和盐度变化的耐受力研究[J].水产科技情报,2010,37(6):274-278.
[17]胡彦波,李昀,温海深,等.不同群体花鲈幼鱼温度耐受特征的初步研究[J].中国海洋大学学报(自然科学版),2019,49(S2):1-7.
[18]杜佳玉,吴晗阅,孟照勇,等.盐度胁迫对细鳞鲑幼鱼呼吸代谢和抗氧化酶活性的影响[J].安徽农业科学,2021,49(22):114-116.
[19]田璐.盐度对黄姑鱼生存生长、非特异性免疫及肠道菌群的影响[D].舟山:浙江海洋大学,2019.
[20]曾荣林,谢仰杰,王志勇,等.大黄鱼幼鱼对低盐度的耐受性研究[J].集美大学学报(自然科学版),2013,18(3):167-171.
[21]郭勤单,徐国成,王有基,等.银鲳仔鱼对不同盐度的耐受力及其耗氧量的研究[J].水产学报,2013,37(5):719-726.
[22]高云涛,高云红,李明月,等.斑石鲷低氧耐受能力及血液生理生化指标变化研究[J].渔业科学进展,2022,43(6):79-88.
[23]段鹏飞,田永胜,李振通,等.棕点石斑鱼(♀)×蓝身大斑石斑鱼(♂)杂交后代与棕点石斑鱼低氧耐受能力初步研究[J].中国水产科学,2022,29(2):220-233.
[24]冼健安,钱坤,郭慧,等.氨氮对虾类毒性影响的研究进展[J].饲料工业,2014,35(22):52-58.
[25]孔杰.我国环境监测中水体氨氮分析方法和影响因素综述[J].中国资源综合利用,2018,36(4):83-85.
[26]席文秋,孙娜,杨占全,等.水产养殖中亚硝酸盐的产生及其消除方法[J].科学养鱼,2017(5):81-82.
[27]吕妍.氨氮等水质指标对水产养殖的影响及解决办法[J].黑龙江水产,2021,40(5):53-56.
[28]吕景才,沈成钢,杨景华.亚硝酸盐对几种淡水鱼苗的急性毒性试验[J].大连水产学院学报,1993,8(1):65-68.
[29]陈思.养殖水温、饵料种类及氨氮和亚硝酸盐对珍珠龙胆石斑鱼幼鱼生长性能的影响[D].湛江:广东海洋大学,2015.
[30]李振言.内陆咸淡水主养紫红笛鲷创高效[J].科学养鱼,2004(7):30.
[31]黎祖福,张伟民,陶小林.紫红笛鲷的养殖[J].海洋科学,1995,19(6):5-7.
Study on the environmental tolerance of juvenile Lutjanus argentimaculatus
YU Zhide 1,2, HUANG Xiaolin 2,3, ZHUANG Jiegui4, CHEN Yibiao 2,3, LI Tao 2,3, YANG Yukai 2,3, HUANG Zhong 2,3, SHU Hu1
(1. School of Life Sciences,Guangzhou University,Guangzhou 510006,China;
2. Shenzhen Base of South China Sea Fisheries Research Institute,Chinese
Academy of Fishery Sciences,Shenzhen 518121,China; 3. South China Sea
Fisheries Research Institute,Chinese Academy of Fishery Sciences/Key Laboratory of
South China Sea Fishery Resources Exploitation amp; Utilization, Ministry of Agriculture and
Rural Affairs/Guangdong Provincial Key Laboratory of Fishery Ecology and Environment,
Guangzhou 510300,China; 4. Shenzhen Longqizhuang
Industrial Development Co.,Ltd,Shenzhen 518121,China)
Abstract: To investigate the environmental tolerance of Lutjanus argentimaculatus to environmental factors, "juvenile L. argentimaculatus with an average weight of (9.7±1.5)g and a body length of (7.3±0.3)cm was used to explore their tolerance to temperature,salinity,and low dissolved oxygen with the gradual method.Different "concentration gradients were set to determine the median lethal concentration(LC 50) for ammonia nitrogen and "nitrite.The results showed that the suitable water temperature range for L. argentimaculatus was (16~35)℃, with a critical lower water temperature of 13.5 ℃, and a critical upper water temperature of 40.6 ℃.Normal "activity was observed when salinity ranged from 12.00 to 67.68, with an extreme salinity tolerance of (73.13± 0.18).The critical point of asphyxiation for juvenile L. argentimaculatus was (1.88±0.08) mg/L, with DO 50 at (0.60±0.03) mg/L, and DO 100 at (0.34±0.03) mg/L.Under ammonia nitrogen stress, the LC 50 at 24, 48, 72, and 96 h were 170.30, 126.62, 95.05, and 64.90 mg/L, respectively.Under nitrite stress, the LC 50 at 24, 48, 72, and 96 h were 289.92, 214.22, 132.02, and 77.78 mg/L, respectively.The safe concentration for ammonia nitrogen is 6.49 mg/L, and the safe concentration for nitrite is 7.78 mg/L.
Key words: Lutjanus argentimaculatus; tolerance; ammonia nitrogen stress; nitrite stress; temperature; dissolved oxygen; salinity

