卵巢甲状腺肿的MRI表现
[摘要] 目的:分析卵巢甲状腺肿(SO)的MRI表现,提高对该病影像学表现的认识及术前诊断准确率。方法:回顾性分析27例经术后病理诊断为SO患者的临床和MRI资料,包括MRI平扫及增强扫描图像。结果:27例均为单侧发病,左侧18例,右侧9例,其中3例合并对侧畸胎瘤。27例中,3例呈多房囊性表现,增强扫描囊壁局部明显强化。24例表现为囊实性肿块,其中21例实性成分较少,呈不规则分隔样或条片样表现,增强扫描19例明显强化,2例中等强化;3例实性成分较多,呈团块样表现,增强扫描呈混合强化。T2WI示23例见小囊样T2WI极低信号;DWI示26例信号强度同子宫肌层或低于肌层,1例信号高于肌层似内膜信号。术前诊断卵巢良性肿瘤18例(SO 6例,畸胎瘤3例,囊腺瘤9例),交界性-恶性肿瘤9例。结论:SO的MRI表现为多房囊性或囊实性肿块;不同囊内信号不一,T2WI存在极低信号的小囊;肿瘤的实性部分明显强化,以分隔或厚壁样明显强化为主,较大实性团块强化不均;实性成分DWI信号无增高。充分认识SO的MRI表现,能够提高其术前诊断准确率,有利于临床医师选择最佳手术方式。
[关键词] 卵巢甲状腺肿;磁共振成像
DOI:10.3969/j.issn.1672-0512.2024.04.021
[通信作者] 梁宇霆,Email:liangyuting@ccmu.edu.cn。
卵巢甲状腺肿(struma ovarii,SO)是一种主要由成熟甲状腺组织组成的特异性或单胚层畸胎瘤[1],属于畸胎瘤分类中的亚型,甲状腺组织>50%时即可诊断。SO发病率低,约占所有卵巢畸胎瘤的5%[2-4]。根据组织学特征,SO可分为良性或恶性[5],良性占绝大多数,仅5%为恶性[6]。因发病率低、临床症状不典型,加之医师对其影像特征认识不足,易导致术前误诊,影响手术方式的选择。病变伴较多实性成分时与恶性肿瘤鉴别困难,常被诊断为交界性甚至恶性肿瘤。本研究通过回顾性分析27例SO患者的临床及MRI资料,总结该病的MRI表现,提高术前诊断准确率,为手术方式的选择提供依据。
1" 资料与方法
1.1nbsp; 一般资料
回顾性分析我院2016—2023年经术后病理诊断的27例SO患者的临床及MRI资料,年龄14~70岁,平均(41.25±15.36)岁。19例无明显临床症状,因体检发现附件肿块就诊;5例因腹痛、腹胀就诊;3例因不规则出血或月经不调就诊。实验室检查5例肿瘤标志物CA125轻中度升高,其中1例伴CA19-9轻度升高,1例伴AFP升高。余20例肿瘤标志物无异常。所有患者均无甲状腺功能异常临床表现,2例影像检查提示SO后行甲状腺功能检查未见异常。
1.2" 仪器与方法
采用GE Discovery 750 3.0 T MRI成像仪,8通道相控阵腹部线圈。扫描前30 min肌内注射盐酸消旋山莨菪碱10 mg以减轻肠管蠕动。扫描范围从髂棘至耻骨联合。扫描序列:轴位T1WI,冠状位和矢状位快速自旋回波T2WI;轴位脂肪抑制T2WI;轴位和矢状位DWI(b值取0、1 000、2 000、3 000 s/mm²);轴位、冠状位和矢状位T1WI增强扫描图像。
1.3" 图像分析
由2位具有10年以上经验的放射科医师对MRI图像进行评估,包括病灶部位、大小、形态(多房或单房)、成分(囊性、囊实性)、信号特点与强度,以及增强扫描强化程度。意见不同时,由具有30年以上工作经验的主任医师作出最终诊断。同时结合胸腹CT评估患者有无胸腔积液及腹盆腔积液。
2" 结果
2.1" SO的MRI表现
27例均为单侧发病,左侧18例,右侧9例,其中3例伴对侧畸胎瘤。肿瘤最大径3.2~21.3 cm,平均(10.59±4.96)cm。
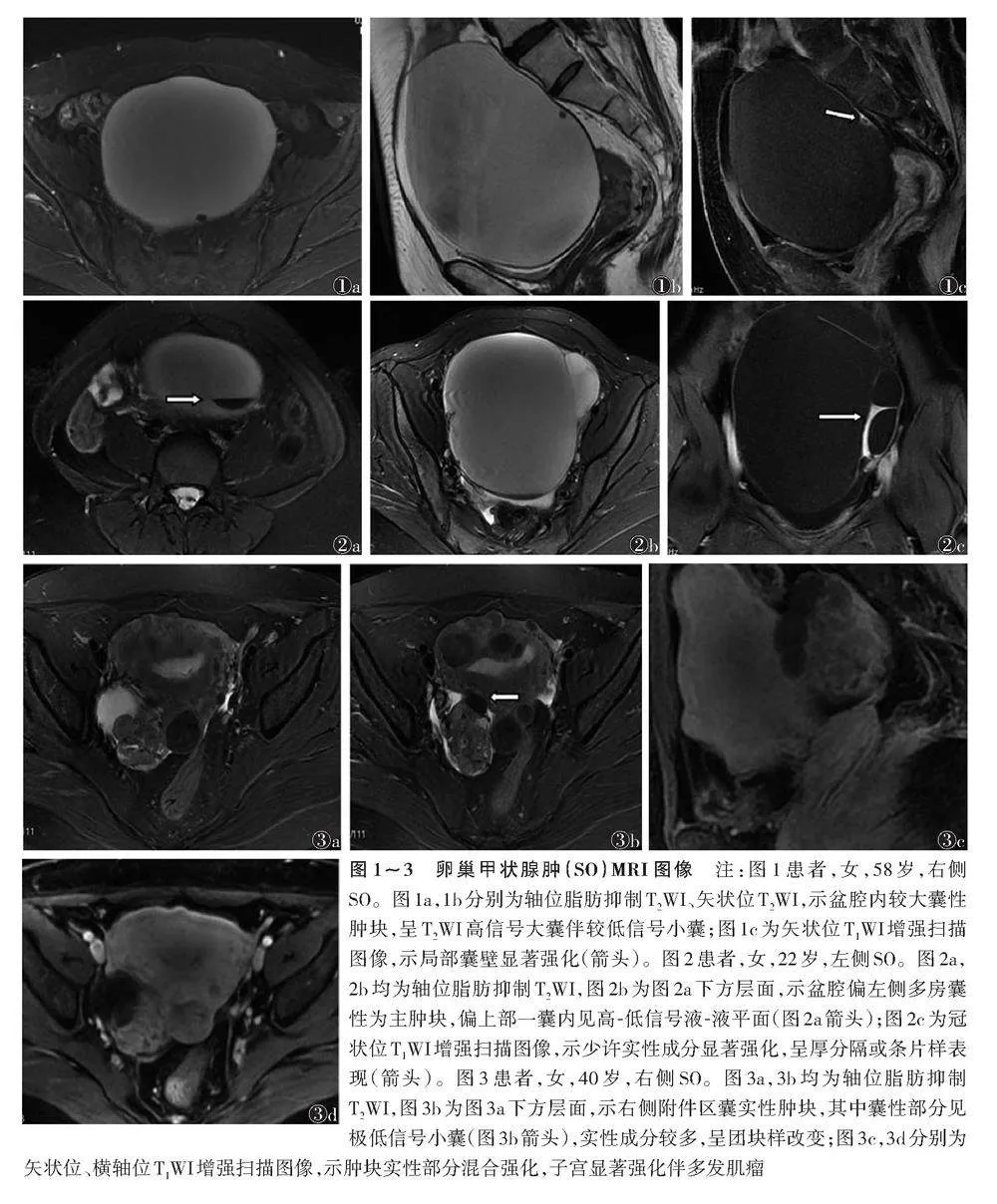
27例中,3例多房囊性肿块,未见明显实性成分,增强扫描囊壁局部明显强化(图1)。24例囊实性肿块中,21例实性成分较少(图2),呈不规则分隔样或条片样表现,增强扫描19例明显强化,2例中等强化;3例实性成分较多,呈团块样表现(1例以实性成分为主),增强扫描呈混合强化(大部分强化低于肌层,期间见不规则分隔样显著强化)(图3)。27例T1WI及T2WI均表现为不同囊腔内信号不一,似彩色玻璃征样表现,其中23例(85.2%)T2WI见极低信号小囊,2例(7.4%)见高-低信号液-液平面(图2a);DWI示26例(96.3%)实性成分信号强度同肌层或低于肌层,1例实性成分信号较高(b值=1 000 s/mm²,ADC值为0.93×10-3 mm²/s),更高b值(2 000、3 000 s/mm²)时,信号强度明显降低,与子宫内膜信号改变一致。25例伴盆腔少量/中等积液(5例中等积液),其中1例伴极少量胸腔积液及肝周积液,1例伴极少量肝周积液。
2.2" 术前MRI诊断及手术方式
术前诊断为卵巢良性肿瘤18例(SO 6例,畸胎瘤3例,囊腺瘤9例),交界性-恶性肿瘤9例。14例行开腹手术,余13例行腹腔镜手术。
3" 讨论
3.1" SO的相关临床特征
SO发病年龄跨度较大,通常在20~60岁[7],育龄期女性多见,偶尔也可见于儿童和高龄女性,文献报道的最低年龄为10岁[8]。本组最大年龄70岁,2例青少年发病(分别为14、15岁),其肿块均较大,长径gt;10 cm。SO多单侧发病,对侧可伴畸胎瘤[9-10],本组3例。SO通常无典型临床症状和体征,肿瘤标志物检查多无异常,可表现为腹痛、腹胀或无症状,部分为体检或意外发现。本组19例无明显症状,体检发现。15%~17%的SO患者合并腹水和/或胸腔积液,伴CA125升高,即假性格梅斯综合征[11]。本组25例伴盆腔积液,但多为少量积液,这在育龄期女性中较常见,5例中等积液者均伴CA125增高,可能与肿瘤本身无关,而是腹水的间接作用。少数SO(5%)可伴甲状腺功能亢进[12],因此对女性甲状腺功能亢进患者,要考虑SO的可能。本组27例均无甲状腺功能亢进相关症状,就诊前均未行相关实验室检查;可能与肿瘤内甲状腺组织无功能有关,或含功能组织较少尚未引起相关症状,也可能因样本例数较少、缺乏代表性。
3.2" SO的MRI表现
国内外对SO的影像研究较少,MRI报道多为小样本(10例以内)或影像资料不全,提到的MRI征象主要包括:多房囊实性、T2WI极低信号小囊、实性成分显著强化(甲状腺组织样强化)、不同囊腔内信号各异(彩色玻璃征),液-液平面等。本研究中上述征象均显示。
3.2.1" 基于病理学基础的MRI典型表现" SO的MRI典型或特异性表现:T2WI极低信号小囊、实性成分显著强化及不同囊腔内信号各异[9,13-21]。囊腔内充填含甲状腺激素的胶冻样黏液,T2WI上不同囊腔内信号高低取决于充填物质的浓度,浓度不同则信号强度不一[19],这也是影像上呈彩色玻璃征的原因。当囊内容物高度浓缩时,因氢质子含量少而呈特征性极低T2WI信号,也称黑珍珠样低信号颗粒[20]。Ikeuchi等[7]研究发现,T2WI极低信号发生率为62%,林娜等[16]研究中7例均见该征象,本组23例(85.2%)显示该征象,不同文献报道差异较大,可能与例数较少有关。因SO中含有甲状腺组织,其增强扫描实性成分显著强化,不同肿瘤中甲状腺组织含量不同,因而强化表现各异,多呈囊壁或分隔样显著强化,多个厚壁或厚间隔囊腔形成分叶状轮廓时可呈花边样强化模式[19],实性成分呈结节状时表现为类珍珠瘤样强化[21]。本组27例中分隔样或囊壁样显著强化22例,3例实性成分较多者,增强扫描呈混合强化。
3.2.2" 其他征象" 有学者认为液-液平面可能也是SO较具特征性的表现[19],可能与合并出血或SO分泌的黏液成分多样有关,但例数较少,有待进一步证实。本组2例(7.4%)见液-液平面,发生率较低。Dujardin等[19]研究认为,SO实性区域的ADC值存在于良性范围内(b值1 200 s/mm²)。李斌等[18]选取低b值(800 s/mm²)进行研究,认为SO实性成分的DWI信号高。陈东等[22]研究发现,SO中实性成分DWI信号高,但ADC值不降低,故认为无弥散受限。Tamura等[17]对18例患者进行回顾性研究,发现2例弥散受限。本研究采用多b值扫描并参考子宫肌层判断信号的高低,发现b值为1 000 s/mm²时,26例SO实性成分或囊壁及分隔DWI信号低于或等于子宫肌层信号;1例信号强度同子宫内膜,但b值更高时扫描信号强度降低,与子宫内膜信号改变一致;提示DWI实性成分信号不高或信号虽高但b值更高时信号下降可为鉴别诊断提供依据。
3.3" 鉴别诊断
3.3.1" 黏液性囊腺瘤(包括交界性-恶性)" 黏液性囊腺瘤(包括交界性-恶性)是卵巢常见的上皮性肿瘤,也是最需与SO鉴别的一类肿瘤,尤其交界性-恶性肿瘤与含实性成分较多的SO鉴别困难。黏液性囊腺瘤与SO一样,也可呈多房、彩色玻璃样表现,但其囊腔内T2WI低信号常较SO中T2WI极低信号小囊信号高,囊壁或实性部分强化程度相对较低,DWI信号较高。本研究术前误诊患者多诊断为黏液性肿瘤,与对SO的影像征象认识不足有关。
3.3.2" 囊腺纤维瘤" 囊腺纤维瘤含致密纤维间质及上皮囊性成分,表现为多房囊实性肿块、单房厚壁囊性肿块或纯囊性肿块,T2WI低信号区在DWI上呈低信号,呈黑-黑征[23],实性成分增强扫描强化不明显。
3.3.3" 其他" ①子宫内膜异位囊肿,也可表现为T2WI极低信号,但囊壁或间隔厚薄较均匀,常伴子宫或盆腔子宫内膜异位症;②性索间质肿瘤,SO实性成分较多或实性为主时需与性索间质肿瘤鉴别,后者临床激素水平常异常,实性成分占比更多,强化偏低,DWI信号偏高;③成熟型畸胎瘤,信号较混杂,典型者肿瘤内见较多脂肪及钙化,部分畸胎瘤出现特征性的脂-液平面,而SO较少含有脂肪,本组3例因含有极少裂隙样脂肪信号而被诊断为畸胎瘤。
综上所述,SO虽罕见,但MRI上具有较特异的征象:多房囊性或囊实性肿块;不同囊内信号不一,T2WI存在极低信号的小囊;肿瘤的实性部分明显强化,以分隔或厚壁样明显强化为主,较大实性团块强化不均;实性成分DWI信号无增高。充分认识SO的MRI表现,能够提高其术前诊断准确率,有利于为患者选择最佳手术方案。
[参考文献]
[1] DUNZENDORFER T,DELAS MORENAS A,KALIR T,et al. Struma ovarii and hyperthyroidism[J]. Thyroid,1999,9(5):499-502.
[2] KONDI-PAFITI A,MAVRIGIANNAKI P,GRIGORIADIS C H,et al. Monodermal teratomas (struma ovarii). Clinicopathological characteristics of 11 cases and literature review[J]. Eur J Gynaecol Oncol,2011,32(6):657-659.
[3] YASSA L,SADOW P,MARQUSEE E. Malignant struma ovarii[J]. Nat Clin Pract Endocrinol Metab,2008,4:469-472.
[4] YOO S C,CHANG K H,LYU M O,et al. Clinical characteristics of struma ovarii[J]. J Gynecol Oncol,2008,19(2):135-138.
[5] KRAEMER B,GRISCHKE E M,STAEBLER A,et al. Laparoscopic excision of malignant struma ovarii and 1 year follow-up without further treatment[J]. Fertil Steril,2011,95(6):2124.e9-e12.
[6] DARDIK R B,DARDIK M,WESTRA W,et al. Malignant strumaovarii:two case reports and a review of the literature[J]. Gynecol Oncol,1999,73(3):447-451.
[7] IKEUCHI T,KOYAMA T,TAMAI K,et al. CT and MR features of struma ovarii[J]. Abdom Imaging,2012,37(5):904-910.
[8] JOJA I,ASAKAWA T,MITSUMORI A,et al. Struma ovarii:appearance on MR images[J]. Abdom Imaging,1998,23(6):652-656.
[9] TANIMANIDIS P,CHATZISTAMATIOU K,NIKOLAIDOU A,et al. Struma ovarii. A case report[J]. Hippokratia,2014,18(4):357-358.
[10] IRANPARVAR ALAMDARI M,HABIBZADEH A,PAKROUY H,et al. An unusual presentation of a papillary thyroid carcinoma in the struma ovarii in a 10 year-old girl:a case report[J]. Int J Surg Case Rep,2018,51:218-220.
[11] 陈凤英,张大伟,张颖,等. 卵巢甲状腺肿的超声和MRI影像表现与病理对照分析[J]. 磁共振成像,2019,10(12):913-916.
[12] 刘冬,沈海林,付芳芳,等. 卵巢甲状腺肿的影像学诊断与病理分析[J]. 临床放射学杂志,2014,33(1):77-80.
[13] TAYLOR E C,IRSHAID L,MATHUR M. Multimodality imaging approach to ovarian neoplasms with pathologic correlation[J]. Radiographics,2021,41(1):289-315.
[14] TEALE E,GOULDESBROUGH D R,PEACEY S R. Graves’ disease and coexisting strumaovarii:struma expression of thyrotropin receptors and the presence of thyrotropin receptor stimulating antibodies[J]. Thyroid,2006,16(8):791-793.
[15] MATSUKI M,KAJI Y,MATSUO M,et al. Struma ovarii:MRI findings[J]. Br J Radiol,2000,73(865):87-90.
[16] 林娜,熊美连,方如旗,等. 卵巢甲状腺肿MRI和CT表现[J]. 中国医学影像技术,2018,34(5):719-722.
[17] TAMURA N,MURAKAMI K,OZAKI R,et al. Current state of management of struma ovarii and preoperative imaging features:a retrospective case series study of 18 patients at a single institution[J]. J Obstet Gynaecol Res,2023,49(3):1007-1011.
[18] 李斌,吴永峻. 卵巢甲状腺肿的MRI表现[J]. 医学影像学杂志,2020,30(10):1893-1895.
[19] DUJARDIN M I,SEKHRI P,TURNBULL L W. Struma ovarii:role of imaging?[J]. Insights Imaging,2014,5(1):41-51.
[20]OKADA S,OHAKI Y,KAWAMURA T,et al. Cystic struma ovarii:imaging findings[J]. J Comput Assist Tomogr,2000,24(3):413-415.
[21] SAVELLI L,TESTA A C,TIMMERMAN D,et al. Imaging of gynecological disease (4):clinical and ultrasound characteristics of struma ovarii[J]. Ultrasound Obstet Gynecol,2008,32(2):210-219.
[22] 陈东,董江宁,高飞,等. 卵巢甲状腺肿MRI表现特征及其病理学基础[J]. 医学影像学杂志,2019,29(6):1009-1012
[23] AVESANI G,CALIOLO G,GUI B,et al. Pearls and potential pitfalls for correct diagnosis of ovarian cystadenofibroma in MRI:a pictorial essay[J]. Korean J Radiol,2021,22(11):1809-1821.
(收稿日期" 2024-01-02)

