澳洲坚果叶片黄化期间光合能量代谢相关基因的表达研究



摘""要:叶片光合作用是维持植物生命活动的能量来源,但在华南地区一些澳洲坚果品种的新梢叶片通常在夏季持续高温条件下发生黄化,严重影响了植株生长和果实生产。为了探究澳洲坚果黄化叶片的光合能量发生机制,本研究基于前期获得的HAES344澳洲坚果不同黄化时期叶片转录组测序数据,鉴定与筛选光合能量代谢相关基因,并通过qRT-PCR分析光合能量代谢中的关键基因在HAES344澳洲坚果叶片黄化过程中的表达变化。结果表明:通过KEGG功能注释和富集分析,在HAES344澳洲坚果叶片黄化期间共鉴定出96个差异表达基因与能量代谢相关,以氧化磷酸化路径富集的差异基因数量最多,其次是碳固定路径,而富集到天线蛋白的差异基因最少;经过筛选(RPKMgt;0.5),共获得43个基因与光合能量代谢相关,其中有27个基因的表达量在黄化叶片中明显降低,另有16个基因的表达量变化则相反。利用qRT-PCR分析光合能量代谢中重要功能基因的相对表达量发现,在HAES344澳洲坚果黄化叶片中有关光系统Ⅱ(PSⅡ)天线蛋白编码基因CAP10A、ATP合酶亚基蛋白编码基因(ATPC、ATPF)、碳同化酶基因(GAPA、GPD、At4g2652、rbcL)、硫氧还蛋白编码基因(Os05g0200100、CXXS1)及质体蛋白跨膜转运基因TIC32的转录水平均显著低于其正常叶片,而有关硫代谢基因(SIR、APR3)和环式电子传递介导基因(PGR5、ndhB、ndhD)的相对表达量则显著高于其正常叶片,表明澳洲坚果黄化叶片中光合能量代谢相关基因的表达模式发生了较大改变,进而影响了光合能量的产生。该研究结果为深入探讨光合能量代谢相关基因在澳洲坚果黄化叶片中的作用机制提供参考依据。
关键词:澳洲坚果;叶片黄化;光合作用;能量代谢;电子传递中图分类号:S664.9""""""文献标志码:A
Expression"of"Genes"Related"to"Photosynthetic"Energy"Metabolism"During"Leaf"Yellowing"of"Macadamia
YANG"Weihai,"GUO"Shanxiang,"XU"Ting,"XIAO"Yi,"LEI"Wenjun
College"of"Life"Science"and"Resources"and"Environment,"Yichun"University,"Yichun,"Jiangxi"336000,"China
Abstract:"Leaf"photosynthesis"is"the"energy"source"of"plant"life"activities."However,"some"macadamia"varieties"(Macadamia"integrifolia)"planted"in"southern"China"are"prone"to"generate"the"etiolated"leaves"under"the"continuous"high"temperature"in"summer,"which"seriously"affects"the"shoot"growth"and"fruit"production"of"macadamia"trees."In"order"to"explore"the"mechanism"of"photosynthetic"energy"generation"in"the"etiolated"leaves"of"macadamia,"the"genes"related"to"photosynthetic"energy"metabolism"were"identified"and"screened"in"this"study,"based"on"the"previously"obtained"transcriptome"sequencing"data"from"the"leaves"of"HAES344"macadamia"at"different"yellowing"stages,"and"the"expression"changes"of"the"key"genes"in"photosynthetic"energy"metabolism"were"analyzed"during"leaf"yellowing"of"HAES344"macadamia"by"qRT-PCR."96"genes"with"differential"expression"in"the"etiolated"leaves"of"HAES344"macadamia"were"identified"to"be"related"to"energy"metabolism"according"to"KEGG"functional"annotation"and"enrichment"analysis,"and"the"number"of"the"differentially"expressed"genes"enriched"in"the"oxidative"phosphorylation"pathway"was"the"highest,"followed"by"carbon"fixation"pathway,"and"the"least"genes"were"enriched"in"the"antenna"proteins."After"screening"(RPKMgt;0.5),"a"total"of"43"genes"related"to"photosynthetic"energy"metabolism"were"obtained."Among"these"genes,"the"expression"level"of"27"genes"decreased"significantly"in"the"yellowed"leaves,"while"the"remaining"16"genes"did"the"opposite."Through"the"qRT-PCR"analysis"of"the"relative"expression"level"of"key"functional"genes"in"the"photosynthetic"energy"metabolism,"the"CAP10A"gene"encoding"photosystem"Ⅱ"(PSⅡ)"antenna"protein,"the"ATPC"and"ATPF"genes"encoding"ATPase"subunit"protein,"the"enzyme"genes"related"to"carbon"assimilation"(GAPA,"GPD,"At4g2652"and"rbcL),"the"Os05g0200100"and"CXXS1"genes"encoding"thioredoxin,"and"the"TIC32"gene"associated"with"plastid"protein"transmembrane"transport"showed"a"significant"lower"transcription"level"in"the"etiolated"leaves"of"HAES344"macadamia"compared"with"the"normal"leaves,"while"the"SIR"and"APR3"genes"related"to"sulfur"metabolism"and"the"PGR5,"ndhB"and"ndhD"genes"mediating"cyclic"electron"transfer"did"the"opposite,"which"suggested"that"the"greatly"changed"expression"patterns"of"genes"related"to"photosynthetic"energy"metabolism"affected"the"production"of"photosynthetic"energy"in"the"macadamia"yellowing"leaves."The"results"of"this"study"would"provide"a"reference"for"further"exploring"the"mechanism"of"photosynthetic"energy"metabolism-related"genes"in"the"etiolated"leaves"of"macadamia.
Keywords:"macadamia"(Macadamia"integrifolia);"leaf"yellowing;"photosynthesis;"energy"metabolism;"electron"transport
DOI:"10.3969/j.issn.1000-2561.2024.06.003
澳洲坚果(Macadamia"integrifolia)起源于澳大利亚,因其果仁营养丰富、风味独特而在热带及亚热带地区广泛栽培。中国是澳洲坚果生产大国,种植面积超过20万hm2,稳居世界第一[1]。云南与广西作为我国澳洲坚果的两大重要产区,其主栽品种HAES344和桂热1号在夏季持续的高温条件下经常出现新梢叶片黄化现象,严重时甚至干枯,进而影响果实产量[2],严重制约了当地澳洲坚果产业的发展。
光合作用对高温胁迫尤为敏感。高温能够破坏光系统Ⅱ(PSⅡ)的捕光天线系统、供体侧放氧复合体以及反应中心结构,影响PSⅡ受体侧电子传递及其光合放氧功能;同时,高温影响光合反应过程中相关酶的活性,进而影响碳同化效率[3]。核酮糖-1,5-二磷酸(RuBP)羧化酶/加氧酶(Rubisco)是碳同化的关键酶和限速酶,该酶在叶绿体基质中大部分处于钝化形态,只有经Rubisco活化酶(RCA)活化后才具备活性[4]。然而,RCA对高温非常敏感,因RCA活性受到抑制而造成活化的Rubisco数量减少,是高温胁迫下叶片Rubisco活性及光合速率降低的一个重要原因[5]。在梨黄化叶片中,RCA活性及其编码基因Rubisco"activase"Ⅳ/Ⅴ的表达均正向调控光合作用[6]。Rubisco的大亚基(rbcL)在光合作用中起着关键性作用[7],胁迫条件下rbcL基因的表达量下调可导致其光合作用下降[8-9]。另外,甘油醛-3-磷酸脱氢酶(GAPDH)[10]、果糖-1,6-二磷酸醛缩酶(FBA)[11]、核糖-5-磷酸异构酶(RPI)[12]等酶的活性水平也与卡尔文循环的运转速率有关,影响着植物的光合能力。高温条件下,叶绿体中GAPDH[13]与FBA[6,"14]显著上调表达,有利于提高其编码酶的蛋白表达水平及活性,增强叶片光合能力。
正常情况下,光反应能够为碳同化提供比例合适的ATP/NADPH能量分子。然而,发生在类囊体片层的光反应是容易受到高温胁迫损伤的关键位点,造成ATP及NADPH的生产和消耗失衡,进而诱导光化学电子传递链组分过度还原与活性氧(ROS)过量产生,导致光抑制的增强和光系统的氧化损伤[15-16]。在叶绿体中,ATP是由ATP合酶(ATPase)催化光合磷酸化反应而产生,NADPH则是在线性电子传递链末端通过叶型铁氧还蛋白(Fd)-NADP+氧化还原酶(LFNR)催化而成。高温胁迫明显降低苜蓿叶绿体的ATPase"活性和ATP含量,光合速率亦明显下降[17]。叶面喷施亚精胺可显著增加热胁迫下ATPase亚基CF1及其编码基因ATPA的表达[18]。ZHANG等[19]指出,高温胁迫容易使得光合线性电子传递受阻,导致非循环光合磷酸化活性下降,影响ATP的产生。HUANG等[20]发现,在短暂的温度胁迫下,植物会激活围绕光系统Ⅰ(PSⅠ)的环式电子传递,亦可通过ATPase驱动ATP合成,保证有足够的ATP用于碳同化、光呼吸以及PSⅡ修复。YAMORI等[21]认为,环式电子传递循环对提高叶绿体内ATP含量或者ATP/NADPH比值以及保护光系统免遭胁迫引起的氧化损害具有重要作用。然而,环式电子传递循环对各电子载体的氧化还原平衡高度敏感。温度变化可通过影响硫氧还蛋白(Trx)的氧化还原状态来调节电子载体的氧化还原活性及其电子传递效率[22]。KANG等[23]认为,Trx不仅可以通过依赖Fd的Trx氧化还原酶(FTR)调节PGR5/PGRL1介导的环式电子传递途径,也可以通过依赖NADPH的Trx还原酶C(NTRC)控制光合电子传递和非光化学淬灭,还能够对叶绿体酶(如GAPDH、RCA)的巯基进行还原调控,以调节光合碳同化过程。过表达NTRC能够促进叶绿体ATPase和Trx调节酶的活化[23],提高PGR5表达量可增强环式电子流[24],进而增强植物的抗性。
前期研究已表明,受高温胁迫引发的HAES344澳洲坚果黄化叶片中叶绿素含量和PSⅡ活性均明显降低[2],但在叶片黄化过程中光合能量代谢相关基因的表达情况尚不清楚。因此,本研究基于前期测序的HAES344澳洲坚果黄化叶片转录组数据[25],采用生物信息学方法对其光合能量代谢相关差异表达基因进行筛选,通过qRT-PCR进一步分析其中重要基因的表达变化,进而解析澳洲坚果叶片黄化过程中光合能量代谢相关基因的差异表达规律,为深入认识澳洲坚果叶片黄化机理奠定基础。
1""材料与方法
1.1""材料
以广东省湛江市的3株树冠生长较一致、夏梢正常抽生的8~10年生HAES344澳洲坚果植株作为供试材料,于2019年6月1日(S1:全绿叶片)、20日(S2:中度黄化叶片,黄化面积占总叶面积的50%~70%)和28日(S3:重度黄化叶片,黄化面积接近100%)分别在树冠外围采集夏梢上初始成熟的第4~5轮叶片作为样品(图1),将叶片用超纯水冲洗干净后剪碎,置于–80"℃冰箱中备用。
1.2""方法
1.2.1""能量代谢相关基因的筛选""基因表达量数据来源于前期获得的HAES344澳洲坚果不同黄化时期叶片(各时期均为3个生物学重复)转录组数据[25]。利用DESeq2软件进行差异基因分析,结合KEGG、Nr、Pfam等数据库的基因功能注释,按照Plt;0.05且[∣log2"(Fold"Change)∣≥1]的标准,筛选出HAES344澳洲坚果叶片黄化过程中与能量代谢相关的差异表达基因。
1.2.2""qRT-PCR分析""从能量代谢差异基因中选择与光合作用相关的部分重要基因进行qRT-PCR分析。根据转录组测序结果中的转录本序列,应用Primer"Premier"6.0软件设计引物,以澳洲坚果中的苹果酸脱氢酶基因MDH为内参基因[26]。基因的引物序列委托南京集思慧远生物科技有限公司合成(表1)。
应用多糖多酚植物总RNA试剂盒(DP441,北京天根生化科技有限公司)提取叶片样品的RNA,经检测RNA质量后,使用Hifair®Ⅲ"1st"Strand"cDNA"Synthesis"SuperMix"for"qPCR试剂盒(YEASEN,上海翌圣生物科技股份有限公司)反转录合成第1链cDNA,再采用Genious"2×"SYBR"Green"Fast"qPCR"Mix试剂盒(ABclonal,武汉爱博泰克生物科技有限公司)对目标基因进行qRT-PCR检测。PCR反应体系(20"μL)为:1.0"µL"cDNA,1.0"µL正向引物,1.0"µL反向引物,10"µL"SYBR"Premix"Ex"Taq,7.0"µL"ddH2O。测定仪器为BIOER实时荧光定量PCR仪(FQD-96A),反应程序(两步法)为:95"℃"5"min,95"℃"10"s,60"℃"30"s,40个循环。试验设置3个生物学重复,每个样品重复3次;用2-∆∆CT法计算基因的相对表达量。
1.3""数据处理
所有的试验数据均是3个独立生物学重复的平均值,利用SPSS"16.0统计软件对数据进行One-"Way"ANOVA(LSD测验)检验,Plt;0.05表示显著性差异。应用GraphPad"Prism"8.0软件制图。
2""结果与分析
2.1""能量代谢相关基因的鉴定
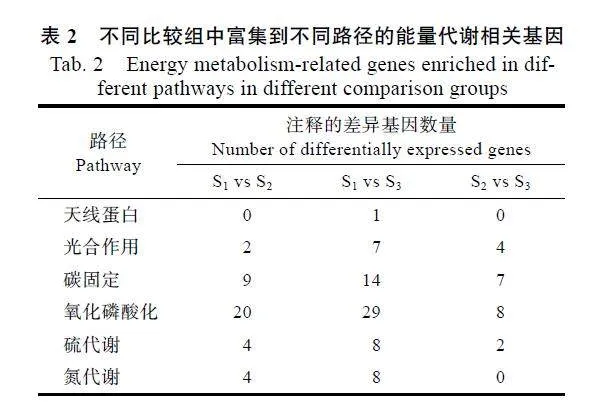
基于前期获得的HAES344澳洲坚果不同黄化时期(S1、S2和S3)叶片转录组数据[25],根据KEGG的注释结果,鉴定出96个与能量代谢途径相关的差异基因。如图2A所示,S1"vs"S2、S1"vs"S3和S2"vs"S3比较组分别有6、17和14个上调基因以及33、46和6个下调基因。韦恩图分析表明,仅有2个差异基因共同存在于S1"vs"S2、S1"vs"S3和S2"vs"S3比较组中,但S1"vs"S2和S1"vs"S3共同包含的差异基因最多,达到18个(图2B)。
KEGG富集分析表明,S1"vs"S2、S1"vs"S3和S2"vs"S3分别有20、29和8个差异基因注释到氧化磷酸化路径,是基因数量富集最多的路径;其次是碳固定路径,3个比较组中分别有9、14和7个差异基因得到注释,但注释到天线蛋白的差异基因最少,仅在S1"vs"S3中发现有1个基因被注释(表2)。
2.2""光合能量代谢相关基因的表达分析
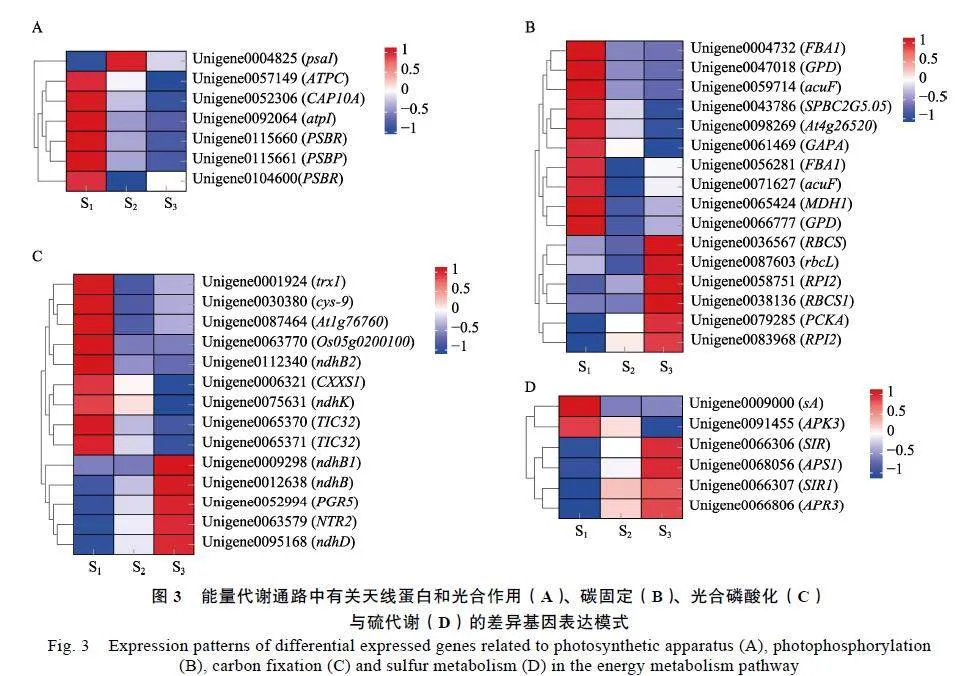
筛除低表达丰度的基因(RPKMlt;0.5)后,共获得1个天线蛋白基因CAP10A和6个光合作用相关基因(图3A)以及16个碳固定相关基因(图3B)、14个光合磷酸化相关基因(图3C)与6个硫代谢相关基因(图3D),这些基因在HAES344澳洲坚果叶片黄化过程中具有不同的表达趋势。
与正常绿叶(S1)相比,在天线蛋白与光合作用途径中,除PSⅠ相关基因psaI在黄化叶片S2中显著上调表达外,其余6个基因则在黄化叶片(S2、S3)中显著下调表达,包括2个ATPase相关基因(ATPC与atpI)和4个PSⅡ复合体组成蛋白相关基因(CAP10A、PSBP和2个PSBR)(图3A);在碳固定途径中,包括3个FBA编码基因(2个FBA1和At4g26520)、3个GAPDH编码基因(GAPA和2个GPD)等在内的10个基因在黄化叶片中显著下调表达,而另外的6个基因的表达则相反,其中包括2个RPI编码基因(RPI2)和3个Rubisco相关基因(rbcL、RBCS和RBCS1)(图3B);在光合磷酸化途径中,包括4个Trx编码基因(Trx1、CXXS1、Os05g0200100、Atlg76760)、2个NADH-质体醌氧化还原酶相关基因(ndhK与ndhB2)和2个LFNR跨膜转运相关基因(TIC32)等在内的9个基因均在黄化叶片中发生下调表达,而包括Trx还原酶编码基因NTR2、PGR5蛋白编码基因PGR5、NADH脱氢酶(NDH)相关基因ndhB等在内的5个基因的表达则相反(图3C);对于硫代谢相关基因,包括亚硫酸还原酶(SIR)编码基因(SIR和SIR1)、5'-腺苷酰硫酸还原酶(APR)基因APR3等在内的4个基因均在黄化叶片中明显上调表达,其余2个基因的表达则相反(图3D)。这一结果显示,上述基因的显著上调或下调表达可能在HAES344澳洲坚果叶片黄化过程中对光合能量代谢具有正调控或负调控作用。
2.3""光合能量代谢相关基因的qRT-PCR分析
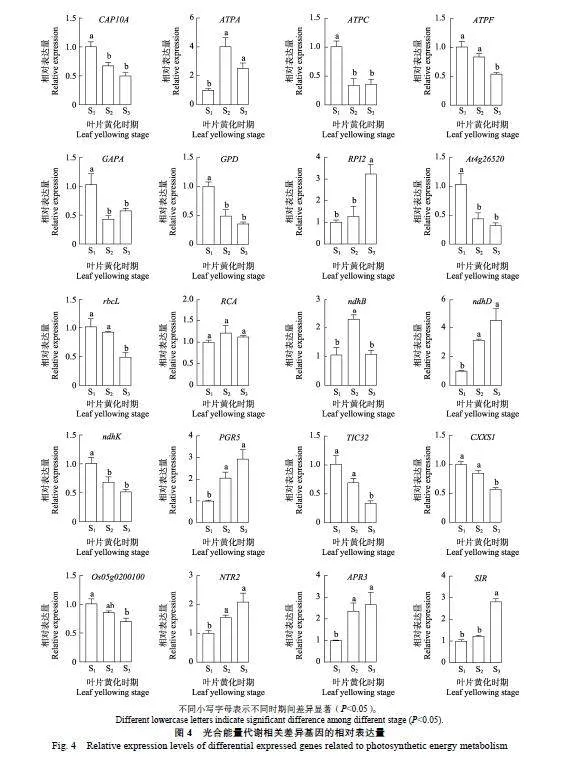
对20个重要的光合能量代谢相关基因进行qRT-PCR分析发现,CAP10A、ATPC、ATPF、rbcL、GAPA、GPD、At4g26520、ndhK、TIC32、CXXS1和Os05g0200100的相对表达量在叶片黄化过程中逐渐降低。其中,CAP10A、ATPC、GAPA、GPD、At4g26520和ndhK在S1时期的相对表达量均显著高于S2和S3,但其在S2与S3之间的表达量差异均不显著;ATPF、rbcL、TIC32和CXXS1在S3时期的相对表达量均显著低于S1和S2,而其在S1与S2之间的表达量差异均不显著;Os05g0200100在S1时期的相对表达量显著高于S3,但其在S1与S2之间以及S2与S3之间的表达量差异均不显著(图4)。
在叶片黄化期间,RPI2、ndhD、PGR5、NTR2、APR3和SIR的相对表达量逐渐升高。其中,ndhD、PGR5、NTR2和APR3在S1时期的相对表达量均显著低于S2和S3,但其在S2与S3之间的表达量差异均不显著;RPI2和SIR在S3时期的相对表达量均显著高于S1和S2,而其在S1与S2之间的表达量差异均不显著。另外,ATPA和ndhB的相对不同小写字母表示不同时期间差异显著(Plt;0.05)。
表达量均呈现先升后降的变化趋势,RCA的表达变化则相对平稳。其中,ATPA在S2和S3时期的相对表达量均显著高于S1,但其在S2与S3之间差异不明显;ndhB在S2时期的相对表达量均显著高于S1和S3,但其在S1与S3之间差异不显著(图4)。
3""讨论
在本研究中,基于KEGG注释和富集分析,从鉴定出的96个与能量代谢途径相关的差异基因中筛选到了43个参与光合能量代谢的功能基因,发现有27个基因在HAES344澳洲坚果黄化叶片中下调表达,其余16个基因则在黄化叶片中上调表达,说明这些基因对黄化叶片的光合能量代谢发挥了重要作用。进一步选取20个关键的光合能量代谢相关基因进行实时荧光定量PCR分析发现,大部分基因的相对表达量变化与转录组中基因的RPKM值变化趋势基本一致,进一步表明本研究挑选的20个关键基因极可能参与了光合能量代谢。
3.1""PSⅡ结构与功能
夏季高温常导致HAES344澳洲坚果新梢叶片变黄,这与ROS积累引起的叶绿素降解和PSⅡ损伤密切相关[2]。叶绿素作为光合作用的决定性因素,影响着光合同化产物的形成[27]。植物在进行光合作用时,叶绿素只有与叶绿素a/b结合蛋白结合形成色素蛋白复合体后才能行使其吸收与传递光能以及参与光化学反应的功能。CP24是PSⅡ捕光天线中的一种外周捕光天线蛋白,在传递光能、维持PSII及类囊体膜结构、耗散过量激发能方面起着重要作用[28]。贾兵等[6]认为,增强砀山酥梨黄化叶片中叶绿素a/b结合蛋白编码基因Chl"a-b"P4/CP24/29.1的表达量可提升类囊体膜中电子及质子的转移能力。KOVÁCS等[29]证实,CP24蛋白与ROS的清除有关,在敲除其编码基因的拟南芥植株中ROS的积累明显较野生型更高。本研究中,编码CP24的CAP10A在澳洲坚果叶片黄化期间显著下调表达,可能是由于澳洲坚果黄化叶片中ROS过量累积所引起的CP24蛋白降解所致,进而影响光能的吸收与传递。另外,PSBP和PSBR也在黄化叶片中显著下调表达,意味着PSⅡ复合体的结构完整性和驱动电子传递反应功能可能遭到破坏[30]。
3.2""叶绿体ATP合成
碳同化是叶绿体利用光反应中形成的同化力(ATP和NADPH)将CO2转化为稳定碳水化合物的过程。其中,ATP是由ATPase催化光合磷酸化反应而产生。高温下编码叶绿体ATPase中CF1蛋白α亚基的ATPA和γ亚基的ATPC1在白杨叶片中显著上调表达,促进ATP的合成以用于PSⅡ修复[31],但在遭受热胁迫的黄瓜叶片中ATPA明显下调表达[18]。本研究中,ATPC和编码CF0蛋白a亚基的ATPF均在HAES344澳洲坚果黄化叶片中显著下调表达,表明ATPase的CF1及CF0蛋白含量明显减少,可能使得CF0与CF1的结合更松散,导致CF1脱离CF0,进而造成ATPase丧失ATP合成功能而表现出ATP酶水解ATP的活性[30]。因此,ATPA在黄化叶片中表现为显著上调表达,说明ATPase水解ATP的能力增强,可能是通过释放能量来提高黄化叶片应对ROS过量积累的一种防卫反应[32]。
3.3""环式电子传递
电子传递链是光合作用形成同化力的核心环节。在高等植物的叶绿体中,NADPH是在光合线性电子传递的最后一步反应中通过LFNR催化还原NADP+而成。杨超等[33]认为,位于叶绿体内膜上的易位子TIC参与了将LFNR前体蛋白从细胞质基质中转运至叶绿体的定位过程。TIC32属于TIC复合体的亚基,介导了质体蛋白这一转运过程[34]。本研究发现,TIC32在黄化叶片中显著下调表达,意味着LFNR的跨膜转运可能发生减弱,进而限制了线性电子传递,降低了叶绿体基质中NADPH的生成能力。环式电子传递是叶绿体中ATP合成的一个重要替代路径,存在PGRL1/PGR5介导途径与NAD(P)H脱氢酶(NDH)复合体介导途径,对植物正常生长发育和抵御逆境具有重要作用[35]。DALCORSO等[36]认为,PGRL1/PGR5复合体可作为质子梯度调节蛋白参与高温条件下线性电子流到环式电子流的转换,对诱导热耗散和保护PSⅡ免遭光抑制是必需的。NDH介导的环式电子传递能够缓解叶绿体基质过度还原,维持电子传递链氧化还原系统的平衡,驱动ATP合成[35]。敲除编码NDH基因的烟草对高温胁迫敏感[37]。本研究中,PGR5、ndhB和ndhD在黄化叶片中显著上调表达,意味着黄化叶片能通过增强环式电子流来生成ATP和耗散过剩热量,用以修复或减轻氧化胁迫对光系统造成的损伤。然而,ndhK和ndhB2在黄化叶片中显著下调表达,说明黄化叶片中构成NDH复合体的亚基含量明显减少,暗示了整个NDH复合体的稳定性可能受到影响[35]。
3.4""叶绿体氧化还原状态
硫氧还蛋白(Trx)是一类小分子蛋白,不仅直接参与ROS的清除,还能通过改变其氧化还原状态来调节光合电子传递速率[22]。KANG等[23]认为,在Trx系统中,氧化态的Trx和Trx类蛋白可被NTR还原,用以维持叶绿体的氧化还原平衡。本研究表明,编码Trx的Trx1和Os05g0200100以及编码Trx类蛋白的CXXS1均在黄化叶片中显著下调表达,意味着Trx的功能可能受到抑制,导致黄化叶片细胞内的氧化还原状态失衡,进而影响了光合电子传递;然而,NTR2显著上调表达,表明黄化叶片可能发生了氧化应激,通过将Trx从氧化态转化为还原态,提高其清除ROS的能力,以缓解氧化胁迫。硫代谢在植物体的生长发育中起着至关重要的作用,SIR和APR可充当电子供体来还原Trx[38]。在黄化叶片中,SIR和APR3的相对表达量显著增加,说明更多的Trx可能得到还原,用以维持光合电子传递和抵抗氧化胁迫。
3.5""碳同化能力
在光合碳同化过程中,Rubisco是最重要的限速酶,但Rubisco活性受到RCA的调控[4]。紫花苜蓿叶片中编码Rubisco大亚基的rbcL在干热胁迫下呈现出先显著增加、后持续降低的表达变化趋势[9],干旱胁迫下rbcL的下调表达导致冬油菜叶片光合作用的下降[8]。PERDOMO等[5]认为,高温胁迫下叶片中Rubisco活性的降低是因为RCA活性受到高温抑制而造成活化的Rubisco数量减少所致。本研究发现,rbcL在重度黄化叶片中显著下调表达,表明Rubisco的大亚基发生了降解,可能是黄化叶片中ROS引起的酶促或非酶促裂解所致[7]。然而,RCA的表达在叶片黄化过程中未发生显著性变化,意味着RCA可能发生了热聚合,使得RCA从可溶性组分向不溶性组分转移,导致RCA含量变化不明显[39]。另外,卡尔文循环的运转速率与GAPDH、FBA、RPI等酶的活性水平关系密切[10-12]。GAPDH是催化光合最初产物1,3-二磷酸甘油酸还原为3-磷酸甘油醛的关键调节酶,其活性的高低会影响光合速率及光合产物的积累。叶绿体GAPDH上调表达及其编码的酶活性提高,有利于增强光合代谢在逆境下的抗性[13]。本研究结果表明,编码GAPDH的GAPA和GPD在黄化叶片中显著下调表达,说明黄化叶片的光合能力下降,也意味着GAPDH的活性变化可能与叶绿体所遭受的氧化还原失衡有关[23]。FBA所催化的反应位于RuBP再生阶段,在很大程度上控制碳的固定和流量。本研究中,编码FBA的At4g2652也在黄化叶片中显著下调表达,意味着RuBP的再生能力减弱,与HAAKE等[11]发现马铃薯叶中因FBA表达减弱而引起光合作用显著降低的结果较一致。然而,编码核糖-"5-磷酸异构酶的RPI2在重度叶片黄化中显著上调表达,可能是黄化叶片对高温环境的应激响应所致。
4""结论
本研究基于转录组数据分析,确定了43个光合能量代谢相关基因在HAES344澳洲坚果夏梢叶片自然黄化过程的表达模式;通过qRT-PCR分析发现,CAP10A、ATPC、ATPF、GAPA、GPD、At4g2652与rbcL等基因在黄化叶片中显著下调表达,可能导致了PSⅡ捕获天线蛋白降解、叶绿体ATP合成功能减弱和碳同化能力下降,而PGR5、ndhB、ndhD、NTR2、SIR和APR3等基因显著上调表达以及TIC32、Os05g0200100、CXXS1等基因显著下调表达,可能造成叶绿体内氧化还原状态失衡,并激发环式电子流,用以减轻氧化胁迫对光合能量机构的损伤。本研究为深入探讨澳洲坚果叶片黄化机制提供参考依据。
参考文献
[1]"杨为海,"曾利珍,"曾辉,"万继锋,"陈倪,"邹明宏,"陆超忠,"张汉周,"罗炼芳,"朱文华."澳洲坚果种质资源叶片形态性状观测分析[J]."热带作物学报,"2020,"41(1):"69-76."YANG"W"H,"ZENG"L"Z,"ZENG"H,"WAN"J"F,"CHEN"N,"ZOU"M"H,"LU"C"Z,"ZHANG"H"Z,"LUO"L"F,"ZHU"W"H."Investigation"and"analysis"on"leaf"morphological"characters"of"macadamia"germplasm"resources[J]."Chinese"Journal"of"Tropical"Crops,"2020,"41(1):"69-76."(in"Chinese)
- 杨为海,"曾辉,"万继锋,"张汉周,"陆超忠."高温条件下澳洲坚果叶片黄化的生理特性[J]."热带作物学报,"2021,"42(3):"830-838.YANG"W"H,"ZENG"H,"WAN"J"F,"ZHANG"H"Z,"LU"C"Z."Preliminary"study"on"physiological"characteristics"of"macadamia"leaf"etiolation"under"high"temperature[J]."Chinese"Journal"of"Tropical"Crops,"2021,"42(3):"830-838."(in"Chinese)
- 唐婷,"郑国伟,"李唯奇."植物光合系统对高温胁迫的响应机制[J]."中国生物化学与分子生物学报,"2012,"28(2):"127-132.TANG"T,"ZHENG"G"W,"LI"W"Q."Defense"mechanisms"of"plants"photosystem"to"heat"stress[J]."Chinese"Journal"of"Biochemistry"and"Molecular"Biology,"2012,"28(2):"127-132."(in"Chinese)
- PORTIS"J"A"R."Rubisco"activase-rubisco’s"catalytic"chaperone[J]."Photosynthesis"Research,"2003,"75:"11-27.
- PERDOMO"J"A,"CAPÓ-BAUCÀ"S,"CARMO-SILVA"E,"GALMÉS"J."Rubisco"and"rubisco"activase"play"an"important"role"in"the"biochemical"limitations"of"photosynthesis"in"rice,"wheat,"and"maize"under"high"temperature"and"water"deficit[J]."Frontiers"in"Plant"Science,"2017,"8:"490."
- 贾兵,"董炜昱,"郭国凌,"张舒琴,"陈猛,"许波,"衡伟."外源Fe2+对梨黄化叶光合能力及糖合成代谢的影响[J]."果树学报,"2022,"39(1):"25-35.JIA"B,"DONG"W"Y,"GUO"G"L,"ZHANG"S"Q,"CHEN"M,"XU"B,"HENG"W."Effects"of"ferrous"sulfate"applied"by"foliar"spray"on"photosynthesis"and"photoproducts"metabolism"of"the"chlorotic"pear"leaves"(Pyrus"bretschneideri"‘DangshanSuli’)[J]."Journal"of"Fruit"Science,"2022,"39(1):"25-35."(in"Chinese)
- 刘拥海,"彭新湘,"李明启."水稻叶片中过氧化氢与核酮糖-1,5-二磷酸羧化酶/加氧酶降解的关系[J]."植物生理学报,"2000,"26(6):"481-486."LIU"Y"H,"PENG"X"X,"LI"M"Q."Degradation"of"ribulose-1,5-bisphosphate"carboxylase/oxygenase"in"rice"leaves"under"oxidative"stress"induced"by"methyl"viologen[J]."Acta"Phytophysiologica"Sinica,"2000,"26(6):"481-486."(in"Chinese)
- 米超,"赵艳宁,"刘自刚,"陈其鲜,"孙万仓,"方彦,"李学才,"武军艳."白菜型冬油菜"RuBisCo"蛋白亚基基因rbcL和rbcS的克隆及其在干旱胁迫下的表达[J]."作物学报,"2018,"44(12):"1882-1890.MI"C,"ZHAO"Y"N,"LIU"Z"G,"CHEN"Q"X,"SUN"W"C,"FANG"Y,"LI"X"C,"WU"J"Y."Cloning"of"RuBisCo"subunits"genes"rbcL"and"rbcS"from"winter"rapeseed"(Brassica"rapa)"and"their"expression"under"drought"stress[J]."Acta"Agronomica"Sinica,"2018,"44(12):"1882-1890."(in"Chinese)
- 许超,"何承刚,"牟兰,"毕玉芬,"姜华."干热胁迫下紫花苜蓿Rubisco羧化酶和活化酶活性变化及其基因表达的研究[J]."草地学报,"2021,"29(2):"228-293."XU"C,"HE"C"G,"MU"L,"BI"Y"F,"JIANG"H."The"activities"of"rubisco"carboxylase"and"activase"and"their"gene"expressions"in"alfalfa"under"drought"and"heat"stresses[J]."Acta"Agrestia"Sinica,"2021,"29(2):"228-293."(in"Chinese)
- 张爱军,"商振清,"董永华,"李广敏,"张晓红."6-BA和KT对干旱条件下小麦旗叶甘油醛-3-磷酸脱氢酶及光合作用的影响[J]."河北农业大学学报,"2000,"32(2):"37-41."ZHANG"A"J,"SHANG"Z"Q,"DONG"Y"H,"LI"G"M,"ZHANG"X"H."Effect"of"6-BA"and"KT"on"glyceraldehy-3-phospate"dehydrogenase"activity"and"phytosynthesis"in"wheat"flag"leaves"under"soil"drought[J]."Journal"of"Agricultural"University"of"Hebei,"2000,"32(2):"37-41."(in"Chinese)
- HAAKE"V,"ZRENNER"R,"SONNEWALD"U,"STITT"M."Amoderate"decrease"of"plastid"aldolase"activity"inhibits"photosynthesis,"alters"the"levels"of"sugars"and"starch,"and"inhibits"growth"of"potato"plants[J]."The"Plant"Journal,"1998,"14(2):"147-157.
- 巴桑玉珍,"扎桑,"王玉林,"徐齐君,"原红军,"尼玛扎西."青稞新光合作用相关基因的克隆和序列分析[J]."大麦与谷类科学,"2017,"34(6):"1-7."BASANG"YUZHEN,"ZASANG,"WANG"Y"L,"XU"Q"J,"YUAN"H"J,"NYIMA"TASHI."Cloning"and"sequence"analysis"of"photosynthesis-related"genes"in"Tibetan"hulless"barley"(Hordeum"vulgare"L."var."Nudum"HK."f.)[J]."Barley"and"Cereal"Sciences,"2017,"34(6):"1-7."(in"Chinese)
- 吴巧玉,"何天久."五种相关光合蛋白基因在马铃薯野生种冷驯化中的表达分析[J]."种子,"2021,"40(12):"56-60.WU"Q"Y,"HE"T"J."Expression"analysis"of"five"photosynthesis-related"protein"genes"in"cold"acclimation"of"wild"potato"varieties[J]."Seed,"2021,"40(12):"56-60."(in"Chinese)
- MICHELIS"R,"GEPSTEIN"S."Identification"and"characterization"of"a"heat"induced"isoform"of"aldolase"in"oat"chloroplast[J]."Plant"Molecular"Biology,"2000,"44:"487-498.
- LI"H,"AHAMMED"G"J,"ZHOU"G"N,"XIA"X"J,"ZHOU"J,"SHI"K,"YU"J"Q,"ZHOU"Y"H."Unraveling"main"limiting"sites"of"photosynthesis"under"below-"and"above-ground"heat"stress"in"cucumber"and"the"alleviatory"role"of"luffa"rootstock[J]."Frontiers"in"Plant"Science,"2016,"7:"746.
- CHOUDHURY"F"K,"RIVERO"R"M,"BLUMWALD"E,"MITTLER"R."Reactive"oxygennbsp;species,"abiotic"stress"and"stress"combination[J]."The"Plant"Journal,"2017,"90:"856-867.
- 莫亿伟,"郭振飞."温度胁迫对苜蓿和柱花草光合作用及N同化的影响[J]."草地学报,"2008,"16(1):"100-102."MO"Y"W,"GUO"Z"F."The"Effects"of"temperature"stress"on"photosynthesis"and"nitrogen"reduction"of"alfalfa"and"Guyana"stylosanthes[J]."Acta"Agrestia"Sinica,"2008,"16(1):"100-102."(in"Chinese)
- WANG"L,"ZHOU"H,"GUO"S,"AN"Y,"SHU"S,"LU"N,"SUN"J."Exogenous"spermidine"maintains"the"chloroplast"structure"of"cucumber"seedlings"and"inhibits"the"degradation"of"photosynthetic"protein"complexes"under"high-temperature"stress[J]."Acta"Physiologiae"Plantarum,"2018,"40(3):1-15.
- ZHANG"R,"SHARKEY"T"D."Photosynthetic"electron"transport"and"proton"flux"under"moderate"heatstress[J]."Photosynthesis"Research,"2009,"100:"29-43.
- HUANG"W,"ZHANG"S"B,"CAO"K"F."Cyclic"electron"flow"plays"an"important"role"in"photoprotection"of"tropical"trees"illuminated"at"temporal"chilling"temperature[J]."Plant"Cell"Physiology,"2011,"52:"297-305.
- YAMORI"W,"SHIKANAI"T."Physiological"functions"of"cyclic"electron"transport"around"photosystem"Ⅰ"in"sustaining"photosynthesis"and"plant"growth[J]."Annual"Review"of"Plant"Biology,"2016,"67(1):"81-106.
- DIETZ"K"J,"PFANNSCHMIDT"T."Novel"regulators"in"photosynthetic"redox"control"of"plant"metabolism"and"gene"expression[J]."Plant"Physiology,"2011,"155(4):1477-1485.
- KANG"Z,"QIN"T,"ZHAO"Z."Thioredoxins"and"thioredoxin"reductase"in"chloroplasts:"a"review[J]."Gene,"2019,"706:"32-42."
- OKEGAWA"Y."Characterization"of"factors"affecting"the"activity"of"photosystem"I"cyclic"electron"transport"in"chloroplasts[J]."Plant"amp;"Cell"Physiology,"2008,"49(5):"825-834.
- YANG"W"H,"XU"H"Y,"XIAO"Q"S,"LI"X"P,"SHAO"Q."Combined"analysis"of"metabolome"and"transcriptome"provides"insights"into"metabolisms"of"chlorophylls,"carotenoids,"and"flavonoids"in"the"yellowing"leaves"of"‘HAES344’"macadamia[J]."Scientia"Horticulturae,"2023,"308:"111600.
- 杨倩,"杨子平,"周娅丽,"陈东泉,"刘恒."澳洲坚果实时荧光定量"PCR"分析中内参基因的筛选[J]."热带作物学报,"2020,"41(8):"1505-1512."YANG"Q,"YANG"Z"P,"ZHOU"Y"L,"CHEN"D"Q,"LIU"H."Screening"of"stable"reference"genes"for"qRT-PCR"analysis"in"Macadamia"integrifolia[J]."Chinese"Journal"of"Tropical"Crops,"2020,"41(8):"1505-1512."(in"Chinese)
- LI"J,"CAO"X"M,"JIA"X"C,"LIU"L"Y,"CAO"H"W,"QIN"W"Q,"LI"M."Iron"deficiency"leads"to"chlorosis"through"impacting"chlorophyll"synthesis"and"nitrogen"metabolism"in"Areca"catechu"L.[J]."Frontiers"in"Plant"Science,"2021,"12:"710093."
- 李韵佳."低温胁迫下三倍体枇杷微量捕光天线蛋白基因EjLhcb4.1/5/6的功能分析[D]."重庆:"西南大学,"2021.LI"Y"J."Functional"characterization"of"light"harvesting"chlorophyll"a/b"binding"antenna"proteins"EjLhcb4.1/5/6"genes"in"triploid"loquat"(Eriobotrya"japonica)"under"cold"stress[D]."Chongqing:"Southwest"University,"2021."(in"Chinese)
- KOVÁCS"L,"DAMKJǼR"J,"KEREÏCHE"S,"LLIOAIA"C,"RUBAN"A"V,"BOEKEMA"E"J,"JANSSON"S,"HORTON"P."Lack"of"the"light"harvesting"complex"CP24"affects"the"structure"and"function"of"the"grana"membranes"of"higher"plant"chloroplasts[J]."The"Plant"Cell,"2006,"18(11):"3106-3120.
- 武维华."植物生理学[M]."3版."北京:"科学出版社,"2018:"122-130.WU"W"H."Plant"physiology[M]."3rd"ed."Beijing:"Science"Press,"2018:"129-130."(in"Chinese)
- SONG"Y"P,"CHEN"Q"Q,"CI"D,"SHAO"X"N,"ZHANG"D"Q."Effects"of"high"temperature"on"photosynthesis"and"related"gene"expression"in"poplar[J]."BMC"Plant"Biology,"2014,"14:"111.
- 蔡智博."拟南芥atpA基因调控植物响应低温胁迫的分子机制研究[D]."哈尔滨:"东北农业大学,"2020.CAI"Z"B."Studies"on"molecular"mechanism"of"atpA"gene"regulating"plants"response"to"low"temperature"stress"in"Arabidopsis[D]."Harbin:"Northeast"Agricultural"University,"2020."(in"Chinese)
- 杨超,"胡红涛,"吴平,"莫肖蓉."高等植物铁氧还蛋白-"NADP+氧化还原酶研究进展[J]."植物生理学报,"2014,"50"(9):"1353-1366."YANG"C,"HU"H"T,"WU"P,"MO"X"R."Advances"in"the"research"of"ferredoxin-NADP+"oxidoreductase"in"higher"plants[J]."Plant"Physiology"Journal,"2014,"50(9):"1353-1366."(in"Chinese)
- ARONSSON"H,"JARVIS"P."The"chloroplast"protein"import"apparatus,"its"components,"and"their"roles[C]//SANDELIUS"A"S,"ARONSSON"H."Plant"cell"monographs,"Vol."13:"the"chloroplast-interactions"with"the"environment."Heidelberg:"Springer-Verlag,"2009:"100-102.
- 刘玉凤,"王珍琪,"鹿嘉智,"张耀丰,"刘翰林,"王峰,"齐明芳,"李天来."叶绿体NAD(P)H脱氢酶复合体调控光合作用的研究进展[J]."植物生理学报,"2019,"55(7):"932-940."LIU"Y"F,"WANG"Z"Q,"LU"J"Z,"ZHANG"Y"F,"LIU"H"L,"WANG"F,"QI"M"F,"LI"T"L."Regulation"of"chloroplast"NAD(P)H"dehydrogenase"complex"in"photosynthesis[J]."Plant"Physiology"Journal,"2019,"55(7):"932-940."(in"Chinese)
- DALCORSO"G,"PESARESI"P,"MASIERO"S,"ASEEVA"E,"SCHÜNEMANN"D,"FINAZZI"G,"JOLIOT"P,"BARBATO"R,"LEISTER"D."A"complex"containing"PGRL1"and"PGR5"is"involved"in"the"switch"between"linear"and"cyclic"electron"flow"in"Arabidopsis[J]."Cell,"2008,"132(2):"273-285."
- PENG"W,"WEI"D,"TAKABAYASHI"A,"ENDO"T,"SHIKANAI"T,"YE"J"Y,"MI"H"L."Chloroplastic"NAD(P)H"dehydrogenase"in"tobacco"leaves"functions"in"alleviation"of"oxidative"damage"caused"by"temperature"Stress[J]."Plant"Physiology,"2006,"141(2):"465-474.
- KIM"S"K,"RAHMAN"A,"MASON"J"T,"HIRASAWA"M,"CONOVER"R"C,"JOHNSON"M"K,"MIGINIAC-MASLOW"M,"KERYER"E,"KNAFF"D"B,"LEUSTEK"T."The"interaction"of"5′-adenylylsulfate"reductase"from"Pseudomon"asaeruginosa"with"its"substrates[J]."Biochimica"et"Biophysica"Acta,"2005,"1710:"103-112."
- 陈候鸣,"陈跃,"王盾,"蒋德安."核酮糖-1,5-二磷酸羧化酶/加氧酶活化酶在植物抗逆性中的作用[J]."植物生理学报,"2016,"52(11):"1637-1648.CHEN"H"M,"CHEN"Y,"WANG"D,"JIANG"D"A."The"role"of"ribulose-1,5-bisphosphate"carboxylase/oxygenase"activase"in"resistance"of"plant"to"abiotic"stresses[J]."Plant"Physiology"Journal,"2016,"52"(11):"1637-1648."(in"Chinese)

