不同类型湿地土壤周丛生物细菌群落结构特征及影响因素





摘" 要: 为探明不同类型湿地土壤周丛生物细菌群落结构差异及主要影响因素,在上海青西地区的稻田、农用池塘、水上森林和湖泊4种湿地开展了原位培养实验,测定不同湿地土壤理化指标和周丛生物生物量,并通过高通量测序表征了周丛生物细菌群落结构特征. 结果表明:周丛生物生物量表现为水上森林gt;农用池塘gt;湖泊gt;稻田,细菌群落多样性则表现为稻田gt;水上森林和农用池塘gt;湖泊,且水上森林和湖泊土壤细菌群落组成较为相似. 各湿地土壤周丛生物的优势菌为伯克氏菌、假单胞菌、嗜氢菌、黄杆菌等. 土壤中较高的碳(C)、氮(N)和磷(P)含量能增加周丛生物细菌群落多样性,而较高的N和P含量则能提高周丛生物细菌群落均匀度. 土壤pH值和碱性速效磷(AP)是造成不同湿地土壤周丛生物细菌群落结构差异的主要驱动因素. 研究结果可为掌握长三角地区湿地土壤周丛生物细菌群落多样性的空间差异和主要驱动因素提供基础数据.
关键词: 周丛生物; 湿地; 土壤; 细菌群落结构; 环境因子
中图分类号: X 172""" 文献标志码: A""" 文章编号: 1000-5137(2024)03-0341-11
Structural characteristics and influencing factors of bacterial communities in periphyton of different kinds of wetlands
LIANG Longrui1, LI Xilin1, LI Li1, YIN Haitao1, HUANG Nannan1, XIAO Jiamu1,
ZHAO Ang’ang1, XIE Yixuan2, ZHANG Ying2, MENG Liang1,3*
(1.School of Environmental and Geographical Sciences, Shanghai Normal University, Shanghai 200234,China; 2.The Shanghai Key Lab for Urban Ecological Processes and Eco-Restoration,East China Normal University,Shanghai 200241,China; 3.Shanghai Yangtze River Delta Urban Wetland Ecosystem National Field Science Observation Station,
Shanghai Normal University, Shanghai 201718, China)
Abstract: In order to explore the structural differences and the main influencing factors of bacterial communities in periphyton of different types of wetland soils, in situ culture experiments were carried out in four kinds of wetlands in Qingxi Zone, Shanghai, including paddy fields, agricultural ponds, aquatic forests, and lakes. The physical and chemical indicators of different wetland soils and the biomass of the periphyton were measured, and the characteristics of bacterial community structure of periphyton were characterized by high-throughput sequencing. The results showed that the biomass of periphyton was in the order of aquatic forestsgt;agricultural pondsgt;lakesgt;paddy fields and the bacterial community diversity was in the order of paddy fieldsgt;aquatic forests and agricultural pondsgt;lakes, and the bacterial community composition of aquatic forests and lakes was similar. The dominant bacteria of periphyton in the wetland soil were Burkholderia, Pseudomonas, Hydrogenophilus, and Flavobacterium. The higher content of carbon (C), nitrogen (N) and phosphorus (P) in the soil can increase the diversity of the bacterial community, while the higher content of N and P can improve the uniformity of the bacterial community. Alkaline effective phosphorus(AP) and pH in soil were the main driving factors for the differences in the bacterial community structure of periphyton in different wetlands. The results can provide basic data for mastering the spatial differences and main driving factors of bacterial community diversity of periphyton in wetland soil in Yangtze River Delta region.
Key words: periphyton; wetland; soil; bacterial communities structure; environmental factor
0" 前 言
自然环境中的周丛生物主要由细菌、真菌、原生生物等微生物组成,其群落结构组成丰富多样[1]. 周丛生物在湿地中尤为多见,普遍存在于湿地水-土界面之间[2],其可提高湿地生物层次结构,增加湿地物种多样性,丰富湿地生态系统的结构和功能,对维持湿地生态系统稳定起着重要作用.
湿地土壤周丛生物的细菌群落结构极易随环境条件的变化而改变[3]. SU等[4]对比了2种不同生长环境下周丛藻类群落结构的差异,发现在相同培养天数下周丛藻类的优势属存在显著差异. LU等[5]研究了营养物质对周丛生物群落结构的影响;发现营养物质越高,周丛生物群落多样性越低,但其中原生动物多样性则明显升高. 国内外有关周丛生物群落结构特征研究大多关注环境因子对周丛藻类群落结构的影响,而其对周丛生物细菌群落结构影响的研究不多.
周丛生物主要生长于潮湿环境中,因此目前主要关注水体环境因子对周丛生物群落结构的影响,然而湿地中相当数量的周丛生物生长于水土界面,其与下覆土壤接触密切[3],推测土壤理化性质也可能对周丛生物群落结构产生影响. 土壤的pH值和营养物质会影响土壤细菌碳源利用功能的多样性,进而改变细菌群落结构;土壤β⁃葡萄糖苷酶(β-GC)和N-乙酰-β-D-葡萄糖苷酶(NAG)分别能降解纤维素和几丁质[6] ,并产生大量碳(C)源和氮(N)源,从而进一步改变细菌群落结构. 然而上述土壤环境因子及土壤酶活性对所附着周丛生物细菌群落结构的影响规律尚不清楚.
本文作者以长三角一体化示范区内的青西郊野公园为研究区域,研究不同人为干扰程度的淡水湿地土壤周丛生物细菌群落结构差异,掌握影响周丛生物群落结构特征的主要土壤环境驱动因子,为长三角淡水湿地土壤周丛生物多样性维持与功能利用提供科学依据,有助于长三角生态绿色一体化示范区的建设与发展.
1" 材料与方法
1.1 研究区域
研究区域为上海市青西郊野公园,其位于上海市青浦区西南部、淀山湖南侧,周边土地利用类型以水域、基本农田保护区和农林复合区为主[7-8]. 选择公园内4种典型的湿地类型:稻田(PS)、农用池塘(LP)、水上森林(FW)和湖泊(LW),每个湿地各在进水口、中心点、出水口设定1个培养点位,各培养点经纬度如表1所示.
1.2 现场培养
周丛生物现场培养从2020年8月3日开始至2020年10月7日结束,放置基质日期为2020年8月3日,采集周丛生物日期为2020年10月5日,2020年10月6—7日完成周丛生物预处理.
1.2.1 材料放置
以PVC塑料板作为周丛生物培养基质[9]. 所用PVC塑料板为片状,厚度为1.0 mm ,长宽为20.0 cm×29.7 cm. PVC板置于各湿地培养点土壤表面并固定,放置位置依据各湿地水位高低进行适当调整,以确保塑料板与水接触. 每个培养点放置3片PVC塑料板作为重复实验.
1.2.2 材料回收
生长2个月后采集各点位基质和下覆土壤.
(1) 土壤采集:用铁铲取各培养点5~10 cm深度的表层土样,装于铁盒中,用保鲜膜密封后4 ℃保存. 每个点位取3份作为重复土样.
(2) 周丛生物采集:取下附着周丛生物的PVC塑料板,装入塑料保鲜盒中4 ℃保存.
1.2.3 样品预处理和测定
周丛生物样品的预处理步骤如下:
(1) 用磷酸缓冲液冲洗PVC塑料板以去除多余土壤,直至仅存附着在基质上的周丛生物.
(2) 将附有周丛生物的PVC塑料板剪成1 cm×1 cm的小片.
(3) 将每个样品所得PVC塑料小片分成3份:一份在质量分数为5%的戊二醛4 ℃保存用于形貌观测;一份鲜样4 ℃保存用于生物量测定;一份鲜样-86 ℃保存用于DNA提取.
周丛生物样品预处理完毕后,用结晶紫法测定生物量,扫描电子显微镜(SEM)观测周丛生物表面形貌. 周丛生物DNA 使用FastDNA® Spin Kit for Soil试剂盒提取,并利用Illumina 测序平台进行16S rDNA 高通量测序,分析周丛生物细菌群落多样性. 为更为准确阐明土壤环境因子对周丛生物影响,仅取与土壤接触的PVC塑料板一侧上周丛生物进行分析测定.
土壤样品pH值使用玻璃电极法测定;硝态氮(NO3--N)使用紫外分光光度法测定;铵态氮(NH4+-N)使用2 mol·L-1 KCL浸提-靛酚蓝比色法测定;有机质(SOM)使用重铬酸钾容量法测定;碱性速效磷(AP)用碳酸氢钠浸提法测定;土壤中性磷酸酶(NP)使用磷酸苯二钠比色法测定;土壤过氧化氢酶(CAT)使用高锰酸钾滴定法测定;土壤β-GC 、土壤NAG使用对-硝基苯酚比色法测定.
1.3 数据处理
利用SPSS软件对实验数据进行统计与绘图,结果均采用平均值±标准误差(mean±SD)表示;基于QIIME 2平台,完成16S rDNA序列处理→操作分类单元OTU生成→物种注释分析→Alpha和Beta多样性分析;使用Canoco软件完成细菌群落多样性与土壤理化指标的冗余分析(RDA).
2" 结果与讨论
2.1 4种湿地土壤理化特征与酶活性
由表2数据可知,稻田和农用池塘湿地土壤呈弱酸性,水上森林和湖泊湿地则为弱碱性;硝态氮、铵态氮含量在稻田和农用池塘土壤中较高,在水上森林和湖泊土壤中偏低;SOM在湖泊土壤中含量较低;AP在农用池塘和稻田中含量偏高. NP是催化土壤有机磷(P)矿化的酶,其在稻田和农用池塘中含量相对较高,这可能是由于这2种湿地有机磷的外源汇入较多[10],激活土壤中NP活性;β-GC可降解纤维素,为土壤提供碳源,其在水上森林和稻田土壤中含量较高,这可能与这2种湿地植物残体的外源输入较多有关.
2.2 湿地土壤周丛生物生长情况
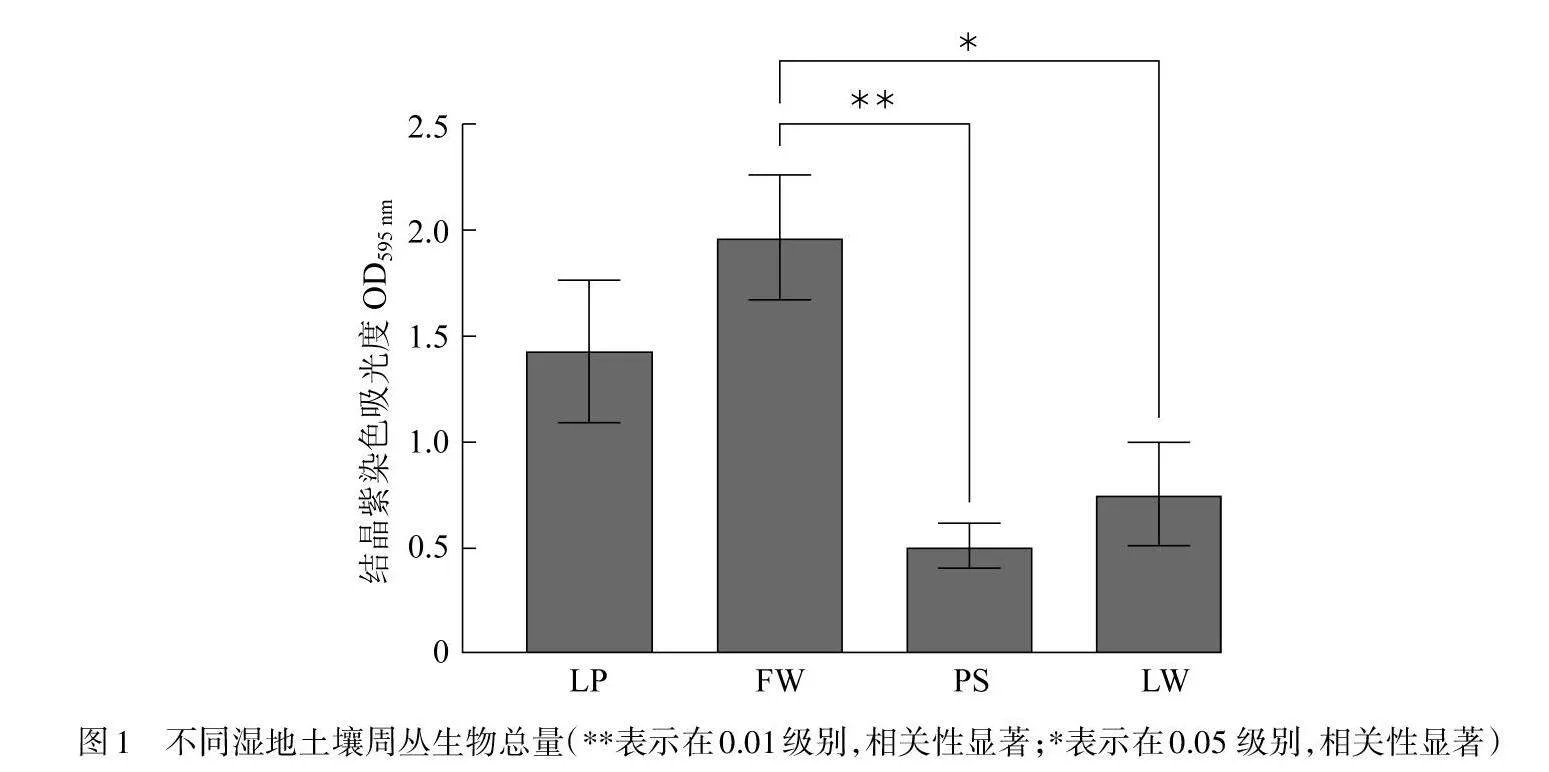
图1所示为4种湿地土壤周丛生物生物量情况,其中水上森林周丛生物生物量最高,其次为农用池塘和湖泊. 稻田周丛生物生物量最少,这可能是由于采样期间稻田水位较低,使周丛生物的水分生长条件受限所致.
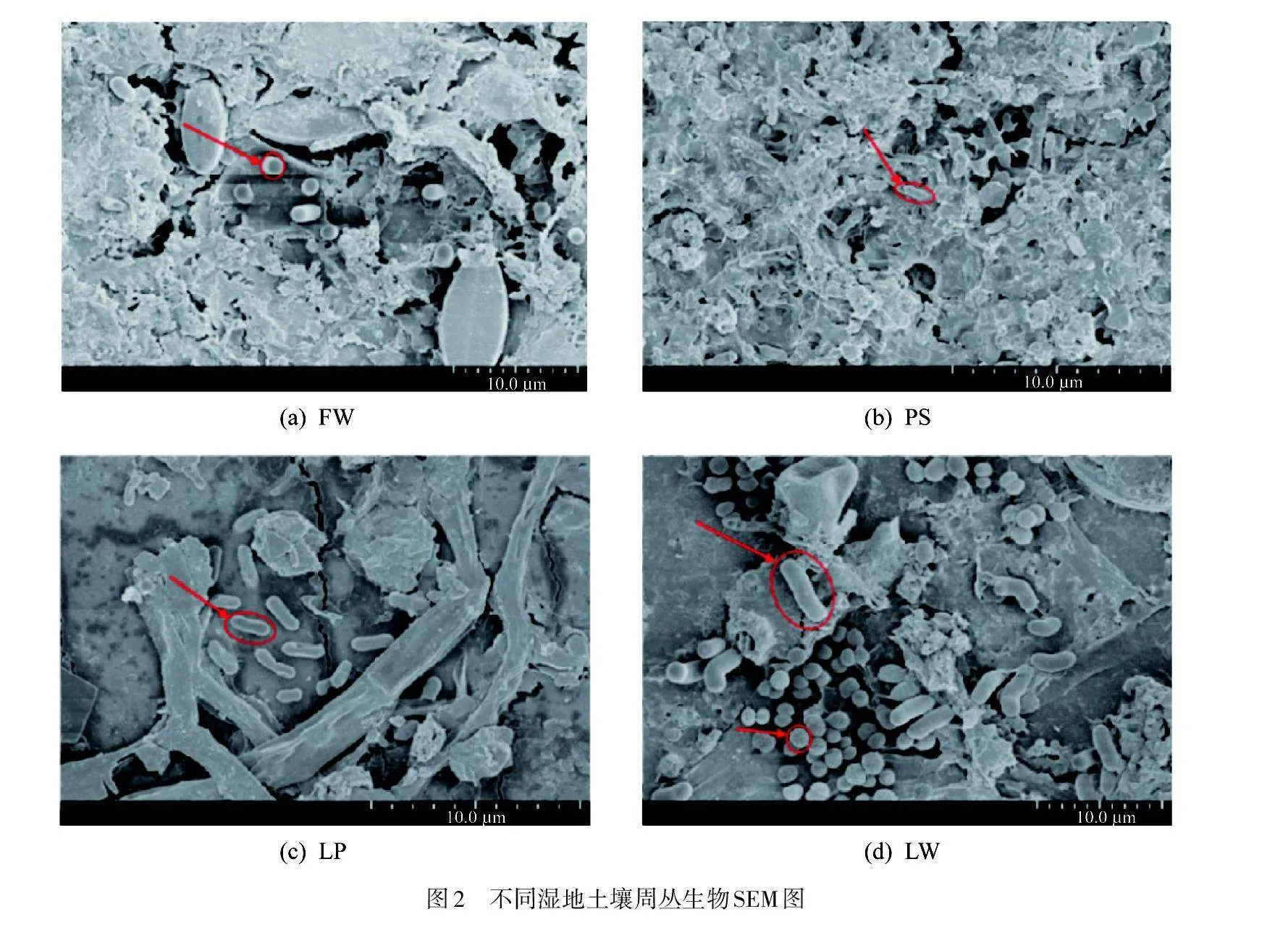
图2为不同湿地土壤周丛生物SEM图. 经过2个月培养,各湿地PVC基质表面均已形成较为致密的周丛生物结构,且生长有不同密度的细菌. 其中水上森林和农用池塘周丛生物细菌以杆菌为主,湖泊湿地周丛生物细菌以杆菌和球菌为主,稻田周丛生物则被大量胞外聚合物(EPS)包裹,所含细菌数量较少,这与周丛生物生物量的结果相一致.
2.3 4种湿地土壤周丛生物细菌群落结构分析
2.3.1 细菌群落物种组成
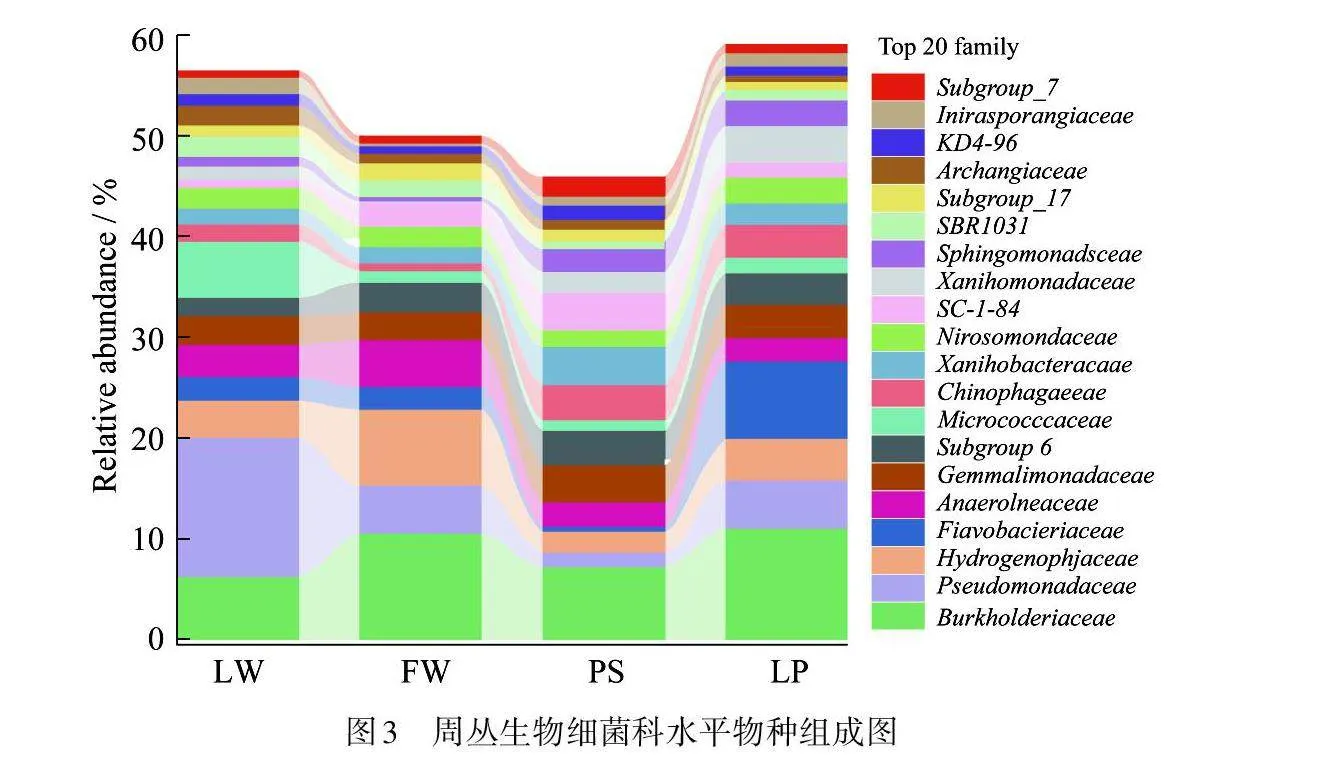
4种湿地中周丛生物细菌在科水平的分布如图3所示. 结果表明:各湿地周丛生物中优势菌为伯克氏菌科 (Burkholderiaceae)、假单胞菌科(Pseudomonadaceae)、嗜氢菌科(Hydrogenophilaceae)和黄杆菌科(Flavobacteriaceae). 其中,湖泊周丛生物中假单胞菌丰度大于10%,其次为微球菌和伯克氏菌;农用池塘周丛生物伯克氏菌丰度最大,且显著高于其他3种湿地,其次为黄杆菌科和假单胞菌科. 伯克氏菌为水上森林、稻田和农用池塘周丛生物中的首要优势菌,这是由于伯克氏菌通常与植物共生,而上述3种湿地植被覆盖情况优于湖泊湿地,从而促进伯克氏菌的大量生长. 值得注意的是,微球菌科(Micrococcaceae)作为湖泊周丛生物中的第二大优势菌科,其在其他3种湿地中丰度却较低,说明微球菌适合生长于湖泊环境.
2.3.2 细菌群落多样性指数分析
2.3.2.1 α多样性
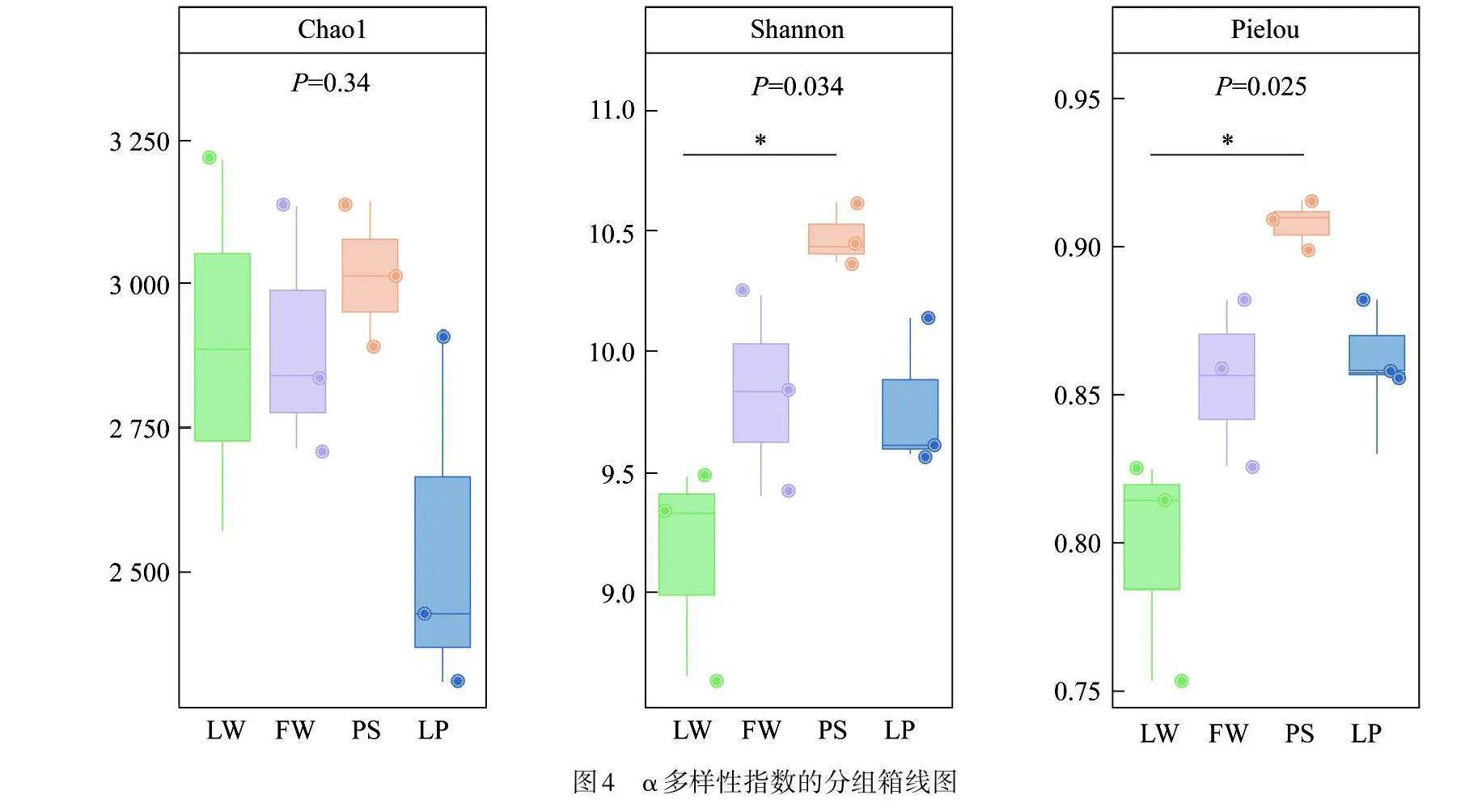
图4为4种湿地土壤周丛生物细菌群落α多样性结果. 由图4可知,4种湿地间周丛生物细菌群落的Chao1指数无显著差异,说明四者细菌群落物种丰富度较为一致. Shannon指数分析表明稻田周丛生物细菌群落多样性最为丰富,湖泊最低,而水上森林和农用池塘与其他2种湿地的差异不明显. 上述结果表明湿地类型会显著影响土壤周丛生物细菌群落多样性,其中稻田由于有机肥等营养物质的大量输入,使其土壤周丛生物细菌具有较高的活性和群落多样性,而湖泊湿地较高的水流速度则不利于土壤周丛生物细菌的稳定生长,使其群落多样性偏低[8-9];Pielou指数表征物种群落的均匀度,4种湿地的Pielou指数同样具有一定差异,且与Shannon指数的排列规律一致.
2.3.2.2 β多样性
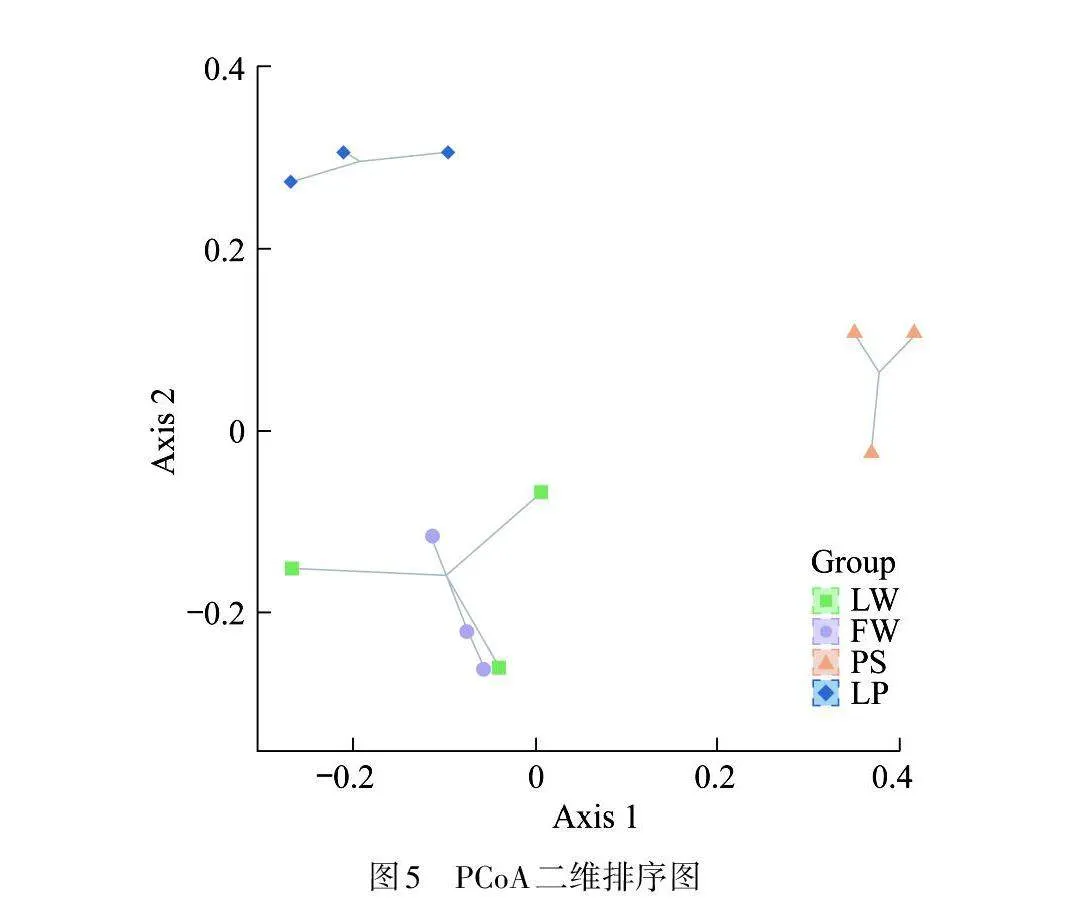
β多样性指数可用于比较不同湿地土壤周丛生物细菌群落组成的相似度. 图5的主坐标分析(PCoA)结果表明:农用池塘和稻田间的细菌群落组成差异较为明显,这是由于两者的作物种植模式不同所致. 水上森林和湖泊受人为干扰较少,且两者处于同一区域,环境因子接近,因此两者土壤周丛生物细菌群落结构较为相似. 此外,由于频繁受到翻耕、灌溉、施用化肥和农药等人为干扰,稻田和农用池塘土壤周丛生物细菌群落组成与水上森林和湖泊相差较大,说明人类活动会显著影响湿地土壤周丛生物细菌群落构建. SU等[4]在研究中同样发现长期施肥显著改变了水稻田土壤周丛生物细菌物种组成方式.
2.3.3 α多样性指数与土壤因子相关性分析
为了进一步探究土壤环境因子对周丛生物细菌结构的影响,分析了土壤理化指标和酶活性与周丛生物细菌多样性间的皮尔森相关性. 如表3所示,4种湿地周丛生物细菌群落Chao1指数与土壤理化指标和酶活性无相关性. Shannon指数与土壤SOM含量、NP、NAG呈正相关(p lt; 0.05),这是由于湿地环境中C,N,P等营养元素较为丰富,从而增加了周丛生物细菌多样性. Pielou指数与土壤pH值呈负相关性(p lt; 0.05),说明pH值越高,湿地周丛生物细菌群落均匀度越低;该指数与NP和NAG则呈显著正相关(p lt; 0.01),说明土壤N和P能提高周丛生物细菌群落均匀度. 钱玮等[11]在对底泥细菌群落结构研究中同样得到高负荷N和P会对细菌群落结构产生影响的相似结论.
2.3.4 OTU(operational taxonomic units)韦恩图
利用高通量测序技术得到用于后续分析的序列条数,在97%相似度下将序列聚类为分类单元用于物种分类,每个分类单元称为OTU. 图6为所有湿地周丛生物细菌OTU韦恩图,显示了各湿地周丛生物特有和共有的细菌群落数. 结果表明4种湿地周丛生物样品中细菌OTU数目为19 638,其中水上森林、稻田、农用池塘、湖泊4种湿地包含的OTU数目分别为6 797,6 491,5 631和7 211. 水上森林和湖泊拥有1 884个相同的细菌OTU数,相似群落数最高并占总群落数的9.59%;稻田和湖泊拥有1 371个相同细菌群落数,相似度则较低. 此外,农用池塘周丛生物特有的细菌群落数量明显低于其他3种湿地,这一方面是由于其总体OT数目较低所致,另一方面也说明该湿地周丛生物细菌群落受自然和人为因素影响程度相当,其与纯人工湿地(稻田)和天然湿地(湖泊和水上森林)共享细菌群落数量较多.
2.3.5 物种组成热图
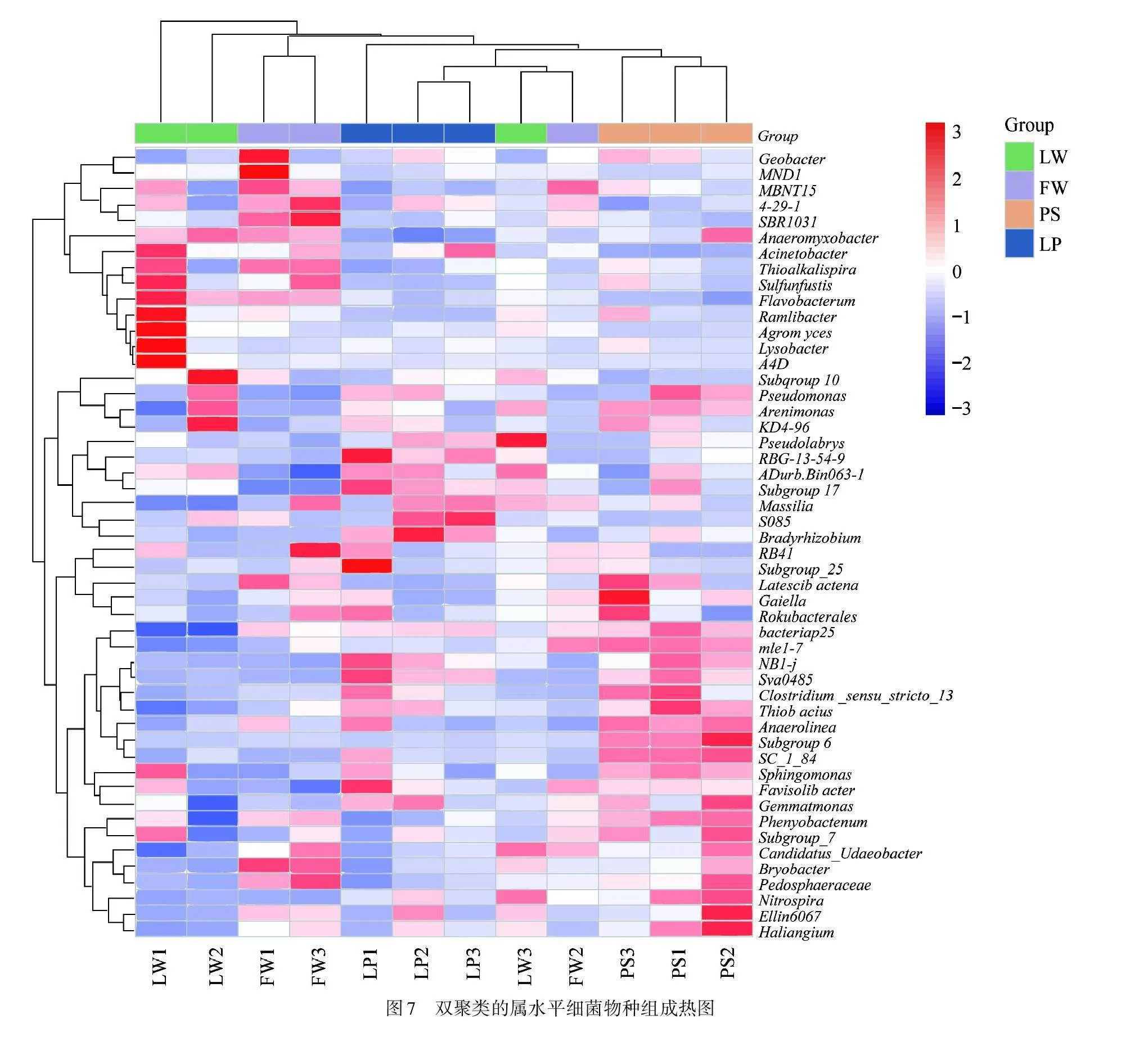
由细菌物种组成热图可直观判断不同周丛生物细菌群落的相似度和优势菌属. 如图7所示,湖泊和水上森林周丛生物细菌群落组成较为相似,而稻田和农用池塘的周丛生物细菌群落组成差异较大,且两者与湖泊和水上森林的差异同样较大,这与PCoA的结果一致. 此外,湖泊和水上森林进水口、中心和出水口点位周丛生物细菌群落结构存在一定差异,这与胡安谊等[12]的研究结果相似,说明自然湿地对周丛生物的微生物组成存在空间分异效应.
2.4 周丛生物细菌代谢通路统计
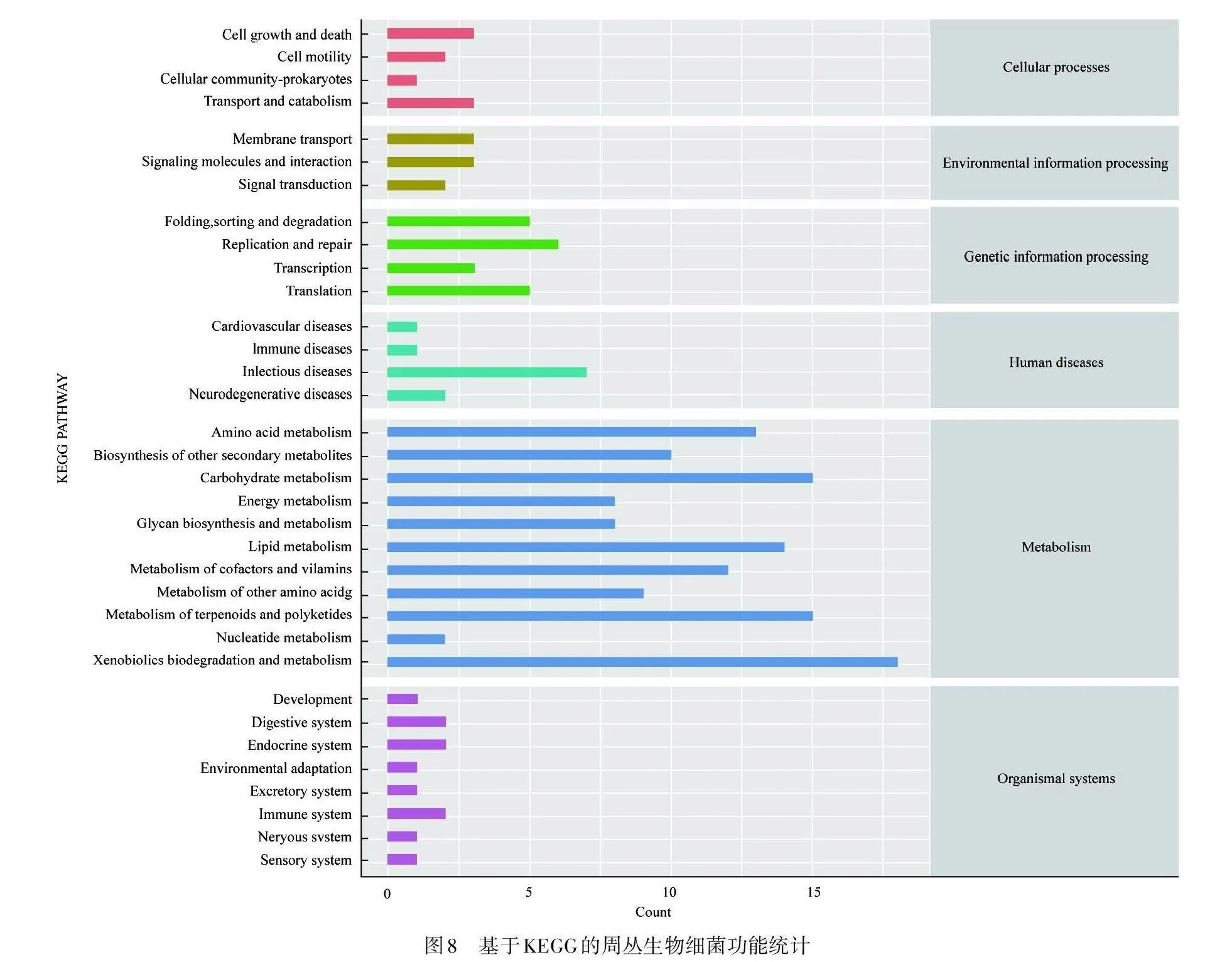
为统计周丛生物细菌的整体功能,引入KEGG数据库(KEGG Pathway Database),以直接鉴定不同湿地周丛生物特定代谢途径细菌的基因数量. 如图8所示,所有湿地周丛生物细菌的主要代谢通路均为代谢(metabolism),其中代谢能力最强的为异生物素生物降解和代谢,之后依次为萜类化合物和聚酮化合物代谢、糖类代谢和脂质代谢.
2.5 主要土壤环境驱动因子
将4种湿地周丛生物细菌群落与土壤理化指标及酶活性进行RDA分析. 如图9所示,RDA1轴能解释群落结构差异的53.29%,RDA2轴能解释差异的20.94%,总体能解释周丛生物细菌群落结构间差异的73.23%. 湖泊周丛生物细菌群落结构与土壤pH值呈正相关;稻田周丛生物细菌群落结构主要与土壤中的AP和NP的含量呈正相关,与土壤pH值和CAT含量呈负相关;农用池塘周丛生物细菌群落结构与土壤中NO3--N,AP和NAG的含量呈正相关;土壤理化指标和酶活性对水上森林周丛生物细菌群落组成无显著影响,说明该湿地可能还存在植被类型、淹水频率、凋落物种类等其他关键环境驱动因子[13-15]. 整体而言,pH值和AP的含量是影响周丛生物细菌群落组成的主要土壤环境驱动因子,NAG,β-GC,SOM和CAT的含量的影响次之,且对细菌群落结构的影响程度差异不大.
3" 结 论
(1) 4种湿地土壤周丛生物呈现不同生长状态. 周丛生物生物量由多到少依次为水上森林、农用池塘、湖泊和稻田;除稻田外,湿地土壤周丛生物表面附着大量细菌,并以杆菌和球菌为主.
(2) 所有湿地周丛生物细菌群落丰富度较为一致,细菌多样性和均匀度则为稻田最高,湖泊最低;水上森林和湖泊周丛生物细菌群落结构相近;湿地周丛生物优势细菌种类为伯克氏菌科、假单胞菌科、嗜氢菌科和黄杆菌科等.
(3) 所有湿地周丛生物细菌的主要功能表现为代谢,其中稻田周丛生物细菌具有更强的萘降解能力,湖泊和农用池塘周丛生物细菌则具有更强的生物合成能力.
(4) 土壤中C,N和P能增加周丛生物细菌群落多样性,而N和P则能提高周丛生物细菌群落均匀度;土壤pH值和AP含量是影响湿地土壤周丛生物细菌群落结构的主要驱动因子.
参考文献:
[1]""" WU Y, XIA L, YU Z, et al. In situ bioremediation of surface waters by periphytons [J]. Bioresource Technology, 2014,151:367-372.
[2]""" WU Y H, LIU J Z, LU H Y, et al. Periphyton:an important regulator in optimizing soil phosphorus bioavailability in paddy fields [J]. Environmental Science and Pollution Research, 2016,23(21):21377-21384.
[3]""" WU Y, LIU J, RENE E R. Periphytic biofilms:a promising nutrient utilization regulator in wetlands [J]. Bioresource Technology, 2018,248(Pt B):44-48.
[4]""" SU J, KANG D, XIANG W, et al. Periphyton biofilm development and its role in nutrient cycling in paddy microcosms [J]. Journal of Soils and Sediments, 2017,17(3):810-819.
[5]""" LU H, FENG Y, WANG J, et al. Responses of periphyton morphology, structure, and function to extreme nutrient loading [J]. Environmental Pollution, 2016,214:878-884.
[6]""" 曹慧,孙辉,杨浩,等. 土壤酶活性及其对土壤质量的指示研究进展 [J]. 应用与环境生物学报, 2003,9(1):105-109.
CAO H, SUN H, YANG H, et al. A review of soil enzyme activity and its indication for soil quality [J]. Chinese Journal of Applied and Environmental Biology, 2003,9(1):105-109.
[7]""" 新华社. 中共中央 国务院印发《长江三角洲区域一体化发展规划纲要》[J].中华人民共和国国务院公报, 2019 (35):10-34.
[8]""" 于初初. 上海郊野公园规划设计特征与使用评价研究 [D]. 北京:北京林业大学, 2020.
YU C C. Study on the planning, design characteristics and usage evaluation of Shanghai country parks [D]. Beijing:Beijing Forestry University, 2020.
[9]""" 陈丽明. 长期秸秆还田下双季稻田土壤碳氮转化特征及其微生物学机制 [D]. 南昌:江西农业大学, 2023.
CHEN L M. Microbiological mechanism of soil carbon and nitrogen transformation under long-term straw return in a double-cropped rice paddy [D]. Nanchang:Jiangxi Agricultural University, 2023.
[10]" RICHARD M, TROTTIER C, VERDRGRM M C J, et al. Submersion time, depth, substrate type and sampling method as variation sources of marine periphyton [J]. Aquaculture, 2009,295(3/4):209-217.
[11]" 钱玮, 朱艳霞, 邱业先. 环境因子对太湖底泥细菌群落结构的影响 [J]. 苏州科技大学学报(自然科学版), 2017,34(3):50-54.
QIAN W, ZHU Y X, QIU Y X. Influence of environmental factors on bacterial community structures in sediments of Lake Tai [J]. Journal of Suzhou University of Science and Technology (Natural Science), 2017,34(3):50-54.
[12]" 胡安谊, 李姜维, 杨晓永, 等. 宁波三江口水域原核生物群落结构分析 [J]. 环境科学, 2015,36(7):2487-2495.
HU A Y, LI J W, YANG X Y, et al. Analysis of prokaryotic community structure in river waters of the Ningbo San Jiang Mouth [J]. Environmental Science, 2015,36(7):2487-2495.
[13]" 赵联远, 苏杰, 刁猛, 等. 水上森林、湿地资源、生态旅游一体化建设与保护浅析 [J]. 江苏林业科技, 2011,38(1):55-57.
ZHAO L Y, SU J, DIAO M, et al. Analysis of integrated construction and protection of water forest, wetland resources, and ecotourism [J]. Journal of Jiangsu Forestry Science and Technology, 2011,38(1):55-57.
[14]" BURKE M K, KING S L, GARTNER D, et al. Vegetation, soil, and flooding relationships in a blackwater floodplain forest [J]. Wetlands, 2003, 23:988-1002.
[15]" 刘霜, 张心昱. 不同植物根际土壤碳氮水解酶活性热点区的空间分布特征 [J]. 生态学报, 2020,40(13):4462-4469.
LIU S, ZHANG X Y. Spatial distribution of carbon and nitrogen acquiring hydrolase activity hotspots in rhizosphere soils of different plants [J]. Acta Ecologica Sinica, 2020,40(13):4462-4469.
(责任编辑:郁慧)

