盐碱胁迫对雄性毛白杨良种苗木生长和生理的影响
摘 要:【目的】适地适树是植树造林的基本原则,毛白杨广泛分布于我国华北平原、黄河中上游平原等地区,而这些区域普遍存在不同类型的盐碱土地。因此,研究盐碱胁迫对雄性毛白杨良种苗木的影响,可为今后盐渍土开发利用和良种苗木推广种植提供技术支撑。【方法】选用‘北林雄株1号’作为雄性毛白杨良种苗木试验材料,通过盆栽浇灌盐水的方式模拟盐碱环境,盐碱类型分为中性盐NaCl、中性混合盐Na2SO4+NaCl、碱性盐NaHCO3和碱性混合盐Na2CO3+NaHCO3。不同盐碱种类设置150和300 mmol·L-1两个浓度。【结果】不同类型盐碱胁迫均会使苗木生长受到抑制,且高浓度下的抑制作用更加明显,中性盐胁迫对植株地上部生长影响较大,高浓度NaCl处理下的苗高增长量相较对照下降了56.61%,而碱性盐胁迫对植株根系生长抑制更强;碱性盐胁迫会显著降低植株的净光合速率,而低浓度的NaCl处理可以增强植株的光合作用;植株根、茎、叶中的Na+含量在盐碱胁迫下显著增加,中性盐处理下植株根部控制Na+的能力强于碱性盐胁迫,且植株由根系向上选择性运输营养元素的能力强于碱性盐胁迫;在高浓度下,Na2SO4+ NaCl处理的根向叶选择性运输K+能力相较对照提升了707.20%,但随着浓度增加,植株自身离子调节能力受到抑制。【结论】综合来看,碱性盐胁迫对雄性毛白杨良种苗木生长和生理产生的负面影响更大。
关键词:盐碱胁迫;生长;光合作用;离子平衡;雄性毛白杨
中图分类号:S792.117 文献标志码:A 文章编号:1673-923X(2024)06-0056-13
基金项目:国家重点研发计划项目(2016YFD0600403);北京市园林绿化局项目(CEG-2015-01-01)。
Effects of saline-alkali stress on seedling growth and physiology of male Populus tomentosa improved variety
WANG Shuo1, LIU Yong1, PENG Yuxin2, ZHENG Zhiwei1, CHANG Xiaochao1, WANG Wenxiao1, YANG Fan2
(1. College of Forestry, Key Laboratory of Silviculture and Forest Protection, Ministry of Education, Beijing Forestry University, Beijing 100083, China; 2. Beijing Institute of Landscape Architecture, Beijing 100102, China)
Abstract:【Objective】The basic principle of afforestation is to match species with the site. Populus tomentosa is widely distributed in north China Plain, the middle and upper reaches of the Yellow River plain and other regions, and there are different types of saline alkali land in these regions. Therefore, the study of the impact of saline alkali stress on male P. tomentosa improved varieties can provide technical support for the development and utilization of saline soil and the promotion and planting of improved seedlings in the future.【Method】The experiment used ‘Beilin Xiongzhu 1’ as the experimental material for male P. tomentosa improved variety. The saline alkali environment was simulated by pot irrigation with saline water. The saline alkali types were divided into neutral salt NaCl, neutral mixed salt Na2SO4+NaCl, alkaline salt NaHCO3, and alkaline mixed salt Na2CO3+NaHCO3. Set high and low concentrations of 150 and 300 mmol·L-1 for different types of saline alkali.【Result】Different types of salt alkali stress inhibited the growth of seedlings, and the inhibitory effect was more obvious at high concentrations. Neutral salt stress had a greater impact on the aboveground growth of plants. The height growth of seedlings under high concentrations of NaCl treatment decreased by 56.61% compared to the control, while alkaline salt stress had a stronger inhibitory effect on the root growth of plants; Alkaline salt stress significantly reduced the net photosynthetic rate of plants, while low concentrations of NaCl treatment enhanced their photosynthesis; The Na+ content in the roots, stems, and leaves of plants significantly increased under salt alkali stress. Under neutral salt treatment, the ability of the roots to control Na+ was stronger than under alkaline salt stress, and the ability of the plants to selectively transport nutrients from the roots was stronger than under alkaline salt stress. At high concentrations, the Na+ content in the root to leaf SK,Na treated with Na2SO4+NaCl increased by 707.20% compared to the control, but as the concentration increased, the plant’s ability to regulate ions was inhibited.【Conclusion】Overall, alkaline salt stress has a greater negative impact on the growth and physiological and biochemical characteristics of male P. tomentosa improved variety.
Keywords: saline-alkali stress; growth; photosynthesis; ion balance; male Populus tomentosa
盐渍土是各种盐土、碱土的统称。盐碱胁迫通常会使植株生长受限、光合作用降低、离子稳态失衡和细胞膜受损导致植株失水死亡等。研究表明,盐危害主要造成土壤溶液渗透势降低,抑制植株生长,破坏植株细胞膜并使生理代谢紊乱[1];而高pH值带来的碱危害会严重影响土壤结构、干扰植物离子吸收、打破植物离子稳态平衡[2]。熊超明等[3]采用Na2SO4、NaCl、Na2CO3、NaHCO3配置的中性盐、混合盐碱、碱性盐分别胁迫草莓,发现由于盐碱类型不同,草莓生长受到的危害程度有很大差异;在对花生的研究中发现,NaCl、NaCl+NaHCO3和NaHCO3三种盐碱类型下,不同的盐碱浓度也会导致花生生理生化指标产生差异[4];史锋厚等[5]研究表明不同处理组培忠杉苗木对不同离子的吸收与分布存在差异,其中叶部Na离子含量大于茎部和根部;Guo等[6]研究发现,与盐胁迫相比,高强度碱性胁迫明显抑制了根系生长和活性,使地上部分Na+含量急剧增加并导致离子失衡,相比于单一盐胁迫,碱性盐胁迫下植物面临着盐度和高pH值双重胁迫作用,仅有少数抗盐碱植物能够存活[7]。这说明盐碱类型和浓度的差异会对植株生长发育产生不同的影响,通常情况下碱性盐胁迫造成的危害程度更大,而形成不同盐碱类型土壤的原因是土壤中的主要盐类成分有较大差异。
毛白杨是我国华北、黄河中上游等地区广泛分布的优良树种[8]。‘北林雄株1号’是三倍体良种毛白杨,良种编号:国S-SC-PB-006-2014,具有不飞絮、生长迅速等优点,其在不同地区的不同繁殖周期中遗传表现稳定[9],同时,毛白杨分布的地区大多存在盐渍土利用问题。于雷等[10]采用5个浓度盐溶液对杨树进行耐盐碱试验,得出随着浓度的升高,幼苗各项生长指标逐渐降低的结论;于海武[11]以毛白杨为材料也得出了相似的结论,认为NaCl盐浓度达到6%时苗木将全部死亡。以往对杨树等乔木树种的盐碱胁迫试验大多以盐浓度作为研究对象,缺乏对于不同类型盐碱胁迫导致生长和生理差异的研究。为此,本研究选用‘北林雄株1号’组培苗为试验材料,结合毛白杨适生地区不同类型盐碱土地情况,设置中性盐NaCl、中性混合盐Na2SO4+NaCl、碱性盐NaHCO3和碱性混合盐Na2CO3+NaHCO3 4种盐碱类型和2个盐碱浓度,探究不同类型盐碱胁迫和浓度对植株生长发育、光合作用及离子平衡的影响,对今后盐渍土开发利用和雄性毛白杨良种苗木推广种植具有重要意义。
1 材料与方法
1.1 试验地概况
试验在北京市大兴区黄垡苗圃遮雨棚中进行。苗圃地理坐标为116°20′E,39°34′N,属暖温带半湿润大陆性季风气候。多年平均气温11.6 ℃,极端最低气温-27.4 ℃,极端最高气温40.6 ℃,多年平均降水量556 mm,7—9月份的降水量占全年降水总量的60%~70%,全年无霜期209 d,年平均日照总时数2 772 h。
1.2 试验材料
试验苗木采购自河北省威县苗圃培育的一年生‘北林雄株1号’组培苗,于2022年6月14日—7月31日在黄垡苗圃炼苗棚经过炼苗后,选择苗高45 cm、地径5 mm左右、长势大致相同的180株栽植于10 L的塑料花盆中,每盆定植1株苗木,土壤基质由草炭、园土、珍珠岩按照1∶3∶1的体积比混合配置而成。花盆下部垫有塑料托盘。
1.3 试验设计
采用双因素完全随机设计,盐碱种类分为A:NaCl(中性盐)、B:Na2SO4+NaCl(中性混合盐)、C:NaHCO3(碱性盐)和D:Na2CO3+NaHCO3(碱性混合盐),混合盐碱按照Na+浓度1∶1配置,不同盐碱种类设置2个不同浓度,均以Na+浓度为准,分别为150和300 mmol·L-1。用1/10霍格兰营养液浇灌的作为0浓度对照(CK),其余按照设置浓度混入营养液中浇灌。每盆每次浇灌500 mL盐溶液,每10 d浇灌一次,期间根据天气情况补充水分,并将渗透到托盘中的液体浇回盆中。第一次浇灌盐溶液作为试验开始第一天,试验周期为50 d,试验共计9个处理,每个处理设置4次重复,每个重复5株,总计180株。

1.4 测定指标及方法
1.4.1 植株株高、地径及各部分生物量测定
试验开始的前一天对所有参试苗木进行苗高、地径的本底数据测量,盐碱胁迫试验结束后再次对所有参试苗木进行苗高、地径测量。
苗高:由地径到苗木顶芽处的长度,采用卷尺测量,测量精度为0.1 cm。
地径:苗木茎部与土面接触点的直径,测量时采用游标卡尺,东西方向测定一次,南北方向测定一次,最终值取两次测定的平均值,测量精度为0.01 cm。
从每个处理中随机选取5株苗木,清理根部基质以后冷藏带回实验室,用蒸馏水清洗干净,随后在烘箱中110 ℃杀青30 min,随后60 ℃烘干至恒质量后测量地上与地下部分干质量,计算茎根比,茎根比=地上部分干质量/地下部分干质量。
1.4.2 光合气体交换参数
于盐碱胁迫第49天上午9:00开始使用Li-6400便携式光合测定仪测量叶片样本的光合参数,每个处理随机选取4株,叶片选取由上至下第5片功能叶,每个参数重复测量3次。记录的光合参数有净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr),光合有效辐射为1 000 μmol·m-2s-1。
1.4.3 不同器官中Na+、K+、Ca2+、Mg2+含量测定
继续使用1.4.1中用于全株生物量测量的苗木,将不同苗木的根、茎、叶组织用球磨仪球磨成粉末,每个样品称量0.2 g备用。
采用H2SO4-H2O2消煮,将植物粉末放置于消煮管中,加入5 mL浓硫酸,在消煮管上放置漏斗防止蒸发并冷凝回流,随后放入预先升温至330 ℃的消煮炉中加热,15 min后拿出放凉后加入2 mL 30%的过氧化氢溶液,随后继续放入消煮炉中加热,重复两次。将消煮液过滤并定容于100 mL容量瓶中,随后装入塑料瓶中保存。采用原子吸收分光光度计测定根、茎、叶中的 Na+、K+、Ca2+、Mg2+含量。分别计算K+、Ca2+、Mg2+与Na+的比值和不同器官对矿质离子的选择性运输(SX,Na+)能力[11]。
SX,Na+=库器官[X/Na+]/源器官[X/Na+]。式中:X代表K+、Ca2+、Mg2+ 3种离子。
1.5 数据处理
采用Excel 2016软件进行数据整理;采用SPSS 20.0软件对数据进行方差分析,对植株生长发育指标和光合气体交换参数进行双因素方差分析,检验盐碱类型和浓度及其交互作用,对苗木不同器官中Na+、K+、Ca2+、Mg2+含量、K+、Ca2+、Mg2+与Na+含量的比值及其选择性运输能力进行单因素方差分析,采用Duncan法进行多重比较(P=0.05);采用Origin 2023软件进行绘图。
2 结果与分析
2.1 盐碱胁迫对苗木生长的影响
不同类型盐碱和浓度对雄性毛白杨良种苗木的生长发育指标具有显著影响。方差分析结果表明,盐碱类型和浓度会对植株苗高增长量和地径增长量产生明显的交互作用,而盐碱类型和浓度分别显著影响植株地上部生物量、地下部生物量和茎根比,但交互作用不显著(表2)。
2.1.1 苗高增长量
由表3可知,雄性毛白杨良种苗木的苗高增长量在不同处理间具有显著差异(P<0.05),且各处理的苗高增长量均显著低于对照,这说明不同盐碱类型和浓度的胁迫明显抑制了苗高增长。在低浓度下,A、B处理的苗高增长量显著低于C、D处理和对照(P<0.05),表明中性盐胁迫对苗高增长的抑制作用强于碱性盐胁迫;在高浓度下,A处理的苗高增长量显著低于B、C、D处理和对照(P<0.05),其苗高增长量相较对照下降了56.61%,表明NaCl盐处理对苗高增长的抑制作用最强。此外,在同一盐碱类型下,高浓度处理的苗高增长量显著低于低浓度处理(P<0.05),说明随着盐碱处理浓度提升,苗高增长受到的抑制作用更强。
2.1.2 地径增长量
由表3可知,雄性毛白杨良种苗木的地径增长量在不同处理间具有显著差异(P<0.05)。在低浓度下,B处理的地径增长量相较对照下降了20.89%,差异达到显著水平(P<0.05),但A、C、D处理的地径增长量与对照差异不显著,且A、B、C、D处理间的差异也不显著;在高浓度下,A、B、C、D处理的地径增长量相较对照分别显著下降了 56.61%、39.35%、40.67%和25.27%(P<0.05),表明不同类型盐碱胁迫对苗木的地径增长量具有明显抑制作用。在同一盐碱类型下,除D处理外,其他高浓度处理的地径增长量下降幅度显著大于低浓度处理(P<0.05)。

2.1.3 生物量
不同类型盐碱胁迫对雄性毛白杨良种苗木生物量的影响分地上和地下两部分进行分析,低浓度对地上部生物量无明显影响,且各处理间无显著差异;而在高浓度下,A、B、C、D处理的地上部生物量比对照分别显著下降了31.38%、24.80%、16.85%和15.56%,且A处理显著低于C和D处理(P<0.05)(图1A),表明高浓度的盐碱处理显著抑制了苗木地上部生物量增长,中性盐处理胁迫导致地上部分生物量减少高于碱性盐胁迫。
而地下部生物量的表现不同,在低浓度下,除B处理外,A、C、D处理比对照分别减少了20.38%、31.61%和30.74%,达到显著水平(P<0.05),碱性盐C处理显著低于中性混合盐B处理;在高浓度下,A、B、C、D处理的地下部生物量相较对照分别显著下降了47.06%、45.08%和52.55%和52.19%(P<0.05)(图1B)。表明除低浓度B处理外,其他不同类型盐碱胁迫明显抑制了苗木的地下生物量增长,随着盐浓度提升抑制作用更强。

2.1.4 茎根比
茎根比反映地上生物量和地下生物量的平衡状态,在低浓度下,A、B处理的茎根比与对照无显著差异,而C、D处理的茎根比明显高于A、B处理和对照(P<0.05);在高浓度下,A、B、C、D处理的茎根比相较对照分别显著增加了29.29%、39.61%、78.15%和76.21%,C、D处理显著高于A、B处理,后2个处理又显著高于对照(P<0.05)(图2),表明碱性盐处理对雄性毛白杨良种苗木的茎根比增大作用明显强于中性盐处理。
2.2 盐碱胁迫对苗木光合气体交换参数的影响
不同类型盐碱和浓度对苗木光合气体交换参数具有显著影响,盐碱类型和浓度对叶片净光合速率、气孔导度、胞间CO2浓度和蒸腾速率产生明显的交互作用(表4)。


净光合速率可以体现植株光合作用积累的有机物。在低浓度下,A、B处理的叶片净光合速率相较对照分别提升了22.65%、6.88%,其中A处理的叶片净光合速率提高达到显著水平(P<0.05);而C、D处理的叶片净光合速率比对照分别下降了80.25%、81.97%(P<0.05),说明碱性盐胁迫会明显降低苗木的叶片净光合速率,而中性NaCl盐可以明显提高叶片净光合速率。在高浓度下,C、D处理的叶片净光合速率明显低于A、B处理和对照,B、C、D处理相较对照分别显著下降了27.78%、85.76%和86.02%(P<0.05)(表5),说明高浓度碱性盐处理的叶片净光合速率下降幅度强于中性混合盐处理,而高浓度的NaCl盐胁迫对叶片净光合速率影响不大。
由表5可知,在低浓度下,B、C、D处理的叶片气孔导度分别相较对照降低了17.65%、77.21%和76.47%(P<0.05),A处理使叶片气孔导度略有上升,但未达到显著水平,说明低浓度的NaCl处理对叶片气孔开合影响不大,但碱性盐和中性混合盐会明显造成叶片气孔关闭。在高浓度下,A、B、C、D处理的气孔导度相较对照分别显著下降了33.82%、50.00%、80.15%和83.82%(P<0.05)。在2种浓度下,碱性盐导致的叶片气孔导度下降幅度均明显高于中性盐,说明碱性盐胁迫导致的叶片气孔闭合强于中性盐胁迫。
叶片胞间CO2浓度和气孔导度可以综合判断植株光合作用受阻的原因。由表5可知,在高浓度下,B处理和C处理的叶片胞间CO2浓度分别为最低值和最高值,比对照分别显著减少和增加了14.87%和19.27%(P<0.05)。在2个浓度下,苗木的叶片胞间CO2浓度变化趋势相同,A、B处理相较对照的胞间CO2浓度降低了约12%,而C、D处理相较对照的胞间CO2浓度则升高了约14%,且升降幅度均达到显著水平(P<0.05)。随着浓度升高,中性盐处理的胞间CO2浓度不断下降,而碱性盐处理的CO2浓度不断上升,结果表明中性盐处理会降低苗木的叶片细胞间的CO2含量,而碱性盐处理相反。
由表5可知,在低浓度下,A、B处理的叶片蒸腾速率与对照相比变化不明显,而C、D处理的叶片蒸腾速率相较对照分别下降了67.13%、59.44%(P<0.05);在高浓度下,A、B、C、D处理的叶片蒸腾速率相较对照分别下降了22.98%、36.08%、68.64%和73.53%,下降程度均达到显著水平(P<0.05)。结果表明,在低浓度下,中性盐处理对苗木的叶片蒸腾速率影响不大,而在2种浓度下,碱性盐处理均会显著降低植株的叶片蒸腾速率。
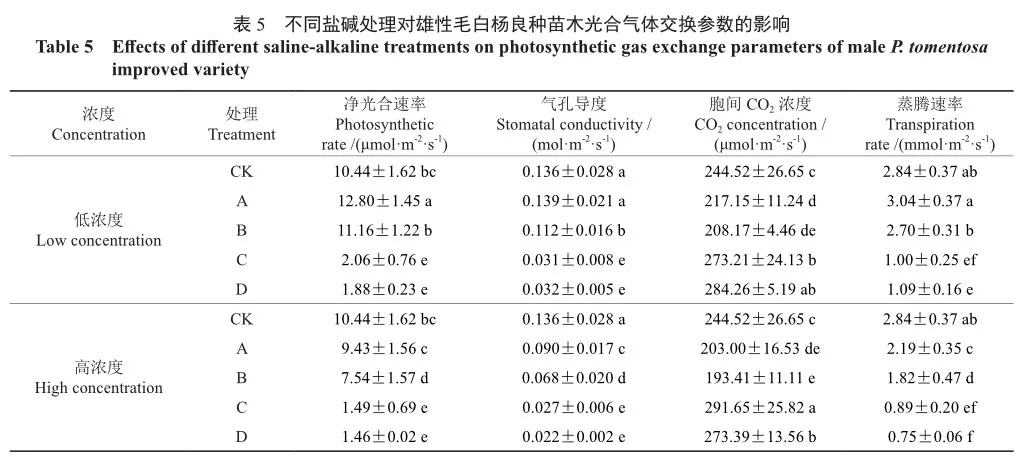
2.3 盐碱胁迫对苗木不同器官离子含量的影响
在2种浓度下,各处理的苗木根中Na+含量上升幅度大于茎和叶片,其中,高浓度的A处理苗木根中Na+含量是对照的9.02倍,且显著高于C、D处理(P<0.05)。在低浓度下,不同处理间的雄性毛白杨良种苗木叶片和茎中Na+含量无显著差异,但C、D处理的茎中Na+含量和B处理的叶片中Na+含量显著高于对照(P<0.05);而在高浓度下,各处理的茎、叶中Na+含量显著高于对照,且不同处理间差异显著,其中C、D处理的叶片中Na+含量显著高于A、B处理和对照(P<0.05)(图3)。

苗木叶片中的K+含量高于根和茎中(图4)。在低浓度下,C、D处理的苗木根中K+含量显著低于A、B处理,且C处理显著低于对照;而B、C、D处理的茎中K+含量显著高于对照(P<0.05)。在高浓度下,不同处理的叶片中K+含量均明显高于对照(P<0.05),且中性盐处理的K+含量显著高于碱性盐;而各处理的根中K+含量均明显低于对照(P<0.05);除A处理外,其余处理的茎中K+含量均显著高于对照(P<0.05)。
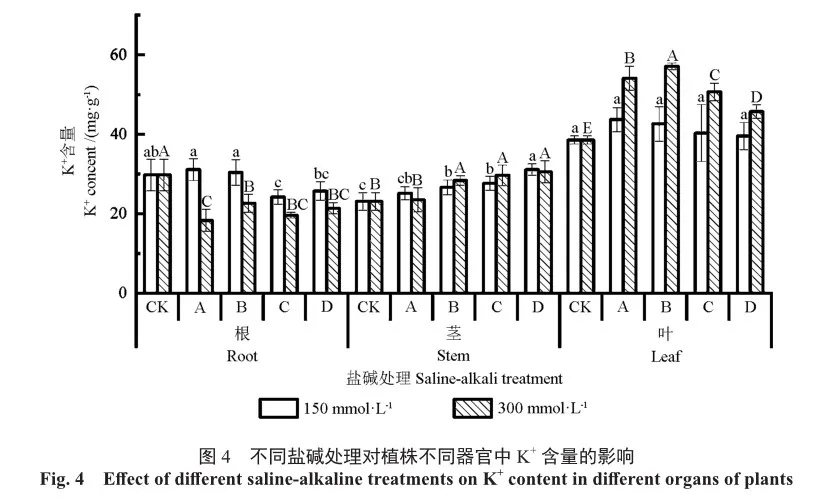
Ca是组成细胞壁的重要元素,从图5中可以看出,苗木叶片中的Ca2+含量高于根和茎。在2种浓度下,不同处理的各个器官中Ca2+含量变化趋势大致相同。低浓度下,A、B处理的叶片中Ca2+含量显著高于C、D处理和对照,而C、D处理的根中Ca2+含量则显著低于对照(P<0.05),此外,各处理的茎中Ca2+含量均显著低于对照(P<0.05)。
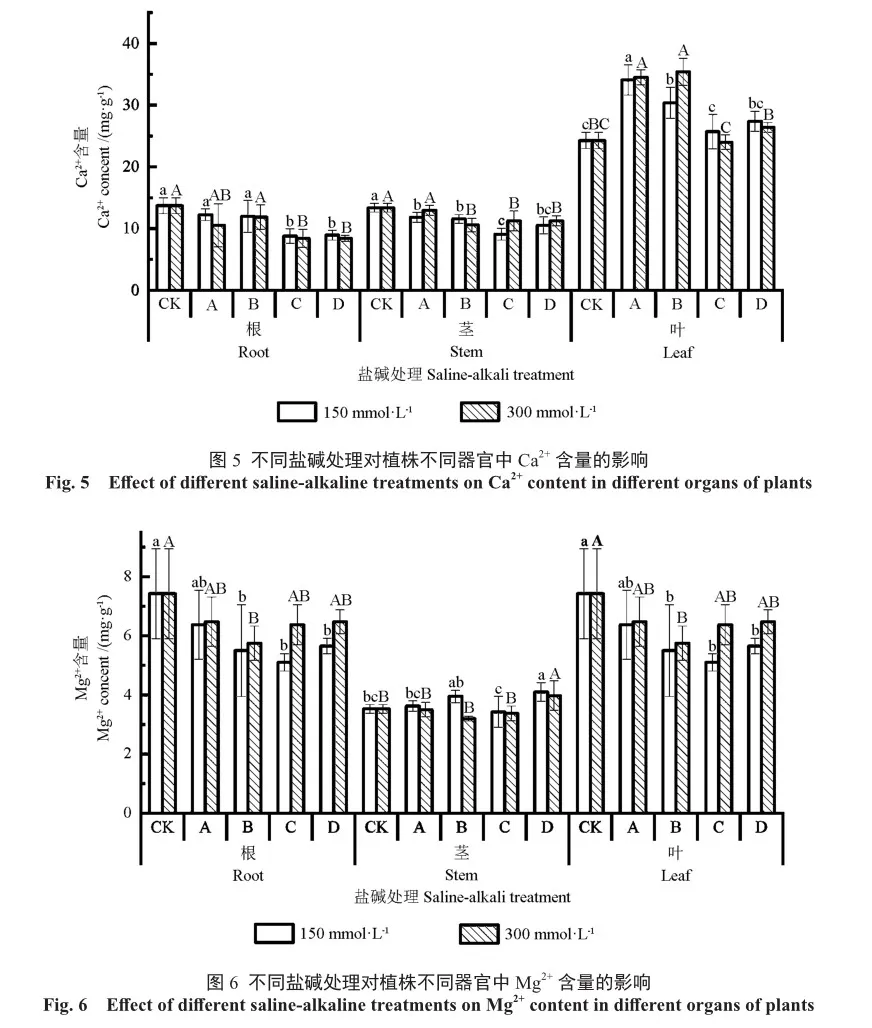
Mg是形成叶绿素的重要元素,由图6可知,雄性毛白杨良种苗木茎中Mg2+含量低于根和叶。在2种不同浓度下,各处理间的叶片中Mg2+含量无显著差异,但低浓度下的B、C、D处理Mg2+含量显著低于对照;D处理的茎中Mg2+含量显著高于A、C处理和对照,各处理的根中Mg2+含量变化与叶片一致。
2.4 不同盐碱处理对苗木不同器官中K+/Na+、Ca2+/Na+和Mg2+/Na+的影响
由表6可知,不同盐碱胁迫大多会降低雄性毛白杨良种苗木根、茎器官中的K+/Na+、Ca2+/Na+和Mg2+/Na+,且高浓度盐处理的离子比值高于低浓度盐处理。在2种浓度下,各处理均会使根中K+/ Na+、Ca2+/Na+和Mg2+/Na+显著下降(P<0.05);植株茎中离子比例与根中情况大致相同,但在高浓度下,A、C、D处理的K+/ Na+和Mg2+/Na+下降幅度更大,其中K+/ Na+相比对照分别显著降低了83.44%、73.94%和75.44%(P<0.05),Mg2+/Na+相比对照分别显著降低了83.75%、80.24%和79.89%(P<0.05);在低浓度下,各处理对苗木叶中离子比例变化影响不大,但在高浓度下,不同处理间的离子比例变化差异达到显著水平(P<0.05),其中C处理的不同离子比下降幅度最大,其叶片中K+/Na+、Ca2+/Na+和Mg2+/Na+相较对照分别显著下降了66.39%、77.60%和77.23%(P<0.05)。
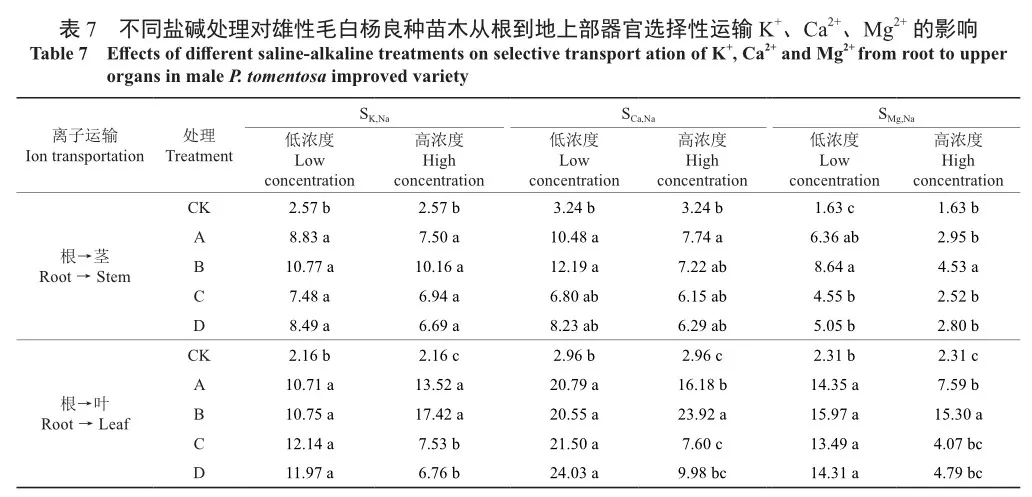
2.5 不同盐碱处理对苗木地上部器官选择性运输K+、Ca2+、Mg2+的影响
由表7可知,不同盐碱处理均会提高植株的根向茎、叶运输离子的能力(SK,Na、SCa,Na、SMg,Na),且大多高浓度盐处理的离子运输能力弱于低浓度盐处理。在2种浓度下,植株根向茎选择性运输K+数值相较对照均显著提高,但各处理间差异不显著。值得注意的是,高浓度下,A、B处理根向叶选择性运输K+数值高于低浓度盐处理,A、B处理的根向叶SK,Na相较对照分别显著提升了526.46%、707.20%(P<0.05),而C、D处理的根向叶SK,Na数值则表现为高浓度盐处理低于低浓度盐处理。
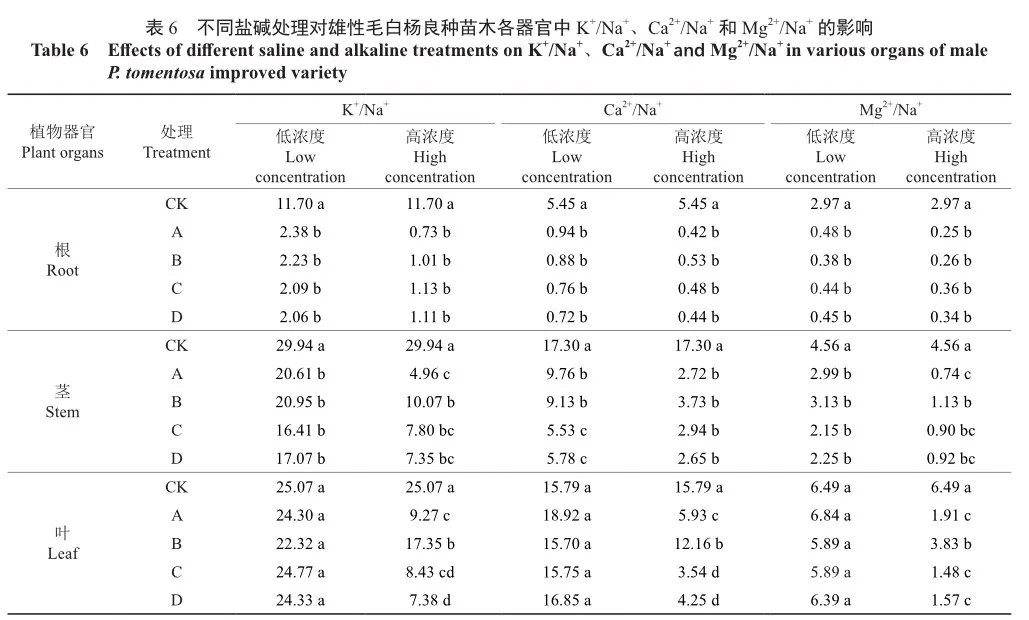
在Ca2+选择性运输方面,低浓度下,A、B处理的根向茎运输Ca2+数值相较对照显著上升(P<0.05),而高浓度下只有A处理相较对照显著上升了138.77%(P<0.05),低浓度下各处理的植株根向叶选择性运输Ca2+数值均显著高于对照(P<0.05),但各处理间无显著差异,而高浓度下只有A、B处理显著高于对照(P<0.05)。
在Mg2+选择性运输方面,低浓度下各处理的根向茎SMg,Na数值均显著高于对照,而高浓度下只有B处理的根向茎SMg,Na数值相较对照显著提升了177.37%(P<0.05);低浓度下各处理均显著高于对照(P<0.05),各处理间差异不显著;但在高浓度下,A处理的根向叶SMg,Na数值显著高于B、C、D处理和对照(P<0.05)。
3 讨 论
3.1 盐碱胁迫对雄性毛白杨良种苗木生长的影响
盐碱胁迫会致使植株光合系统损伤,体内离子失衡,生理代谢功能紊乱,最终表现出明显的生长抑制。苗高和地径生长量的变化以及生物量分配是植株对盐碱胁迫响应的体现[13-14]。本研究发现,不同种类盐碱处理均对雄性毛白杨良种苗木的苗高和地径增长量产生了影响,经盐碱处理后的植株苗高和地径生长量均一定程度降低。其中,NaCl盐处理主要影响植株苗高生长,NaCl+Na2SO4盐处理在低浓度时就会显著抑制植株地径生长,随着浓度升高,不同类型盐碱处理对苗木的生长抑制作用都会加强,这与程方等[15]、郭瑞等[16]对不同杨属植物进行盐胁迫得到的结论相一致。此外,植株在逆境下会通过调节生物量分配的方式应对胁迫,而茎根比是评价苗木质量的重要指标[17],它是指植株地上部分干质量与地下部分干质量的比值,茎根比越小,苗木根系越发达,应对胁迫环境的能力越强。在高浓度盐碱胁迫下,各处理的苗木地上部分生物量均低于对照组,NaCl盐处理的地上部生物量显著低于NaHCO3盐和Na2CO3+NaHCO3混合盐处理,说明中性盐处理对地上部生物量积累的抑制作用显著强于碱性盐处理,郭慧娟[18]对棉花的研究也表明盐胁迫对地上部的生长抑制强于碱胁迫。此外,研究发现2种碱性盐胁迫下的茎根比在2种浓度下均显著高于中性盐胁迫和对照,这可能是由于碱性盐胁迫对苗木根系的抑制作用相较于地上部分更为强烈,从而呈现出茎根比差异,这说明碱性盐处理对植株根系生长产生了巨大的抑制作用。综合来看,盐碱胁迫均会抑制雄性毛白杨良种苗木的生长,中性的盐处理主要抑制苗木地上部分生长,而碱性的盐胁迫对苗木地下部分所带来的负面影响更大。
3.2 盐碱胁迫对雄性毛白杨良种苗木光合气体交换参数的影响
光合气体交换参数的变化可以体现盐碱胁迫对植株光合作用的影响。本研究发现,低浓度的NaCl盐处理可以提高植株的光合速率,这可能是由于该处理的叶片气孔导度小幅上升,CO2通过率提高,直接影响了CO2进入叶绿体的数量[19],从而增强了光合速率。在高浓度下,叶片气孔导度和胞间CO2浓度均下降,且与叶片净光合速率下降情况相似,说明高浓度下2种中性盐胁迫导致的净光合速率下降是由于气孔导度降低阻碍了CO2顺利进入植物细胞,属于气孔限制因素。本研究发现,在2种碱性盐胁迫下叶片净光合速率、气孔导度、蒸腾速率显著下降,而胞间CO2浓度明显上升,说明碱性的盐胁迫导致的光合速率降低是由于非气孔限制因素造成的[20],这与植株光合电子传递过程以及光合系统受损紧密相关。以往的研究表明,叶片中光合电子传递的场所是类囊体膜,而盐碱胁迫产生的过氧化物会导致植株的生物膜系统损坏,影响光合电子传递过程[21]。此外,光合系统PSⅠ和PSⅡ均是色素-蛋白质复合体,其受离子毒害影响较大,且碱性盐胁迫下的离子毒害作用往往更加剧烈,这导致2种碱性盐胁迫相比2种中性盐胁迫光合结构受损程度更高,叶绿素分解更快,表现出净光合速率下降更为显著。综合以上结果,雄性毛白杨良种苗木对低浓度的中性盐胁迫具有一定抗性,且低浓度NaCl处理可以提升叶片的净光合速率,而碱性盐处理会显著抑制植株的光合作用。
3.3 盐碱胁迫对雄性毛白杨良种苗木不同器官中离子含量及选择性运输的影响
植物对营养元素的吸收受到盐碱胁迫的抑制,一些特定营养元素的缺失会改变植物的代谢过程并影响植株生物合成。盐碱胁迫主要是由于土壤中的过量盐离子引起,植株中Na+过度积累导致离子毒害和矿质元素匮缺[12]。Poustini等[22]对小麦的研究表明,耐盐品种的小麦茎中Na+含量最少;於朝广[12]对2种中山杉幼苗进行盐胁迫后发现,茎中Na+含量小于根和叶中的含量,并以此说明2种中山杉均具有一定的耐盐性。本研究发现,不同盐碱处理均会导致苗木根、茎、叶中的Na+浓度升高,且根中的Na+浓度升高幅度远大于茎和叶。这说明盐碱胁迫下,植株通过将过量Na+控制在根部来调节自身离子平衡,表明雄性毛白杨良种苗木具有一定的耐盐碱性。此外,在高浓度下,NaCl盐处理的根中Na+浓度高于NaHCO3盐处理,而叶片中Na+浓度低于NaHCO3盐处理,这说明NaCl盐处理的地下部分Na+分配比例更高,以此减少了Na+在地上部分积累带来的危害,这与杨树、油菜通过控制Na+在根部和老叶中来维持叶片正常光合作用的结果具有一定的相似性[23-24],说明雄性毛白杨良种苗木在中性盐胁迫下的Na+调节能力强于碱性盐胁迫。
K、Ca、Mg等离子是植株生长发育所必需的营养元素,同时也是参与盐碱胁迫下离子平衡调节的重要元素[25]。Adams等[26]认为植株细胞质中维持高于一定含量的K+对植株耐盐性是非常必要的,但由于Na+和K+具有相似的离子半径和水合能,因此会产生明显的拮抗效应[27],所以盐胁迫会导致K+吸收受限。本研究发现,高浓度下各处理根中K+含量显著降低,而叶片中K+含量显著上升,这可能是由于盐碱胁迫使根部吸收K+的能力减弱以及植株向上选择性运输K+以维持叶片正常光合作用共同导致。Ali等[28]对棉花的研究表明,植株会通过调整组织中Na+和K+的平衡响应盐胁迫,并且认为维持一定比例的K+/Na+比单一维持较低的Na+浓度更为重要。本研究表明,在低浓度盐碱处理时,植株叶片中的K+/Na+与对照相比没有显著差异,这说明在此浓度下,植株通过将根部的K+向上运输的方式维持了叶片中的K+/Na+;而在高浓度下,碱性盐胁迫处理的叶片中K+/Na+显著低于中性盐和对照组,一方面可能由于高碱度和盐度造成根部吸收K+能力减弱,另一方面是由于其根向叶选择性运输K+的能力减弱,从而表现出叶片K+/Na+下降。以上结果说明,高浓度下的2种碱性盐处理对植株根部选择性吸收K+具有很强的抑制作用;相比于中性的盐处理,植株在碱性的盐处理下调节不同器官中K+/Na+和向上选择性运输K+的能力均明显减弱。
Ca2+是细胞壁的主要成分,同时也是植株体内的一种信号分子。相关研究认为Ca2+可以抵消一部分Na+的毒害,并减弱盐碱胁迫对植株生长发育的抑制[29-30];Mg2+与植株叶绿素生成密切相关,一定程度上参与调控植株的光合作用[12]。本研究发现,不同盐碱处理均会提升苗木从根部向地上部选择性运输Ca2+、Mg2+的能力,但是不同器官中Ca2+/Na+和Mg2+/Na+随着盐碱浓度的提升而不断下降。结合不同器官中离子含量的分布,认为盐碱胁迫导致根部对于Ca2+、Mg2+的吸收减弱,但植株的蒸腾作用和自身调节离子平衡机制使得叶片中的Ca2+、Mg2+含量上升,长此以往将会造成植株体内Ca2+、Mg2+缺乏,从而抑制植株的生长发育。
综合来看,雄性毛白杨良种苗木可以通过调整离子平衡响应盐碱胁迫。盐胁迫和碱性盐胁迫均会提高植株根系向地上部分选择性运输K+、Ca2+、Mg2+的能力,但是随着盐碱浓度的提升,植株选择性运输能力有所减弱。高浓度的盐碱处理会阻碍植株根部吸收矿质营养元素,进而导致各器官中K+/Na+、Ca2+/Na+和Mg2+/Na+不断下降。从数值上看,雄性毛白杨良种苗木在中性盐胁迫下控制自身离子平衡的能力要强于碱性盐胁迫。
3.4 研究局限与展望
本研究对不同类型盐碱和浓度处理的苗木生长和生理指标进行了测定,但未根据各项指标数据对苗木耐盐性进行评价,今后可采用数学统计方法综合评价苗木耐盐性。另外,本试验所设置的盐碱浓度水平较少,相同盐碱类型下浓度因素所导致的苗木差异还需进一步研究。
4 结 论
总体来说,不同盐碱类型和浓度对雄性毛白杨良种苗木生长和生理影响不同。第一,盐碱胁迫均会抑制苗木生长,中性盐胁迫对苗木的地上部分生长抑制作用明显,而碱性盐处理对苗木根系的生长抑制作用明显;第二,低浓度的NaCl处理可以提升叶片净光合速率,而2种碱性盐处理则会显著抑制苗木的光合作用;第三,在盐碱胁迫下,苗木通过选择性运输K+、Ca2+、Mg2+的方式控制各器官中的离子平衡,但随着胁迫浓度的增加,苗木自身调节离子平衡能力减弱,且中性盐胁迫下苗木控制离子平衡的能力强于碱性盐胁迫。
参考文献:
[1] 李合生.现代植物生理学[M].北京:高等教育出版社,2002. LI H S. Modern plant physiology[M]. Beijing: Higher Education Press,2002.
[2] YANG C, CHONG J, LI C, et al. Osmotic adjustment and ion balance traits of an alkali resistant halophyte Kochia sieversiana during adaptation to salt and alkali conditions[J]. Plant and Soil, 2007,294(1-2):263-276.
[3] 熊超明,杨婉莹,王文晓,等.不同盐碱胁迫对草莓生长与生理的影响[J].北方园艺,2023(11):38-44. XIONG C M, YANG W Y, WANG W X, et al. Effects of different saline-alkali stress on growth and physiological characteristics of Fragaria ananssa Duch[J]. Northern Horticulture, 2023(11):38-44.
[4] 徐婷,李锁丞,王海江,等.盐碱胁迫下花生生长及生理特性的研究[J].西北农业学报,2023,32(6):866-877. XU T, LI S C, WANG H J, et al. Study on growth and physiological characteristics of peanut under saline-alkali stress[J]. Acta Agriculturae Boreali-occidentalis Sinica,2023,32(6): 866-877.
[5] 史锋厚,宋珂,郭锐,等.盐胁迫对培忠杉苗木离子分布的影响[J].中南林业科技大学学报,2022,42(2):10-16. SHI F H , SONG K, GUO R, et al. Effects of salt stress on the ion distribution of ×Taxodiomera peizhongii seedlings[J]. Journal of Central South University of Forestry Technology, 2022,42(2):10-16.
[6] GUO H J, HUANG Z J, LI M Q, et al. Growth, ionic homeostasis, and physiological responses of cotton under different salt and alkali stresses[J]. Scientific Reports,2020,10(1):21844.
[7] YANG C, SHI D, WANG D. Comparative effects of salt and alkali stresses on growth, osmotic adjustment and ionic balance of an alkali-resistant halophyte Suaeda glauca (Bge.)[J]. Plant Growth Regulation,2008,56(2):179-190.
[8] 朱之悌.全国毛白杨优树资源收集、保存和利用的研究[J].北京林业大学学报,1992(增刊3):1-25. ZHU Z T. Collection, conservation and utilization of plus tree resources of Populus tomentosa in China[J]. Journal of Beijing Forestry University,1992(Suppl.3):1-25.
[9] 康向阳.‘北林雄株1号’、‘北林雄株2号’新品种选育[C].中国林业学术大会,2013. KANG X Y. Breeding of new varieties ‘Beilin Xiongzhu 1’and ‘Beilin Xiongzhu 2’[C]. China Forestry Academic Conference, 2013.
[10] 于雷,王敏,侯庚,等.‘辽胡1号杨’扦插苗耐盐碱性分析[J].湖南生态科学学报,2022,9(4):77-81. YU L, WANG M, HOU G, et al. Analysis of salt and alkaline tolerance of poplar cuttings ‘Liaohu No.1’[J]. Journal of Hunan Ecological Science,2022,9(4):77-81.
[11] 于海武.毛白杨无性系耐盐性比较与转耐盐基因的研究[D].北京:北京林业大学,2004. YU H W. Study on comparison of salt-resistance abilities among different Populus tomentosa clones and gene transformation for salt tolerance[D]. Beijing: Beijing Forestry University,2004.
[12] 於朝广,李颖,谢寅峰,等.NaCl胁迫对中山杉幼苗生长及离子吸收、运输和分配的影响[J].植物生理学报,2016, 52(9):1379-1388. YU C G, LI Y, XIE Y F, et al. Effects of NaCl stress on growth and absorption, transportation and distribution of ions in Zhongshanshan seedlings[J]. Plant Physiology Journal,2016, 52(9):1379-1388.
[13] 李峰,谢永宏,覃盈盈.盐胁迫条件下湿地植物的适应策略[J].生态学杂志,2009,28(2):314-321. LI F, XIE Y H, QIN Y Y. Adaptive strategies of wetland plant in salt stress environment[J]. Chinese Journal of Ecology, 2009,28(2):314-321.
[14] 鲁晓宇,郭家鑫,陶一凡,等.不同盐碱胁迫对棉花营养元素吸收转运以及代谢的影响[J].中国生态农业学报,2023, 31(3):438-451. LU X Y, GUO J X, TAO Y F, et al. Effects of different salt and alkali stress on absorption, transportation, and metabolism of nutrient elements in cotton[J]. Chinese Journal of EcoAgriculture,2023,31(3):438-451.
[15] 程方,赵小军,倪云,等.5个南方型杨树无性系苗木耐盐性盆栽试验[J].林业科学研究,2019,32(3):105-112. CHENG F, ZHAO X J, NI Y, et al. Study on salt tolerance of five southern poplar clones in pot culture[J]. Forest Research, 2019,32(3):105-112.
[16] 郭瑞,尹建道,姬梅凤,等.5种杨树幼苗期耐盐力对比分析[J].东北林业大学学报,2012,40(10):28-33. GUO R, YIN J D, JI M F, et al. Salt resistance of five poplar clones during seedling period[J]. Journal of Northeast Forestry University,2012,40(10):28-33.
[17] 宗建伟,张志龙,薛可欣,等.盐碱胁迫下文冠果生理响应机制研究[J].林业科学研究,2021,34(3):158-165. ZONG J W, ZHANG Z L, XUE K X, et al. Study on growth and physiological response mechanism of Xanthoceras sorbifolia Bunge under salt-alkali stress[J]. Forest Research,2021,34(3): 158-165.
[18] 郭慧娟.不同盐碱胁迫下棉花离子组响应特征及离子稳态机制研究[D].石河子:石河子大学,2019. GUO H J. Ionome response characteristics and ion homeostatic mechanism of cotton under different salt stresses[D]. Shihezi: Shihezi University,2019.
[19] 李远航,贺康宁,张潭,等.盐胁迫对黑果枸杞光合生理指标的影响[J].中国水土保持科学,2019,17(1):82-88. LI Y H, HE K N, ZHANG T, et al. Effects of salt stress on the photosynthetic and physiological indexes of Lycium ruthenicum[J]. Science of Soil and Water Conservation,2019,17(1):82-88.
[20] 贾文飞,魏晓琼,李林宇,等.盐碱处理对越橘生长形态、光合生理及离子含量的影响[J/OL].吉林农业大学学报, http:// kns.cnki.net/kcms/detail/22.1100.S.20220922.1231.002.html. JIA W F, WEI X Q, LI L Y, et al. Effects of saline-alkali treatments on growth morphology, photosynthetic physiology and ion content of blueberry[J/OL]. Journal of Jilin Agricultural University,http://kns.cnki.net/kcms/detail/22.1100.S.20220922. 1231.002.html.
[21] SUDHIR P, MURTHY S D S. Effects of salt stress on basic processes of photosynthesis[J]. Photosynthetica: International Journal for Photosynthesis Research,2004,42(4):481-486.
[22] POUSTINI K, SIOSEMARDEH A. Ion distribution in wheat cultivars in response to salinity stress[J]. Field Crops Research,2004,85(2):125-133.
[23] SUN Y, OU Y B, GAO Y F, ZHANG X, et al. Different tolerance mechanism to alkaline stresses between Populus bolleana and its desert relative Populus euphratica[J]. Plant and Soil,2018,426(1-2): 349-363.
[24] 孙鲁鹏,杨洋,王卫超,等.油菜苗期对盐碱胁迫的离子响应机制[J].中国农业科技导报,2023,25(5):46-54. SUN L P, YANG Y, WANG W C, et al. Ion response mechanism of canola seedlings to saline-alkali stress[J]. Journal of Agricultural Science and Technology,2023,25(5):46-54.
[25] CHEN Y, LU P, SUN P, et al. Interactive salt: alkali stress and exogenous Ca2+ effects on growth and osmotic adjustment of Lolium multiflorum in a coastal estuary[J]. Flora,2017,229:92-99.
[26] ADAMS P, THOMAS J C, VERNON D M, et al. Distinct cellular and organismic responses to salt stress[J]. Plant and Cell Physiology,1993,33(8):1215.
[27] PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants: a review[J]. Ecotoxicology and Environmental Safety, 2005,60(3):324-349.
[28] ALI L, ASHRAF M, MAQBOOL M, et al. Optimization of soil K: Na ratio for cotton (Gossypium hirsutum L.) nutrition under field conditions[J]. Pakistan Journal of Botany,2013,45(1): 127-134.
[29] KHAN M N, SIDDIQUI M H, MOHAMMAD F, et al. Interactive role of nitric oxide and calcium chloride in enhancing tolerance to salt stress[J]. Nitric Oxide,2012,27(4):210-218.
[30] KHAN M N, SIDDIQUI M H, MOHAMMAD F, et al. Calcium chloride and gibberellic acid protect linseed (Linum usitatissimum L.) from NaCl stress by inducing antioxidative defence system and osmoprotectant accumulation[J]. Acta Physiologiae Plantarum,2010,32(1):121-132.
[本文编校:吴 彬]

