不同无血清培养体系对人脐带间充质干细胞生物学功能的影响
林惠珠?李翠平?陈晓燕?阳莉

【摘要】 目的 探討3种不同无血清培养体系对人脐带间充质干细胞(hUC-MSC)体外培养的生物学功能的影响。方法 取3株脐带组织,各分3组实验组,经贴壁法分别置于3组不同无血清培养体系(A组:纯化学成分合成的无血清培养体系,B组:血小板裂解物+基础培养基的无血清培养体系,C组:纤维蛋白原包被+含重组人蛋白质的无血清培养体系)中培养至第3代,比较其细胞增殖能力、细胞表型、三系分化能力以及免疫调节功能。结果 3组实验组细胞均呈长而扁平的梭形,贴壁生长,大小均一。其增殖曲线趋势相似,A组和B组P2、P3代次的增殖能力优于C组(P均< 0.05)。3组实验组细胞均符合国际干细胞协会对hUC-MSC细胞表面标志物鉴定的要求,A组和B组P3代次的CD29和CD90的表达量均高于C组(P均< 0.05),并且3组实验组均具有三系分化能力。3组实验组中P3代次的T淋巴细胞增殖率、Th1和Th17细胞亚群分泌的细胞因子比例均低于对照组,调节性T细胞(CD4+ CD25+ FOXP3+)比例均高于对照组,而3组实验组之间两两比较差异无统计学意义(P均> 0.05)。结论 3种不同无血清培养体系的hUC-MSC均能保持其基本的生物学特性和免疫调节活性,纯化学成分合成的无血清培养体系和血小板裂解物+基础培养基的无血清培养体系的增殖能力和细胞表面标志物表达均优于纤维蛋白原包被+含重组人蛋白质的无血清培养体系。
【关键词】 人脐带间充质干细胞;无血清培养体系;生物学功能
Effects of different serum-free culture systems on the biological function of hUC-MSCs Lin Huizhu, Li Cuiping, Chen Xiaoyan, Yang Li. Biotherapy Center, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Yang Li, E-mail: yangli22@mail.sysu.edu.cn
【Abstract】 Objective To evaluate the effects of three different serum-free culture systems on the biological function of human umbilical cord mesenchymal stem cells (hUC-MSC) cultured in vitro. Methods Three strains of umbilical cord tissues were obtained,divided into 3 experimental groups and cultured to the 3rd generation (P3) in three different serum-free culture systems (Group A: serum-free culture system synthesized by pure chemical components,group B: serum-free culture system consisting of platelet lysate+basic culture medium,group C: serum-free culture system consisting of fibrinogen coating+recombinant human protein). The cell proliferation,cell phenotype,three-line differentiation and immunomodulatory function were compared. Results All the cells in three groups were long and flat fusiform,adherent to the wall and uniform in size. The proliferation curve trend was similar,and the proliferation ability of P2 and P3 generations in groups A and B was better than that in group C (both P <
0.05). The cells in three experimental groups all met the requirements of the International Stem Cell Society for identification of hUC-MSC cell surface markers. The expression levels of CD29 and CD90 in P3 generations in groups A and B were higher than those in group C (all P < 0.05),and all three experimental groups had the ability of three-line differentiation. Compared with the control group,the proliferation rate of T lymphocytes in P3 generation and the proportion of cytokines secreted by Th1 and Th17 cell subsets were significantly decreased in the three experimental groups,and the proportion of regulatory T cells (CD4+ CD25+ FOXP3+) was significantly increased in the three experimental groups,but there was no statistical significance among three experimental groups (all P > 0.05). Conclusions The hUC-MSC in three groups can maintain basic biological characteristics and immunomodulatory activity. The proliferation ability and expression levels of cell surface markers in groups A and B are superior to those in group C.
【Key words】 Human umbilical cord mesenchymal stem cell; Serum-free culture system; Biological function
人脐带间充质干细胞(hUC-MSC)是一类具有自我更新能力和多向分化潜能的成体干细胞,因来源广泛、取材方便、低免疫原性、增殖能力强等优点,已被广泛应用于基因治疗等研究领域[1-3]。
在临床、科研应用前,需要通过初步分离和体外扩增以获得足够数量的hUC-MSC,而影响hUC-MSC培养效率和安全性的关键因素在于细胞培养体系。目前,在体外选用不同培养体系培养hUC-MSC方面,无血清培养体系的安全性和培养效率优于动物血清培养体系[4-5]。无血清培养更利于细胞的生长,容易进行纯化和下游加工、细胞功能的精准评估、增强生长和产量、增强细胞内中介物的检测,可以消除来自血清的不均一性,简化分离纯化步骤和鉴定各种细胞产物的程序,避免病毒污染造成的危害。经历了天然培养基、合成培养基后,无血清培养基成为当今细胞培养领域的一大趋势。无血清培养基一般包括细胞因子合成物和人血小板裂解物,不同的培养基成分对细胞的生长影响较大,因此本研究采用3种不同无血清培养体系对hUC-MSC进行体外扩增培养,比较培养后细胞的形态、增殖能力、表面标志物的表达率、三系分化能力及免疫调节作用的差异,以筛选出最佳的无血清培养体系,提高hUC-MSC的细胞产量和质量。
材料与方法
一、材 料
1.脐带组织
3株约30 cm的脐带取自中山大学附属第三医院岭南医院产科健康供体,且供体签署知情同意书。供体筛选标准:HBV、丙型肝炎病毒、HIV、巨细胞病毒、EB病毒、梅毒检测均为阴性,且无家族遗传病史,无传染病史。本研究获中山大学附属第三医院干细胞临床研究机构伦理专家委员会批准(批件号:[2020年份]14号)。
2.试剂与仪器
间充质干细胞无血清培养基、消化酶均购自友康生物科技(背景)股份有限公司。Helios UltraGROTM购自美国AventaCell公司。MSC-T4购自珠海贝索生物技术有限公司。α-MEM培养基、RPMI 1640培养基、DMEM低糖培养基均购自美国Gibco公司。OriCell人脐带间充质干细胞成脂、成骨、成软骨诱导分化培养基试剂盒均购自广州赛业生物科技有限公司。人淋巴细胞分离液购自挪威Axis-shield公司。调节性T细胞(Treg)检测试剂盒、白细胞活化试剂盒、破膜剂和流式抗体FITC-CD3、APC-CD8、PE-cy7-IFN-γ、APC-IF-17A、FITC-CD8均购自美国BD公司。流式抗体CD29-FITC、CD31-FITC、CD34-FITC、CD44-FITC、CD45-FITC、CD73-PE、CD90-PE、CD105-PE、CD166-PE、HLA-DR-FITC均购自美国Bechman公司。CD3细胞分选磁珠购自德国Miltenyi公司。CellTrace? CFSE 细胞增殖试剂盒购自美国Thermo Scientific公司。CD3、CD28单克隆抗体和IL-2购自美国Perprotech公司。倒置显微镜购自德国Leica DMil公司,离心机购自德国Eppendorf公司,二氧化碳培养箱购自美国Thermo Scientific公司,流式细胞仪购自美国Bechman Coulter公司。
二、方 法
1. hUC-MSC的分离培养
将3株脐带组织分别设为3组实验组,A组:纯化学成分合成的无血清培养体系,B组:血小板裂解物+基础培养基的无血清培养体系,C组:纤维蛋白原包被+含重组人蛋白质的无血清培养体系。分别剔除脐带表皮和血管,取华通氏胶,剪至3 mm3大小平均接种于9个150 mm培养皿,每组3个150 mm培养皿,分别加入3种不同无血清培养基,置37 ℃、5%二氧化碳培养箱中培养至细胞融合度达20%~30%,消化收集细胞记为P0代细胞,分别继续传代培养至P3代,冻存备用。
2. hUC-MSC 的增殖活性
分别将P0代次的hUC-MSC以8 000 cells/cm2
的密度接种于培养瓶中,待细胞融合度为80%~
90%,收集细胞、计数、传代至P3代,绘制细胞生长曲线。
3. hUC-MSC表面标志物的检测
收集P3代次hUC-MSC,用生理盐水洗涤后将细胞浓度调整为2×106 cells/mL,按每管100 μL分别加入5 μL的CD29、CD31、CD34、CD44、CD45、CD73、CD90、CD105、CD166、人类白细胞抗原(HLA-DR)单克隆抗体,混匀、4 ℃避光孵育30 min;
用生理盐水洗涤、重悬后,用流式细胞仪检测hUC-MSC细胞表面标志物的表达情况。
4. hUC-MSC体外三系潛能诱导分化
收集P3代的hUC-MSC按成骨诱导分化培养试剂盒培养2~4周,用4%多聚甲醛固定细胞,行茜素红染色,镜检观察。
收集P3代的hUC-MSC按成脂诱导分化培养试剂盒培养2~4周,4%多聚甲醛固定细胞,行油红O染色,镜检观察。
收集P3代的hUC-MSC按成软骨诱导分化培养试剂盒培养4周后,用4%多聚甲醛固定细胞团。取人软骨组织为阳性对照、脐带组织为阴性对照,切片,行苏木素染色,镜检观察。
5. hUC-MSC免疫调节功能
5.1单个核细胞的提取
通过密度梯度离心法分离30 mL健康人外周血提取单个核细胞,加入磷酸盐缓冲溶液(PBS)重悬、用CD3磁珠分选提取细胞,分选后用FITC-CD3标记,用流式细胞仪检测T淋巴细胞的纯度。
5.2羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)的标记
取5.1步驟分选的细胞1×106 cells/mL,加入CFSE,于37 ℃避光孵育20 min;加入预冷10%胎牛血清的RPMI1640培养液,冰浴5 min,用生理盐水洗涤3次、重悬,细胞浓度调整为1×
106 cells/mL。
5.3 hUC-MSC对T淋巴细胞增殖的影响
将1×105 cells/well的hUC-MSC与5×105 cells/well
于5.1步骤标记的细胞置于24孔板中共培养,各加入CD3、CD28单克隆抗体和IL-2,以前一步骤分选的细胞和标记的细胞做为对照孔,共培养4 d,收集细胞,用生理盐水洗涤、离心、重悬,用流式细胞仪检测淋巴细胞增殖的情况。
5.4 hUC-MSC对T淋巴细胞免疫功能的调节
将hUC-MSC与5.1步骤标记的T淋巴细胞按1∶5的比例共培养4 d后,按白细胞活化试剂盒说明刺激收集细胞,用FITC-CD3、APC-CD8和FITC-CD8标记、破膜,分别进行IFN-γ(PE-Cy7), TNF-α(PE)和IL-17A(APC)染色,用流式细胞仪检测Th1、Th17细胞分泌细胞因子的情况,按Treg检测试剂盒标记细胞,流式细胞仪检测Treg(CD4+CD25+FoxP3+)的比例。
三、统计学处理
采用SPSS 25.0进行数据分析。符合正态分布的计量资料用表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
结 果
一、hUC-MSC的细胞形态
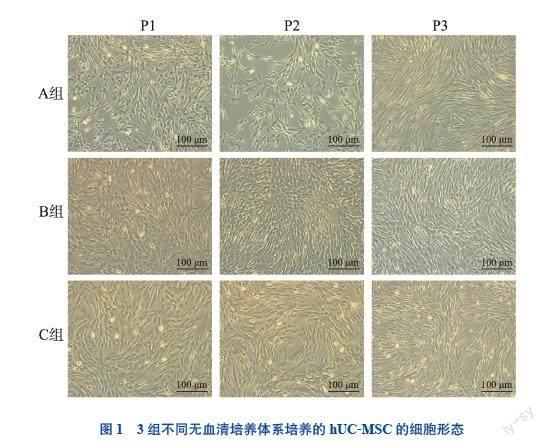
3组实验组的hUC-MSC均贴壁生长,细胞形态均为长而扁平的梭形细胞,大小均一,极性排列,集落呈涡旋状,类似于成纤维细胞。见图1。
二、hUC-MSC的增殖活性比较
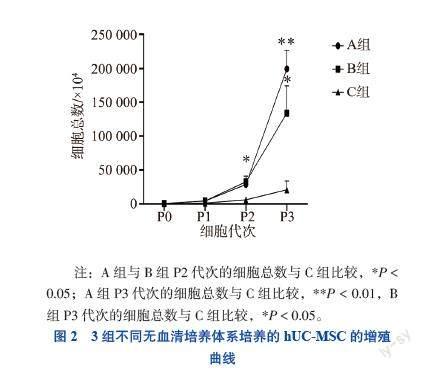
根据P0~P3代次hUC-MSC的计数结果绘制增殖曲线。3组实验组的细胞增殖曲线趋势相似, P0~P1代次的hUC-MSC增殖较慢;P2代次开始,hUC-MSC进入对数增长期,增殖能力强。3组实验组细胞总数两两比较,A组与B组P2、P3代次的细胞总数比较差异均无统计学意义(P均> 0.05),A组与B组P2、P3代次的增殖能力均优于C组(P均< 0.05)。见图2。
三、hUC-MSC的细胞表面标志物
流式细胞仪分析结果显示,3组实验组P3代次的hUC-MSC细胞表面标志物CD29、CD44、CD73、CD90、CD105、CD166表达率均≥95%;CD34、CD45、 CD31、HLA-DR表达率均≤2%,均符合国际干细胞协会对hUC-MSC细胞表面标志物鉴定的要求[6]。3组实验组两两比较,A组与B组的细胞表面标志物表达率比较差异均无统计学意义(P均> 0.05),A组和B组的CD29、CD90表达率均高于C组(P均< 0.05)。见表1。
四、hUC-MSC的三系分化能力
3组实验组的hUC-MSC在体外均具有成骨、成脂、成软骨分化的功能。成骨诱导4周后经茜素红染色,镜下可见红色的钙盐沉积,见图3A。成脂诱导4周后经油红O染色,镜下可见橘红色的脂滴,见图3B。成软骨诱导4周后切片观察,可见经苏木素染液染成紫红色的软骨细胞,见图3C。
五、hUC-MSC对T淋巴细胞的免疫调节作用
1. 3组不同无血清培养体系培养的hUC-MSC对T淋巴细胞增殖的影响
hUC-MSC与经过CFSE标记的T淋巴细胞共培养4 d后,流式结果显示,3组实验组中T淋巴细胞增殖的比例均低于对照组(P均< 0.05),3组实验组两两比较差异无统计学意义(P均> 0.05),见图4A、F。由此表明,3组实验组的hUC-MSC均能抑制T淋巴细胞的增殖。
2. 3组不同无血清培养体系培养的hUC-MSC对Th1、Th17细胞分泌的细胞因子和对Treg的
调节
hUC-MSC与T淋巴细胞共培养4 d后,流式结果显示,3组实验组中P3代次的Th17细胞亚群分泌的细胞因子(CD8-IL-17A+)比例和Th1细胞分泌的细胞因子(CD3+TNF-α+)均低于对照组(P均<
0.05),见图4B、C、F。Th1细胞亚群分泌的细胞因子(CD3+IFN-γ+)比例均低于对照组,3组实验组两两比较,差异无统计学意义(P均> 0.05),见图4B~D、F。由此表明,3组不同无血清培养体系培养的hUC-MSC均能抑制Th1和Th17细胞分泌炎症因子。
hUC-MSC与CD3分选的T淋巴细胞共培养4 d
后,流式结果显示,3组实验组中CD4+ CD25+ FoxP3+细胞比例均高于对照组,3组实验组两两比较,差异无统计学意义(P > 0.05),见图4E、F。由此表明,3组不同无血清培养体系培养的hUC-MSC均能诱导Treg细胞的增殖。
讨 论
MSC无血清培养基,是整个间充质干细胞体外培养的核心。间充质干细胞培养基从上市到现在,已经走过了3代。第3代培养基是用成分明确的非动物来源的化学物质完全替代了血清或血小板裂解物(牛血清替代物),没有未知组分、没有动物源组分,人体安全性高,批次性能差别小。hUC-MSC在无血清培养体系中能实现大量扩增,然后回输到人体,具有调节组织免疫微环境和促进组织修复的功能。无血清培养基的营养添加因子不同,可影响hUC-MSC体外扩增的效率,细胞表型、分化能力及遗传特性等[7-8]。目前主要从3个方面进行hUC-MSC的鉴别:①细胞贴壁生长;②细胞表型高表达CD73、CD90、CD105,低表达或不表达CD34、CD45、CD11b、CD19和 HLA-DR;③具有体外分化成脂、成骨、成软骨的潜能[6]。为了筛选出高效稳定的hUC-MSC体外无血清培养体系,本研究分别用3组不同无血清培养体系对hUC-MSC进行体外扩增培养。结果显示,3组实验组的hUC-MSC均符合国际干细胞协会制定的鉴定标准,各组细胞形态无明显差异,其中纯化学成分合成的无血清培养体系和血小板裂解物的无血清培养体系的hUC-MSC在细胞表面标志物及增殖活性上优于纤维蛋白原包被+含重组人蛋白质的无血清培养体系[6]。既往文献表明,无血清培养基含有向细胞内转运离子的转铁蛋白和调节葡萄糖摄取量的胰岛素,以及促生长因子和一些促细胞贴壁的蛋白质等,这些添加物能够选择性地促进MSC体外培养中的生长和分化,进而引起hUC-MSC在增殖及表型表达方面的差异[9-11]。
hUC-MSC具有调节多种免疫细胞的功能,特别是T淋巴细胞。辅助性T细胞根据细胞因子分泌的不同分为 Th1、Th17和Treg等,通过受体介导的细胞因子,发挥不同的免疫效应。Th1分泌TNF-α、IFN-γ等,介导机体的炎性反应和组织损伤;Th17分泌 IL-17A,具有抗感染作用[12-13]。目前,CD4+ CD25+ FOXP3+ 是Treg标志物主要的检测组合之一,而 Foxp3是控制Treg发育和功能的关键转录因子之一,需要进行破膜后检测[14]。抑制T淋巴细胞的活化、增殖和细胞因子分泌,显著上调Treg比例,进而影响其他免疫细胞功能,这一特性是MSC临床疗效评价最为重要的属性之一[15-17]。
本研究3组实验组的T淋巴细胞增殖率、Th1和Th17细胞分泌的细胞因子比例均降低,Treg比例均升高,3组不同无血清培养体系培养的hUC-MSC均保持着免疫调节功能。
综上所述,3组不同无血清培养基培养的hUC-MSC均能保持其基本的生物学特性和免疫调节活性,纯化学成分合成的无血清培养体系和血小板裂解物的无血清培养体系优于纤维蛋白原包被+含重组人蛋白质的无血清培养体系。
参 考 文 献
[1] 张蘋, 郭莹, 高亚杰, 等. 低氧预处理人脐带间充质干细胞促进其源性外泌体对心肌梗死后心肌损伤的修复. 中国组织工程研究, 2019, 23(17): 2630-2636.
[2] Mishra V K, Shih H H, Parveen F, et al. Identifying the therapeutic significance of mesenchymal stem cells. Cells, 2020, 9(5): 1145.
[3] Naji A, Eitoku M, Favier B, et al. Biological functions of mesenchymal stem cells and clinical implications. Cell Mol Life Sci, 2019, 76(17): 3323-3348.
[4] 白喜龙, 冯春, 葛晓凡, 等. 改良型无血清培养基对人脐带间充质干细胞生物学特性的影响. 江苏医药, 2020, 46(7): 649-653, 757.
[5] 白尚星. 不同培养基对人脐带间充质干细胞生物学特性的影响. 中国实用医药, 2014, 9(14): 6-8.
[6] Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 2006, 8(4): 315-317.
[7] 张丽, 王文芳, 郭芸, 等. 无血清培养体系分离培养人脐带间充质干细胞. 皮肤病与性病, 2019, 41(1): 4-6.
[8] Yin J Q, Zhu J, Ankrum J A. Manufacturing of primed mesenchymal stromal cells for therapy. Nat Biomed Eng, 2019, 3(2): 90-104.
[9] 韩颢, 白虹. 无血清培养基对深低温冻存复苏后的间充质干细胞免疫功能的研究. 天津医科大学学报, 2019, 25(3): 225-228, 263.
[10] 王武, 齐保军, 武忠炎, 等. 人脐带间充质干细胞向神经元样细胞诱导分化: 两种方法的比较. 中国组织工程研究, 2019, 23(1): 41-46.
[11] Hoang V T, Trinh Q M, Phuong D T M, et al. Standardized xeno- and serum-free culture platform enables large-scale expansion of high-quality mesenchymal stem/stromal cells from perinatal and adult tissue sources. Cytotherapy, 2021, 23(1): 88-99.
[12] 王方迪, 侯瑞霞, 李俊琴, 等. 間充质干细胞对T细胞免疫调节机制的研究进展. 中国免疫学杂志, 2021, 37(22): 2715-2721.
[13] Amatya N, Garg A V, Gaffen S L. IL-17 signaling: the Yin and the Yang. Trends Immunol, 2017, 38(5): 310-322.
[14] Attias M, Al-Aubodah T, Piccirillo C A. Mechanisms of human FoxP3+ Treg cell development and function in health and disease. Clin Exp Immunol, 2019, 197(1): 36-51.
[15] 韩晓燕, 纳涛, 张可华, 等. 人间充质干细胞生物学有效性的质量评价. 中国新药杂志, 2018, 27(21): 2511-2518.
[16] 李清, 唐笛, 王莹, 等. 间充质干细胞与免疫的相互作用: 从基础研究到临床应用. 生命科学, 2016, 28(8): 933-940.
[17] 黄南渠, 屠琳, 王启兵, 等. 丹参酮ⅡA千预间充质干细胞对LPS诱导N9小胶质细胞激活的抑制作用. 遵义医科大学学报. 2022, 45(1): 19-24.
(收稿日期:2023-03-16)
(本文编辑:洪悦民)

