玉米矮秆基因及调控机理的研究进展
唐 兰,吴元奇
(四川农业大学 玉米研究所,四川成都 611134)
玉米(Zea mays L.)是一年生禾本科(Gramineae)草本植物,起源于墨西哥中部,由野生大刍草进化而来。近年来,随着推广面积和播种面积的增加,玉米已成为国内外第一大粮食作物[1]。玉米是一种典型的集粮、经、饲、能、医于一体的多元作物[2],是确保我国粮食安全、能源安全、经济发展和乡村振兴等诸多方面的主力军。纵观农业发展史,世界农业的发展深受粮食作物株高改良的影响,株高与作物的最终产量密切相关[3-5]。矮秆作为作物株高性状的一种特殊类型,具有抗倒性、株型紧凑、群体光合利用率高及适宜机械化生产等特点。以小麦和水稻矮化品种的培育和推广为主要标志的“第一次绿色革命”带来了全球粮食产量的飞跃,解决了由于人口快速增长而引发的粮食危机[6]。本文综述了调控玉米矮秆的QTL/基因及分子机制,旨在展望现代生物技术在矮秆玉米品种遗传改良中的发展前景,以期为玉米矮秆遗传育种提供参考。
1 玉米矮化育种过程
1935 年,EMERSON 发现玉米矮秆基因br2。br2是控制玉米果穗以下茎节长度缩短的隐性矮秆基因[7-8],是目前研究与应用最广泛的矮秆基因。20 世纪60 年代后期,墨西哥利用br2 矮秆基因成功选育出优良的矮秆玉米杂交种,其中成效最为显著的是本雀·比利亚AN-360[9]。1965 年开始,玉米矮化育种逐渐成为国内育种工作的焦点,选育出了耐密植、耐肥、产量高等特点的玉米矮秆杂交种,如南矮号、攀登号、成矮号等[10-11]。20 世纪80 年代末,矮秆自交系的组配模式实现了由“矮秆×矮秆”向“矮秆×高秆”的转变,并成功选育出一批中高秆、高秆玉米杂交种,在生产上得到了大面积的推广应用[12-13]。如利用矮秆自交系478 与高秆自交系杂交育成的川单13、南玉13、掖单13 和鲁单49;河北冀南玉米研究所通过采用“高、矮杂交,定向选择”的方法,极大地解决了连锁不良性状等问题,选育出理想玉米杂交种矮单268[14-15]。2013 年,姜惟廉等[16]选育出我国第1 个多基因矮生系5003 和姊妹系5005,矮生系5003 具有适应性广、抗逆性强、配合力高等特点。近年来,学者们发现了一些不同于br2 基因的新矮秆玉米材料,如董丽等[7]在K718 中发现的玉米矮秆突变体K718d,该突变体受隐性单基因控制;邱正高等[17]发现了一个新的隐性玉米矮秆基因,并对其进行了鉴定和遗传分析,命名为dm676。矮秆基因的发掘及遗传研究利用是玉米育种工作中的重要环节。因此,创制和鉴定新的优良矮秆玉米种质资源将是解决矮化单基因育种的重要途径。
2 玉米株高的构成因子
株高是玉米理想株型的关键要点。玉米茎秆是在根和叶间起输导和支撑作用的重要器官,既有“源”的功能,也有“库”的功能,是叶片和籽粒的中间桥梁,也是各项生理活动的必经之路[18]。成熟期玉米的株高由茎秆的节间数目和节间长度共同决定,茎节总数目的多少以及单个茎节长度的变化对植株的整体株高具有较大影响,节间数目越少,节间长度越短,则植株越矮,反之亦然[19]。茎节细胞分裂分化的过程会引起节间细胞数目和细胞大小的差异,独立的茎节长度又与茎秆细胞的纵向长度和单位面积内细胞的数目有关[20]。玉米的茎秆节间以穗部为界线分为穗上节间和穗下节间。穗上节间的长度对雌穗的伸长有影响,穗下节间的长度对穗位高有影响。玉米突变体d2003 的茎秆细胞在电镜扫描下发现,在同一茎秆和相同倍镜中,突变体细胞数目显著少于对照K36。由此推测,突变体d2003 株高降低的原因是玉米茎秆中节间细胞数目减少。谷风娟[21]通过对玉米Ehel、B73、F1和F2:3家系节间相关性状的调查分析显示,株高与穗位高、穗下节间数、穗上平均长度和穗下平均长度均表现为极显著的正相关。邱正高等[17]研究表明,穗位节间以及穗下1 节间的纵向细胞长度缩短是导致玉米矮秆突变体dm676 矮化的原因。同样,张贺通[22]研究发现,玉米矮秆突变体dle1 茎秆节间纵切面细胞长度显著短于LY8405,说明矮秆材料dle1 株高和穗位高降低的原因是穗下节间数目减少及节间细胞纵向长度变短。
2.1 调控玉米株高QTL 的研究
株高是玉米育种过程中的关键数量性状。随着分子生物相关技术的进展,株高QTL 精细定位的研究逐渐增加。迄今为止,Maize-GDB 数据库已经有319 个控制株高的QTL 得到了初步定位,这些QTL分布在玉米基因组的10 条染色体上。例如,陆明洋等[23]利用1 份在玉米自交系87-1 的遗传背景上综3 的染色体单片段代换系SSSL-Y7 为试验材料,将与株高显著相关的QTL qph1-4 定位在第1 条染色体1.07 bin 位置上,位于SSR 标记MPH47 和umc2396 之间,距两标记的遗传距离分别为1.5 和0.3 cM。刘忠祥等[24]在2 年3 个环境中利用2 个高代回交的重组自交系将株高主效QTL qPH3.2 定位在第3 条染色体上,遗传距离为20 cM,随后利用在目标区段内筛选出的分子标记,将qPH3.2 定位在SSR 标记YH305-Y72(2 Mb)和YH112-Y50(1.6 Mb)上。尤诗婷等[25]通过BC2F5群体,利用高密度的SNP连锁图,采用完备区间作图法共检测到6 个株高、穗位高的QTL。腾峰[26]利用染色体片段代换系SL15 和综3 进行qPH3.1 精细定位,通过F2群体中671 和2153 株单株,最终将qPH3.1 定位在大小12.6 kb 的区间内。杨梅[27]通过筛选出F2群体中的交换单株用于精细定位,将qPH3.3 的定位区间缩小至1 Mb 的范围。张梦迪等[28]在混合分离分析法(BSA)重测序的基础上,最终将与株高显著相关的QTL qPH2.4 定位在第2 条染色体上,物理距离为13.95 Mb。综上研究表明,玉米株高既有可能是由主基因+多基因控制的,也有可能是由单基因控制的遗传性状。
2.2 玉米矮秆基因的研究
随着国内外对新的矮秆基因不断的深入研究,迄今为止,据前人研究和maize-GDB(http://chinese.maizegdb.org/data-center/phenotype)报道的玉米矮秆基因有60 多个,为矮秆基因家族添加了许多新成员。除了D8、D9、Dt、D8-1023、D*-10、D11 为显性基因外,其余大多数为隐性基因。玉米第1、3、5、6、8、9 条染色体上的矮秆基因见图1。
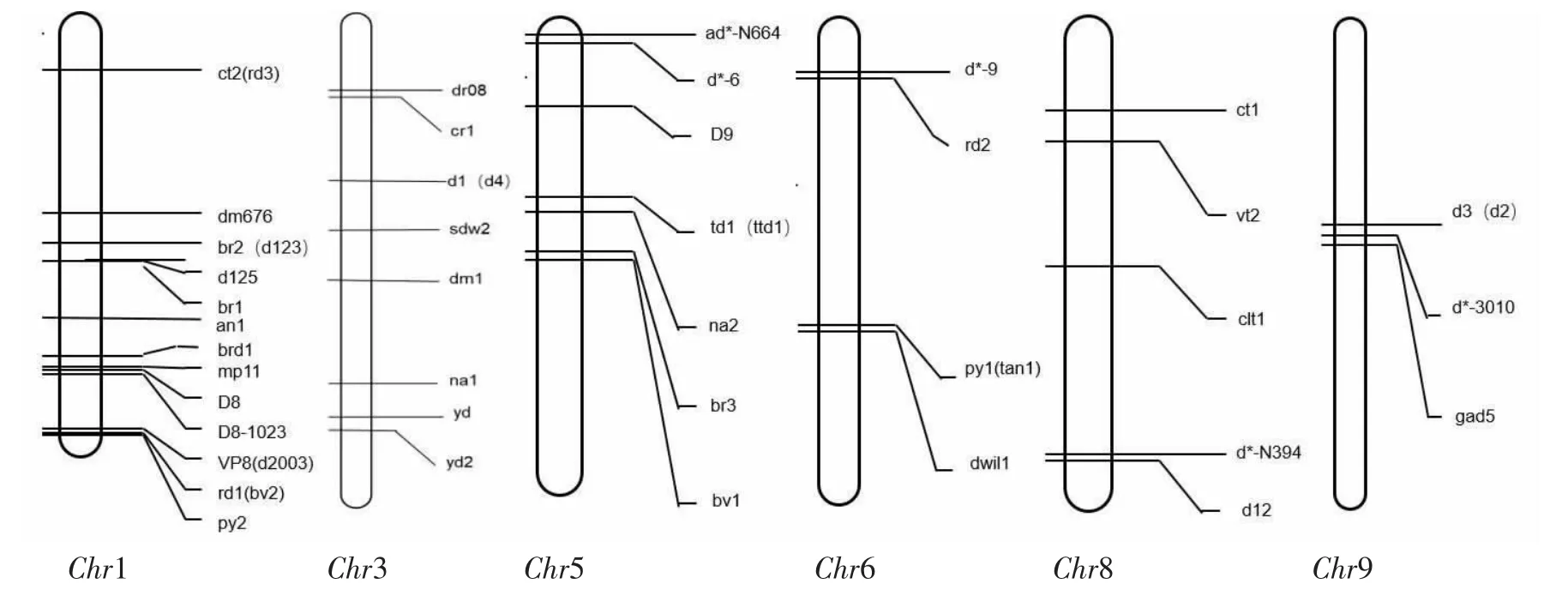
图1 玉米染色体上的矮秆基因Figure 1 Dwarf genes on maize chromosomes
玉米株高(plant height,PH)、穗位高(ear height,EH)被克隆的基因几乎都涉及激素的合成、运输和信号转导,主要为赤霉素、油菜素甾醇和生长素等对玉米株高和穗位高的调控,部分玉米矮秆基因表型及分子机制见表1。
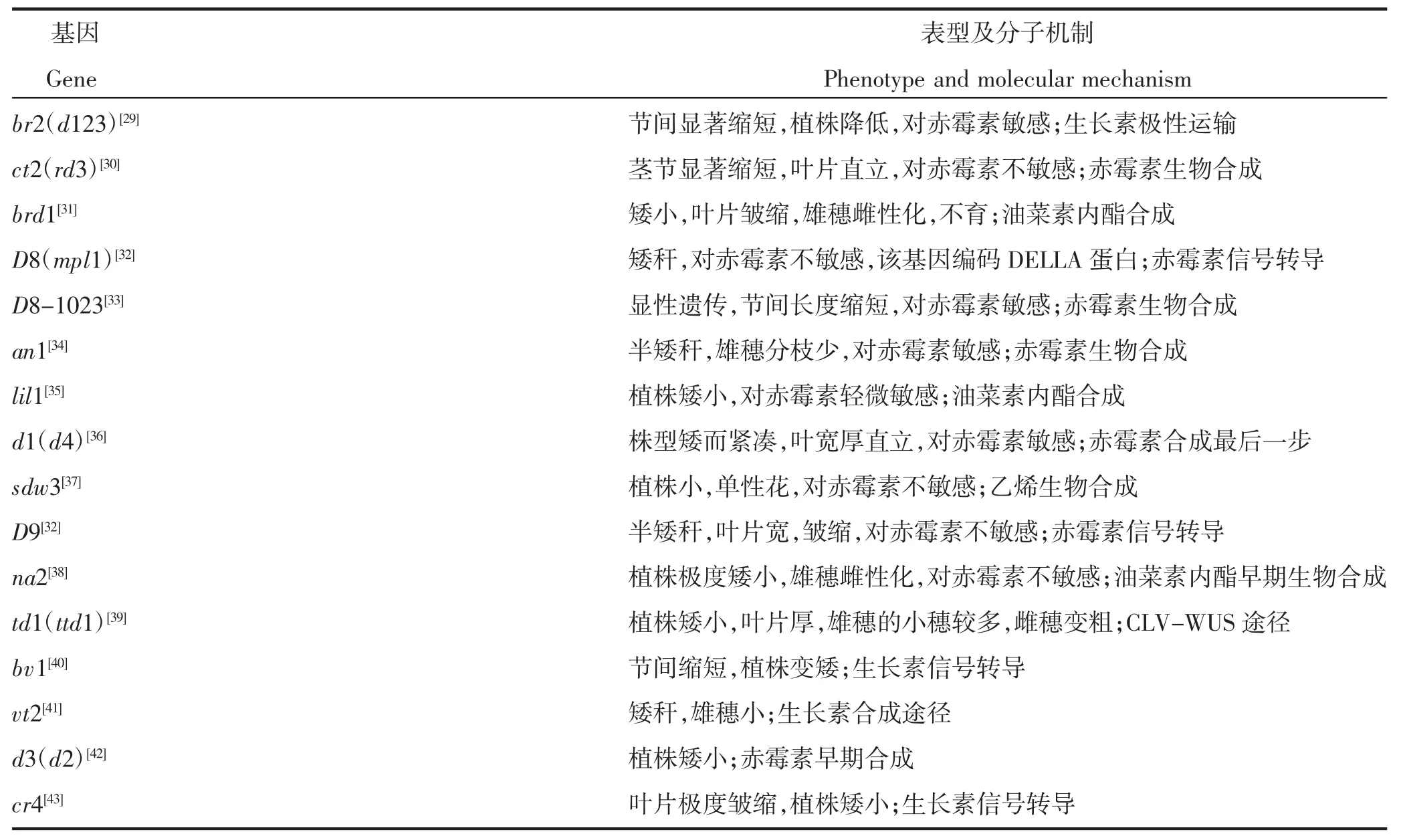
表1 玉米矮秆基因表型及分子机制Table 1 Maize dwarf gene phenotype and molecular mechanism
3 玉米株高调控机理研究进展
除了矮化基因对玉米株高的调控,植物激素对植物的生长发育也至关重要,株高发育与植物激素息息相关。在已知的7 种植物激素中,赤霉素(GAs)、生长素(IAA)、油菜素内酯(BRs)、独脚金内酯(SLs)、脱落酸(ABA)和乙烯(Ethylene)对玉米的株高均具有较大影响。植物激素矮化突变体可分为两类:激素敏感型和激素不敏感型。对激素不敏感型矮化突变体外施用活性激素后,突变体植株不能恢复到野生型的高度,且体内相应激素含量与野生型相比无差异或更高,表明突变体的激素合成途径正常,很有可能是突变体内部激素信号接收和转运途径的阻碍而导致的矮化。激素敏感型矮化突变体经过体外施用相应活性激素后,突变体株高可部分恢复或完全恢复至野生型植株的高度,证明突变体相应激素的生物合成途径出现缺陷,体内相应激素缺乏从而导致矮化[44]。
3.1 赤霉素与株高调控相关研究
20 世纪30 年代,日本科学家黑泽英一在研究水稻“恶苗病”的致病原因时,首次发现了赤霉素[45]。赤霉素具有独特的四环双萜结构,参与调控植物生长发育的各个方面:茎秆的伸长、种子的萌发、根系的生长延伸等。最新研究结果显示,造成植株矮化的基因大多与赤霉素的生物合成代谢受阻和细胞信号转导中断有关。随着人们对赤霉素相关突变体、基因组学、基因克隆等方面的深入研究,赤霉素的生物合成途径逐渐被完善。在高等植物体内,赤霉素的生物合成途径主要分为3 个阶段[46-47]:第一阶段是在质体中,在贝壳杉烯合成酶(KS)和柯巴基焦磷酸合成酶(CPS)的催化下,合成第一个中间体内根贝壳杉烯;第二阶段是在内质网上,由2 个细胞色素P450 单加氧酶催化,经过5 步连续氧化反应,最终氧化反应生成GA12 醛;第三阶段是在细胞质中,GA12 醛转化为GA 活性结构GA1、GA3、GA4 赤霉素生物合成受阻是导致植株矮化的主要原因之一。在玉米中,对赤霉素敏感的矮秆基因d1,该基因编码赤霉素合成途径的重要酶(GA3ox),d1 突变造成赤霉素合成受阻,从而导致玉米矮化[48]。根据前人研究发现,大多数玉米矮秆基因d123、d125、dm1、VP8、D8-1023、Dt、d6 等都是在赤霉素合成途径中基因突变导致的玉米矮化。
另一类导致植物矮化的原因是GA 信号传导途径中断。GA 信号传导途径模式为活性GA 分子与受体GID1 蛋白结合后,GA-GID1 复合体与DELLA 蛋白N 端结合导致DELLA 蛋白异构化,形成三聚体(GIDI-GA DELLA 蛋白复合体)并促进DELLA 蛋白与SCF SLY1/GID2/SNE 间的相互作用。DELLA 蛋白被泛素化,降低了植物的生长能力,然而经过26S 蛋白酶作用后,该复合体被降解,进而解除DELLA 蛋白抑制作用[49-50]。玉米的D8 基因、水稻的SLR1 基因、小麦的Rht1 基因均编码DALLE 蛋白,其结构域的缺失会导致GA 信号传导中断,从而使植株矮化并且对外施赤霉素不敏感[51]。
3.2 油菜素内酯与株高调控相关研究
油菜素内酯是植物生长发育必不可少的物质,它调控植物诸多的生命历程,包括根的伸长、茎的伸长、叶的伸展和抗逆能力[52-53]。BR 的矮化机理与GA相似,都是由生物合成阻碍和信号转导缺陷引起的植株矮化。早期的研究证明,植物中BR 的生物合成途径可分成两条:一条为早期C-6 氧化途径;另一条为晚期C-6 氧化途径[54]。在玉米中,突变体brd1基因编码催化油菜素内酯合成最后阶段的酶(C-6 氧化酶),该基因突变导致BR 合成途径中断,从而使brd1 突变体茎节间缩短、叶片皱缩、雄穗雌性化[31]。矮秆突变体na2 在BR 生物合成早期过程中存在缺陷,其编码BR 合成过程中的C23-甾醇还原酶[38]。
3.3 生长素与株高调控相关研究
生长素是植物生长发育期中不可或缺的植物激素,能促进细胞伸长生长,调节细胞膜上的氢离子通道,使细胞壁酸化,细胞结构松弛,细胞可以膨胀生长,是影响株高的主要激素之一。IAA 具有双重性,即低浓度促进生长,高浓度抑制生长,如果浓度过高甚至会对植物的生长造成伤害。生长素的合成途径主要有两条:依赖色氨酸和非依赖色氨酸途径,其中色氨酸合成途径是IAA 合成最主要的途径,色氨酸通过色氨酸氨基转移酶和类黄素单加氧酶两个酶催化成生长素,如果编码两个酶的基因发生改变或者缺失,就会导致植株发育受阻,表型矮化。拟南芥的TAA1 在玉米中的同源基因vt2,vt2 突变体表现出半矮化且雄穗没有分枝,因此生长素合成途径中的基因突变会导致玉米植株矮化[41]。
生长素信号转导过程中存在一些TIR1/ABF 受体、AUX/IAA 阻遏子、SCF 降解复合体及ARF 转录激活因子,这些转导因子的缺陷也会影响植株株高[55]。MULTANI 等[56]研究发现,玉米矮化突变体br2和高粱矮化突变体dw3 具有高度同源性,它们均属于MDR 基因,其编码的蛋白调控生长素运输途径。
3.4 其他激素调控株高相关研究
研究发现,除了主要植物激素调控植株的株高,脱落酸(ABA)、乙烯(ET)、茉莉酸(Jas)、独脚金内酯(SLs)等也参与植株株高的调控[57]。玉米的ZmACS7基因,编码1-氨基环丙基-1-羧酸(ACC)合成酶,对玉米株高、根系、花期等方面进行调控[37]。对水稻矮秆突变体d27 的研究显示,外源喷施独脚金内酯类似物GR24 后,突变体表型得以恢复,因此判断可能是独脚金内酯生物合成受到抑制导致了突变表型的产生[58]。另外还受相关转录因子、温度等的调控。相关转录因子并没有直接参与植物激素合成信号或信号转导途径,但它们能够激活或抑制基因的转录水平,也对植物茎的发育起重要的调控作用[59]。深入研究表明,植物之间的协同和拮抗作用也调控植物的株高,其中在GA 缺陷突变体中,PIN 蛋白被降解,从而抑制了生长素的转运途径[60]。多胺对植物的茎也有调控作用,拟南芥的ACL5 基因编码亚精胺合酶和精胺合酶的同源蛋白,调控多胺类分子的合成从而影响植株的茎秆伸长[61]。综上所述,调控玉米植株矮化的途径是多种多样的,不同的植物激素具有很复杂的相互作用及反馈调节,要想全面解析矮化机理,还需要鉴定和克隆更多矮秆基因。
4 总结与展望
目前,已被克隆的玉米矮秆基因近40 个,但这些材料大多数生长势弱、植株过矮、株型不理想、存在隐性致死等不良性状,育种上利用价值不大,且真正服务于育种生产和应用的矮秆基因比较单一。这不仅限制了玉米产量的进一步提高,而且还使育成品种的遗传基础日益狭窄,种质资源多样性降低。对矮化基因的研究不仅有利于丰富玉米株高调控的理论基础,也能为耐密植、抗倒伏和宜机收的玉米株型改良提供理论参考与育种材料。因此,还需要在此基础上,精细定位一些控制PH 和EH 极显著降低,但不影响产量的关键基因,并深入挖掘其功能,使之能够真正服务于育种生产和应用。
虽然玉米矮化育种充满挑战,但是不可否认,矮秆品种具有广阔的应用前景。第一次绿色革命中水稻、小麦半矮秆基因Semidwarf1 和Rht 的应用,使世界粮食总产量得以大幅提升,极大程度地改善了粮食短缺问题。通常来说,玉米的株高为数量性状,与产量呈正相关,可以通过多个群体共定位到株高主效QTL 或株高QTL 聚合的方式来筛选创制综合性状优良的玉米矮秆品种。随着生物技术的发展,可以采用基因编辑技术对该区域进行不同长度的遗传操控,得到广泛的目标表现变异的突变体,从而创制出一系列玉米株高连续变异的材料,得到产量增加株高降低的育种资源。除此之外,还可以创建新型遗传群体遗传材料,通过增加稀有等位基因的频率来提高GWAS 的检测能力,从而鉴定出更多的玉米矮秆QTL。通过以上方法能有效拓宽矮秆玉米的种质资源,同时也表明,矮化育种仍然是未来育种家们的一个重要研究方向。

