茵陈蒿汤对代谢相关脂肪性肝病小鼠“肠TPH1-肝HTR2A轴”的影响*
黄艳阳,隋国媛,赵 娜,杨关林,贾连群
(1. 辽宁中医药大学中医脏象理论及应用教育部重点实验室 沈阳 110847;2. 辽宁中医药大学研究生学院 沈阳 110847;3. 辽宁中医药大学中西医结合学院 沈阳 110847)
代谢相关脂肪性肝病(Metabolic associated fatty liver disease,MAFLD),曾用名非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)在全球成年人中患病率为22.10%-28.65%,在中国成年人中患病率为17.95%-22.31%,且呈逐年升高趋势[1-3]。MAFLD不仅会导致肝病残疾和死亡,也会造成心血管疾病、糖尿病等疾病的发病率升高[4-5]。湿热蕴结证是MAFLD 常见中医证候[6-7],清热祛湿中药茵陈蒿汤防治MAFLD 疗效确切[8-9]。茵陈蒿汤最早载于《伤寒论》,茵陈具有清热利湿、疏利肝胆功能;栀子具有清泄三焦湿热功能;大黄具有通利大便,导热下行功能,三药合用,湿去热除。已有研究发现茵陈蒿汤可通过调控脂质代谢、氧化应激、炎症反应等途径抑制MAFLD 发生发展[8]。文献报道湿热证与5-羟色胺(5-hydroxytrypatamine,5-HT)代谢紊乱密切相关[10],清热祛湿法可调控5-HT代谢紊乱[11]。体内约95%的5-HT由肠嗜铬细胞合成、分泌,色氨酸羟化酶1(Ryptophan hydroxylase-1,TPH1)为肠嗜铬细胞合成5-HT 的限速酶,调控5-HT 浓度[12]。最新研究发现肠源性5-HT 调控5-羟色胺受体2A(5-hydroxytryptamine receptor 2A,HTR2A)介导的肝脏甘油三酯合成促进NAFLD 发生发展[12-14]。由此推断,茵陈蒿汤可能通过此信号通路发挥防治MAFLD 作用。本研究以MAFLD 小鼠为研究对象,探讨茵陈蒿汤对肠TPH1-肝HTR2A 轴的影响,为临床中西医结合防治MAFLD 提供新的研究策略及科学依据。
1 材料与方法
1.1 实验动物
24只SPF级雄性C57BL/6J小鼠,5-6周龄,18-22 g,购买于北京华阜康生物科技股份有限公司[许可证号:SCXK(京)2019-0008]。通过辽宁中医药大学实验动物伦理委员会批准,于辽宁中医药大学实验动物中心饲养。
1.2 实验药品
茵陈蒿汤的组成:茵陈18 g,栀子9 g,大黄6 g;购买于辽宁中医药大学附属医院,煎煮后生药量为0.495 g·mL-1。
1.3 主要仪器
正置光学显微镜(日本尼康,Nikon Eclipse E100);全自动生化分析仪(日本日立,型号7180);多功能酶标仪(Thermo 公司,型号1510);实时荧光定量PCR 仪(美国Applied Biosystems 公司,型号7500);化学发光成像系统(上海天能科技有限公司,型号Tanon-5200)。
1.4 主要试剂
TC、TG、LDL-C、HDL-C、ALT、AST 测定试剂盒(上海科华生物工程股份有限公司提供,产品批号分别为202110412、202202012、20210612、20210312、20210422、20210512);苏木素-伊红染液(Servicebio 提供,产品货号为G1003);RT-qPCR 试剂盒(北京康为世纪生物科技有限公司,产品货号为CW2601M);PKC-ε 抗体(武汉三鹰,20877-1-AP);HTR2A、SREBP-1c 抗体(absin 公司提供,产品货号分别为abs120613、abs152294);TPH1、SERT、GPAT1 抗体(Bioss 公司提供,产品货号bs-1215R、bs-1893R、bs-5063R)。
1.5 模型制备、分组及给药方式
24 只小鼠随机分为对照组、模型组和茵陈蒿汤组,每组8只。对照组给予基础饲料,模型组及茵陈蒿汤组给予高脂饲料[小黍有泰(北京)生物科技有限公司提供,产品货号:2021070030]。前期研究表明茵陈蒿汤中剂量(按实验动物与人体体表面积比等效量计算动物等效剂量)改善MAFLD 优于低剂量和高剂量,高剂量茵陈蒿汤可增加肝毒性[15-16],因此本研究选用茵陈蒿汤中剂量。12周后灌胃给药,茵陈蒿汤组给予茵陈蒿汤(每天0.3 mL)灌胃,正常组与模型组给予等体积的生理盐水灌胃,灌胃4周。
1.6 指标检测
1.6.1 血脂和肝功能检测
采用随机数表法每组选取6只小鼠。全自动生化分析仪对血清TC、TG、AST、ALT、LDL-C、HDL-C 含量进行检测。
1.6.2 肝脏组织HE染色
4%多聚甲醛固定肝脏组织24 h 以上,石蜡切片脱蜡至水、苏木素染色、伊红染色、脱水封片、显微镜镜检后采集图像进行分析。
1.6.3 肝脏组织油红O染色
取小鼠肝脏组织制备新鲜冰冻切片后固定,切片入油红染液浸8-10min(加盖避光)染色,依次浸入两缸60%异丙醇各3 s、5 s 分化,两次纯水浸洗,取出切片停留3 s 后浸入苏木素复染3-5 min,三次浸洗,各5 s、10 s、30 s。60%乙醇为溶剂分化2-8s,2 缸蒸馏水水洗各10 s,返蓝液返蓝1 s,纯水浸洗2次,各5 s、10 s,甘油明胶封片剂封片,显微镜镜检,图像采集分析。
1.6.4 ELISA法检测含量
采用随机数表法每组选取6只小鼠。根据试剂盒说明书检测小鼠血清5-HT、肝脏TC、TG、二酰基甘油(diacylglycerol,DAG)、磷脂酶C(phospholipase C,PLC)含量。
1.6.5 Western blot检测蛋白表达情况
采用随机数表法每组选取3 只小鼠,检测小肠TPH1、5- 羟色胺转运蛋白(Serotonin reuptake transporter,SERT)及肝脏HTR2A、蛋白激酶C-ε(Protein kinase C-Epsilon,PKC-ε)、磷酸化磷脂肌醇3激酶(Phosphorylated phosphoinositide 3-kinase,PPI3K)、磷酸化蛋白激酶B(Phosphorylated protein kinase B,P-AKT)、磷酸化雷帕霉素靶蛋白(Phosphorylated mammalian target of rapamycin,PmTOR)、固醇调节元件结合蛋白-1c(Sterol regulatory element binding protein-1c,SREBP-1c)、甘油-3-磷酸酰基转移酶1(Glycerol-3-phosphate acyltransferase 1,GPAT1)、脂肪酸合酶(Fattsynthase,FASN)。称取小鼠肝脏组织0.1 g 后,加入1 mL 含PMSF 的RIPA 裂解液,于冰上充分研磨后,冰上静置30 min,离心取上清。使用BCA 试剂盒检测各组蛋白浓度后,制备样品,计算出每个样本的上样体积后进行电泳操作。电泳后,封闭,一抗4℃孵育过夜,洗膜,二抗,洗膜,曝光,分析灰度值。
1.6.6 RT-qPCR检测mRNA水平
采用随机数表法每组选取6 只小鼠,检测小肠TPH1、SERT 及肝脏HTR2A、SREBP-1c、GPAT1、FASN mRNA水平。称取小鼠肝脏组织0.1 g后,TRIzol法提取总RNA,测定RNA 浓度,稀释为200 ng·μL-1后,在冰上配置反应体系后,反转录为cDNA,按照说明书采用SYBR Green 进行实时荧光PCR。结果用△△Ct 法进行相对定量分析,用2-△△Ct表示。引物序列见表1。
1.6.7 统计学方法
应用Prism 8.4.0 软件进行统计分析,计量资料结果以均值±标准差(±s)表示,多组间比较采用ANOVA分析,P<0.05为差异具有统计学意义。
2 结果
2.1 各组小鼠肝脏HE和油红O染色病理特征
由图1所示,对照组肝细胞排列整齐,无明显脂肪变性;模型组肝细胞体积肿胀,有明显脂肪变性;与模型组比,茵陈蒿汤组肝细胞脂肪变性显著减少。由图2所示,相较于对照组,模型组肝脏脂质沉积显著升高,茵陈蒿汤显著改善肝脏脂质沉积。
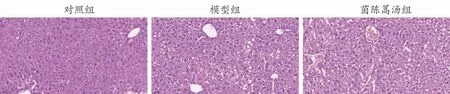
图1 各组小鼠肝脏HE染色结果(200×)
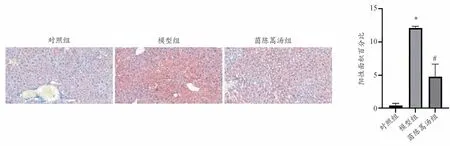
图2 各组小鼠肝脏油红O染色结果(200×)
2.2 各组小鼠肝脏TC、TG、DAG、PLC含量
由表2 所示,相较于对照组,模型组肝脏TG 和TC水平显著升高(P<0.05);相较于模型组,茵陈蒿汤组肝脏TG和TC水平显著降低(P<0.05)。
表2 各组小鼠肝脏TC、TG、DAG、PLC含量(±s,n=6)
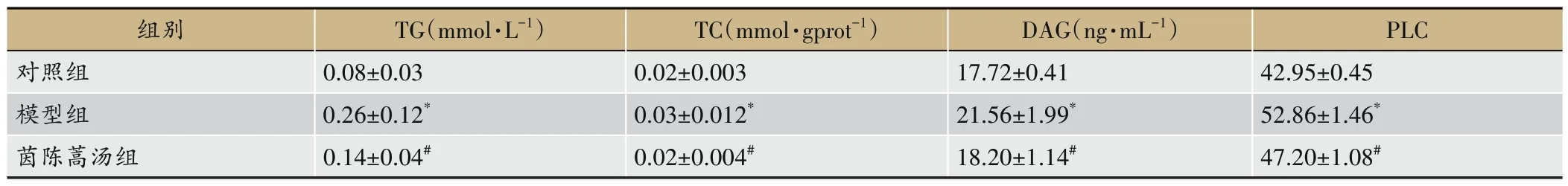
表2 各组小鼠肝脏TC、TG、DAG、PLC含量(±s,n=6)
注:与对照组比,*P<0.05;与模型组比,#P<0.05。
PLC 42.95±0.45 52.86±1.46*47.20±1.08#组别对照组模型组茵陈蒿汤组TG(mmol·L-1)0.08±0.03 0.26±0.12*0.14±0.04#TC(mmol·gprot-1)0.02±0.003 0.03±0.012*0.02±0.004#DAG(ng·mL-1)17.72±0.41 21.56±1.99*18.20±1.14#
2.3 各组小鼠肝功能、血脂水平
由表3 所示,相较于对照组,模型组血清AST、ALT、HDL-C、LDL-C、TG、TC 水平显著升高(P<0.05);相较于模型组,茵陈蒿汤组血清AST、ALT、LDL-C、TG水平显著降低(P<0.05)。
表3 各组小鼠肝功能、血脂特征(±s,n=6)
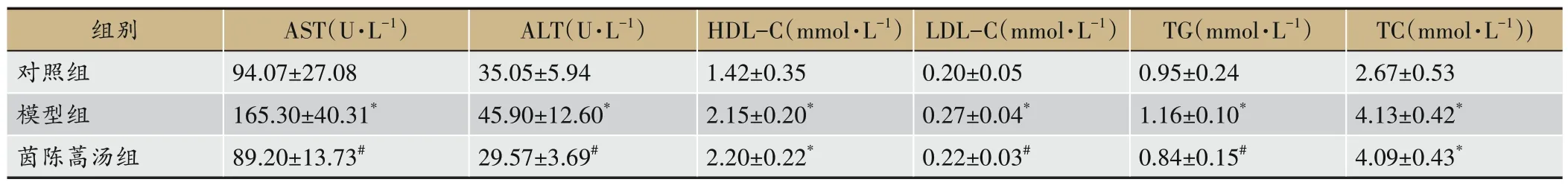
表3 各组小鼠肝功能、血脂特征(±s,n=6)
注:与对照组比,*P<0.05;与模型组比,#P<0.05。
TC(mmol·L-1))2.67±0.53 4.13±0.42*4.09±0.43*组别对照组模型组茵陈蒿汤组AST(U·L-1)94.07±27.08 165.30±40.31*89.20±13.73#ALT(U·L-1)35.05±5.94 45.90±12.60*29.57±3.69#HDL-C(mmol·L-1)1.42±0.35 2.15±0.20*2.20±0.22*LDL-C(mmol·L-1)0.20±0.05 0.27±0.04*0.22±0.03#TG(mmol·L-1)0.95±0.24 1.16±0.10*0.84±0.15#
2.4 各组小鼠血清5-HT含量比较
由表4 所示,相较于对照组,模型组血清5-HT 水平显著升高(P<0.05);与相较于模型组,茵陈蒿汤组血清5-HT水平显著降低(P<0.05)。
表4 各组小鼠血清5-HT特征(±s,n=6)

表4 各组小鼠血清5-HT特征(±s,n=6)
注:与对照组比,*P<0.05;与模型组比,#P<0.05。
5-HT(ng·mL-1)234.49±12.53 261.62±22.95*224.43±9.94#组别对照组模型组茵陈蒿汤组
2.5 各组小鼠小肠TPH1、SERT mRNA水平
由表5 所示,相较于对照组,模型组小鼠小肠TPH1 mRNA 表达水平显著升高,SERT mRNA 表达水平显著降低(P<0.05);茵陈蒿汤干预后,相较于模型组,小肠TPH1 mRNA表达水平显著降低,SERT mRNA表达水平显著升高(P<0.05)。
表5 各组小鼠小肠TPH1、SERT mRNA水平(±s,n=6)
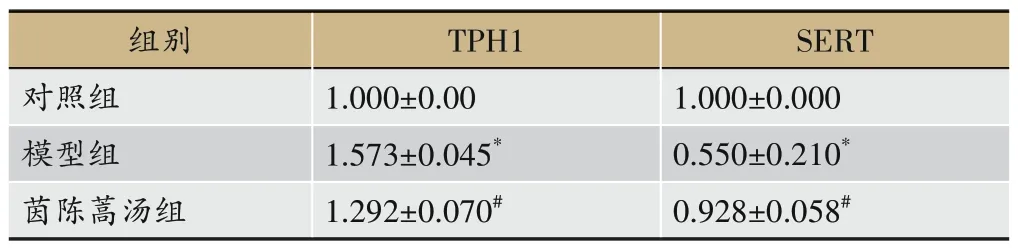
表5 各组小鼠小肠TPH1、SERT mRNA水平(±s,n=6)
注:与对照组比,*P<0.05;与模型组比,#P<0.05。
SERT 1.000±0.000 0.550±0.210*0.928±0.058#组别对照组模型组茵陈蒿汤组TPH1 1.000±0.00 1.573±0.045*1.292±0.070#
2.6 各组小鼠肝脏HTR2A、SREBP-1c、GPAT1、FASN mRNA水平
由表6 所示,相较于对照组,模型组小鼠肝脏HTR2A、SREBP-1c、GPAT1、FASN mRNA 表达水平显著升高(P<0.05);茵陈蒿汤干预后,HTR2A、SREBP-1C、GPAT1、FASN mRNA表达水平显著降低(P<0.05)。
表6 各组小鼠肝脏HTR2A、SREBP-1c、GPAT1、FASN mRNA水平(±s,n=6)

表6 各组小鼠肝脏HTR2A、SREBP-1c、GPAT1、FASN mRNA水平(±s,n=6)
注:与对照组比,*P<0.05;与模型组比,#P<0.05。
FASN 1.000±0.000 3.000±0.373*2.063±0.325#组别对照组模型组茵陈蒿汤组HTR2A 1.000±0.000 2.770±0.245*2.052±0.207#SREBP-1c 1.00±0.000 3.576±0.830*2.150±0.202#GPAT1 1.000±0.00 2.400±0.589*1.480±0.150#
2.7 各组小鼠小肠TPH1、SERT蛋白表达
由图3 和表7 所示,相较于对照组,模型组小鼠肝脏TPH1 蛋白表达水平显著升高(P<0.05),SERT 蛋白表达水平显著下降(P<0.05);茵陈蒿汤干预后,肝脏TPH1 蛋白表达水平显著下降(P<0.05),SERT 蛋白表达水平显著升高(P<0.05)。
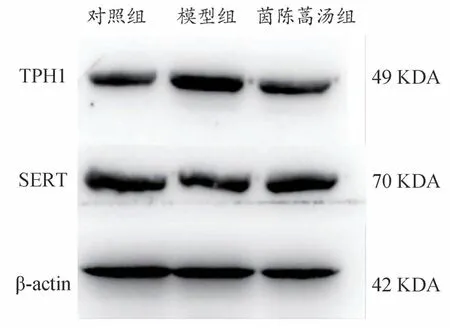
图3 各组小鼠小肠TPH1、SERT表达水平
表7 各组小鼠TPH1、SERT蛋白含量(±s,n=6)
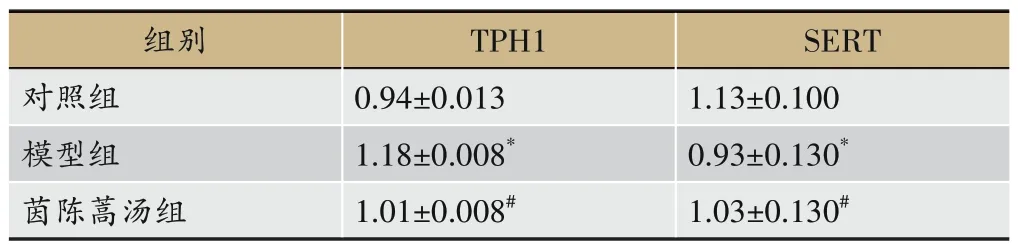
表7 各组小鼠TPH1、SERT蛋白含量(±s,n=6)
注:与对照组比,*P<0.05;与模型组比,#P<0.05。
组别对照组模型组茵陈蒿汤组TPH1 0.94±0.013 1.18±0.008*1.01±0.008#SERT 1.13±0.100 0.93±0.130*1.03±0.130#
2.8 各组小鼠肝脏HTR2A、PKC-ε、P-PI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN蛋白表达
由图4 和表8 所示,相较于对照组,模型组小鼠肝脏 HTR2A、PKC- ε、P-PI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN 蛋白表达水平显著升高(P<0.05);茵陈蒿汤干预后,肝脏HTR2A、PKC-ε、PPI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN 蛋白表达水平显著下降(P<0.05)。
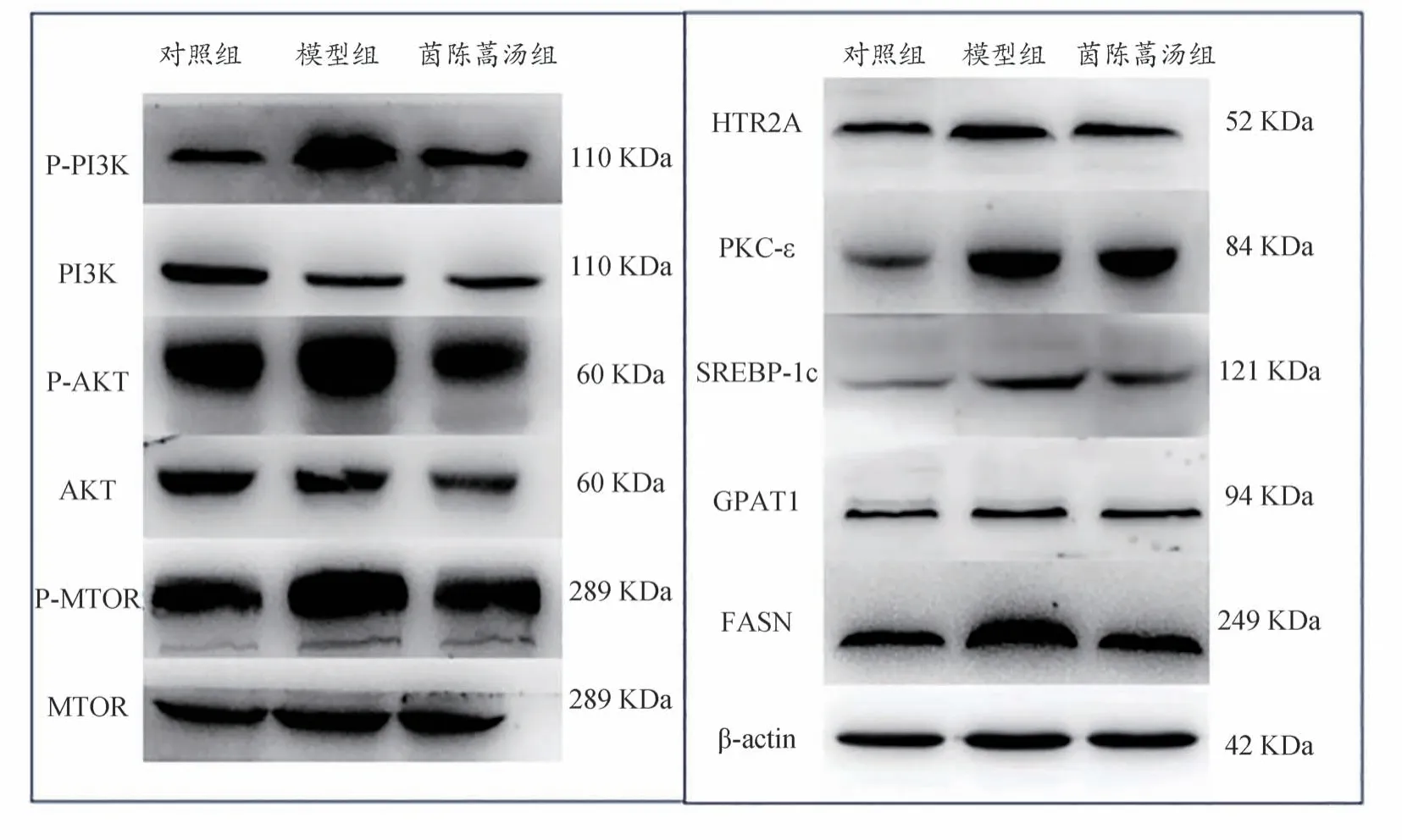
图4 各组小鼠肝脏HTR2A、PKC-ε、P-PI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN表达水平
表8 各组小鼠肝脏HTR2A、PKC-ε、P-PI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN蛋白含量(±s,n=6)
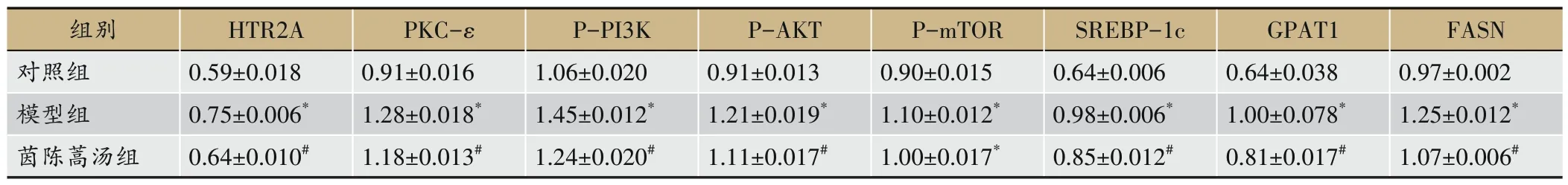
表8 各组小鼠肝脏HTR2A、PKC-ε、P-PI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN蛋白含量(±s,n=6)
注:与对照组比,*P<0.05;与模型组比,#P<0.05。
组别对照组模型组茵陈蒿汤组HTR2A 0.59±0.018 0.75±0.006*0.64±0.010#PKC-ε 0.91±0.016 1.28±0.018*1.18±0.013#P-PI3K 1.06±0.020 1.45±0.012*1.24±0.020#P-AKT 0.91±0.013 1.21±0.019*1.11±0.017#P-mTOR 0.90±0.015 1.10±0.012*1.00±0.017*SREBP-1c 0.64±0.006 0.98±0.006*0.85±0.012#GPAT1 0.64±0.038 1.00±0.078*0.81±0.017#FASN 0.97±0.002 1.25±0.012*1.07±0.006#
3 讨论
《湿热病篇》云:“太阴内伤,湿饮停聚,客邪再至,内外相引,故病湿热”。湿热蕴结脾胃,阻碍中焦气机,气机升降失和,肝失疏泄,气血精津郁而变生他邪,由此可致肝系病证。MAFLD 发病多因劳逸失度、饮食失节、禀赋不足、情志失调、久病体虚等因素导致脾胃运化失调,湿热内生,气机升降失和,津血不行,化生浊毒闭阻肝脏[17]。清热祛湿中药茵陈蒿汤方中茵陈为君,归脾、胃、肝、胆经;栀子为臣,归肝、肺、胃、心、三焦经;大黄为佐,归胃、大肠、肝经。现代药理研究发现茵陈蒿汤具有调节血脂、保肝利胆等作用[17-18]。本研究发现,与对照组比较,模型组小鼠肝细胞体积肿胀,有明显脂肪变性,血清AST、ALT、LDL-C、TG、TC水平显著升高,肝脏TG、TC 水平显著升高,表明造模较为成功。与模型组比较,茵陈蒿汤组肝细胞脂肪变性显著减少,血清AST、ALT、LDL-C、TG 水平显著降低,肝脏TG、TC水平显著降低,提示茵陈蒿汤可有效改善MAFLD。
临床和动物研究表明5-HT 是MAFLD 的独立危险因素[19-21]。5-HT 产生受到色氨酸和TPH 的调节[22],SERT 可以将其从间质空间摄取到上皮细胞终止其作用,降低SERT 的表达会减少5-HT 的灭活,蓄积的5-HT 可能会促进MAFLD 的发展。肠道特异性Tph1 基因敲除可抑制肠源性5-HT 合成,调控肝脏脂质代谢,5-HT 可分为中枢5-HT 与外周5-HT,二者的调控互不影响,体内约95%的5-HT 由外周肠嗜铬细胞合成分泌[20]。已有研究发现5-HT可促进肝脏TG合成[23-25],5-HT合成抑制剂可显著改善高脂饮食诱导的肝脏TG蓄积[26]。本研究发现,与对照组比较,模型组血清5-HT、小肠TPH1以及肝脏TG水平显著升高,小肠SERT水平显著降低;与模型组比,茵陈蒿汤组血清5-HT、小肠TPH1 以及肝脏TG 水平显著降低,小肠SERT 水平显著升高,由此可见,茵陈蒿汤可能通过调控5-HT降低肝脏TG合成抑制MAFLD发生发展。
最新研究发现肠源性5-HT 调控HTR2A 介导的肝脏TG合成促进NAFLD发生发展[13-14]。5-HT受体的7 个亚家族中除5-HT3 受体外,其余均属于G 蛋白偶联受体超家族[26]。HTR2A 作为5-HT 受体之一,是5-HT 调控肝脏TG 合成促进MAFLD 发生发展的关键因子[13]。肝脏特异性HTR2A 基因敲除小鼠可显著抑制高脂饮食诱导的肝脏TG 蓄积,HTR2A 拮抗剂显著抑制5-HT 诱导的肝细胞TG 蓄积[12-13]。HTR2A 可通过DAG 启动PKC-ε 从而诱导肝脏TG 的合成,DAG 和PKC 被认为是具有信号传导功能的因子,DAG 是PKC的变构激活剂[27]。在MAFLD 大鼠模型中PKC-ε 的表达与PI3K的表达呈负相关,与肝脂肪变性的程度呈正相关[28]。DAG 在肝脏中的积累会导致PKC-ε 的激活从而降低PI3K 的含量,PI3K/AKT/mTOR 信号通路在肝脏脂代谢的平衡过程中起重要作用,PI3K 可以激活AKT 使之磷酸化,进而磷酸化其下游的mTOR 复合物1,激活主要的脂肪生成调节因子SREBP-1c,调控FFA、TG 代谢[29-31]。主要在肝脏和脂肪细胞中表达的SREBP-1c,是参与TG 合成基因的主要转录调节因子,SREBP-1c 过度表达会增加肝脏TG 合成[32]。SREBP-1c 是GPAT1 的主要转录调节因子,GPAT1 启动子区含有SREBP-1c的结合位点,SREBP-1c过表达可促进GPAT1 表达[32]。GPATs 作为TG 合成的限速酶,催化磷酸甘油与一分子脂酰辅酶A 生成1-脂酰基甘油-3-磷酸,是TG 生物合成的起始步骤[33]。目前发现在哺乳动物体内有4 种亚型,其中GPAT1 定位于线粒体外膜,其在肝脏和脂肪组织中高表达,基因过表达和敲除实验均表明GPAT1 在NAFLD 发生发展过程中发挥重要作用[34]。FASN 存在于胞质中,且FASN 的启动子区也存在SREBP-1c 转录因子的结合位点,在SREBP-1c 与其结合后,可以直接调控促进脂肪酸的从头合成途径,即由乙酰辅酶A 和丙二酰辅酶A 从头合成棕榈酸脂的催化步骤,促进肝细胞内脂质大量堆积从而促进MAFLD 的发生发展[35-36]。本研究发现与对照组比,模型组小鼠肝脏HTR2A、PKC-ε、P-PI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN 蛋白表达水平显著升高;茵陈蒿汤干预后HTR2A、PKC-ε、PPI3K、P-AKT、P-mTOR、SREBP-1c、GPAT1、FASN 蛋白表达水平显著降低。由此可见,茵陈蒿汤可能通过调控5-HT/HTR2A信号通路降低肝脏TG合成。
综上所述,茵陈蒿汤可通过肠TPH1-肝HTR2A轴抑制肝脏TG 合成进而改善MAFLD,为临床中西医结合防治MAFLD提供新的研究策略及科学依据。

