南美红辣椒脉斑驳病毒RT-LAMP检测体系的建立及优化
张俊蕾 盖晓彤 赵正婷 刘弟 陈敏 姜宁 刘雅婷





关键词:南美红辣椒脉斑驳病毒;反转录一环介导等温扩增;灵敏度;检测
南美红辣椒脉斑驳病毒(chilli veinal mottle vi-rus,ChiVMV)属于马铃薯Y病毒科马铃薯Y病毒属Potyviruts,其基因组由一条正单链RNA组成,全长约9700bp。ChiVMV主要依靠各种蚜虫以非持久性方式传播。1979年在马来半岛的辣椒上首次发现了南美红辣椒脉斑驳病毒;2017年印度辣椒种植地区感染ChiVMV最严重地块的感病率高达41.82%;我国于2003年首次在陕西省的辣椒上发现ChiVMV;随后2010年在云南省大理市巍山县的烟田里发现烟株受ChiVMV侵害,主要症状为褪绿黄化、花叶、疱斑和叶缘下卷;2014年报道称ChiVMV在四川烟株上的侵染率达到3%左右;2022年在贵州的烟叶上检测到ChiVMV。病毒检测是监测、预报、防控病毒病的重要环节。目前检测ChiVMV的方法主要有电子显微镜技术、免疫血清学技术、指示植物检测技术以及分子生物学技术等,但是这些检测方法因技术复杂、费时费力、成本高等原因难以在基层田间推广,因此建立一种简单、快速、灵敏、高效检测ChiVMV的技术尤为重要。2000年日本学者Notomi等发明的环介导等温扩增技术(loop-media-ted isothermal amplification,LAMP)是分子生物学研究领域中一种极为重要的手段,其特点是针对靶基因的6个区域设计4条特异引物,利用DNA链置换聚合酶(Bst DNA polymerase)在等温条件(65~90℃)保温几十分钟完成核酸扩增反应,通过荧光染色等方法在数分钟内即可观察结果。但LAMP检测方法只针对DNA模板,为实现用该方法以RNA模板进行扩增,在LAMP反应体系中加入反转录酶,可在某等温条件下一步进行RNA逆转录和核酸扩增,即为反转录一环介导等温扩增技术(re-verse transcription, loop-mediated isothermal am-plification,RT-LAMP)。近年来,RT-LAMP已被广泛应用于动植物病毒检测,与传统的检测方法相比,该技术成本低、灵敏度极高、操作简单、不需要昂贵的仪器和分析手段,适用于田间基层进行病毒检测。目前还未见利用RT-LAMP技术检测ChiVMV的相关报道,本研究旨在建立一种简便、快捷、灵敏的ChiVMV检测方法。
1材料和方法
1.1材料
本试验所用的ChiVMV、马铃薯Y病毒(potatovirus Y,PVY)、烟草花叶病毒(tobacco mosaic vi-rus,TMV)、黄瓜花叶病毒(cucumber mosaic vlrus,CMV)、番茄褐色皱纹果病毒(tomato brown rugosefruit virus,ToBRFV)、番茄环纹斑点病毒(tomatozonate spot virus,TZSV)、烟草脉带花叶病毒(to-bacco vein banding mosaic virus,TVBMV)、番茄斑萎病毒(tomato spotted wilt virus,TSWV)、朱顶红褪绿环斑病毒(hippeastrum chlorotic ringspot vi-rus,HCRV)的阳性烟叶样品由本课题组纯化和保存。
1.2方法
1.2.1引物设计
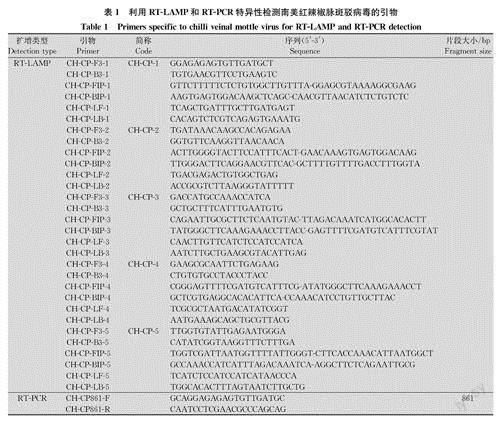
依据GenBank中登录的云南地区ChiVMV分离物基因组(GenBank序列登录号:MT974520)衣壳蛋白(capsid protein,CP)基因的保守区域,利用Primer Explorer 5.0(http:∥primerexplorer. jp/e/)设计5组引物(表1),每组包含F3/B3(外引物)、FIP/BIP(内引物)和LF/LB(环引物),引物由成都生物公司合成。
1.2.2RNA的提取
采用TRNzoI Universal总RNA提取试剂盒(北京天根公司)提取病毒总RNA,采用1.5%的琼脂糖凝胶电泳检测,若出现3条明亮条带证明所提取RNA质量较好,提取的RNA保存于-800C冰箱备用。
1.2.5引物筛选
采用设计的5组引物(表1),以ChiVMV阳性的烟叶总RNA为模板进行扩增,体系参考WarmStart通用LAMP/RT-LAMP 2×预混液(含UDG)(美国NewEngland Biolabs公司)说明书:WarmStart LAMP2×Mix 12.5uL,F3/B3(10mmol/L)各0.5uL,FIP/BIP (10mmol/L)各4uL, LF/LB (10 mmol/L)各1uL,RNA(1ug)2uL,加Nuclease-free H90补足至25uL。65℃恒温扩增60min,每组引物均以健康烟叶RNA为模板的阴性对照,试验重复3次,最终筛选出1组特异性强的引物。
1.2.6RT-LAIV[P檢测体系优化
以ChiVMV阳性的烟叶总RNA为模板,采用单一变量法对反应温度(59、61、63、65、67、69℃)、反应时间(30、40、50、60、70、80 min)、反应体系中Mg2+浓度(2、4、6、8、10、12mmol/L,其中RT-LAMP基本反应体系内2.5uL 10×ThermopolBuffer中含有2 mmol/L Mg2+)、dNTPs浓度(0,0.2、0.6、1.0、1.4、1.8、2.2 mmol/L)、甜菜碱浓度(0、0.6、0.8、1.0、1.2、1.4、1.6 mmol/l.)和内外引物浓度比(1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1)进行优化。所有单因素优化试验中均以健康烟草RNA作为阴性对照,优化某一因素时其他因子参照RT-LAMP基本体系。反应结束后,反应产物中加入0.5uL的1000×SYBR Green工荧光染料(北京索莱宝科技有限公司)进行可视化检测,随后取5uL扩增产物进行琼脂糖凝胶电泳检测。试验重复3次。
1.2.7RT-LAMP体系的验证
RT-LAMP反应结果的判定方法:1)电泳检测。取5uL反应产物用1.5%琼脂糖凝胶电泳分析,凝胶成像仪(上海天能)内观察到条带呈现梯状,则为阳性。2)荧光检测。25uL RT-LAMP扩增产物中加入0.5uL1000×SYBR Green I荧光染料后,阳性样品内荧光染料为荧光绿色,阴性为橙黄色]。
2结果与分析
2.1最佳条件的筛选与优化
2.1.1引物筛选
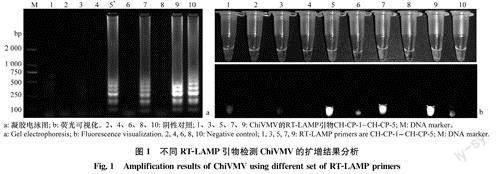
本研究设计了5组引物,琼脂糖凝胶电泳检测结果(图la)显示,引物组CH-CP-3~CH-CP-5均能扩增出条带,但引物CH-CP-5出现假阳性,而引物组CH-CP-3的扩增产物形成的梯状电泳条带比其他引物更清晰、明亮且无假阳性;将荧光染色剂加入反应产物中,染色结果与电泳结果一致(图1b),没有扩增条带的产物为橙黄色,有扩增条带的产物则为绿色,将其置于紫外灯下观察,没有条带的产物不能发出白色荧光,而有条带的产物可以发出白色荧光,表明引物组CH-CP-3的特异性最强,故选用CH-CP-3作为该体系的引物。
2.1.2反应温度优化
利用筛选出的引物组CH-CP-3,在RT-LAMP基本体系的基础上对反应温度进行优化,结果表明,采用CH-CP-3引物组,在63、65、67、69℃4个温度下产物均产生梯状电泳条带(图2a),同时荧光检测结果与电泳检测结果一致(图2b),即这4个反应温度结果均呈现绿色,且在紫外灯下显白色荧光。但63℃(泳道4)时扩增产物形成的梯状电泳条带更清晰、明亮,且基于实际应用选择最佳扩增反应温度为63℃。
2.1.3反应时间优化
利用筛选出的引物组CH-CP-3,反应体系采用RT-LAMP基本体系,反应温度设为63℃,对反应时间进行优化,结果表明,在6个时间下产物均形成梯状电泳条带(图3a),荧光检测结果与凝胶电泳检测结果一致(图3b),有梯状条带的呈现绿色,且在紫外灯下显白色荧光。在50min条件下扩增产物形成的梯状电泳条带比30、40min更清晰明亮,且与60~80min相差不大(图3a),为节省试验时间,最佳反应时间选择50min。
2.1.4甜菜碱浓度优化
基于上述优化反应体系对甜菜碱浓度(0、0.6、0.8、1.0、1.2、1.4、1.6mmol/L)进行优化,结果表明,7个浓度下均能扩增出条带,但在1.0~1.4mmol/L之间的3个浓度条件下,扩增产物形成的梯状电泳条带更清晰、明亮(图4a);荧光检测结果与凝胶电泳检测结果一致(图4b),有梯状条带的都呈现绿色,在紫外灯下显白色荧光。结合实际应用及后期集成,选择甜菜碱的最适反应浓度为1.0mmol/L。
2.1.5dNTPs浓度优化
基于上述优化的反应体系对dNTPs反应浓度(0、0.2、0.6、1.0、1.4、1.8、2.2mmol/L)进行优化,结果表明,dNTPs浓度在0.2~1.8mmol/L下均能扩增出条带,且5个浓度扩增产物形成的梯状电泳条带亮度均相差不大(图5a);荧光检测结果与凝胶电泳检测结果一致(图5b),有梯状条带的呈现绿色,且在紫外灯下显白色荧光。结合实际应用及后期集成,选择的最适反应dNTPs浓度为0.2mmol/L。
2.1.6Mg2+浓度优化
基于上述优化反应体系,在2~12mmol/L之间以2mmol/L为梯度设置6个Mg2+浓度进行优化。结果表明2~8mmol/L浓度下均能扩增出条带,但在4mmol/L条件下的扩增产物形成的梯状电泳条带更清晰、明亮(图6a);荧光检测结果与凝胶电泳检测结果一致(图6b),有梯状条带的都呈现绿色,且在紫外灯下显白色荧光。结合实际应用及后期集成,选择最适Mg2+浓度为4mmol/L。
2.1.7内外引物浓度比优化
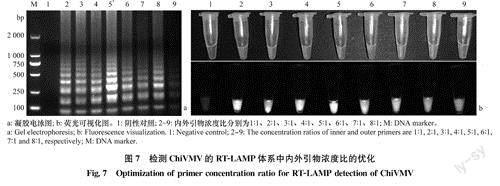
基于上述优化反应体系,设置8个内外引物比梯度1:1~8:1,以筛选出最适的内外引物浓度比。结果表明,8个内外引物浓度比均能扩增出条带,但在4:1条件下扩增产物形成的梯状电泳条带更清晰、明亮(图7a);其荧光结果与凝胶电泳检测结果一致(图7b),有梯状条带的都呈现绿色,且在紫外灯下显白色荧光。结合实际应用,选择最适内外引物浓度比为4:1。
2.2RT-LAMP灵敏度试验
将507.4ng/uL的总RNA进行10倍梯度的连续稀释获得9个浓度,各取1uL作为模板分别采用优化的RT-LAMP及RT-PCR检测方法进行扩增。结果表明,RT-LAMP的检测灵敏度可达到5.07×10-s ng/uL(图8a,b),而RT-PCR仅可达到5.07×10-3ng/uL(图8c),可见RT-LAMP的灵敏度是普通RT-PCR的100倍。
2.3RT-LAMP特异性试验
以分别含有ChiVMV、HCRV、TZSV、TSWV、TVBMV、ToBRFV、TMV、CMV及PVY病毒的烟叶总RNA为模板,利用优化的RT-LAMP检测体系进行扩增。凝胶电泳结果表明,只能在携带ChiVMV的烟叶样品中扩增出条带,其他样品中无扩增条带(图9a);其荧光结果与凝胶电泳结果一致,仅携带ChiVMV的样品显绿色,且在紫外灯下显白色荧光(图9b)。表明建立的ChiVMV RT-LAMP检测体系具有很好的特异性。
3结论与讨论
目前利用RT-LAMP进行检测的应用较多,如植物病毒检测方面,2010年Liu等运用该技术检测了RNA病毒烟草花叶病毒;2020年高彦萍等建立了马铃薯卷叶病毒的RT-LAMP检测技术。在细菌检测方面,2012年黄丽等建立了柑橘黄龙病的RT-LAMP检测方法。此外,2018年张吉红等建立了转基因油菜‘Ms8’品系的LAMP检测体系等。
本研究根据ChiVMV的CP序列,设置了5组RT-LAMP引物,从中筛选出最佳引物组CH-CP-3,随后采用单因素试验探究了反应温度、反应时间,甜菜碱、dNTPs、Mg2+浓度和内外引物浓度比等反应条件及组分对RT-LAMP体系的影响。结果显示,反应时间,dNTPs、Mg2+浓度和内外引物浓度比对RT-LAMP体系的影响比较明显;甜菜碱浓度的影响比较小。在25uL反应体系中各组分最佳加入量分别为:补足至25uL。最佳反应条件为63℃50min,且其灵敏度是RT-PCR的100倍。由此可见,与RT-PCR相比,RT-LAMP具有用时短、反应温度低、灵敏度高的特点,应用前景广阔。
RT-LAMP技术采用6条引物进行扩增,灵敏度极强,但也极易产生假阳性。产生假阳性的主要原因是该检测技术扩增时拷贝系数高,能检测到空气中存在的阳性气溶胶粒子。因此本研究在总结前人经验的基础上,在操作过程中采取“一步一环境”的措施,即在体系加样、RNA模板加样、荧光染色剂加样、凝胶电泳等操作流程时均在不同的操作间,并在加完RNA模板后用石蜡油封层,以减少气溶胶污染的可能性。此外,RT-LAMP需要6条引物,加之其拷贝系数高,导致其对引物具有高要求.因此当引物设计不恰当时也极容易产生假阳性现象,故本研究在引物筛选时对每条引物均设阴性对照,以防产生假阳性现象而影响后续试验。本研究建立并优化了烤烟上南美红辣椒脉斑驳病毒(ChiVMV) RT-LAMP检测技术,并采用了RT-PCR和荧光检测方法对优化的检测方法进行平行比对验证,二者检测结果一致,说明本研究建立的ChiVMVRT-LAMP检测技术具有可靠性。除此之外,RT-LAMP检测可通过肉眼观察直接判断结果(可视化判读结果)且灵敏度是RT-PCR的100倍,較RT-PCR操作简易,可满足科研、基层单位和简陋现场等对该病毒检测的需要,具有广阔的应用前景。

