高效液相色谱-串联质谱法同时测定地表水中33 种药物
李庆山,卜庆伟,曹红梅,洪 宸,吴晓泽,郭亚丽,姜巍巍
1.中国矿业大学(北京)化学与环境工程学院,北京 100083
2.上海城市水资源开发利用国家工程中心有限公司,上海 200082
药物在疾病预防和治疗、生长发育调节以及代谢功能改善等方面都发挥了巨大的作用,但残留药物的排放也对人体健康和生态环境产生了潜在的危害[1-3]。 据统计,2013 年我国抗生素总使用量约为16 万t[4]。 进入人体或动物体内的药物有50%以上不能被吸收,主要以原药或代谢产物的形式随尿液和粪便排出体外[5],导致药物在地表水、地下水、饮用水、土壤、沉积物、湖泊、海洋等各种环境介质中被广泛检出[6-8]。 虽然药物在地表水中以ng/L ~μg/L 的痕量水平存在,但药物活性成分在环境中难降解,且能够诱导耐药菌群或抗性基因的产生,长期暴露于含有药物的水环境中还会导致药物在生物体内累积,对水生生物产生繁殖毒性、生长毒性和免疫毒性等危害[9-10]。为了获取药物在水环境中的存在水平、环境归趋和生态风险等基础数据,有必要建立环境中各种药物的分析方法。
目前国内外建立的药物分析方法主要基于固相萃取-高效液相色谱-串联质谱法(SPE-HPLCMS/MS),该方法可有效富集、净化水质样品,并以高灵敏度检出而被广泛应用[11-12]。 比如,王娅南等[13]基于SPE-HPLC-MS/MS 建立了地表水中40 种抗生素的分析方法,采用正、负离子模式分别采集,方法检出限为0.002 ~0.270 ng/L,测定地表水加标回收率为61.0%~149%,相对标准偏差为1.2%~32%。 FENG 等[14]建立了表层水中5类40 种抗生素的分析方法, 加标回收率为41.3%~112.6%,利用该方法分析长江南京段表层水,共检测到13 种抗生素,质量浓度为13.4 ~780.5 ng/L。 ZHOU 等[12]建立了11 类50 种抗生素在地表水、湖水、污水、沉积物、粪便和污泥中的分析方法,方法定量限分别为0.52 ~5.88 ng/L、2.36~65.8 ng/L、1.73 ~20 ng/L、0.64 ~6.67 ng/g、1.33~17.4 ng/g、1.50 ~28.6 ng/g,方法回收率为50%~150%。 MAIA 等[15]建立了7 种喹诺酮类抗生素的分析方法,标准曲线线性范围为50 ~1 300 ng/L,方法检出限和定量限分别为6.7 ~59.0 ng/L和23.3~196.6 ng/L,该方法被应用于污水中抗生素存在水平的分析。 上述分析方法主要涵盖磺胺类、四环素类、喹诺酮类、大环内酯类、β-内酰胺类等抗生素类药物,但是除抗生素外受纳环境还会受其他多种药物的影响,比如抗病毒药、消炎药和调节血脂药等[16-17]。 特别是近年来受新冠疫情的影响,疫情发生区水环境中抗病毒药物的检出率明显升高[18]。 此外,不同种类药物的物理化学属性差异较大,为了提高分析方法的准确性,需要重点对前处理条件进行优化,比如固相萃取柱的选择、样品pH、洗脱溶剂类型及用量等[19]。
本研究选择产量大、环境中检出率高、毒性强的化合物及抗新冠药物,确定了25 种抗生素药物(包括7 种磺胺类、5 种大环内酯类、4 种四环素类、5 种喹诺酮类、1 种β-内酰胺类、3 种其他类)和8 种非抗生素药物(3 种调节血脂药、2 种抗病毒药、1 种抗痉挛药、1 种消炎药、1 种抗寄生虫药)共33 种目标物。 采用SPE-HPLC-MS/MS 技术,通过优化色谱、质谱条件及前处理方法,建立了测定地表水中33 种药物的分析方法,并将建立的分析方法应用于北京市凉水河地表水中药物的分析测定。
1 研究方法
1.1 仪器与试剂
仪器:高效液相色谱-三重四级杆串联质谱仪(Shimadzu LC/MS-8040,LabSolution 色谱工作站,日本);12 孔固相萃取装置(Supelco 公司,美国);旋涡混合器(江苏海门其林贝尔仪器制造有限公司,中国);超声波清洗仪(江苏昆山舒美超声仪器有限公司,中国);氮吹仪(北京帅恩科技有限责任公司, 中国); Oasis HLB 型固相萃取柱(6 mL/500 mg, Waters 公司, 美国);0.22 μm PTFE 膜针式过滤器(Millipore,美国);0.45 μm 玻璃纤维滤膜(直径142 mm,Millipore,美国);Shimpack XR-ODS 反相色谱柱(2 mm×75 mm,2.2 μm,岛津公司,日本),pH 计(Mettler Toledo,瑞士)。
试剂:甲醇、乙腈(色谱纯,Fisher,美国);甲酸、氨水、氢氧化钠(分析纯,Aladdin,上海);乙酸铵(分析纯,麦克林,上海)。
标准品:磺胺嘧啶(SD)、磺胺二甲嘧啶(SMT)、磺胺甲嘧啶(SMR)、磺胺甲恶唑(SMX)、磺胺间甲氧嘧啶(SMM)、磺胺吡啶(SPD)、甲氧苄啶(TP)、阿奇霉素(ATM)、红霉素(ETM)、林可霉素(LIN)、 罗红霉素(RTM)、 克拉霉素(CTM)、金霉素(CTC)、多西环素(DC)、四环素(TC)、土霉素(OTC)、环丙沙星(CPX)、恩氟沙星(EFX)、诺氟沙星(NFX)、氧氟沙星(OFX)、培氟沙星(PFX)、氨苄西林(AMP)、氯霉素(CP)、氟苯尼考(FF)、灰黄霉素(GSV)、贝螺杀(NIC)、利托那韦(RTV)、磷酸氯喹(PCQ)、苯扎贝特(BF)、卡马西平(CBZ)、氯贝酸(CA)、双氯芬酸(DF)、吉非罗齐(GF)、磺胺二甲嘧啶-D4(SMT-D4)、卡马西平-D10 (CBZ-D10)、 罗红霉素-D7 (RTMD7)、氯霉素-D5(CP-D5)、诺氟沙星-D5(NEXD5)、去甲基金霉素(DMC)。 DC、ETM、GF、SMM购自日本Tokyo Chemical Industry 公司;CTC 购自德国Dr.Ehrenstorfer 公司;LIN 购自英国Apollo Scientific 公司;SMR 购自美国Alfa Aesar 公司;PCQ 购自中国食品药品检定研究院;CP-D5、SMTD4、NFX-D5 购自坛墨质检标准物质中心;RTMD7、 CBZ-D10 购自加拿大 Toronto Research Chemicals 公司;其余标准品均购自北京百灵威科技有限公司。 标准品纯度均高于98%,满足定量分析要求。
标准溶液的配制包括标准储备液的配制、混合标准储备液的配制以及混合标准工作液的配制。 标准储备液的配制:准确称取10 mg 标准品于10 m L 色谱标样存储瓶中,喹诺酮类的药物(CPX、EFX、NFX、OFX、PFX)先用0.5 m L NaOH(0.1 mol/L)溶解,再用甲醇定容至10 m L。 PCQ直接用去离子水配制,4 ℃下冷藏一周。 其余标准品均用甲醇溶解,配制得到1 mg/m L 标准储备液,-20 ℃冷冻保存,保存时间为3 个月。 混合标准储备液的配制:分别移取0.1 m L 标准储备液于10 m L 色谱标样瓶, 用甲醇定容, 配制得到10 μg/m L 的混合标准储备液,-20 ℃冷冻保存,保存时间为一个月。 混合标准工作液的配制:将混合标准储备液稀释至适当浓度的混合标准工作液,使用前配制,现配现用。
1.2 分析条件
1.2.1 色谱条件
Shim-pack XR-ODS 反相色谱柱(2 mm ×75 mm,2.2 μm,岛津公司,日本);进样量10 μL;流速0.3 m L/min;柱温30 ℃;流动相A:0.2%甲酸-2 mmol/L 乙酸铵-水溶液,流动相B:乙腈。 流动相梯度:0 ~5 min,10% ~15% B;5 ~7 min,15%~20% B;7 ~11 m in,20% ~40% B;11 ~14 min,40%~60% B;14 ~16 min,60%~95% B,保持2 m in;18 ~18.1 m in,95%~10% B;18.1 ~22 m in,10% B。
1.2.2 质谱条件
采用 ESI +/ESI-切换, 多反应监测模式(MRM),正离子模式下离子源接口电压-3.5 kV,负离子模式下离子源接口电压4.5 kV,溶剂管温度250 ℃,加热模块温度400 ℃,雾化气氮气,流速3 L/min,干燥气为氮气,流速15 L/min,碰撞气为氩气。
1.3 样品前处理方法
地表水样采集运回实验室后经0.45 μm 玻璃纤维滤膜过滤。 准确量取2 份2 000 m L 子样品,分别用甲酸、氨水调节pH 至3.0 和9.0,随后加入100 ng 定量内标(1 μg/mL),充分混匀,采用HLB 固相萃取小柱对水样中的目标物进行富集。固相萃取柱活化条件依次为8 m L 甲醇、8 m L 高纯水,活化完成后,以大约3 ~5 m L/min 的流速将水样通过固相萃取柱。 富集完成后,用8 m L 的高纯水淋洗HLB 柱,抽真空干燥60 m in 以去除残余水分。 富集pH=3 水样的HLB 柱用8 m L 甲醇洗脱,富集pH=9 的水样先用4 m L 甲醇洗脱,再用4 m L 体积分数5%氨化甲醇进行洗脱。 洗脱液分别收集于K-D 浓缩器中,用柔和高纯氮气吹至近干,用初始流动相定容至1 m L,涡旋混合后经PTFE 膜针式过滤器过滤,置于4 ℃冰箱内避光保存,待HPLC-MS/MS 分析。
2 结果与讨论
2.1 色谱条件的优化
色谱柱的选择应首先保证目标物的分离度和分析时间,其次是柱容量。 柱长影响目标物的分离度和分析时间,柱长越长,分离度越高,但分析时间也会延长。 内径越小意味着柱效越高,分离效果越好,但对检测器的灵敏度要求越高[20-21]。由于本方法中目标物涵盖了四环素类、喹诺酮类、大环内酯类、磺胺类等抗生素,每一类又包含了数种性质相似的药物,为了保证目标物的有效分离,尽量节省分析时间,我们综合对比了文献中报道的50 mm×2 mm、75 mm×2 mm、75 mm×3 mm 和100 mm×2 mm 4 种常用的Shim-pack XR-ODS 反相色谱柱[22-23],发现75 mm×2 mm 可满足本方法的分析要求。 在色谱柱粒径的选择上,小粒径液相色谱柱填料具有柱效高、稳定性强等优点,适用于多种抗生素的分析。 研究发现,在高效液相色谱系统中2.2 μm 颗粒填料比5.0 μm 颗粒填料的柱效高3 倍[23]。 综合分析,最终选择Shimpack XR-ODS 色谱柱(2 mm×75 mm,2.2 μm)进行后续实验。
流动相的选择以及梯度程序的优化是色谱条件优化的重要环节[13]。 单一的流动相组分无法满足多种药物的分离效果,响应强度欠佳。 甲醇或乙腈是目前应用最为广泛的有机相组成[24],本研究对比了甲醇和乙腈对目标物的分离效果,发现乙腈的洗脱能力更强,对33 种目标物的分离效果较好,故选择乙腈作为有机相。 以纯水作为无机相时,发现喹诺酮类药物、四环素类药物及PCQ 有严重的拖尾现象,此外,还发现DF、DC、CBZ、GF 等药物离子化程度较差导致的响应强度低。 加入甲酸可以促进目标物产生[M+H]+分子离子峰,因此考虑向水相中加入甲酸[13],结果发现加入体积分数0.2%甲酸能有效提升正离子模式下目标物的响应强度和灵敏度。 为了使无机相保持弱酸弱碱盐缓冲体系,并且保证负离子模式下目标物分析的稳定性和准确性,最后向无机相中加入2 mmol/L 乙酸铵。 最终确定流动相的组成:0.2%甲酸-2 mmol/L 乙酸铵-水溶液(流动相A)和乙腈(流动相B)。 18 min 内可将33 种目标物实现有效分离,总离子流色谱图见图1。

图1 各目标物及内标物的总离子流色谱图Fig.1 Total ion chromatogram of the target compounds and internal standards
2.2 质谱条件的优化
将目标物和内标物配制成100 ng/m L 标准溶液,在ESI+/ESI-模式下进行全扫,采用一级质谱进行母离子全扫,选择峰强度高、稳定的分子离子作为母离子,依次优化碎裂电压、子离子、碰撞电压。 SD、SMT、SMR、SMX、SMM、SPD、TP、CBZ、ATM、ETM、 LIN、 RTM、 CTM、 AMP、 GSV、 RTV、PCQ、CTC、DC、OTC、TC、CPX、EFX、NFX、OFX、PFX、SMT-D4、CBZ-D10、RTM-D7、NFX-D5、DMC在正离子模式下响应强度较高。 BF、CA、DF、GF、CP、FF、NIC、CP-D5 在负离子模式下响应强度较高。 33 种目标物的质谱参数、保留时间及内标如表1 所示。

表1 33 种目标物的质谱参数、保留时间及内标Table 1 Parameters of mass spectrum,retention time and internal standard for the 33 target compounds
2.3 前处理条件的优化
在前期的研究和文献报道的基础上[12-13,25],本研究选取适用于酸性、碱性和中性化合物的通用型Oasis HLB 固相萃取柱对样品进行富集和净化。 不同药物在HLB 固相萃取填料上的吸附程度与药物本身的pKa和水样pH 有关。 当酸性药物的样品pH 高于pKa或碱性药物的样品pH 低于pKa时,大多数药物分子会以亲水的离子形式存在,从而不容易被固相萃取柱保留[26]。 因此,本研究首先考察了样品pH 对药物回收率的影响。 用甲酸和氨水将水样pH 分别调整为3.0、7.0、9.0,并向样品中加入100 ng定量内标,进行加标回收实验(10 m L 甲醇洗脱),每组3 个平行,加标量为100 ng/L,结果见图2。 实验结果表明,样品pH 对药物回收率结果影响较大。 CTC、DC、TC、OTC、AMP、SD在酸性条件下回收率较好,SMT、CPX、EFX、NFX、OFX、PFX、CA 在碱性条件下回收率较好,其他药物的回收率在不同pH 条件下没有明显的差异。 为了简化样品分析的工作量,后续实验中将CTC、DC、TC、OTC、AMP、SD 在pH=3 的条件下分析,其他药物在pH= 9 的条件下分析。

图2 不同pH 条件下药物的回收率Fig.2 Recoveries of pharmaceuticals under different pH condition of water samples
本研究中分析的目标物种类较多,理化性质各异,单一的洗脱溶剂无法获得好的洗脱效果,首先对比了甲醇和乙腈对目标物的洗脱效果(洗脱溶剂用量10 m L),每组3 个平行,加标量为100 ng/L。 结果显示,乙腈会严重降低喹诺酮类、大环内酯类药物的回收率,回收率范围为0 ~66.4%,而甲醇的洗脱效率明显高于乙腈,因此初选甲醇作为洗脱溶剂。 根据文献报道发现,向甲醇中加入甲酸或氨水,可以改变目标物在固相萃取柱上的存在形态,降低HLB 填料与目标物的相互作用力,增大回收率[27-28]。 因此,本研究对比了5%甲酸-甲醇、纯甲醇和5%氨水-甲醇对目标物的洗脱效率(图3)。 结果表明,对于酸性水样,用5%甲酸-甲醇或5%氨水-甲醇作为洗脱溶剂的洗脱效率下降,特别对于四环素类抗生素影响较大,回收率范围为90.0%~243%,而纯甲醇对四环素类抗生素的洗脱效率明显提升,这主要是由于甲醇的极性高,洗脱能力强,在甲酸、氨水存在的条件下洗脱能力反而变差,回收率降低[29]。 因此,在酸性条件下选择纯甲醇作为洗脱溶剂。 对于碱性水样,5%氨水-甲醇作为洗脱溶剂会提升TP、ETM、RTM、CTM、CPX、PFX、GSV、NIC、CBZ、GF 的洗脱效率, 相比于甲醇溶剂分别提高了 3.55%、25.1%、35.4%、31.7%、43.8%、7.45%、13.9%、23.3%、7.97%、6.99%,但是会降低SMX、SMT、LIN、OFX、PCQ 的洗脱效率。 5%甲酸-甲醇作为洗脱溶剂与纯甲醇的洗脱效率相比没有明显的提升。 因此,为了进一步提升药物的洗脱效率,在碱性条件下首先用纯甲醇进行洗脱,再用5%氨化甲醇进行洗脱。
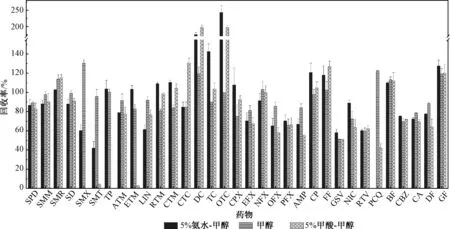
图3 不同洗脱溶剂类型对药物的回收率影响Fig.3 Effect of composition of elute solvent on the recoveries of pharmaceuticals
本研究还考察了洗脱溶剂用量对回收率的影响,pH=3 条件下分别选用8、10、12 m L 甲醇进行实验。 pH= 9 条件下分别选用甲醇和体积分数5%氨化甲醇作为洗脱溶剂依次进行洗脱,两者的体积比为1 ∶1,洗脱溶剂总体积分别选用8、10、12 m L,洗脱溶剂加入顺序为先加入纯甲醇,再加入体积分数5%氨化甲醇进行洗脱,每组3 个平行,加标量为100 ng/L,结果如图4 所示。 实验结果表明,无论是酸性水样还是碱性水样,提高洗脱溶剂的体积对于目标物的洗脱效率没有明显提升。 为了节省氮吹时间和溶剂用量,最终确定为8 m L 洗脱溶剂进行实验。

图4 洗脱溶剂用量对药物回收率影响Fig.4 Effect of volume of elute solvent on the recoveries of pharmaceuticals
2.4 质量保证与质量控制
将混合标准储备液(10 μg/m L)稀释成0.05、0.10、0.20、0.50、1、5、10、50、100、200、250、500 ng/m L 的系列混合标准溶液,并分别向系列混合标准溶液中加入100 ng 内标进行测定。 以目标化合物的峰面积与对应的内标峰面积之比对质量浓度绘图,得到每一个目标药物的标准曲线,均呈现良好的线性关系(相关系数r>0.995)。 取地表水样品为基底,加标浓度考虑低(10 ng)、中(100 ng)、高(500 ng)水平,利用优化的前处理结果对样品进行处理分析,根据加标浓度计算加标回收率及相对标准偏差,加标回收率的计算如式(1)所示,结果见表2。 结果表明,在低、中、高3 个添加水平下(n = 6) 考察方法的回收率分别为55.0%~119%、53.7%~122%、62.7% ~116%,相对标准偏差分别为1.67% ~32.1%、1.75% ~18.8%、1.22%~12.3%。 以3 倍信噪比(S/N=3)对应的浓度为仪器检出限(LOD), LOD 为0.001 ~1.71 ng/L。 以10 倍信噪比(S/N=10)对应的浓度为仪器定量限(LOQ),LOQ 为0.012 ~4.68 ng/L。 方法检出限(MDL)根据各目标化合物的仪器检出限、回收率和浓缩倍数等确定,其计算公式如式(2)所示[30]。 MDL 为0.011 ~7.60 ng/L,各目标物的质量控制参数见表2。

表2 方法检出限、加标回收率、回归方程及相关系数Table 2 Detection lim its,recoveries,calibration curve and correlation coefficient of the method
式中:R 为目标化合物的加标回收率,%;Ce为含有目标物的样品经过前处理后的实测质量浓度,ng/L;C0为目标物在溶液中的质量浓度,ng/L。
式中M 为样品浓缩倍数。
3 实际样品分析
使用建立的方法对北京市凉水河12 个地表水样中的药物浓度进行分析,每种药物的浓度水平如图5 所示。 TC、OPX、RTV、DF 在凉水河的检出率为100%,AMP 的检出率为0%,其余药物均有不同程度检出,检出率为8.33% ~91.7%。 磺胺类抗生素的平均质量浓度为14.9 ng/L,四环素类抗生素的平均质量浓度为5.70 ng/L,喹诺酮类抗生素的平均质量浓度为29.8 ng/L,大环内酯类抗生素的平均质量浓度为18.3 ng/L,非抗生素类药物的平均质量浓度为5.90 ng/L。 OFX、TP、NFX 和CTM 的浓度水平较高,最高质量浓度分别为239、170、121 和84.3 ng/L。 AMP、SMM、GSV、SMT、OTC、CTC、PCQ、CP、PFX、NIC 和FF 的浓度水平较低,检出范围分别为ND(未检出)、ND ~0.72 ng/L、ND ~1.54 ng/L、ND ~1.96 ng/L、ND ~2.19 ng/L、ND ~2.82 ng/L、ND ~2.84 ng/L、ND ~2.92 ng/L、ND ~3.15 ng/L、ND ~3.27 ng/L、ND ~4.48 ng/L。 值得注意的是,RTV 和PCQ 作为新冠肺炎诊疗方案中推荐的药物,其中RTV 在凉水河中100%检出,质量浓度为0.67 ~11.5 ng/L,这可能与疫情期间药物的使用及其自身的持久性有关[18]。

图5 北京市凉水河中33 种药物的浓度水平Fig.5 The concentrations of 33 pharmaceuticals in the Liangshui River of Beijing
通过文献分析发现(表3),凉水河地表水中磺胺类抗生素的浓度水平低于汾河和雄安新区境内河流浓度水平,与常州境内河流浓度水平相似,但要高于长江重庆段和潮汕境内河流浓度水平,这表明凉水河中磺胺类抗生素处于中等污染水平。 凉水河中大环内酯类抗生素ATM、ETM、LIN、RTM 的存在水平与其他地区相似,而CTM的质量浓度为ND ~84.3 ng/L,平均质量浓度为31.5 ng/L,略高于其他地区。 CTC、DC 在雄安新区和潮汕地区河流中未检出,在汾河和凉水河中的浓度水平类似。 喹诺酮类药物NFX、OFX 在河流中存在的浓度水平整体偏高,这可能与农田区有机肥料的施用有关,药物通过地表径流进入地表水,此外喹诺酮类药物在环境中半衰期较长,导致其更易于在环境中累积[31-33]。AMP 在环境中的存在水平较低,凉水河中未检出,雄安新区境内河流中检出率为67.0%,质量浓度为ND ~2.32 ng/L。 凉水河中CP 和CBZ与文献中报道的浓度水平类似。

表3 中国地表水中部分药物浓度水平Table 3 The concentrations of some pharmaceuticals in su rface waters in China
据统计,武汉地区新冠疫情期间,洛匹那韦、利托那韦、磷酸氯喹、利巴韦林、阿比多尔、莫西沙星和甲泼尼龙7 种抗击新冠病毒的药物使用量约为2 472 kg(按确诊50 333 人计算),其中检测到利巴韦林在地表水中的质量浓度为1.04 ~52.2 ng/L[18],明显高于本研究中报道的地表水中抗病毒类药物浓度。 基于定量构效关系(QSAR)模型计算发现,抗病毒类药物对水藻、水蚤、鱼类和甲壳类动物具有生态毒性效应,其毒性效应与心血管药物、抗焦虑药、安眠药、抗精神病药、胃肠药等相似[34-35]。 虽然目前对于地表水中抗病毒类药物报道的浓度数据较少,但是随着疫情的常态化发展,导致抗病毒药物的使用量增加,地表水中抗病毒类药物的存在水平、环境归趋和生态风险应该引起足够的重视。
4 结论
本研究采用SPE-HPLC-MS/MS 技术,通过重点优化目标分析物的色谱条件、质谱条件、样品的pH、洗脱剂类型及用量等,建立了地表水中33 种药物同时分析测定方法,方法检出限为0.011 ~7.60 ng/L,地表水加标回收率为53.7%~122%,相对标准偏差为1.22%~32.1%(n=6)。 方法成功应用于北京市凉水河地表水药物的分析,共检出32 种药物,检出质量浓度为ND ~239 ng/L。抗生素类药物在水体中的检出质量浓度为ND ~239 ng/L,非抗生素类药物的检出质量浓度为ND ~54.6 ng/L。 其中,磺胺类抗生素的检出质量浓度为ND ~47.2 ng/L,大环内酯类抗生素的检出质量浓度为ND ~84.3 ng/L,四环素类抗生素的检出质量浓度为ND ~25.3 ng/L,喹诺酮类抗生素的检出质量浓度为ND ~239 ng/L,其他类抗生素的检出质量浓度为ND ~4.47 ng/L,β-内酰胺类抗生素未检出。 该研究结果为地表水典型药物的分析提供了一种高效、准确的分析方法,具有较高的应用价值。

