浙东白鹅种鹅多杀性巴氏杆菌分离鉴定及药敏试验
贾惠言,周 潇,戴久丽,王 力,陈淑芳
(宁波市农业科学研究院,浙江宁波 315040)
多杀性巴氏杆菌(Pasteurella multocida)是引起鹅巴氏杆菌病的主要病原体,该菌在自然界和畜禽体内都有存在,其抵抗力较弱,在日光曝晒下能够死亡,在无菌的生理盐水以及蒸馏水中也会快速死亡,主要通过接触性传染的方式侵害鸡、鸭、鹅等禽类[1-4]。鹅巴氏杆菌病一年四季均可发生,病鹅常常发生剧烈的腹泻症状,所以又称霍乱,通常主要侵害成年禽类,以性成熟后的禽类最为易感。如果没有及时采取有效防治,病死率可高达70%~95%,该病一旦暴发,易导致鹅群大批死亡、生产性能低下,给养鹅业造成较大的经济损失,是危害现代养鹅业的疾病之一[5-7]。
鹅可通过外源性感染和自体感染发病[8]。外源性感染主要是由采食污染的饮水或者饲料引起,或者由消化道和呼吸道感染,也可以通过吸血昆虫和损伤的皮肤、黏膜等多种途径感染[8,9]。一般来说,健康鹅往往是通过外源性感染引起发病。另外,大部分动物体内都存在巴氏杆菌,是一种常见的条件性致病菌,主要在扁桃体和上呼吸道内分布,由于具有较弱的毒力,当机体健康状况良好时不会出现发病,但在抵抗力下降时,该菌开始大量繁殖,且毒力明显增强,并侵入血液或者淋巴,从而导致自体感染[4]。病例主要表现为突然发病,出现败血症病状,下痢,死亡率高,剖解特征:全身黏膜、浆膜小点出血,出血性肠炎及肝脏坏死[10]。目前关于巴氏杆菌病的报道主要集中在牛、羊、兔等畜类和鸡鸭等家禽,而鹅的报道主要集中在其他种类的肉鹅,尚无关于浙东白鹅种鹅的报道。
2023 年3 月浙江省某浙东白鹅种鹅场的种鹅突然发病,死亡2 只。病鹅体温明显升高,临床表现为精神萎靡,颈部弯曲,双眼无神,羽毛杂乱,双翅无力;食欲较差,不采食,但会喝水;鼻窦肿大,口鼻中均流黏液,张口呼吸;排白色或绿色稀便,粪便有腥臭,偶尔发现粪便混有血液,发病后期会有持续性出血性下痢;体型偏瘦,伴有跛行和关节肿胀。剖检主要病理变化为病死鹅的皮下与腹膜充血严重,并伴有小点状出血;心包和胸膜粘连,心包膜有出血点,心包积液明显,并渗出黄色液体,渗出液中带有纤维蛋白块;肝脏呈棕色,略肿大,肝脏表面发现出血点和坏死灶;肌胃出血明显,大肠和小肠黏膜充血;脾脏柔软,伴有肿大;肺脏明显充血,伴有出血,呈暗红色。因此,本试验对浙东白鹅种鹅样本进行致病菌的分离与鉴定,并通过药敏试验对该病的用药治疗提供参考,以期为种鹅巴氏杆菌病的综合防治提供参考。
1 试验器材与方法
1.1 试验材料
浙江省某浙东白鹅种鹅场患病种鹅1 只、死亡种鹅2 只。
1.2 培养基及试剂
血琼脂培养基(购自青岛海博生物技术有限公司)、胰酪大豆胨琼脂培养基(购自青岛海博生物技术有限公司)、麦康凯培养基(购自青岛海博生物技术有限公司)、SS 琼脂培养基(购自青岛海博生物技术有限公司)、革兰氏染色液、DNA marker DL2000(购自北京全式金生物技术股份有限公司)、2×TransTaq-T PCR Supermix(购自北京全式金生物技术股份有限公司)、琼脂糖(购自北京全式金生物技术股份有限公司)、E-Test 药敏试纸条(购自法国梅里埃)。

图1 分离菌株在不同培养基上的生长情况及菌落形态
1.3 试验仪器
手术剪和手术刀等解剖器械、接种环和培养皿等细菌培养耗材、注射器、BCE3202-1CCN 电子分析天平(北京赛多利斯制造)、IBAO 型电热鼓风干燥箱(施都凯仪器设备有限公司)、SQ810C 型自动高压灭菌锅(雅马拓科技贸易有限公司制造)、生化培养箱(施都凯仪器设备有限公司)、烧瓶、5810 型台式高速离心机(eppendorf)、SW-CJ-IF 型超净工作台(苏州安泰技术公司制造)、NE910 正置显微镜(宁波永新光学有限公司)、S1000 型梯度PCR 仪(BIO-RAD生命医学有限公司)、SubcellGT 核酸电泳仪(BIO-RAD 生命医学有限公司)、ChemDocMP 凝胶成像仪(BIO-RAD 生命医学有限公司)。
2 试验方法
2.1 取样
病死鹅用消毒水表面消毒后,将鹅腹部朝上置于手术台,首先稍微清理一下腹部羽毛,而后提起下腹部表皮用手术剪剪开一个小口,沿剪开的小口撕开腹部表皮。观察并记录皮下与肌肉的出血情况;剪开胸腹腔,观察并记录脏器病变情况;向上剪开颈部表皮,观察并记录颈部的皮下出血情况、食管与气管的出血情况;向下剪开消化道,观察并记录肌胃、腺胃、肠道组织的病变情况和内容物渗出情况。对病死鹅或患病鹅的内脏组织和眶下窦进行无菌采样。
2.2 细菌分离与鉴定
2.2.1 培养基的制备
血琼脂培养基、胰酪大豆胨琼脂培养基、麦康凯培养基和SS 琼脂培养基按照说明书用超纯水进行配制。配好的培养基121℃灭菌30min,晾凉后倒入平板,4℃冰箱内倒置保存。
2.2.2 分离培养与生化鉴定
在无菌条件下,将肝、脾、眶下窦等病料分别接种于血琼脂培养基、胰酪大豆胨琼脂培养基、麦康凯培养基和SS 琼脂培养基,置于37℃恒温培养箱培养24h。观察菌落生长状况与形态。无菌挑选分离纯化后的单个优势菌落,对被检病料作触片或涂片,片子在环境中自然干燥后用酒精灯火焰进行固定,固定后进行革兰氏染色,用显微镜观察菌落的颜色和形态。根据微量生化发酵管说明书分别接种葡萄糖、乳糖、果糖、木糖、麦芽糖、蔗糖、蕈糖、山梨醇、卫矛醇、肌醇、甘露醇、硫化氢、尿素酶、赖氨酸和鸟氨酸等生化管[11]。
2.2.3 单菌落鉴定
对菌株进行16SrDNA 的扩增测序及序列分析。以分离到的纯菌落作为模板,进行菌落PCR。该PCR 的反应体系为50μL:模板2μL、dNTP4μL、上游引物与下游引物各0.5μL、Taq酶0.5μL、10XBuffer5μL 以及ddH2O37.5μL。PCR反应条件:预变性5min(95℃),变性1min(95℃),退火1min(55℃),延伸2min(72℃),35 个循环;终延伸8min(72℃)。在PCR 产物中取5μL,在1%琼脂糖凝胶中电泳;剩余的PCR产物送测序公司进行测序,将测序结果在NCBI数据库中进行BLAST 同源性比对分析。
2.3 药敏试验
2.3.1 配制菌液
以下操作均在超净工作台上进行,无菌条件下用无菌的接种环挑取多杀性巴氏杆菌纯菌落2个,2 个菌落加入灭菌PBS 后,用漩涡混匀器充分混合,制成多杀性巴氏杆菌菌悬液。
2.3.2 药敏试纸条的放置
用无菌棉签沾取菌悬液,涂布于血琼脂平板,用无菌镊将E-test 试纸条放置其上,置于37℃恒温培养箱培养24h,记录各E-test 试纸条读数。参照抗微生物药物敏感性试验执行标准进行结果判定。
3 试验结果分析
3.1 病原菌分离培养、菌落形态特征及生化试验结果
对病死鹅肝、脾及眶下窦进行无菌采样,分别接种于血琼脂培养基、胰酪大豆胨琼脂培养基、麦康凯培养基和SS 琼脂培养基,37℃生化培养箱培养24h。在血琼脂上形成灰白色露珠样小菌落(图1a),在TSA 培养基上形成透明的露珠样小菌落(图1b),在麦康凯培养基(图1c)和SS 培养基(图1d)上不生长。生化试验结果显示该菌株可发酵葡萄糖、果糖、蔗糖、木糖、蕈糖和山梨醇;不发酵乳糖、菊糖、麦芽糖、卫矛醇、肌醇和甘露醇;硫化氢、尿素酶、赖氨酸和鸟氨酸反应阴性。
3.2 革兰氏染色结果
从AST 平板挑单菌落进行涂片,片子固定后进行革兰氏染色,如图2 所示,显微镜观察结果显示革兰氏染色为阴性,镜下可见椭圆形短小杆菌,该菌两极染色深、两端为钝圆。

图2 分离菌株革兰氏染色镜检结果(1000x)
3.3 分离菌株16S rDNA 的PCR 扩增结果
根据细菌基因组DNA 提取试剂盒说明书提取分离菌DNA,PCR 扩增其16S rDNA 基因,引物由上海博亚生物技术有限公司合成,引物序列见表1。PCR 产物进行1%琼脂糖凝胶电泳,获得1500bp 条带,与预期结果相符(图3)。

表1 细菌16S rDNA 基因通用引物

图3 分离菌株16S rDNA PCR 扩增结果
3.4 分离菌株16S rDNA 的PCR 扩增片段测序及序列分析
将分离到的纯菌落送至浙江尚亚生物技术有限公司进行菌落测序,返回测序结果后,在NCBI 数据库中与已有的多杀性巴氏杆菌序列进行BLAST 同源性比对。如表2 所示,分离菌株与多杀性巴氏杆菌同源性高达99.93%,判定该分离株为多杀性巴氏杆菌。
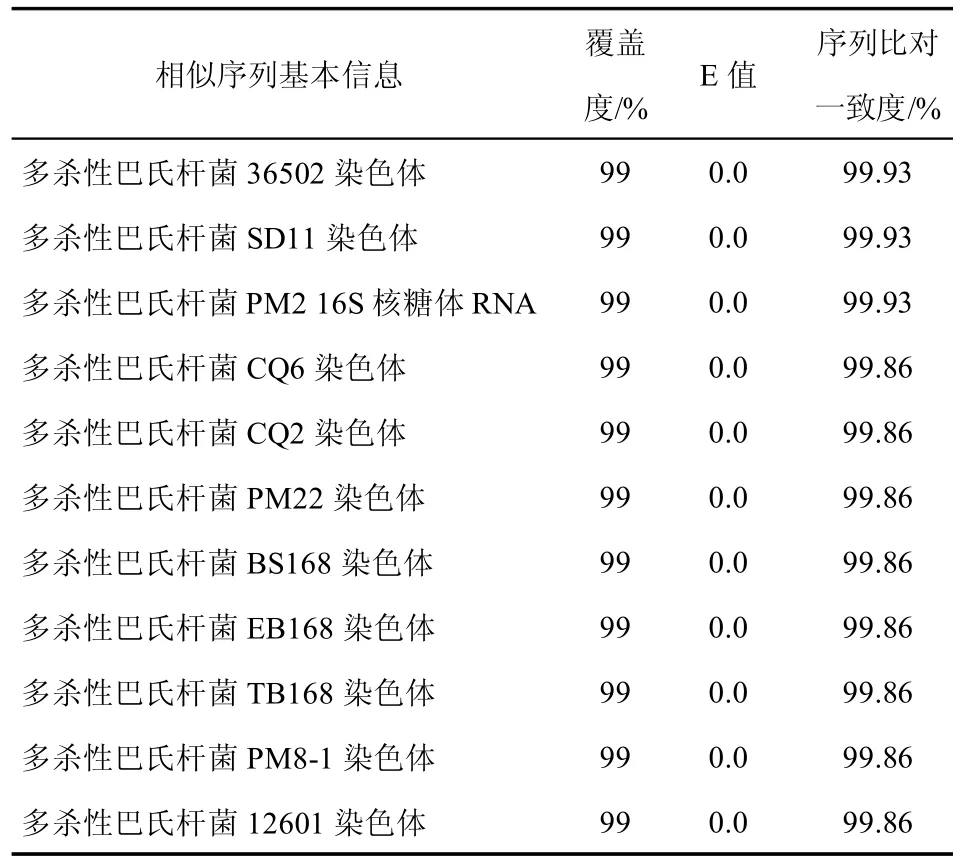
表2 细菌16S rDNA 基因通用引物
3.5 药敏试验
选取庆大霉素、美罗培南、氨苄西林、阿莫西林、红霉素、复方新诺明、头孢曲松、环丙沙星、粘菌素这9 种抗生素,根据说明书用E-test法对分离菌株进行最小抑菌浓度检测。参照抗微生物药物敏感性试验执行标准(CLSI)进行结果判定[12],如表3 所示,庆大霉素的最小抑菌浓度为1μg/mL,2023 版CLSI 中对庆大霉素敏感的最小抑菌浓度折点为小于等于2μg/mL,该菌对庆大霉素敏感;美罗培南的最小抑菌浓度小于0.008μg/mL,CLSI 中对美罗培南敏感的最小抑菌浓度折点为小于等于1μg/mL,该菌对美罗培南敏感;氨苄西林的最小抑菌浓度为0.064μg/mL,CLSI 中对氨苄西林敏感的最小抑菌浓度折点为小于等于8μg/mL,该菌对氨苄西林敏感;阿莫西林的最小抑菌浓度为0.064μg/mL,CLSI 中对阿莫西林敏感的最小抑菌浓度折点为小于等于8μg/mL,该菌对阿莫西林敏感;红霉素的最小抑菌浓度为8μg/mL,CLSI 中对红霉素敏感的最小抑菌浓度折点为小于等于0.5μg/mL,对红霉素耐药的最小抑菌浓度折点为大于等于8μg/mL,中介范围为1~4μg/mL,因此该菌对红霉素耐药;复方新诺明的最小抑菌浓度小于0.064μg/mL,CLSI中对复方新诺明敏感的最小抑菌浓度折点为小于等于2/38μg/mL,该菌对复方新诺明敏感;头孢曲松的最小抑菌浓度为0.064μg/mL,CLSI 中对头孢曲松敏感的最小抑菌浓度折点为小于等于1μg/mL,该菌对头孢曲松敏感;环丙沙星的最小抑菌浓度小于0.032μg/mL,CLSI 中对环丙沙星敏感的最小抑菌浓度折点为小于等于0.25μg/mL,该菌对环丙沙星敏感;粘菌素的最小抑菌浓度小于0.5μg/mL,CLSI 中对粘菌素敏感的最小抑菌浓度折点为小于等于1μg/mL,该菌对粘菌素敏感。

表3 分离菌株药敏试验结果
4 讨论
巴氏杆菌病的发生流行与气候变化、饲养管理、营养状况、兴奋、损伤以及潜伏性疾病等有关[4]。暴发季节主要在夏季、秋季和冬季,该病在发病禽舍舍饲时很难完全清除,可以在同一场地连续发生。虽然目前已有多杀性巴氏杆菌疫苗,对降低禽霍乱造成的损失有一些保护作用,但多杀性巴氏杆菌存在血清型多、交叉免疫力差和保护期短等问题,导致疫苗的免疫效果不理想,使该病在鸭群中仍时有发生[13,14]。近年来随着鹅产业的不断发展,鹅巴氏杆菌病的诊治和药敏报道不断增加[15,16]。
2023 年3 月在浙江省象山县种鹅场获得患鼻窦炎的种鹅病料,为确证感染鼻窦炎的细菌种类,本研究从发病浙东白鹅的种鹅无菌采集肝、脾及眶下窦,分离并纯化到1 株细菌,通过在4种培养基上观察培养特性、革兰氏染色性质、显微镜下形态学观察、生化鉴定试验等方法,发现该菌株与多杀性巴氏杆菌的特性基本一致,初步认为纯化到的菌株为多杀性巴氏杆菌。随着分子生物学的发展,细菌的分离鉴定早已有很多报道使用PCR 方法作为鉴定的辅助方法,可以从序列上更加准确地确定病原[3]。目前,已有文献报道利用多杀性巴氏杆菌中的标志基因建立鉴定多杀性巴氏杆菌的PCR 方法[17]。为进一步验证该结果,用16S rDNA PCR 的方法来确证,用巴氏杆菌的序列设计引物后进行PCR 扩增,得到一个1500bp 的条带,与预想的一致。将该单菌落进行测序,测序结果与NCBI 数据库中多杀性巴氏杆菌已有的序列进行BLAST 比对,同源性达99.93%,从DNA 序列的层面证实了分离到的菌株为多杀性巴氏杆菌。
大量监测结果表明,畜牧业中抗菌药物仍存在使用不当的情况,这种不当的使用非常容易使细菌对抗菌药物产生耐药性。细菌产生耐药性后,容易形成找药困难或无药可医的局面,从而造成该细菌快速传播,对畜牧业发展产生负面影响。因此,不可滥用抗生素,需根据药敏的结果,选择敏感药物按常规剂量和疗程对畜禽进行治疗。本研究对分离到的菌株进行了药物敏感试验,结果表明,分离菌株对庆大霉素、美罗培南、氨苄西林、阿莫西林、红霉素、复方新诺明、头孢曲松、环丙沙星、粘菌素8 种抗生素均敏感,对红霉素耐药。
针对本次在浙东白鹅种鹅场发现巴氏杆菌引起的生病与病死情况,除去采样的试验病死鹅(试验病死鹅采样后也进行无害化处理),病死鹅立即采取无害化处理,病鹅采取隔离饲养,同时对运动场地、饲养圈舍、饲养用具以及被污染的场地进行全面消毒灭源,每天2 次,疫情得到控制后每周进行1 次消毒[18];病鹅及时根据药敏试验结果将药物与水混合均匀后任其饮水;健康鹅群每只翅下注射2mL 禽霍乱组织灭活苗,应注重健康鹅的生活环境,尽量保证鹅舍的通风,保持鹅舍的干燥,粪便应及时处理,定期抽血检查,争取发现早、治疗早,避免造成巨大损失。
畜禽产业疫病重在防控,多杀性巴氏杆菌易感染成年鹅,种鹅要做好防范措施,后备种鹅应在70 日龄接种鹅巴氏杆菌灭活苗,经产种鹅应在每年7 月份开产前接种鹅巴氏杆菌灭活苗。需要注意疫苗的保存温度和保质期,并且在开封后尽快使用。
5 结论
此次在浙江省某浙东白鹅种鹅场患病鹅与病死鹅体内分离到单一致病菌,该菌在形态学和生化反应等方面均符合多杀性巴氏杆菌的特征,菌落PCR 的结果显示该致病菌16S rDNA 序列与多杀性巴氏杆菌的DNA 序列同源性高达99.93%,进一步确证了本次分离到的致病菌为多杀性巴氏杆菌。此次分离到的致病菌对庆大霉素、美罗培南、氨苄西林、阿莫西林、复方新诺明、头孢曲松、环丙沙星、粘菌素等8 种敏感,可为单独用药或联合用药治疗提供参考,但该菌对红霉素耐药,应避免使用。

