荞麦麸皮蛋白的制备及功能特性研究
王立博 陈静 任艳娟 闫铭欢 张亚坤 王昊然 吴伟菁 罗登林

摘要:探究了蕎麦麸皮蛋白的最佳制备工艺及功能特性差异。通过单因素实验对pH、温度、料液比和时间进行初步优化,并在此基础上采用响应面实验确定最佳工艺参数:pH为10,料液比为1∶10,时间为60 min,温度为40 ℃。进一步分析了温度和pH对苦荞麸皮蛋白和甜荞麸皮蛋白功能特性的影响。结果表明,随着温度升高,两种蛋白的溶解性及持水性均呈上升趋势,在60~80 ℃时,两种蛋白有较好的起泡性和乳化性,且稳定性良好。碱性环境(pH≥8)可提高两种蛋白质的溶解性、持水性、乳化性和乳化稳定性。与大豆分离蛋白相比,极酸(pH=2)或碱性(pH≥8)条件下,甜荞麸皮蛋白展现出良好的起泡性,而苦荞麸皮蛋白则展现出良好的泡沫稳定性。综上所述,适当热处理及碱性环境可改善荞麦麸皮蛋白的功能特性。
关键词:荞麦麸皮;蛋白;单因素实验;响应面法;功能特性
中图分类号:TS201.21 文献标志码:A 文章编号:1000-9973(2023)12-0016-09
Preparation and Functional Properties of Buckwheat Bran Protein
WANG Li-bo1, CHEN Jing1, REN Yan-juan1, YAN Ming-huan1, ZHANG Ya-kun2,
WANG Hao-ran3, WU Wei-jing4, LUO Deng-lin1*
(1.College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023,
China; 2.College of Agricultural Equipment Engineering, Henan University of Science and
Technology, Luoyang 471023, China; 3.College of Food Science and Engineering,
Beijing University of Agriculture, Beijing 102206, China; 4.Department of
Public Health and Medical Technology, Xiamen Medical College,
Xiamen 361023, China)
Abstract: The optimal preparation process and functional property differences of buckwheat bran protein are investigated. The pH, temperature, solid-liquid ratio and time are preliminarily optimized by single factor experiment. On this basis, response surface experiment is used to determine the optimal process parameters: pH is 10, solid-liquid ratio is 1∶10, time is 60 min and temperature is 40 ℃. The effects of temperature and pH on the functional properties of tartary buckwheat bran protein and common buckwheat bran protein are further analyzed. The results show that the solubility and water holding capacity of tartary buckwheat bran protein and common buckwheat bran protein both increase with the increase of temperature.At 60~80 ℃, the foaming and emulsification properties of tartary buckwheat bran protein and common buckwheat bran protein are good and the stability is also good. The alkaline environment (pH≥8) can improve the solubility, water holding capacity, emulsification property and emulsification stability of tartary buckwheat bran protein and common buckwheat bran protein. Compared with soybean isolated protein, the foaming
property of common buckwheat bran protein is good under very acidic (pH=2) or alkaline (pH≥8) conditions, while the foam stability of tartary buckwheat bran protein is good. In summary, appropriate heat treatment and alkaline environment can improve the functional properties of buckwheat bran protein.
Key words: buckwheat bran; protein; single factor experiment; response surface method; functional properties
荞麦与小麦、大米等谷物具有相似的化学和利用特性,隶属于蓼科(Polygonaceae)荞麦属(Fagopyrum)双子叶植物,常被归类为一种“伪谷物”[1]。甜荞(F. esculentum Moench)和苦荞(F. tataricum (L.) Gaertn.)是常用于農业种植的2个重要荞麦品种[2],两者所含成分相似,富含淀粉、蛋白质、膳食纤维、黄酮类、多酚和维生素等功能物质[3-4]。这些功能物质赋予两者良好的加工特性及独特的药用价值。近年来,关于荞麦用于开发功能性食品的价值已被广大研究者所证实,而现有的关于荞麦在食品中的应用研究多是以籽粒或全粉的形式来进行复配应用,例如粥、面条、面包、馒头、饼干、茶[5-7],而基于荞麦各功能组分的相关应用研究鲜有报道。
荞麦蛋白营养均衡且氨基酸种类丰富,尤其是在荞麦麸皮中蛋白含量约为12%~24%,其中含有8种人体必需的氨基酸。其中,赖氨酸含量比大米和小麦多2倍以上[8-9]。研究表明,经常食用荞麦或荞麦制品可以预防“赖氨酸缺乏症”,实现人体营养均衡[10]。因此,荞麦可作为一种比一般谷物更优越的蛋白质来源[11]。但由于荞麦自身的无麸质特性,这也决定了荞麦麸皮蛋白在食品加工和应用中的局限性[12]。考虑到苦荞麸皮中黄酮类、多酚等物质的含量较高以及对蛋白提取潜在的影响,本实验以苦荞麸皮为代表,结合单因素实验和响应面实验进行荞麦麸皮蛋白的提取工艺优化研究。在此基础上,探究苦荞麸皮蛋白(tartary buckwheat bran protein,TBBP)和甜荞麸皮蛋白(common buckwheat bran protein,CBBP)在不同pH和温度条件下功能特性的变化规律,以期为荞麦蛋白在功能食品中的进一步研究和应用提供参考依据。
1 材料与方法
1.1 材料与试剂
苦荞麸皮(黑丰1号):山西雁门清高食业有限责任公司;甜荞麸皮(榆林红花):定边县塞雪粮油工贸有限责任公司;大豆分离蛋白(分散型,soybean isolate protein,SPI):河南省鲲华生物技术有限公司。
1.2 试剂
考马斯亮蓝G250:上海蓝季科技发展有限公司;十二烷基磺酸钠:天津市光复精细化工研究所;氢氧化钠、盐酸、石油醚、无水乙醇(均为分析纯):天津市德恩化学试剂有限公司。
1.3 仪器与设备
UNIC UV-2100紫外分光光度计 广州瑞丰实验设备有限公司;TDZ5-WS离心机 湖南湘仪离心机仪器有限公司;FE20 pH计 武汉德盟科技有限公司;LGJ-10D冷冻干燥机 北京四环起航科技有限公司。
1.4 方法
1.4.1 TBBP的制备
以苦荞麸皮粉为原料,按1∶10(质量与体积比)加入75%乙醇,用保鲜膜封口,常温下250 r/min电动水浴搅拌40 min,以去除类黄酮、色素等物质,经4 500 r/min离心10 min,收集沉淀,上述步骤重复5次。按1∶10(质量与体积比)在沉淀中加入石油醚,用保鲜膜封口并置于通风橱浸泡脱脂12 h,经75%乙醇洗涤3次后放入50 ℃烘箱中干燥4 h备用[13]。
将经处理的苦荞麸皮粉与蒸馏水按一定比例混合均匀,滴加1 mol/L NaOH溶液调节pH,于不同温度下200 r/min水浴搅拌一定时间,经4 500 r/min离心20 min后,收集上清液滴加1 mol/L HCl溶液至pH为4.2,经4 000 r/min离心15 min后富集沉淀,用蒸馏水冲洗2~3次,将沉淀按1∶3(质量与体积比)于蒸馏水中溶解,用1 mol/L NaOH溶液调pH至中性,真空冷冻干燥后,即得TBBP[12]。
1.4.2 TBBP提取工艺参数单因素实验
考虑到影响TBBP得率的主要因素为pH、温度、料液比和时间,以pH 9、温度35 ℃、料液比1∶10、时间60 min为固定值分析各因素变化对蛋白质得率的影响。各因素设置:pH为8,8.5,9,9.5,10;温度为25,30,35,40,45 ℃;料液比为1∶6、1∶8、1∶10、1∶12、1∶14(质量与体积比);时间为20,40,60,80,100 min。以TBBP得率(干重)为响应值,按照上述设置进行单因素实验。
蛋白质得率(%)=提取得到粗蛋白质量(干重)脱脂苦荞麸皮质量(干重)×100%。
1.4.3 响应面法优化TBBP的提取条件
采用四因素三水平的Box-Behnken实验,考察pH、温度、料液比和时间对TBBP得率的影响。各因素水平设置见表1。
1.4.4 蛋白质功能特性的测定
基于上述最优工艺制备TBBP和CBBP,并以大豆分离蛋白为参照,考察不同温度(20,40,60,80,100 ℃)及pH (2,4,6,8,10)对制备的TBBP和CBBP溶解性、持水性、起泡性以及乳化性的影响。
1.4.4.1 溶解性的测定
量取20 mL不同温度和pH的蛋白质溶液(1%,质量与体积比),室温下2 000 r/min涡旋30 s,4 500 r/min离心15 min,之后用紫外分光光度计在595 nm处测定上清液中蛋白质的含量[14]。
溶解性(%)=上清液中蛋白质含量样品中总蛋白含量×100%。
1.4.4.2 持水性的测定
称取0.5 g蛋白样品粉末(干重)置于离心管中,与不同温度和pH下制备的0.05 mol/L磷酸盐缓冲溶液混合制成1%的蛋白质溶液,并以500 r/min磁力搅拌至溶解,经4 500 r/min离心10 min后,弃去上清液,称量离心管和沉淀总重[15]。
持水性(%)=m3-m2m1×100%。
式中:m1为样品质量,g;m2为离心管和样品总重,g;m3为离心管和沉淀总重,g。
1.4.4.3 起泡性及泡沫稳定性的测定
量取一定体积(V1)不同温度和pH条件下制备的蛋白质溶液(1%,质量与体积比)于50 mL试管中,10 000 r/min均质1 min,立即记录溶液的体积(V2)。室温静置30 min后,记录体积(V3)[16]。
起泡性(%)=V2-V1V1×100%,
泡沫穩定性(%)=V2-V3V2-V1×100%。
式中:V1为原始体积,mL;V2为0 min时溶液和泡沫的总体积,mL;V3为30 min时溶液和泡沫的总体积,mL。
1.4.4.4 乳化性及乳化稳定性的测定
准确量取12 mL不同温度和pH条件下制备的蛋白质溶液(1%,质量与体积比)于100 mL离心管中,加入4 mL大豆油,在10 000 r/min条件下均质1 min,立即从离心管的底部吸取20 μL溶液并与5 mL 0.1%(质量与体积比)SDS溶液混匀,在500 nm处测定吸光度值。30 min后继续取样测定吸光度,计算乳化稳定性[17]。
乳化性(m2/g)=2×2.303×A0×Nc×L×θ×10,
乳化稳定性(min)=30×A0A0-At。
式中:A0为0 min时测得的吸光度;At为30 min时测得的吸光度;N为稀释因子,N=100;c为蛋白质样品浓度,g/mL;θ为乳化液中油相的比例,θ=0.25;L为孔板体积,L=0.01 m-2。
1.5 数据处理
采用SPSS 26.0及Origin 2021进行数据的分析与绘图;采用Design-Expert 13.0进行响应面分析,P<0.05表示差异显著。
2 结果与分析
2.1 TBBP提取的单因素实验结果分析
由图1中A可知,随着pH的增加,TBBP得率呈现先下降后上升的趋势,在pH为8.5时,蛋白质得率最低,为19.33%。当pH>8.5时,随着pH的增加,TBBP得率有明显的上升,并且在pH为9.5时达到拐点(P<0.05),为20.74%。当pH过高时,蛋白质易发生变性,其加工性质及营养价值均会降低,考虑到后续蛋白功能特性需要,确定pH值为9.5。
由图1中B可知,当温度逐渐升高时,蛋白质得率呈现阶梯式上升趋势;当温度为25~30 ℃时,蛋白质得率无显著变化。当温度达到35 ℃时蛋白质得率最高(P<0.05),为20.43%;当温度大于35 ℃时,蛋白质得率处于稳定状态(P>0.05),因此确定最佳温度为35 ℃。
由图1中C可知,TBBP得率随着料液比的增加呈现先上升后缓慢下降的趋势,当料液比小于1∶8时,蛋白质得率无显著变化。当料液比为1∶10时蛋白质得率达到最大值(P<0.05),为20.41%,之后随着料液比的增加,TBBP得率缓慢降低,但无显著差异,因此确定最佳料液比为1∶10。
由图1中D可知,当时间为20~40 min时,蛋白质得率显著增加(P<0.05),当时间为40 min时达到最大值,为20.39%;当时间大于40 min时,蛋白质得率先降后升,但无显著差异,为提高提取效率和节约资源,确定最佳时间为40 min。
2.2 响应面法优化实验设计及结果分析
2.2.1 响应面实验设计与结果
根据单因素实验结果,选择pH(9.5)、温度(35 ℃)、料液比(1∶10)和时间(40 min)为影响因素,以蛋白质得率为响应值,进行四因素三水平的响应面实验,具体实验方案见表1,响应面实验结果见表2。以TBBP得率为指标,使用Design-Expert 13.0软件对自变量进行二次多元线性回归分析,得到回归方程:Y=-0.620 716+0.344 960A-0.962 104B+6.972 83C- 0.347 200D+0.143 780AB-0.207 075AC-0.005 493AD-0.050 270BC+0.009 190BD+0.003 363CD-0.071 657A2-0.004 715B2-0.156 897C2+0.000 842D2。
2.2.2 响应面模型的方差分析
对回归模型进行检验,方差分析结果见表3。
由表3可知,该模型的F值为24.88,具有重要意义,P<0.000 1,表明该回归模型极显著;失拟项的P值为0.562 3>0.05,模型的相关系数R2=0.961 4,调整系数RAdj2=0.922 7,表明该响应面模型的拟合程度较好,可用于TBBP最佳工艺条件的分析与预测[18-19]。由F值的大小可知各因素对蛋白质得率的影响程度为pH(A)>料液比(C)>时间(D)>温度(B)。
2.2.3 各因素之间的交互作用
由图2中A1和A2可知,随着pH的增加,TBBP得率也随之逐渐增加,而随着温度的升高,蛋白质得率呈缓慢下降的趋势。等高线图显示,沿pH的等高线比较密集,说明pH对蛋白质得率的影响更显著。而等高线图部分弯曲,表明pH和温度两个因素存在交互作用且影响显著(P<0.05)。由图2中B1和B2可知,随着料液比的增加,蛋白质得率显著升高(P<0.05)。等高线显示,沿料液比等高线比较密集,因此料液比对蛋白质得率的影响比温度显著。等高线呈椭圆形,表明料液比和温度两个因素的交互作用高度显著(P<0.01)[20]。由图2中C1和C2可知,随着温度的升高,蛋白质得率显著下降(P<0.05),而时间的变化对蛋白质得率无显著影响。等高线图显示,沿时间方向等高线比较密集,表明时间对蛋白质得率的影响显著。而等高线呈马鞍形,表明时间和温度两个因素的交互作用较强,影响极显著(P<0.001)[21]。
2.2.4 响应面优化及验证实验
通过回归模型分析,确定最佳工艺条件:pH为9.92,温度为38.48 ℃,料液比为1∶9.53,时间为58.42 min,预测蛋白质得率为22.76%。为方便实验操作,将工艺参数调整为pH 10、温度40 ℃、料液比1∶10、时间60 min,在此条件下进行验证实验,TBBP得率为(22.09±0.37)%,CBBP得率为(22.34±0.45)%,与最佳条件下预测值接近,证明该优化实验结果可靠,模型适用于蛋白质的提取。
2.3 蛋白质功能特性结果与分析
在响应面优化最佳工艺条件下制备TBBP和CBBP,以SPI为参照,考察不同温度及pH对蛋白质功能特性的影响。
2.3.1 蛋白质溶解性结果与分析
由图3中A可知,随着温度的升高,TBBP和CBBP的溶解性整体呈增加的趋势,在100 ℃时达到最大溶解性,分别为30.27%和48.95%,而SPI在60 ℃时的溶解性最大,为32.71%,而温度过高或者过低,SPI的溶解性显著降低。表明高热处理对TBBP和CBBP的影响小于SPI,不易导致荞麦蛋白的过度聚集,致使蛋白质的溶解性降低。
由图3中B可知,当pH在蛋白质等电点附近(pH=4.2)时,SPI、TBBP和CBBP的溶解性均达到最低值,分别为4.77%、6.78%和3.49%,这一特性与大多谷物蛋白相似,如燕麦蛋白[22]。而当pH>4时,蛋白质的溶解性均显著增强,其中,TBBP和CBBP的溶解性较相近,且显著高于SPI,这是因为当pH远离等电点时,荞麦蛋白分子的電荷和静电排斥力会增加,从而促使蛋白质与水分子结合,进而展现出较高的溶解性[23]。
2.3.2 蛋白质持水性结果与分析
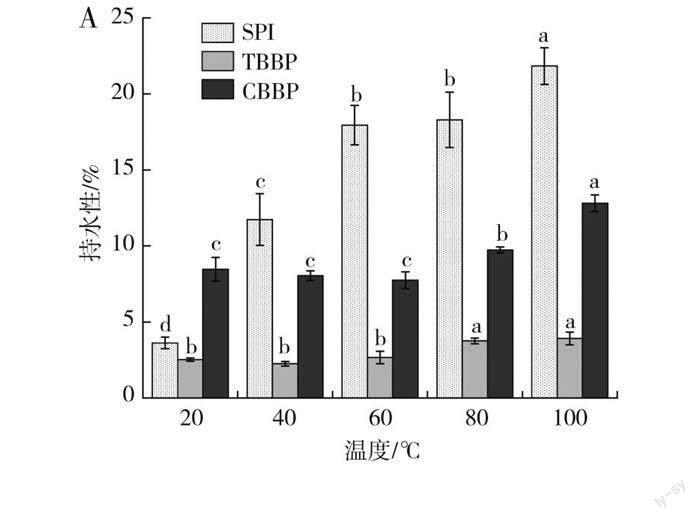
不同温度和pH对蛋白质持水性的影响见图4。
由图4中A可知,3种蛋白在100 ℃时持水性均达到最大值。其中SPI的持水性增加最剧烈(从3.62%增加至21.84%),而在60 ℃时,TBBP和CBBP的持水性呈阶梯式增加,分别从2.66%和7.74%增加到3.92%和12.81%。这是由于随着温度升高,分子热运动更加剧烈,使水分子在蛋白质体系中的分布更加均匀,促使蛋白质与水结合的速度加快。此外,高温处理亦会使包裹在球状蛋白质分子内部的极性侧链发生解离,转向蛋白质分子表面,从而提高了蛋白质的持水性[24]。
由图4中B可知,SPI的持水性随着pH的增加呈先降低后升高的趋势,而TBBP和CBBP的持水性在pH<4时无显著差异,之后随着pH的增加呈上升趋势,这是因为随着pH值远离等电点,蛋白质与水分子间的结合能力逐渐增强。其中,TBBP和CBBP的持水性远低于SPI,这归因于它们的表面疏水性差异。当pH=4时,SPI、TBBP和CBBP的持水能力相近且均为最小值,分别为5.58%、4.25%和4.89%,这一现象与紫苏籽粕蛋白的报道相似[25],这是由于在等电点附近时,蛋白质分子之间不存在静电斥力,分子间引力增强,促进蛋白质分子间的相互结合,导致蛋白质与水分子的结合能力减弱。
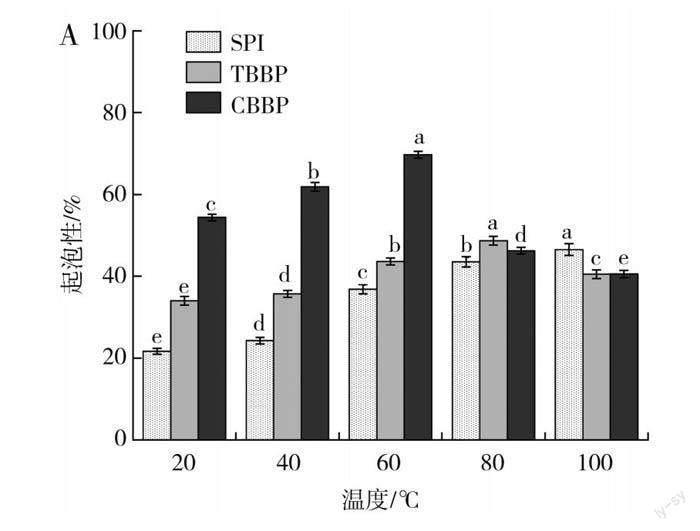
2.3.3 蛋白质起泡性和泡沫稳定性结果与分析
由图5中A和C可知,随着温度的升高,SPI的起泡性显著增加,在100 ℃时起泡性达到最大值(43.54%),其泡沫稳定性在60 ℃时达到最大值,为65.71%。随着温度升高,CBBP和TBBP的起泡性及泡沫稳定性整体呈现先上升后下降的趋势,起泡性分别在60 ℃和80 ℃时最高,为69.73%和48.67%。当温度低于60 ℃时,CBBP的起泡性远高于其余两种蛋白,这是因为温度较低时,蛋白质分子间运动减缓,蛋白质的黏度增加,因而表现出良好的起泡性[26]。当温度升高时(>60 ℃),蛋白质的黏度下降,因而TBBP和CBBP溶液的起泡性及泡沫稳定性均显著下降。
由图5中B和D可知,蛋白质溶液的起泡性及泡沫稳定性随着pH的增加均呈先下降后上升的趋势。当pH在2~4时,SPI、TBBP和CBBP的起泡性显著降低(分别从54.15%、38.90%和90.80%降低至19.07%、12.95%和17.77%),而当pH>4时,蛋白质溶液的起泡性均显著升高。这是因为只有蛋白质的可溶性部分参与泡沫的形成,因此在等电点附近(pH=4.2)蛋白质的起泡性能减弱,极酸或碱性条件下蛋白质的溶解性增大,而使得蛋白质溶液的起泡性能增强并逐渐趋于平稳[27]。其中,CBBP的起泡性升高最显著,而TBBP的泡沫稳定性则高于其余两种蛋白。因此,与SPI相比,极酸(pH=2)或碱性(pH≥8)条件下,CBBP展现出良好的起泡性(>91%),但泡沫稳定性欠佳(<9%);而TBBP的起泡性较差(<39%),但泡沫稳定性较好(>69%)。
2.3.4 蛋白质乳化性和乳化稳定性结果与分析
由图6中A和C可知,随着温度的升高,3种蛋白质的乳化性均呈现先升高后降低的趋势。SPI和CBBP的乳化性波动显著,两者在80 ℃时乳化性最高,分别为8.41 m2/g和8.86 m2/g,而TBBP的乳化性在60 ℃时最高,为4.76 m2/g。这可能是因为适当的加热可以使蛋白质结构舒展,暴露出更多的疏水基团,提高蛋白质分子的柔软性和表面疏水能力,使得蛋白质更容易吸附到油-水界面,从而使蛋白质的乳化性提高[24]。随着温度继续升高,蛋白质的乳化性均显著下降,并且TBBP和CBBP表现出较低的乳化性,这是因为高温导致蛋白质发生变性而聚集,使蛋白质分子的疏水性与亲水性的比值减小,从而影响蛋白质的乳化性[28]。
由图6中B和D可知,蛋白质的乳化性及乳化稳定性在pH为4时均达最低值,此时SPI、TBBP和CBBP的乳化性分别为1.77,2.17,0.88 m2/g。当pH为6~8时,TBBP和CBBP的乳化性及乳化稳定性显著升高,并且CBBP的乳化性及乳化稳定性显著高于其他两种蛋白,这与pH对蛋白质的溶解性影响规律基本一致(见图3中B),即在接近等电点时,蛋白质分子表面的正负电荷数量基本相同,分子间作用力较小,乳化微粒间相互碰撞发生聚集沉淀,导致蛋白质的乳化性降低[29]。当pH远离蛋白质等电点后,氨基酸侧链发生解离,产生静电排斥力,避免了蛋白质的聚集,从而表现出良好的乳化性和乳化稳定性[30]。
3 結论
本实验采用碱提酸沉的方法从荞麦麸皮中提取蛋白质,先通过单因素实验对TBBP的提取条件进行初步优化,在此基础上进行四因素三水平的响应面实验,确定提取的最优工艺参数:pH为10,料液比为1∶10,时间为60 min,温度为40 ℃,在此条件下TBBP的得率为(22.09±0.37)%,CBBP得率为(22.34±0.45)%,接近预测值,表明提取工艺条件可靠,可用于蛋白质的提取。
在此工艺条件下制备TBBP和CBBP,并探究不同温度及pH对两种蛋白功能特性的影响。结果发现,随着温度的升高,两种蛋白的溶解性及持水性均呈现增加趋势,在60~80 ℃时,两种蛋白展现出较好的起泡性和乳化性,且稳定性较好。过高的温度会导致蛋白质聚集,黏度下降,从而使得两者的起泡性和乳化性降低。当pH在等电点附近时(pH=4.2),蛋白质的溶解性、持水性、起泡性及泡沫稳定性、乳化性及乳化稳定性均最低。碱性环境(pH≥8)可提高蛋白质的溶解性、持水性、乳化性和乳化稳定性。与SPI相比,极酸(pH=2)或碱性(pH≥8)条件下,CBBP展现出良好的起泡性(>91%),但泡沫稳定性欠佳(<9%),而TBBP的起泡性较差(<39%),但泡沫稳定性较好(>69%)。综上所述,适当的加热处理及碱性环境可改善TBBP和CBBP的功能特性,后续可针对荞麦蛋白展现的功能特性差异进行深层次研究。
参考文献:
[1]FABIIO A D, PARRAGA G. Origin, Production and Utilization of Pseudocereals[M]//Pseudocereals: Chemistry and Technology,Hoboken:Wiley Blackwell,2017:1-27.
[2]TMSKZI S, LANG B. Buckwheat: Its Unique Nutritional and Health-Promoting Attributes[M]//Gluten-Free Ancient Grains,Cambridge:Woodhead Publishing,2017:161-177.
[3]QIN P, WANG Q, SHAN F, et al. Nutritional composition and flavonoids content of flour from different buckwheat cultivars[J].International Journal of Food Science & Technology,2010,45(5):951-958.
[4]ZHU F. Buckwheat starch: structures, properties, and applications[J].Trends in Food Science & Technology,2016,49:121-135.
[5]PULIGUNDLA P, LIM S.Buckwheat noodles: processing and quality enhancement[J].Food Science and Biotechnology,2021,30:1471-1480.
[6]KOWALSKI S, MIKULEC A, MICKOWSKA B, et al. Nutritional properties and amino acid profile of buckwheat bread[J].Journal of Food Science and Technology,2022,59(8):3020-3030.
[7]BRITES L T G F, ORTOLAN F, SILVA D W, et al. Gluten-free cookies elaborated with buckwheat flour, millet flour and chia seeds[J].Food Science and Technology,2018,39:458-466.
[8]WANG J, XIAO J, LIU X, et al. Analysis of tartary buckwheat (Fagopyrum tataricum) seed proteome using offline two-dimensional liquid chromatography and tandem mass spectrometry[J].Journal of Food Biochemistry,2019,43(7):12863.
[9]ZHOU Y, OUYANG B, DU L, et al. Effects of ultra-high-pressure treatment on the structural and functional properties of buckwheat 13S globulin[J].Food Science and Human Wellness,2022,11(4):895-903.
[10]JANSSEN F, PAULY A, ROMBOUTS I, et al. Proteins of amaranth (Amaranthus spp.), buckwheat (Fagopyrum spp.), and quinoa (Chenopodium spp.): a food science and technology perspective[J].Comprehensive Reviews in Food Science and Food Safety,2017,16(1):39-58.
[11]JIN J, OHANENYE I C, UDENIGWE C C. Buckwheat proteins: functionality, safety, bioactivity, and prospects as alternative plant-based proteins in the food industry[J].Critical Reviews in Food Science and Nutrition,2022,62(7):1752-1764.
[12]WU L, LI J, WU W, et al. Effect of extraction pH on functional properties, structural properties, and in vitro gastrointestinal digestion of tartary buckwheat protein isolates[J].Journal of Cereal Science,2021,101:103314.
[13]YU Y, LIANG G, WANG H. Interaction mechanism of flavonoids and tartary buckwheat bran protein: a fluorescence spectroscopic and 3D-QSAR study[J].Food Research International,2022,160:111669.
[14]DU M, XIE J, GONG B, et al. Extraction, physicochemical characteristics and functional properties of mung bean protein[J].Food Hydrocolloids,2018,76:131-140.
[15]周小理,侍榮华,周一鸣,等.热处理方式对苦荞蛋白功能特性的影响[J].农业工程学报,2018,34(9):292-298.
[16]KAUSHIK P, DOWLING K, MCKNIGHT S, et al. Preparation, characterization and functional properties of flax seed protein isolate[J].Food Chemistry,2016,197:212-220.
[17]BI B, YANG H, FANG Y, et al. Characterization and emulsifying properties of β-lactoglobulin-gum Acacia seyal conjugates prepared via the Maillard reaction[J].Food Chemistry,2017,214:614-621.
[18]HAMMI K M, JDEY A, ABDELLY C, et al. Optimization of ultrasound-assisted extraction of antioxidant compounds from Tunisian Zizyphus lotus fruits using response surface methodology[J].Food Chemistry,2015,184:80-89.
[19]DAILEY A, VUONG Q V. Optimization of aqueous extraction conditions for recovery of phenolic content and antioxidant properties from macadamia (Macadamia tetraphylla) skin waste[J].Antioxidants,2015,4(4):699-718.
[20]XU D P, ZHENG J, ZHOU Y, et al. Ultrasound-assisted extraction of natural antioxidants from the flower of Limonium sinuatum:optimization and comparison with conventional methods[J].Food Chemistry,2017,217:552-559.
[21]WANG W, MA X, XU Y, et al. Ultrasound-assisted heating extraction of pectin from grapefruit peel: optimization and comparison with the conventional method[J].Food Chemistry,2015,178:106-114.
[22]李玉娥,王愈,陈振家.燕麦分离蛋白的提取及功能性测定[J].粮油食品科技,2018,26(4):31-35.
[23]魏君慧,薛媛,冯莉,等.杏鲍菇分离蛋白和清蛋白的理化性质及功能分析[J].食品科学,2018,39(18):54-60.
[24]ZHAO Q, HONG X, FAN L, et al. Solubility and emulsifying properties of perilla protein isolate: improvement by phosphorylation in the presence of sodium tripolyphosphate and sodium trimetaphosphate[J].Food Chemistry,2022,382:132252.
[25]范三红,贾槐旺,张锦华,等.不同提取方法对紫苏籽粕蛋白功能性质的影响[J].中国调味品,2021,46(12):61-69.
[26]LIU Y, ZHAO G, ZHAO M, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J].Food Chemistry,2012,131(3):901-906.
[27]MA K K, GREIS M, LU J, et al. Functional performance of plant proteins[J].Foods,2022,11(4):594.
[28]NISHINARI K, FANG Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsification[J].Food Hydrocolloids,2014,39:301-318.
[29]WANG S, XU X, WANG S, et al. Effects of microwave treatment on structure, functional properties and antioxidant activities of germinated tartary buckwheat protein[J].Foods,2022,11(10):1373.
[30]HOUDE M, KHODAEI N, BENKERROUM N, et al. Barley protein concentrates: extraction, structural and functional properties[J].Food Chemistry,2018,254:367-376.
收稿日期:2023-06-24
基金項目:国家自然科学基金青年基金项目(32202096);河南省重点研发与推广专项(科技攻关)(232102110159);教育部产学合作协同育人项目(220503880205011);河南省重大公益专项(201300110300);河南科技大学博士科研启动基金(13480082)
作者简介:王立博(1988—),男,讲师,博士,研究方向:谷物科学与利用。
*通信作者:罗登林(1976—),男,教授,博士,研究方向:食品营养与健康。

