散结片联合立体定向放射治疗对肝癌大鼠肿瘤组织中PKM2/STAT3通路及巨噬细胞极化的影响*
董 晶 张 远 徐振华 时 桢 国 滨△ 李金芳 陈自力
1.广州中医药大学金沙洲医院 (广东 广州, 510080) 2.寿光市人民医院肿瘤放疗科 3.贵州医科大学附属医院
肝癌起病隐匿,发现时多为中晚期,治疗难度大,患者大多预后不良。放射治疗曾是肝癌非手术治疗的首选,随着立体定向放射治疗的临床应用,肝癌的疗效有了进一步提高。散结片是中药复方片剂,经过数年的药理学研究及体外、动物实验观察,证实本品对肝癌细胞有显著的杀伤力及抑制作用,并在临床应用中取得了显著的疗效。巨噬细胞有M1型(杀伤肿瘤)与M2型(促进肿瘤)两种极化类型,肿瘤为逃避巨噬细胞的杀伤作用,可迫使其极化状态发生改变,以促进肿瘤发展。此外,许多类型的癌细胞以糖酵解的方式来增加葡萄糖摄取,丙酮磷酸激酶(PK)是糖酵解途径中的限速酶之一,PKM2为肿瘤的增殖、转移提供了优势[1],并可通过磷酸化信号转导和转录激活因子3(STAT3)促进癌细胞转移[2]。近年来,中药联合放疗对肿瘤治疗的研究逐渐增加,本研究运用散结片联合立体定向放射治疗肝癌大鼠,观察联合治疗对肝癌大鼠肿瘤组织中PKM2/STAT3信号通路及巨噬细胞极化的影响。
1 材料和方法
1.1 实验动物与分组 大鼠肝癌RH-35细胞购自上海一研生物公司。健康SD雄性大鼠50只, 6~8周龄,体质量220~320 g,购自南京协同生物公司[动物合格证号:SCXK(苏)2018-0125] ,常规饲养,自由饮食饮水。实验大鼠按照随机数字表法分为健康组(健康大鼠正常喂养)、肝癌组(肝癌模型大鼠)、散结片组(模型大鼠+散结片)、放疗组(模型大鼠+定向放疗)、联合组(模型大鼠+散结片+定向放疗),每组10只。
1.2 药物与试剂 散结片(珠海米迪泰克生物公司,国药准字:Z20040106)。TUNEL工作液(苏州玉衡生物公司),细胞周期性蛋白(CyclinD1)、细胞周期性蛋白依赖激酶(CDK4)引物(武汉淼灵生物公司),PKM2、STAT3、p-STAT3一抗(北京百奥莱博科技公司),M1型巨噬细胞标志蛋白(CD11c)、M2型巨噬细胞标志蛋白(CD206)一抗(深圳海思安生物公司),辣根过氧化物酶二抗(河北鹏宇生物有限公司),戊巴比妥钠(台州浩博生物公司)。
1.3 模型建立及治疗方法 健康组大鼠常规饲养,剩余大鼠接受0.5 ml(2×106个/ml)RH-35细胞肝小叶内注射,制成肝癌模型大鼠[3]。模型建立成功后,模型组大鼠进行常规饲养;放疗组大鼠肿瘤直径>1 cm时腹腔麻醉后行CT定位,经治疗计划系统进行靶区规划及靶点设计,给予40 Gy剂量1次性照射。散结片组大鼠给予12.5 g/kg散结片灌胃,给药10 d;联合组大鼠在定位放疗的基础上给予12.5 g/kg散结片灌胃,给药10 d。
1.4 检测指标
1.4.1 HE染色观察肝癌大鼠病理组织形态 各组大鼠戊巴比妥钠麻醉后处死,取出肝脏组织,放于组织固定液中固定72 h,其余部分于-80℃保存。10%甲醛固定后乙醇脱水、透明石蜡包埋、常规切片,然后将石蜡切片进行透明水化,并进行HE染色,最后以中性树胶封片,封片后在偏光显微镜下观察大鼠肝脏组织中的病理改变。
1.4.2 TUNEL检测肝癌细胞凋亡 各组大鼠肝癌组织切片脱蜡,蛋白酶K室温孵育15~30 min,PBS清洗后加入TUNEL检测液(TdT荧光标记),室温避光孵育1 h,PBS冲洗3次。滴加50 μl convertr-POD,室温避光孵育0.5 h。PBS清洗,DAB液显色,冲洗,苏木精复染,脱水透明,封片。荧光显微镜下观察,计数阳性细胞。
1.4.3 RT-PCR检测实验大鼠肝组织癌细胞增殖相关基因CyclinD1、CDK4 mRNA表达水平 取肝癌组织,剪碎、研磨后加入1 ml Trizol试剂,匀浆机匀浆8 min左右,加入0.2 ml三氯甲烷摇匀,常温放置15 min后4℃、12 000 r/min离心15 min,取上清;加入0.5 ml异丙醇混匀,静置5~10 min,4℃、10 000 r/min离心10 min,弃上清;加入75%乙醇重悬沉淀,4℃、10 000 r/min离心10 min,干燥室干燥5 min,溶解于无RNA酶的水中。将提取的RNA逆转录为cDNA后进行PCR反应,反应条件为:94℃ 5 min,94℃ 30 s、55℃(CDK4退火温度为56℃)30 s、72℃ 1 min,30个循环,72℃延伸5 min。引物序列见表1。反应产物进行琼脂糖凝胶电泳,紫外透射仪观察、拍照,并分析目的基因相对表达量。

表1 PCR引物序列
1.4.4 免疫组化检测实验大鼠肝组织CD11c、CD206水平 各组大鼠肝脏组织用4%多聚甲醛固定,石蜡包埋、切片,经脱蜡、水化、封闭、抗原修复、封闭后,37℃放置30 min,滴加稀释的CD11c、CD206一抗(1∶200),4℃孵育过夜。次日依操作顺序加入二抗及SABC,室温DAB显色,封片后显微镜观察。
1.4.5 免疫印迹检测实验大鼠肝组织PKM2、STAT3、p-STAT3水平 各组大鼠肝癌组织剪碎、过滤,离心后重悬沉淀,制备细胞悬液,使用RIPA溶液从细胞中提取总蛋白,BCA法测定蛋白浓度。SDS-PAGE凝胶电泳后转膜,5%脱脂牛奶封闭1 h 后,分别加入PKM2、STAT3、p-STAT3一抗(1∶500) 4℃孵育过夜。TBST洗涤5 min,洗涤3次后加入辣根过氧化物酶二抗(1∶1 500)室温孵育1 h。洗膜后加入ECL工作液,获取图像并进行相对表达量分析。
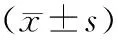
2 结果
2.1 实验大鼠肝组织病理改变情况 健康组大鼠肝细胞排列有序,形态正常;肝癌组大鼠肝癌细胞生长旺盛,细胞核大小不一,总体上细胞生长分布均匀且紧密,肿瘤组织间隙有大量毛细血管分布。散结片组、放疗组、联合组大鼠肿瘤细胞有不同程度的空泡,肿瘤组织的排列更为疏松,癌细胞有所减少。见图1。

图1 实验大鼠肝组织病理改变情况 (HE染色,200×)
2.2 实验大鼠肝癌细胞凋亡情况 肝癌组大鼠肝癌细胞凋亡率显著低于散结片组[(35.42±4.22)%,t=23.410,P<0.001],散结片组大鼠肝癌细胞凋亡率与放疗组较为接近[(36.83±3.71)%,t=0.794,P=0.438],放疗组大鼠肝癌细胞凋亡率低于联合组[(48.76±5.93)%,t=5.393,P<0.001]。见图2。

图2 实验大鼠肝癌细胞凋亡情况 (TUNEL,TdT荧光标记, 200×)
2.3 实验大鼠肝组织CyclinD1、CDK4 mRNA表达水平 见表2。

表2 实验大鼠肝组织CyclinD1、CDK4 mRNA表达水平
2.4 实验大鼠肝组织CD11c、CD206表达情况 见图3、表3。

图3 实验大鼠肝组织CD11c、CD206表达情况 (免疫组化染色,400×)
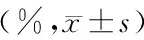
表3 实验大鼠肝组织CD11c、CD206表达情况
2.5 实验大鼠肝组织PKM2 、STAT3、p-STAT3表达情况 见表4,图4。

图4 实验大鼠肝组织PKM2 、STAT3、p-STAT3表达情况

表4 实验大鼠肝组织PKM2、STAT3、p-STAT3表达情况
3 讨论
近几年我国肝癌患者新发病例中死亡人数占新发病例的近4/5[4]。肝癌的病死率较高,威胁患者生命,常见的治疗方法为放疗,放疗会产生一定的抵抗性,长时间使用效果会减弱,中药安全性较高,无毒副作用。因此本文研究散结片联合立体定向放射治疗对肝癌大鼠肿瘤组织中PKM2/STAT3信号通路及巨噬细胞极化的影响。
体内肿瘤发生于细胞增殖和凋亡调控机制失调时,因而细胞凋亡是机体维持平衡的一个关键环节,因此促进肝癌凋亡可以达到治疗效果。广泛应用于临床的放疗及化疗均主要通过诱导肿瘤细胞凋亡发挥疗效。肝脏对放疗的耐受较低,但癌细胞需高照射剂量才可杀死,因此,常规的放疗对肝癌的治疗受限。立体定向放疗可精准定位,大剂量集束照射病变区,杀死肿瘤细胞,并减少其对周围组织的损伤。但放疗存在一定的副作用,影响患者预后。中西医结合在避免局部复发、提高患者生存质量方面具有一定的优势。散结片可直接作用于肝癌细胞膜系结构,在短时间内造成肝癌细胞崩溃碎裂,对肝癌细胞的杀伤作用较为显著。散结片主要包含白附子、白鲜皮、牛黄,具有清热解毒、活血化瘀、软坚散结的作用,肝癌主要病机是气滞血瘀、湿热瘀毒、肝肾阴虚。本文通过TUNEL实验发现,在放疗的基础上联合散结片促进肝癌细胞凋亡的效果明显好于单一治疗的效果。此外,联合组肿瘤组织的排列更为疏松,癌细胞有所减少,空泡增加。有研究发现PKM2可通过促进STAT3磷酸化诱导乳腺癌细胞癌转移[5]。STAT3 是 STAT家族成员之一,在各种癌症中被激活。STAT3被磷酸化后,具有转录调控的作用。在本文中,肝癌大鼠体内PKM2、STAT3水平明显高于正常组,在经过治疗后降低,以联合组效果最为显著。邓秋媛等[6]研究发现,通过抑制PKM2/STAT3信号通路水平可抑制肝内胆管癌细胞的转移并促进癌细胞凋亡。刘晶等[7]提出,抑制STAT3表达可提高肝癌细胞对化疗药物的敏感性,并促进癌细胞的凋亡。另有研究表明,散结片中的牛黄可促进肝癌细胞的凋亡并抑制增殖[8]。本研究与上述研究结果相似,联合组可能是通过抑制PKM2/STAT3通路水平,促进肝癌细胞凋亡。
Cyclins是细胞周期机制的核心之一,对细胞周期有正调控作用。CyclinD1与CDK4结合形成CyclinD1/CDK4复合物,正向调控癌细胞,促使细胞分裂。当处于静止期G0的细胞受刺激后首先出现cyclinDl,并同时诱导CDK4等的表达,结合成相应的CyclinDl/CDK4复合体,作用于下游蛋白,促使细胞分裂。Rb是一种抑癌基因,可以通过调控细胞周期G1期的控制点来抑制细胞增殖。CyclinDl/CDK4复合物可以使Rb磷酸化,磷酸化的Rb促进DNA转录,并调节DNA的复制和DNA损伤修复,使细胞通过限制点进入S期,诱导肿瘤发生。在本文中,经过放疗及散结片的治疗,Cyclins、CDK4水平降低,且以联合组效果更佳。刘波等[9]研究发现,Smad通路通过抑制CyclinDl、CDK4水平,促进了肝癌细胞的凋亡并抑制了增殖。Okabe等[10]研究发现,STAT3、CyclinD1呈正相关关系,在胸腺上皮质瘤中均高表达,降低STAT3后通过抑制CyclinD1水平,减少癌细胞增殖。本研究与上述研究结果相似,放疗联合散结片可能是通过抑制STAT3通路,从而降低CyclinD1水平,调控细胞周期,抑制肝癌细胞增殖。
巨噬细胞是体内重要的免疫细胞,当体内产生炎症反应时,其依据体内环境的变化可分化成不同的细胞表型,进而表达相应的细胞功能,此过程称为巨噬细胞的极化。不同巨噬细胞表型可通过特异标志物鉴定,目前多将CD11c作为M1型巨噬细胞极化的标志,将CD206作为M2型巨噬细胞极化的标志。M1型巨噬细胞具有抑制肿瘤增殖和侵袭的作用;M2型巨噬细胞具有促进肿瘤细胞增殖和侵袭的作用。本研究结果显示,与健康大鼠相比,肝癌大鼠中CD11c水平降低、CD206水平升高,在经过定向放疗及散结片的干预后,CD11c水平升高、CD206水平降低,且以联合组效果更好,提示散结片联合定向放疗可有效抑制M2型巨噬细胞极化,促进M1型局势细胞极化。 STAT3是联系炎症与肿瘤的重要因子,STAT3参与肿瘤血管生成、侵袭转移等恶性生物学行为。在与炎症相关的肿瘤中,如结肠癌及神经系统淋巴瘤中,M2型巨噬细胞能够促进肿瘤细胞中STAT3的活化,从而引发一系列致癌信号的激活[11,12]。M2型巨噬细胞分泌大量的细胞因子,这些因子同时也是STAT3信号活化的重要参与者。M2型巨噬细胞可正向调节肝癌细胞中STAT3水平,肝癌细胞株中STAT3蛋白磷酸化水平在与M2型巨噬细胞共培养后明显增高。毕建强等[13]报道,放疗通过降低STAT3及NF-κB水平,抑制鼻咽癌大鼠瘤体增加,并促进癌细胞凋亡。白鲜皮是散结片中的一味中药,吴丽美[14]研究发现,白鲜皮可通过降低STAT3水平,改善肝纤维化。因此本文推测,散结片联合定向放疗抑制了PKM2/STAT3信号通路,降低了CD206表达,从而抑制细胞向M2型转化,又通过促进CD11c表达,促使巨噬细胞向M2型转化,从而起到促进癌细胞凋亡并抑制增殖的作用。
综上所述,散结片联合定向放疗可能通过抑制PKM2/STAT3通路,促进巨噬细胞M1型极化并抑制其M2型极化,促进肝癌细胞的凋亡并抑制其增殖。

