丝素蛋白/壳聚糖复合纤维膜的制备与应用
雷彩虹, 俞林双, 金万慧, 朱海霖, 陈建勇
(1. 浙江理工大学 纺织科学与工程学院(国际丝绸学院), 浙江 杭州 310018; 2. 浙江省现代纺织技术创新中心, 浙江 绍兴 312000; 3. 湖北省纤维检验局, 湖北 武汉 430000)
丝素蛋白(SF)是一种来源于蚕丝的大分子蛋白质[1],由甘氨酸、丙氨酸和丝氨酸等多种氨基酸组成,具有良好的生物相容性和生物降解性,以及一定的抗炎作用[2]。近年来,丝素基生物材料已在创伤修复领域得到了很多研究与应用[3],成为伤口敷料应用的优先选择材料[4]。单一的丝素基生物材料的抗菌性能弱,限制了其在创面敷料中的应用[5]。壳聚糖(CS)是一种由天然多糖脱除部分乙酰基得到的材料,具有无毒性、良好的生物相容性和较强的抗菌性[6],在医用敷料领域具有广泛的应用[7]。
静电纺丝制备的纤维膜呈现出相互连接的网状结构,具有可调节的孔隙率和较好的生物相容性[8],不仅利于细胞呼吸增殖,加速创面愈合,其较大的比表面积又能增加吸水量,可有效提高止血效率[9]。赵新哲等[10]将胶原蛋白与聚氧化乙烯(PEO)在盐酸溶液中混合,通过静电纺丝制得一种新型的止血敷料。Li等[11]用静电纺丝制备苯丙氨酸基聚酯脲复合纳米纤维膜,其具有良好的细胞相容性和血液相容性,对大肠杆菌和金黄色葡萄球菌均具有很好的抑制作用,以及减少伤口二次感染的可能性。Varshney等[12]利用静电纺丝技术制备丝素蛋白/大豆分离蛋白共混膜,大鼠全层皮肤损伤实验表明该共混膜有利于伤口愈合,能够促进组织再生。由此可见,静电纺丝技术是一种制备功能性纤维膜的高效方法,在创伤敷料领域具有很大的发展潜能,可开发出优异性能的纤维膜材料。
本文以壳聚糖为生物抗菌剂,以六氟异丙醇和三氟乙酸为溶剂分别溶解丝素蛋白和壳聚糖,制备混合纺丝溶液;最后利用静电纺丝技术制备得到复合纤维膜,并研究其微观形貌、吸水率、止血性能和抗菌性能,以期开发一种具有良好止血效果和抗菌效果的丝素基纤维膜材料,为开发新的丝素基伤口敷料提供参考。
1 实验部分
1.1 实验材料
蚕茧,浙江米赛丝绸有限公司;六氟异丙醇(99.5%)、三氟乙酸,上海晶纯生化科技股份有限公司;壳聚糖(黏度为100~200 mPa·s),国药集团化学试剂有限公司;无水碳酸钠、无水氯化钙、无水乙醇、氯化钠,分析纯,杭州高晶化工有限公司;磷酸盐缓冲液(PBS,pH值为7.2~7.4),上海阿拉丁生化科技股份有限公司;新西兰兔血,杭州赛洛进生物科技有限公司;营养琼脂、酵母浸粉、蛋白胨,杭州百思生物技术有限公司;金黄色葡萄球菌标准菌株(ATCC 6538)、大肠杆菌标准菌株(ATCC 11229),上海鲁微科技有限公司;灭菌级医用止血纱布敷料,南昌市奥康医疗器械有限公司。
1.2 丝素蛋白/壳聚糖复合纤维膜的制备
丝素蛋白的制备[13]:将蚕茧在2%碳酸钠溶液中于98 ℃脱胶3 h后,取出用去离子水冲洗直至没有腻滑感,再于60 ℃烘干,密封备用;然后,按1∶50的浴比将洗净后的蚕丝加入三元溶液CaCl2/CH3CH2OH/H2O(量比为1∶2∶8)中在98 ℃下溶解3 h,在室温下冷却后置于凯特TG18 G台式高速离心机中,以1 200 r/min的速度进行离心,15 min后取出上清液抽滤;将抽滤完的清液倒入透析袋中在去离子水中透析3 d,每隔12 h更换一次去离子水,得到丝素蛋白溶液;最后,在-80 ℃下对丝素蛋白溶液进行冷冻干燥3 d后得到纯丝素蛋白[14]。
纺丝液的配制:以六氟异丙醇为溶剂,配制质量分数为12%的丝素蛋白溶液;同时以三氟乙酸为溶剂,配制质量分数为3%的壳聚糖溶液;根据丝素蛋白与壳聚糖质量比(10∶0、10∶1、5∶1、10∶3、5∶2)配制不同的丝素蛋白/壳聚糖(SF/CS)混合液,磁力搅拌12 h,静置消泡,即得到丝素蛋白/壳聚糖纺丝液。
静电纺丝制备SF/CS复合纤维膜:将SF、SF/CS纺丝液倒入一次性注射器内,用内径为0.84 mm的不锈钢点胶针头作为喷射口,注射泵推进速度为0.5 mL/h,电压设置为15 kV,针头与滚轴的接收距离为10 cm,纺丝时间为2 h,利用JDF05静电纺丝机,采用硅油纸包裹滚轴的方式收集复合纤维膜。静电纺丝过程中电压和接收距离可进行微调,最后将制得的SF/CS复合纤维膜用75%乙醇浸泡1 h后取出,室温自然干燥。纯丝素蛋白纤维膜(质量比为10∶0)样品记为SF,质量比为10∶1、5∶1、10∶3、5∶2的SF/CS复合纤维膜样品依次记为SF/CS1、SF/CS2、SF/CS3、SF/CS4。
1.3 表面形貌观察
将样品平铺在导电胶上镀金处理,通过JSM-5610LV场发射扫描电子显微镜对其表面形貌进行观测,设置电压为5 kV。通过 Image-Pro Plus 6.0 软件在电镜照片中随机选取100根纤维进行测量并计算平均直径及方差。
1.4 化学结构测试
采用Nicolet is50傅里叶变换红外光谱仪分析不同复合纤维膜样品的化学结构,测试范围为 4 000~500 cm-1。
1.5 吸水率测试
吸水率是评价材料体外止血性能的重要指标[15]。首先,将各样品剪成3 cm×3 cm的正方形,称取质量记为md(g)。然后,将样品分别放入10 mL的PBS溶液中,在室温下静置24 h后取出,除去样品表面多余的水后称取质量,记为mW(g)。以止血纱布为对照,每组样品测量3次取平均值。样品吸水率(W)的计算公式为
1.6 体外凝血指数测试
体外凝血指数(BCI)是衡量材料止血效果的重要指标。当血液接触材料时会使血液凝结,当未凝固的血液遇到水时,红细胞会吸收水分而破裂释放血红蛋白,因此,采用DR3900台式可见分光光度计测定上清液的血红蛋白浓度,计算凝血指数[16]。将50 mg样品放入离心管中,在37 ℃的恒温培养箱中孵育5 min,然后在离心管中加入100 μL新西兰兔血。将相同体积的兔血放入含有50 mg止血纱布的离心管中作为对照;另取离心管,其中不加任何样品加入等量兔血作为阴性对照。孵育后立即将20 μL 0.2 mol/L CaCl2溶液加到离心管中,5 min后加入25 mL去离子水,在50 r/min、37 ℃下振荡5 min,振荡后取适量上清液,采用台式可见分光光度计在545 nm下测定上清液的紫外吸光度。实验组和对照组每组样品测量3次取其平均值。样品的体外凝血指数SBCI计算公式为
式中:A1为各组样品测得的紫外吸光度;A0为阴性对照组的紫外吸光度。
1.7 体外凝血时间测试
体外凝血时间是指材料接触血液到血液完全凝固时所需要的时间,表征材料促进血液凝固的能力,时间越短表明其止血效果较好[17]。将20 mg样品放在试管中,于37 ℃预热5 min后加入1 mL新西兰兔血,于37 ℃恒温孵育3 min,然后加入500 μL 25 mmol/L CaCl2溶液,记录直至倒置试管血液不流动时的时间,即为凝血时间。将未添加样品的空白组作为对照组,采用同样的处理方式进行测试。每组测量3次取平均值。
1.8 抗菌性能测试
参照 GB/T 20944.1—2007 《纺织品 抗菌性能的评价 第1部分:琼脂平皿扩散法》和 GB/T 20944.3—2008 《纺织品 抗菌性能的评价 第3部分:振荡法》,对样品的抗菌性能进行测试。检测菌种选用金黄色葡萄球菌和大肠杆菌,样品的抗菌性能以抑菌圈直径和抑菌率表征。
抑菌圈直径:将液态的无菌琼脂培养基倒入培养皿中,待其冷却固化后,取适量菌液在平板上均匀地涂板,并将复合纤维膜制成直径为6 mm的圆形试样,分别置于培养皿的中间位置,于37 ℃恒温密封培养;24 h后用游标卡尺测定抑菌圈直径的大小。每组样品测量3次取平均值。
抑菌率:向装有3.6 mL生理盐水的离心管中放入400 μL浓度为107CFU/mL的菌液,称取50 mg样品放入菌悬液中,振荡使细菌均匀分布,培养24 h后稀释104倍,然后移取10 μL菌液涂琼脂平板并密封倒置。将平板在37 ℃恒温培养24 h后,对平板上生长的细菌菌落数进行计数(Nm)。以未放样的空白组细菌菌落数为对照组(N0),每组样品测量3次取平均值。样品的抑菌率(R)计算公式为
2 结果与讨论
2.1 表面形貌分析
图1示出不同质量比的丝素蛋白/壳聚糖复合纤维膜的表面形貌。从图1(a)~(b)可看出,未浸泡乙醇前,纯丝素蛋白纤维膜中的纤维呈光滑松散、无串珠结构,而浸泡乙醇后纤维呈致密网状结构。从图1(c)~(f)可看出,加入壳聚糖后,SF/CS复合纤维膜中出现较细的纤维。与纯丝素蛋白膜((0.61±0.22) μm)相比,制得的4种SF/CS复合纤维膜的纤维直径均增加,SF/CS1、SF/CS2、SF/CS3、SF/CS4复合纤维膜的平均直径分别为(0.74±0.37) μm、(0.79±0.21) μm、(0.78±0.34) μm、(0.77±0.38) μm。静电纺的网状结构有利于纤维膜接触创面时增加细胞的结合位,使其增殖[18]。

图1 复合纤维膜的扫描电镜照片
2.2 化学结构分析
图2为不同质量比的SF/CS复合纤维膜的红外光谱图。可以看出,所有纤维膜在3 280 cm-1附近均出现O—H和N—H伸缩振动峰,在1 625 cm-1处出现酰胺I的吸收峰[19],在1 520 cm-1处出现酰胺II的吸收峰[20],都表现为典型的β折叠结构,这种结构可使SF不溶于水。同时复合纤维膜在1 029 cm-1处出现吸收峰,为壳聚糖中二级醇羟基υ( C—O ) 结构[21]。以上表明CS的典型特征峰和SF的特征峰均在SF/CS复合纤维膜中出现,说明SF与CS属于物理共混且没有新物质产生。
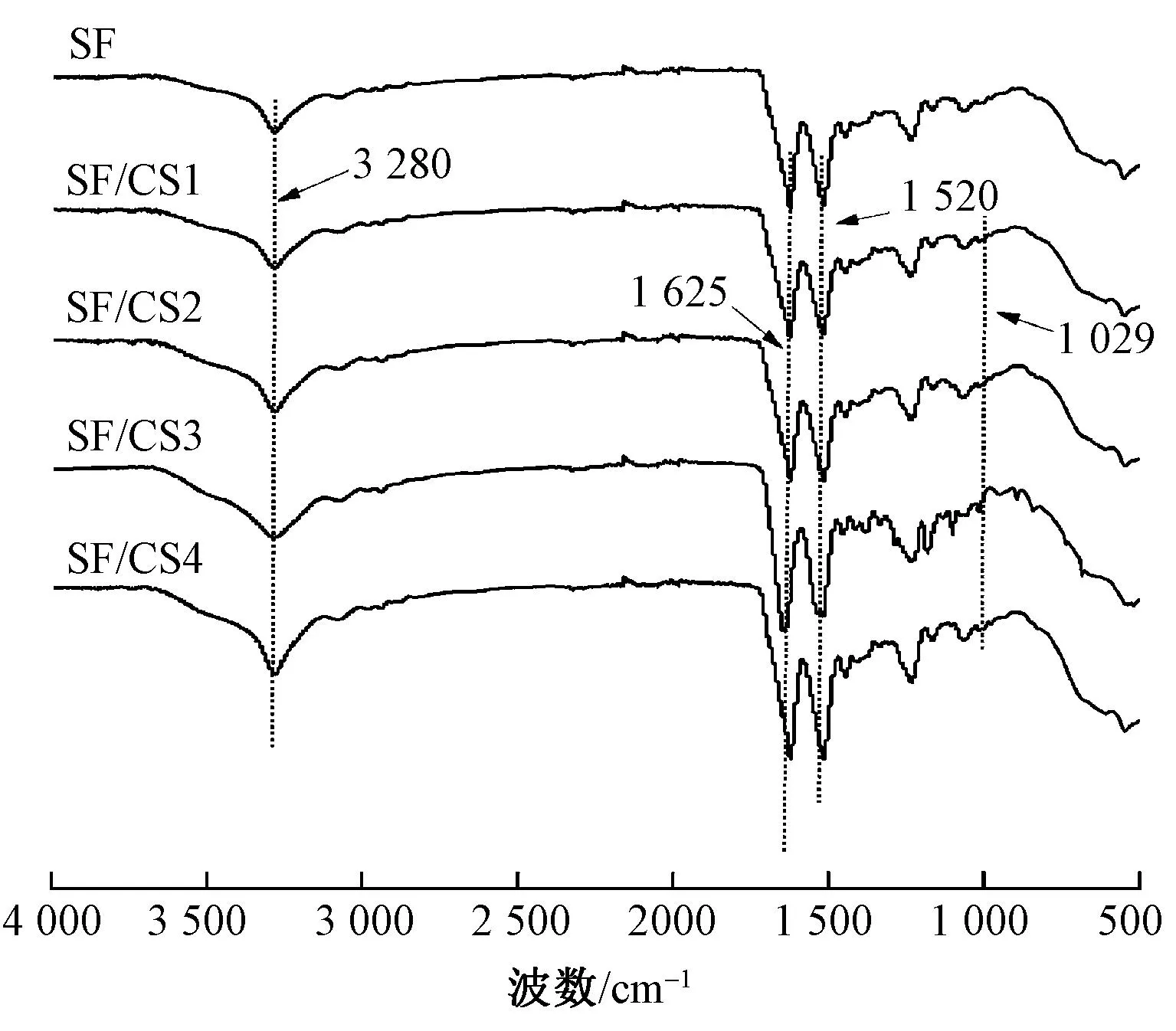
图2 复合纤维膜的红外光谱图
2.3 吸水率分析

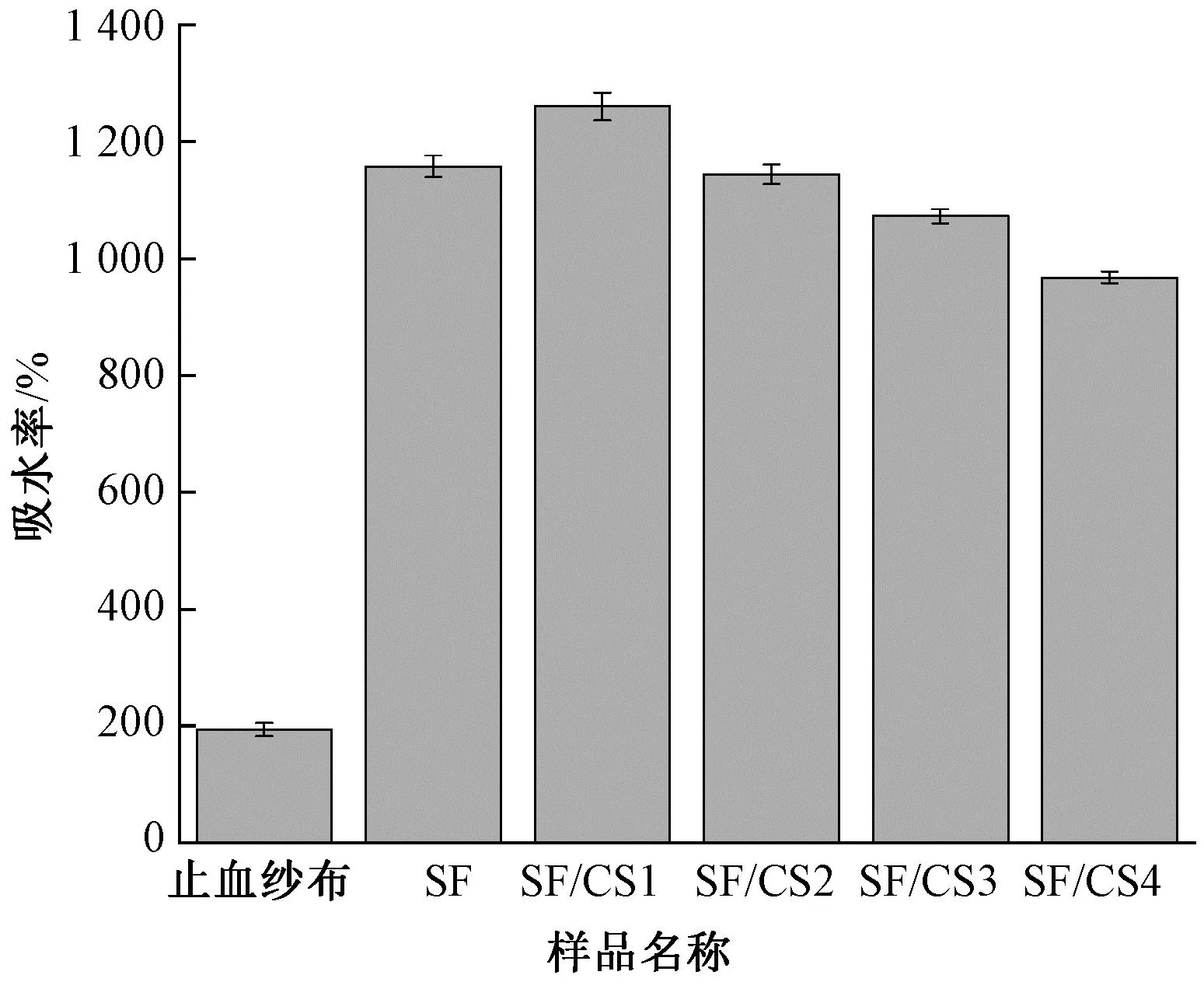
图3 复合纤维膜的吸水率
2.4 体外凝血指数分析
图4示出不同质量比的SF/CS复合纤维膜的体外凝血情况及凝血指数。
从图4(a)可看出,加入纤维膜后,血液凝固成血凝块并沉降在离心管的底部,随着壳聚糖添加量的增加,复合纤维膜吸收血液的量增多,上清液的颜色逐渐变淡。从图4(b)可以看出,与止血纱布((80.01±1.38)%)相比,纯SF丝素蛋白纤维膜和SF/CS1、SF/CS2、SF/CS3和SF/CS4复合纤维膜的BCI值均减小,分别为(75.15±0.80)%、(67.96±0.79)%、(33.11±0.41)%、(28.24±0.86)%和(24.36±0.69)%,表明其体外促凝血能力优于止血纱布,这归因于SF/CS复合纤维膜具有较高的吸水率(见图3),在与血液接触时能够快速吸水分,增加血液的黏度促使血液加速凝固。
2.5 体外凝血时间分析
图5示出不同质量比的SF/CS复合纤维膜的体外凝血效果。
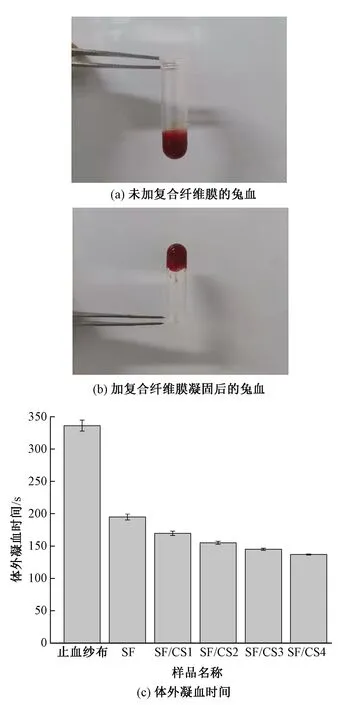
图5 复合纤维膜的体外凝血效果
由图5可以看出,随着壳聚糖添加量的增加,复合纤维膜的凝血时间逐渐缩短,其中SF/CS4复合纤维膜的凝血时间((137.00±0.82) s)最短,凝血效果最好,说明壳聚糖可以增强丝素蛋白纤维膜的凝血性能。这是由于壳聚糖是显正电性的多糖聚合物,可通过静电作用力吸附带负电荷的血小板和红细胞,壳聚糖的亲水性氨基可吸附纤维蛋白原,且能抑制溶纤酶的活性,利于血栓的形成[23]。
2.6 抗菌性能分析
图6示出采用琼脂平皿扩散法[24]测量的不同质量比的SF/CS复合纤维膜对金黄色葡萄球菌和大肠杆菌的抑菌圈直径。可以看出,纯丝素蛋白纤维膜对2个菌种仅具有轻微的抗菌性能,随着壳聚糖添加量的增加,SF/CS复合纤维膜对2种菌种的抑菌圈直径都呈现逐渐增大的趋势。从图6还可看出,复合纤维膜对金黄色葡萄球菌的抗菌性明显优于大肠杆菌,这是由于壳聚糖可与革兰氏阴性菌的脂多糖、革兰氏阳性菌中的磷壁酸结合,从而导致细胞壁的损伤,使细胞膜功能紊乱,且对革兰氏阳性菌的抑制作用比革兰氏阴性菌强[23]。
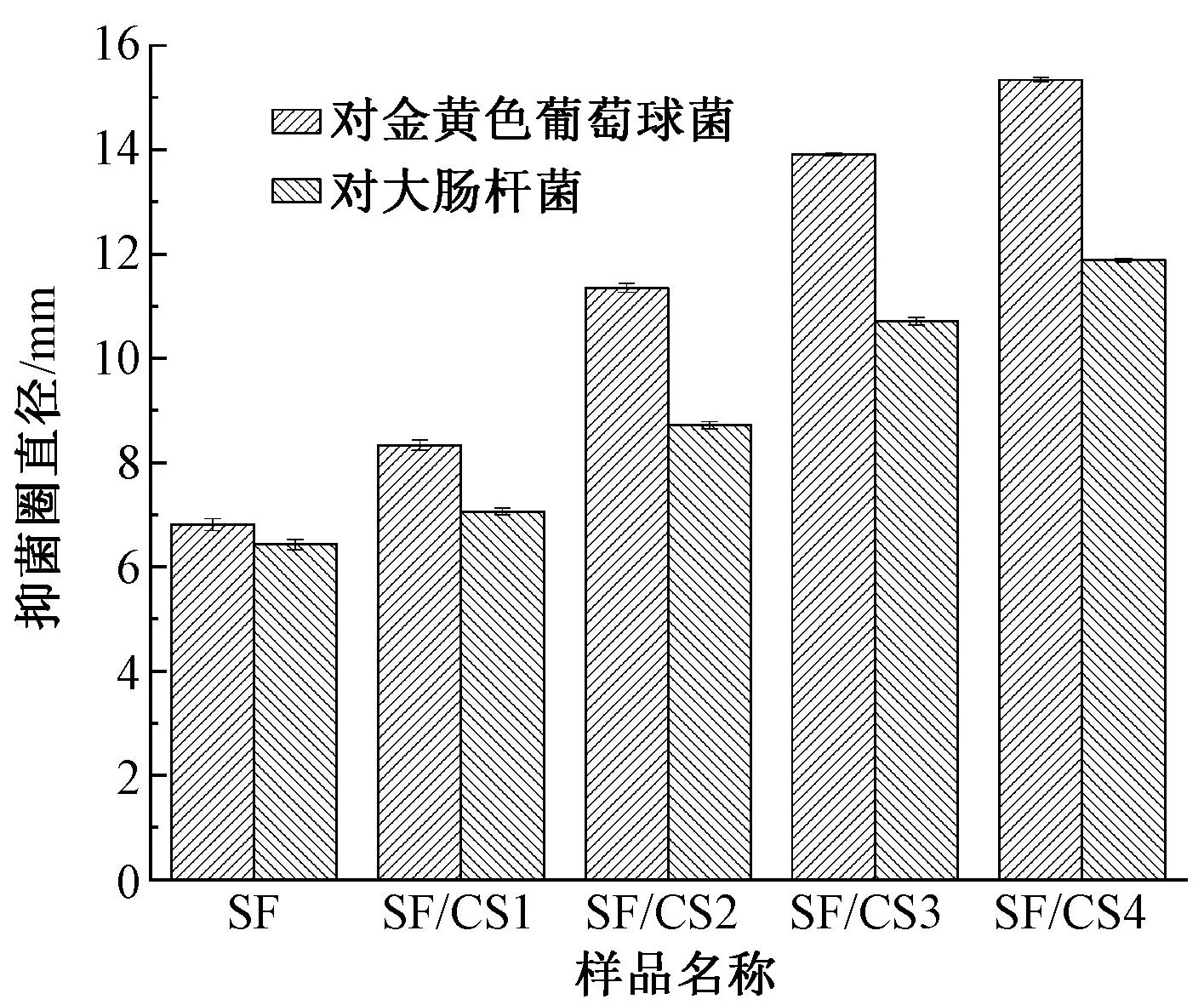
图6 复合纤维膜的抑菌圈直径
图7示出采用振荡法[25]测量的不同质量比的SF/CS复合纤维膜的抗菌效果。从图7(a)~(b)可看出,与空白对照的琼脂平板相比,纯丝素蛋白纤维膜的琼脂平板上菌落数量减少,但仍能观察到大量菌落,这说明虽然纯丝素蛋白纤维膜对金黄色葡萄球菌和大肠杆菌有一定的抑制作用,但其抑菌效果并不显著。当壳聚糖添加量增加时,SF/CS1、SF/CS2、SF/CS3、SF/CS4琼脂平板上生长的菌落数目逐渐减少。其中当SF和CS的质量比为5∶2时,所制得的复合纤维膜SF/CS4具有较强的抗菌活性,对金黄色葡萄球菌的抑菌圈直径和抑菌率分别为(15.34±0.04) mm和(93.27±0.97)%,对大肠杆菌的抑菌圈直径和抑菌率分别为(11.88±0.04) mm和(73.93±0.85)%。壳聚糖的抗菌机制是其分子中携带了正电荷,可与负电性微生物的细胞壁相结合,从而破坏菌体的细胞壁[26]。此外,复合纤维膜的抗菌性能与壳聚糖的添加量成正相关,但当SF和CS的质量比超过5∶2时,纺丝液进行静电纺丝时稳定性变差,因此,综合壳聚糖用量、凝血效果和抗菌性,本文实验没有进一步制备更高质量比的SF/CS复合纤维膜。
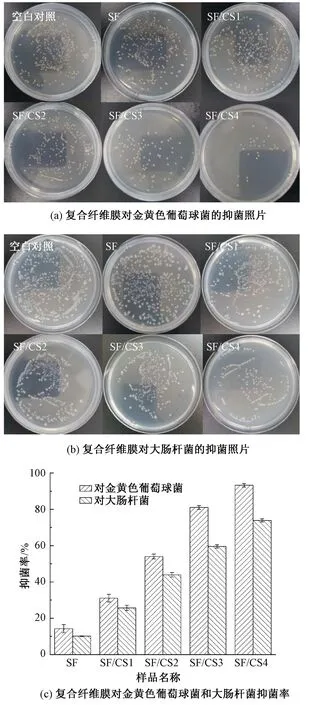
图7 复合纤维膜对金黄色葡萄球菌和大肠杆菌的抗菌效果
3 结 论
本文采用静电纺丝技术制备了不同质量比的丝素/壳聚糖(SF/CS)复合纤维膜,并探讨了其微观形貌、吸水率、止血性能和抑菌性能。复合纤维膜的抗菌性、止血性能与壳聚糖的添加量密切相关,当丝素蛋白和壳聚糖质量比为5∶2时,制得的复合纤维膜(SF/CS4)具有较高的吸水率,抗菌效果较好,对大肠杆菌的抑菌圈直径和抑菌率分别为(11.88±0.04) mm和(73.93±0.85)%,对金黄色葡萄球菌的抑菌圈直径和抑菌率分别为(15.34±0.04) mm和(93.27±0.97)%。由止血性能测试结果可知,SF/CS4复合纤维膜的体外凝血指数较小,体外凝血时间较短,止血性能优于止血纱布。本文实验制备的丝素基复合纤维膜材料性能较优,未来可进一步探究其在伤口创面愈合中的应用。

