天疱疮患者合并感染的特征及高危因素分析
郑小苹,周斐然,李仲华,杨清銮,杨逸轩,邵凌云,阮巧玲
1. 温州医科大学附属平阳医院,浙江 温州 325035; 2. 复旦大学附属华山医院,上海 200040; 3. 江苏省太仓市第一人民医院,江苏 苏州 215413
天疱疮是一组自身免疫性水疱性疾病,以组织学棘层松解(细胞间黏附丧失)、黏膜和(或)皮肤水疱为特征,有4种主要类型:寻常型天疱疮、落叶型天疱疮、IgA天疱疮和副肿瘤性天疱疮。天疱疮患者可能合并各种浅部和深部感染,这主要是由于患者皮肤屏障被破坏;此外,系统性应用糖皮质激素及免疫抑制剂治疗也显著增加了患者感染及死亡的风险[1-2]。既往回顾性病例对照研究显示,天疱疮患者合并感染的发生率为68%,其中细菌感染占52%,真菌感染占50%,疱疹病毒感染占19%,寄生虫感染占1.5%[3]。金黄色葡萄球菌、真菌是天疱疮患者合并感染中最常见的病原体[3-4],皮肤软组织感染、肺部感染和尿路感染是天疱疮患者中最常见的系统感染[4-5]。本研究回顾性分析了2017—2021年于复旦大学附属华山医院住院治疗的142例天疱疮患者,分析其合并感染的临床特点及高危因素,为预防和控制感染提供参考。
1 材料和方法
1.1 研究对象
连续收集2017年1月—2021年12月于复旦大学附属华山医院住院治疗的天疱疮患者数据。天疱疮患者须符合以下纳入标准[6]:①经临床、病理、直接或间接免疫荧光,以及抗桥粒芯糖蛋白 1、3抗体检测确诊;②临床病例资料完整;③首次住院。排除标准:①合并其他类型自身免疫性疾病;②合并恶性肿瘤等其他免疫抑制因素。
1.2 研究方法
回顾性分析142例患者的临床资料,包括性别、年龄、体质指数(body mass index,BMI)、诊断类型、是否使用糖皮质激素、3个月内糖皮质激素累计剂量、是否合并使用其他免疫抑制剂,以及是否有合并症如糖尿病、低白蛋白血症(血清白蛋白的质量浓度<35 g/L)等;将3个月内糖皮质激素累计剂量换算为甲泼尼龙使用剂量。对于合并感染的患者,分析感染部位及主要病原体。
1.3 统计学方法
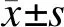
2 结果
2.1 天疱疮患者合并感染特征
142例天疱疮患者中,男性74例,女性68例;平均年龄55.89(20~88)岁,其中>60岁者占40.1%;平均BMI为(23.32±3.24)kg/m2。寻常型天疱疮63例,落叶型天疱疮29例,副肿瘤型天疱疮2例,红斑型天疱疮1例,未分型天疱疮47例。合并糖尿病者占19.7%(28例),合并低白蛋白血症者占16.2%(23例)。治疗过程中使用全身糖皮质激素者占65.5%(93例),合并使用其他免疫抑制剂(包括吗替麦考酚酯、氨甲蝶呤、硫唑嘌呤、环孢素、雷公藤、利妥昔单抗)者占14.1%(20例)。74例患者合并感染,占52.1%。
2.2 天疱疮患者合并感染的影响因素分析
根据是否合并感染,将天疱疮患者分为感染组和未感染组。单因素分析(见表1)发现,感染组合并低白蛋白血症者占27.0%(P<0.001),使用全身糖皮质激素者占83.8%(P<0.001),显著高于未感染组,且感染组患者3个月内糖皮质激素累计剂量显著高于未感染组(P=0.001)。两组患者在性别、年龄、BMI、天疱疮类型、是否合并糖尿病、是否合并使用其他免疫抑制剂方面无显著差异。多因素分析(见表2)发现,合并低白蛋白血症(OR=7.96,95%CI为[1.95,32.41]和使用全身糖皮质激素(OR=6.47,95%CI为[2.73,15.33])是天疱疮患者合并感染的独立危险因素。
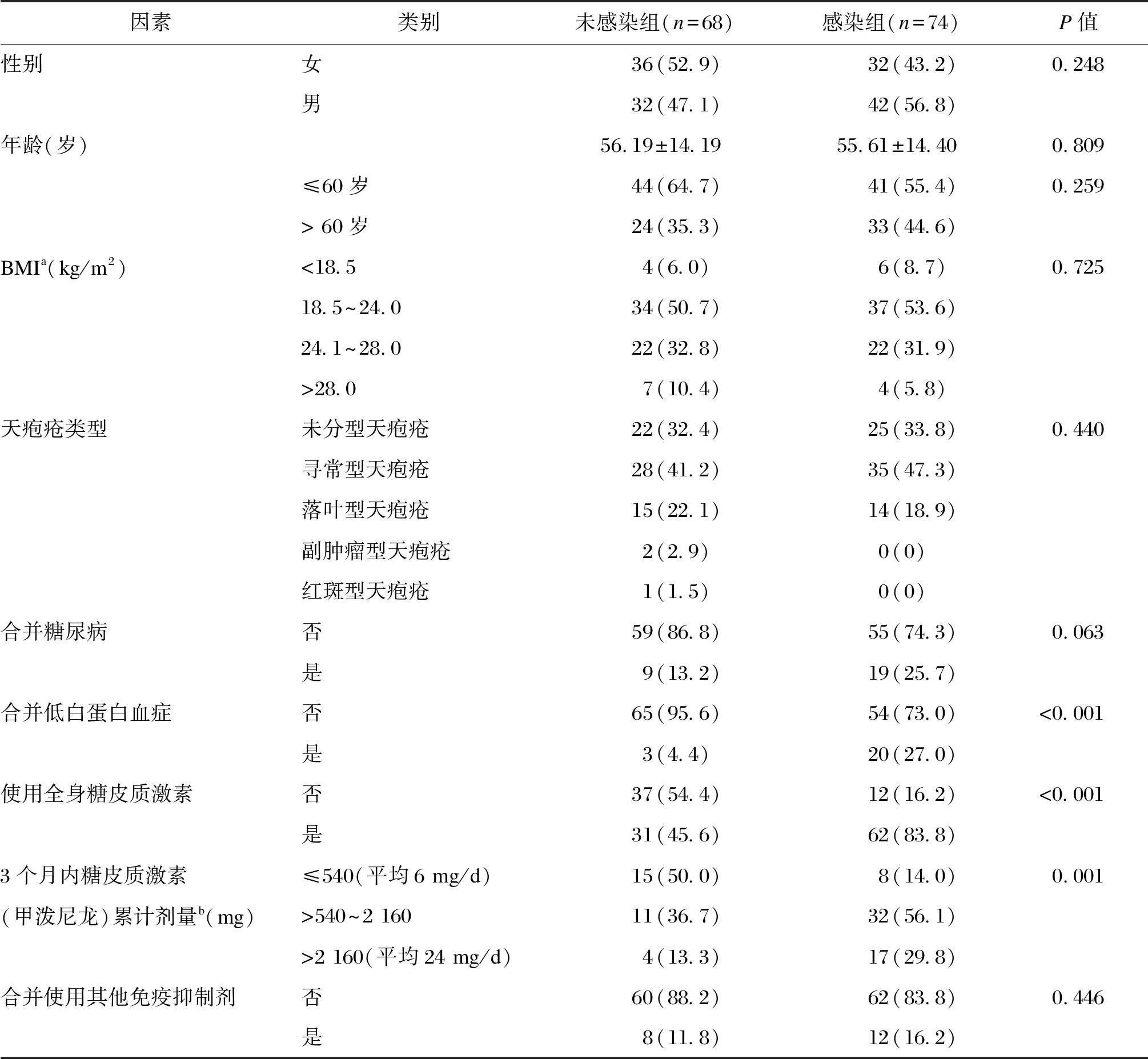
表1 天疱疮患者合并感染的危险因素(单因素分析) [n(%)]

表2 天疱疮患者合并感染的危险因素(多因素logistic回归分析)
2.3 天疱疮患者合并感染的易感部位及主要病原体分析
74例发生合并感染的天疱疮患者中,单系统感染50例(67.6%),多系统感染24例(32.4%)。单系统感染中,皮肤创面感染31例(62.0%),肺部感染16例(32.0%),尿路、中耳、胆囊感染各1例(2.0%)。多系统感染中, 皮肤创面感染16例(66.7%),肺部感染16例(66.7%),血流感染6例(25.0%),中枢神经系统感染5例(20.8%)。结果显示,天疱疮患者无论合并单系统感染还是多系统感染,易感部位均以皮肤创面及肺部为主。74例合并感染者中,创面感染47例,共培养出64株病原菌,以革兰氏阳性菌(57.8%)为主,前3位病原体为金黄色葡萄球菌(17例,26.6%)、铜绿假单胞菌(7例,10.9%)、凝固酶阴性葡萄球菌(6例,9.4%),具体数据如表3所示。非单纯创面感染中,肺部感染32例居首位,其中单纯细菌感染8例,单纯真菌感染10例,细菌、真菌混合感染14例。因肺部的细菌病原体多不明确,此次暂不统计。24例肺部真菌感染者中,以隐球菌感染为主(10例,41.7%),其次是肺曲霉(5例,20.8%)和肺孢子菌(4例,16.7%)感染。
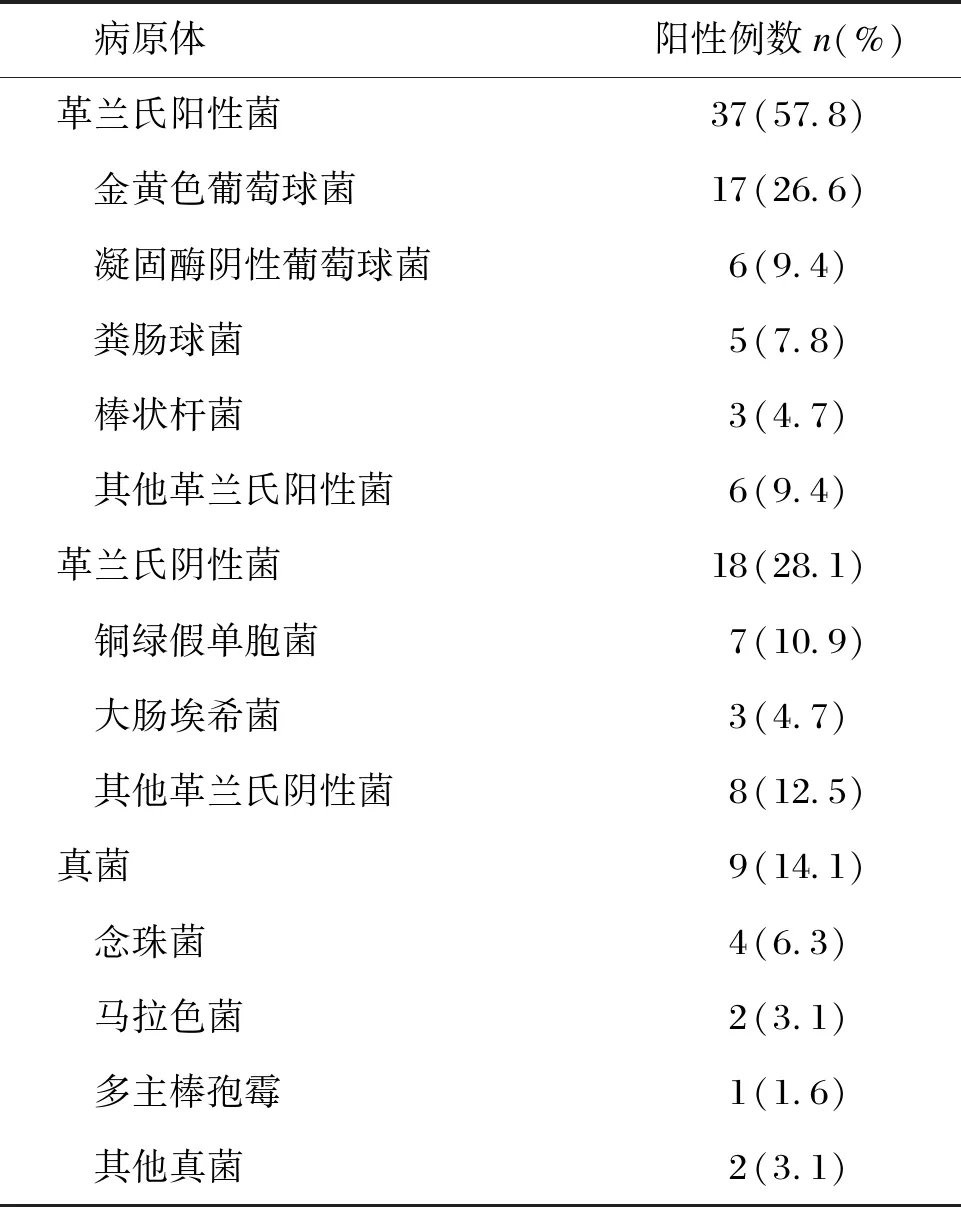
表3 引起创面感染的病原体
2.4 天疱疮患者合并感染的预后分析
74例发生合并感染的天疱疮患者中,69例好转,5例死亡(6.8%)。其中好转病例的平均年龄为54.32岁,死亡病例的平均年龄为73.40岁,死亡病例的年龄显著大于好转病例(P<0.001)。单因素分析发现,合并低白蛋白血症者的死亡率(25.0%)显著高于未合并低白蛋白血症者(0)(P=0.001),而天疱疮分型、是否合并糖尿病、是否使用全身糖皮质激素、是否合并使用其他免疫抑制剂对死亡率无显著影响(见表4)。本研究中,多因素分析未获得有统计学意义的预后影响因素。69例好转病例中,44例存在皮肤创面感染,26例存在肺部感染,4例存在血流感染,3例存在中枢神经系统感染。5例死亡病例均发生肺部感染,其中3例合并血流感染,2例合并中枢神经系统感染,无皮肤创面感染病例。5例死亡病例均发生真菌感染,其中1例为单纯真菌感染,4例为细菌、真菌混合感染。
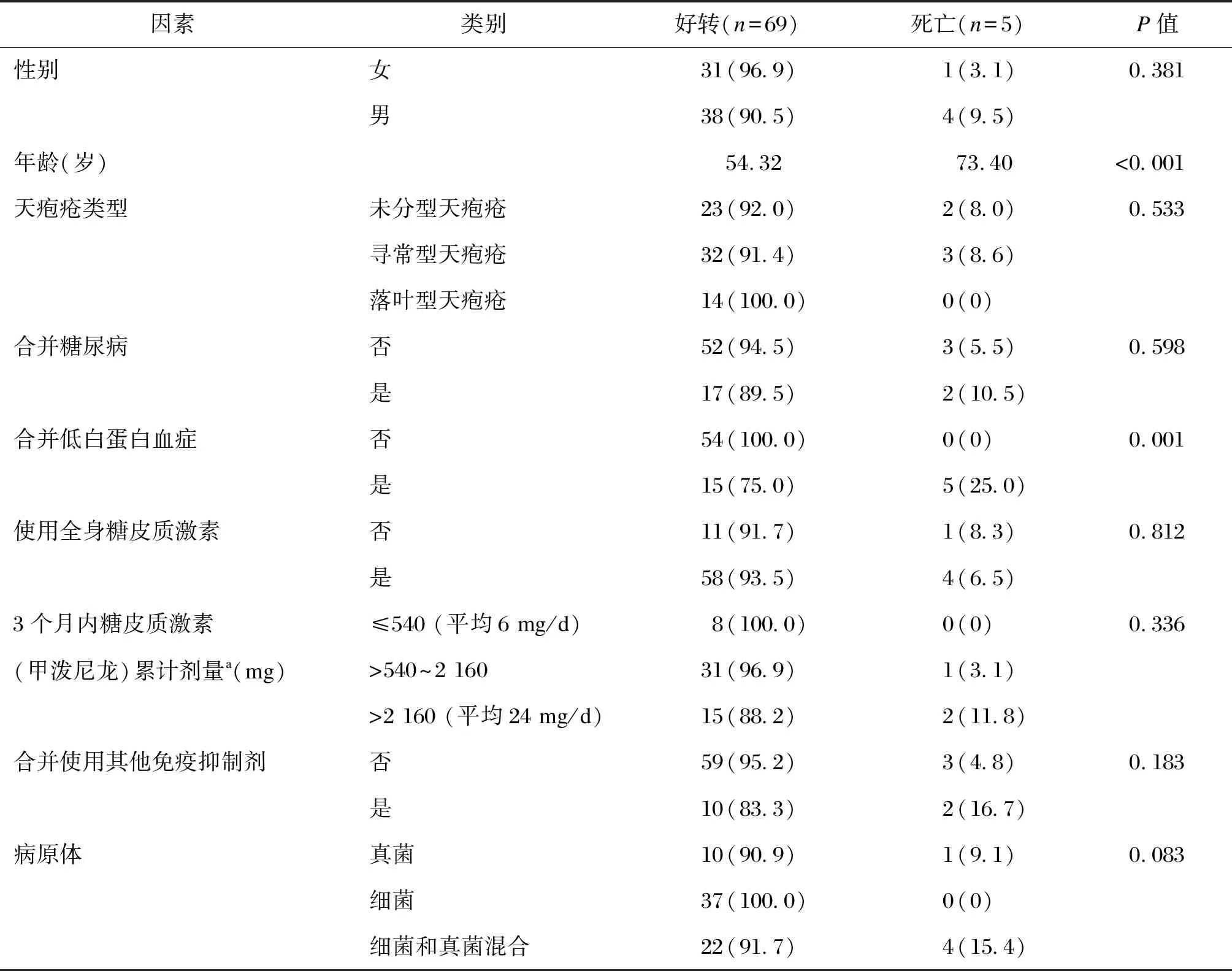
表4 天疱疮患者合并感染的预后影响因素(单因素分析)[n(%)]
3 讨论
天疱疮患者容易合并感染,原因有多种[7-9]:抗桥粒芯糖蛋白自身抗体损伤表皮棘层细胞形成皮损,皮损易破溃形成糜烂,导致皮肤屏障被破坏;长期系统应用糖皮质激素、免疫抑制剂等使患者免疫力降低。此外,天疱疮作为一种自身免疫性疾病,也可导致患者免疫系统功能紊乱,免疫防御功能减弱。本研究显示,天疱疮患者中合并感染的发生率较高,达52.1%,与既往研究显示的68%相近[3]。
本研究中低白蛋白血症和使用较高剂量的糖皮质激素是天疱疮患者合并感染的独立危险因素。低白蛋白血症可能是天疱疮病情严重程度的指标之一,与创面大量渗出相关,可导致机体内环境平衡失调。另一方面,白蛋白在免疫调节方面发挥着重要作用,可与多种炎症介质相互作用,促进中性粒细胞脱颗粒,增强吞噬作用。因此,低白蛋白血症削弱了机体免疫系统作用,增加了机体的感染风险[10]。在天疱疮治疗中,有效控制病情,关注白蛋白水平的变化,嘱患者优质蛋白饮食,必要时行输注白蛋白支持治疗很重要。自糖皮质激素用于天疱疮治疗后,患者的死亡率明显下降,由75%降至30%[11]。但长期应用糖皮质激素会导致多种不良反应,且不良反应的发生与激素剂量有关[12-13]。本研究显示,使用全身糖皮质激素是天疱疮患者合并感染的独立危险因素,尤其与患者过去3个月内的糖皮质激素累计剂量显著相关,而合并使用其他免疫抑制剂不是合并感染的危险因素。既往多项研究显示,合并使用其他免疫抑制剂如利妥昔单抗未显著增加天疱疮患者的合并感染风险[14-15]。结果提示,在能有效控制天疱疮病情的前提下,可通过适当减少糖皮质激素用量或缩短糖皮质激素疗程,增加使用其他免疫抑制剂,来降低合并感染发生的风险。本研究未显示易发生合并感染的天疱疮类型, 但由于未分型天疱疮的病例数较多,相关结论仍须进一步确认。
对于天疱疮合并感染,了解其病原学的分布可为经验性治疗提供一定的指导。本研究发现,天疱疮患者最常见的合并感染是创面细菌感染,可能的原因包括表皮剥脱致皮肤屏障受损使细菌更易侵入创面、大量体液渗出为细菌在创面的定植和增殖提供了条件等。最常见的病原菌为革兰阳性菌中的金黄色葡萄球菌,与大多数文献报道的一致[16-17],其次为铜绿假单胞菌,这可为创面感染的经验性抗生素用药提供参考。系统感染中最常见的是肺部感染,与一项回顾性天疱疮病例对照研究显示最常见的系统感染为呼吸道感染相一致[18]。肺部感染的病原体以细菌、真菌为主,本研究32例肺部感染者中有24例为真菌感染,其中隐球菌感染占41.7%。需要注意的是,5例死亡病例均存在肺部感染与真菌感染。因此,临床医师对于具有感染高危因素且高度怀疑感染的患者,应警惕肺部感染,尤其是肺部真菌感染。对合并肺部感染的患者进行隐球菌筛查亦非常重要。临床医师应结合患者原发病病情及病原菌的耐药性特点,针对性地合理选用抗菌药物,从而提高抗感染治疗效果,改善患者预后,避免抗菌药物的滥用及耐药菌恶性循环,同时要做好耐药菌监测及医院感染预防与控制工作,避免多重耐药菌的传播[19]。

