SiO生产过程反应容器与加热元件材质选择
袁 坤 刘志明 陈思明
(1.青海盐湖镁业有限公司,青海 格尔木 816099;2.中国科学院 过程工程研究所,北京 100190;3.青海盐湖元品化工有限责任公司,青海 格尔木 816099;4.战略金属资源绿色循环利用国家工程研究中心,北京 100190)
随着气候问题的日益严重,国际社会对碳排放量日益重视。目前,我国二氧化碳排放总量占世界总排放量的29%,居世界首位,平均碳排放量水平较全球高出约65%[1]。基于此,习近平总书记在2020年提出了“双碳”目标,国家相继出台了一系列政策促进二氧化碳排放地降低,因此新能源汽车产业得到飞速发展。
人们对于高性能动力锂电池的需求持续攀升,带动动力电池的负极材料需求也直线上涨。2022年全球负极材料出货量达到155.6万t,同比增长71.9%,其中,我国负极材料出货量同比增长84.0%,达到143.3万t[2]。电池成本中,负极材料占5%~15%。当前常用的锂离子电池负极材料主要为改性天然石墨和人造石墨,其理论比容量仅为372 mA·h/g,难以满足未来大容量锂离子电池对负极材料的需求。Si基材料较C基材料具有更高的理论能量密度(4 198 mA·h/g),较低的嵌锂电位(<0.5 V vs.Li+/Li),并且储量丰富,价格便宜,被视为下一代锂离子电池材料的有力竞争者,但由于充放电导致的体积变化(纯硅负极材料完全锂化后的体积膨胀率可达320%),使得硅基负极材料存在着不可逆容量高,循环性能差等问题,为硅基负极材料在锂离子电池上的大规模商业化应用带来了一定困难。针对上述技术难点,研究者们对硅基负极材料进行了改性处理。KIM等[3]采用了化学镀蚀法制备出了直径为100 nm的硅纳米棒,有效限制了硅基材料在充放电过程中的体积变化。经优化后的材料在30次循环后质量比容量仍能保持2 411 mA·h/g。王帅等[4]用机械球磨法将微米硅与纳米Ag2O进行复合,再通过沥青进行包覆后热解,制备得到Si/(SiO+Ag)-C复合材料。该材料可得到1 039 mA·h/g的可逆比容量,经80次循环后可逆比容量仍可稳定在943 mA·h/g。SHIVARAJU等[5]采用纳米硅与多孔MCM-41复合后,发现该材料具有较高的初始比容量(2 767 mA·h/g),在500周循环后仍具有705 mA·h/g(C/2放电)。ZUO等[6]将SiO2与碳纳米管复合制备SiO2-CNT复合材料,并通过CNT和SiO2的多孔结构进行锂离子的储存,结果证实,在200次循环后,电池仍可保留99%的库仑效率。硅基材料改性的结果较大地推动了硅基材料在锂电池上的使用,但目前硅基材料的多数改性方法因设备、操作复杂等因素导致其工业应用难度较大。
与纯硅基负极材料相比,SiO材料目前已实现了商业应用。这是因为SiO的理论容量为2 400 mA·h/g,且体积膨胀率较小(完全锂化时体积膨胀率仅为150%),SiO材料较纯硅基负极材料具有更好的循环稳定性。
SiO合成方法有热蒸发法、湿化学法和高能机械球磨法三种[7]。目前,国内企业大多采用高纯硅粉与高纯石英粉混合,在高真空度且高温条件下进行反应,生成SiO。考虑到反应温度较高,SiO企业采用高纯石墨作为反应容器及加热元件的材质,但仍遇到了材料腐蚀导致的生产过程不稳定及产物损失问题。
本文以常规坩埚材质及加热元件材质出发,通过热力学模拟不同材质在SiO生产过程可能发生反应的平衡产品的分布情况,以确定该材质可能发生的腐蚀状态。最后,通过热力学模拟,提出适用于SiO生产的坩埚材质及加热元件材质。
1 计算方法
反应过程热力学及平衡产品模拟分别由HSC 6.0软件Reaction Equations模块和Equilibrium Compositions模块计算得到。其中,平衡产品模拟过程中压力设定为10 Pa,坩埚材质在SiO生产过程反应的平衡产品模拟过程中,反应物质硅和SiO2的初始物质的量设定均为1 mol,所选坩埚材质初始物质的量设定为4 mol;加热元件材质在SiO生产过程反应的平衡产品模拟过程中,SiO的初始物质的量设备为1 mol,所选坩埚材质初始物质的量设定为4 mol。
2 结果与讨论
2.1 反应过程热力学分析
SiO可由SiO2还原制得。常规的还原剂有固基还原剂炭和硅,以及气基还原剂CO。由于SiO2具有极高的稳定性,SiO生产过程要求体系中O2含量尽可能低。SiO合成可能发生的化学反应方程式见式1~8,对应常压反应过程的标准吉布斯自由能变化情况如图1所示。从图1可知,气基还原剂CO对SiO还原的吉布斯自由能变值在计算温度范围内为正值,说明该反应在该状态下难以进行。对比两种固基还原剂炭和硅,炭比硅对SiO2还原生成SiO具有更大的热力学趋势。值得注意的是,在较高温度下,SiC的生成吉布斯自由能变值低于生成SiO的数值,说明在相同条件下,SiC更易于生成。基于上述分析可知,Si是合成SiO更适宜的还原剂。
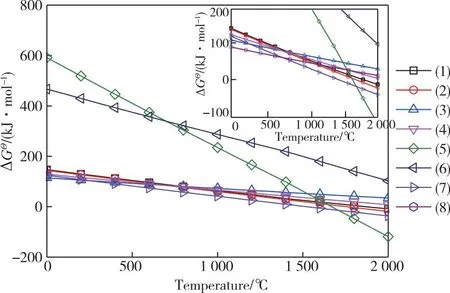
图1 SiO合成过程可能发生反应的标准吉布斯自由能变值与反应温度的关系图
SiO2+Si = 2SiO(g)
(1)
SiO2+C = SiO(g)+CO(g)
(2)
SiO2+CO(g)= SiO(g)+CO2(g)
(3)
SiO2+1/2C = SiO(g)+1/2CO2(g)
(4)
SiO2+2C = Si+2CO(g)
(5)
SiO2+C = Si+CO2(g)
(6)
SiO2+3C = SiC(g)+2CO(g)
(7)
SiO2+2C = SiC(g)+CO2(g)
(8)
如反应式1,在SiO制备过程中,反应物SiO2和Si均为固体,生成的SiO为气体,根据吉布斯自由能计算公式可知,降低反应过程压力可有效促进反应平衡向右进行。我们模拟了10 Pa条件下SiO2与Si反应的自由能变值与反应温度的关系,如图2所示。由图2可知,在10 Pa下,SiO的理论生成温度降至1 160 ℃,远低于常压状态下的1 868 ℃,因此国内主流SiO生产企业均在10 Pa条件下生产SiO,SiO的生产温度可降至约1 400 ℃。目前SiO生产企业采用间歇生产模式,使用的加热元件及反应容器材料为高纯石墨,在生产过程中存在着腐蚀的情况,造成生产波动。基于此,我们对反应容器及加热元件材质进行分析,为SiO反应过程设备选择提供理论支持。
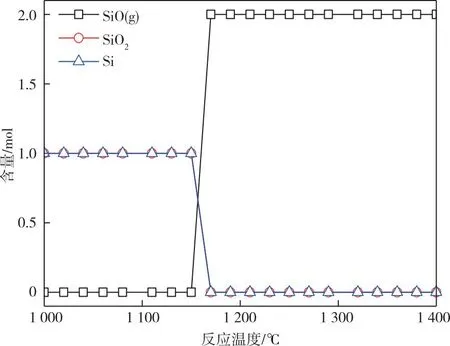
图2 10 Pa条件下SiO2与硅反应的热力学平衡产品分布关系图
2.2 反应容器材质的选择
目前常用的高温(>1 400 ℃)坩埚材质主要有石墨、刚玉、碳化硅、氮化硼、氮化铝、氮化硅等,我们分别对上述六种材质在10 Pa条件下SiO2+Si与硅反应中的可能生成产物进行了模拟。图3为石墨在SiO2+Si反应中热力学平衡产品分布情况。由图3可知,在低于1 250 ℃时,石墨与Si会反应生成SiC;当反应温度高于1 250 ℃时,石墨对SiO生成过程影响逐渐减小。由此可见,石墨在SiO生成过程存在Si的腐蚀问题。此外,高纯石墨质地较软且造价偏高,坩埚使用过程易造成损坏,因此不适用于大规模生产。

图3 石墨与反应物料Si与SiO2反应的热力学平衡产品分布关系图
图4为Al2O3在SiO2与Si反应中热力学平衡产品分布情况。如图4所示,在较低温度下(<1 080 ℃),Al2O3不仅会与SiO2反应生成相应硅酸铝盐,还可以与Si反应生成铝。虽然当温度超过1 080 ℃时,Si与SiO2反应逐渐转变为反应过程的主反应,Al2O3对SiO生成过程的影响逐渐减少,但升温过程中所产生的低熔点的硅酸铝盐会导致坩埚内物料的导热效率下降,并污染反应物料,同时生成的Al蒸汽也易造成对SiO产物的污染。
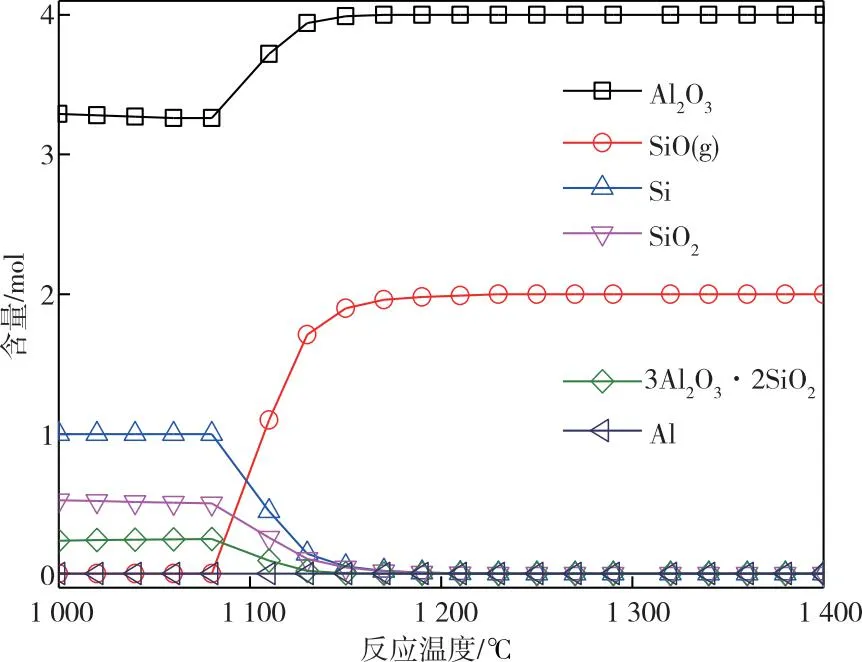
图4 Al2O3与反应物料Si+SiO2反应的热力学平衡产品分布关系图
图5为SiC在SiO2+硅反应中热力学平衡产品分布情况。由图5可知,当温度低于1 080 ℃时,SiC无腐蚀现象发生,而温度超过1 080 ℃时,SiC有与SiO2反应的趋势,其反应产物为气态的SiO与CO,但反应量较少,因此SiC材质在模拟温度范围内仅有发生微量腐蚀的倾向。

图5 SiC与反应物料Si+SiO2反应的热力学平衡产品分布关系图
图6为BN在SiO2+Si反应中热力学平衡产品分布情况。由图6可知,当温度低于1 170 ℃时,BN可与接触的Si和 SiO2反应形成Si2N2O和B,上述物质在10 Pa下都具有较高沸点,可停留在坩埚内壁,阻止腐蚀的进一步发生,起到保护坩埚的作用。当温度高于1 170 ℃时,BN不与Si和 SiO反应。

图6 BN与反应物料Si+SiO2反应的热力学平衡产品分布关系图
图7为AlN在SiO2与硅反应中热力学平衡产品分布情况。由图7可知,在模拟温度范围内,AlN有被腐蚀的倾向,且会与生成的SiO反应,造成SiO产物的损失。

图7 AlN与反应物料Si和SiO2反应的热力学平衡产品分布关系图
图8为Si3N4在SiO2和Si反应中热力学平衡产品分布情况。由图8可知,当温度低于1 150 ℃时,Si3N4不被腐蚀,而当温度超过1 150 ℃时,随着反应温度的升高,在高真空度条件下,Si3N4产生分解,生成Si和N2,Si会进一步与反应物中的SiO2反应生成SiO而被损耗,因而造成坩埚的腐蚀。

图8 Si3N4与反应物料Si+SiO2反应的热力学平衡产品分布关系图
综上所述,适用于SiO生产的坩埚材质可选择SiC和BN,而从经济角度来看,SiC更具有使用前景。
2.3 加热元件材质的选择
考虑到整个反应在高真空度下进行,只能采用加热元件直接热量供给。常规的加热元件材质有石墨棒、硅碳棒和硅钼棒。高纯石墨棒加热元件表面最高温度可达3 000 ℃。如图9所示,在10 Pa时,高纯石墨加热元件在温度高于1 250 ℃条件下不会与SiO反应,但在反应炉降温过程中,高纯石墨仍有被SiO腐蚀的可能。高纯石墨由于材质硬度,存在着元件寿命较短的问题,不适于在工业生产中大规模应用。硅碳棒的主要材质为SiC,SiC与SiO反应的平衡模拟产品分布如图9所示。由图9可知,SiC在温度超过1 080 ℃时仅受到轻微腐蚀,且在模拟温度范围内不会与生成的SiO反应。硅钼棒的主要材质为MoSi2,MoSi2与SiO反应的平衡模拟产品分布如图10所示。由图10可知,当温度低于1 290 ℃时,MoSi2未发现有腐蚀的趋势;当温度超过1 290 ℃时,MoSi2开始分解为Si和Mo5Si3,但上述两种物质在高温条件下(>1 290 ℃)未发现与产物SiO反应的倾向。值得指出的是,在氧化气氛下,硅钼棒表面会氧化生成一层致密的SiO2层,该SiO2层可有效隔离硅钼棒内部材质与加热气氛,起到较大程度延长元件使用寿命的作用。为此,我们也进行了SiO2与SiO反应的平衡模拟产品分布的分析,如图11所示。由图11可知,在温度超过1 170 ℃时,硅钼棒表面的SiO2不会与SiO反应。因此,通过先在氧化气氛中进行预处理的方法,有望延长硅钼棒在SiO生产过程中的使用寿命。比较而言,硅碳棒电热元件表面温度最高可达1 450 ℃,难以满足SiO实际生产的温度要求,而硅钼棒电热元件表面温度最高可达1 800 ℃。由上述分析可知,通过氧化气氛预处理的硅钼棒更适用于SiO生成。
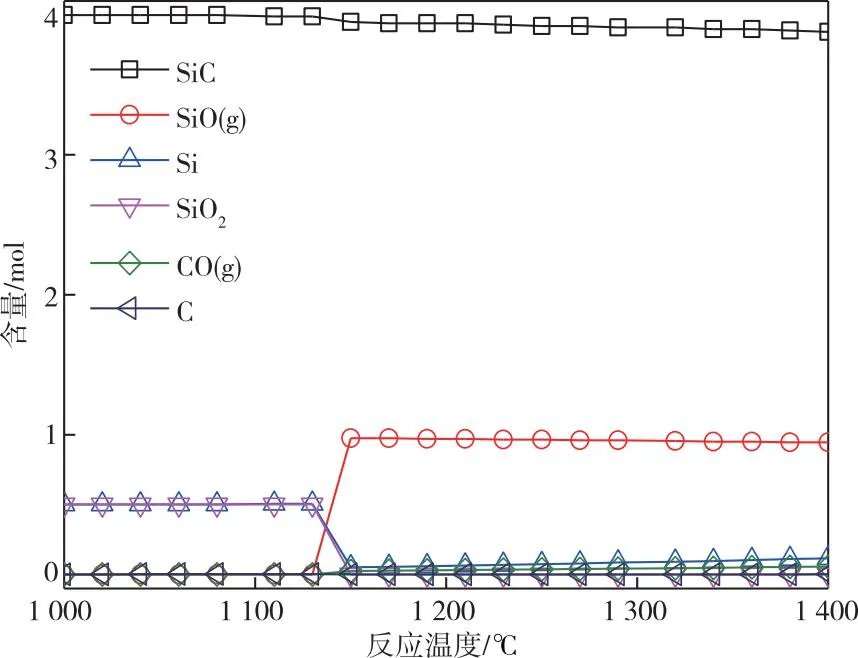
图9 SiC与产物SiO反应的热力学平衡产品分布关系图
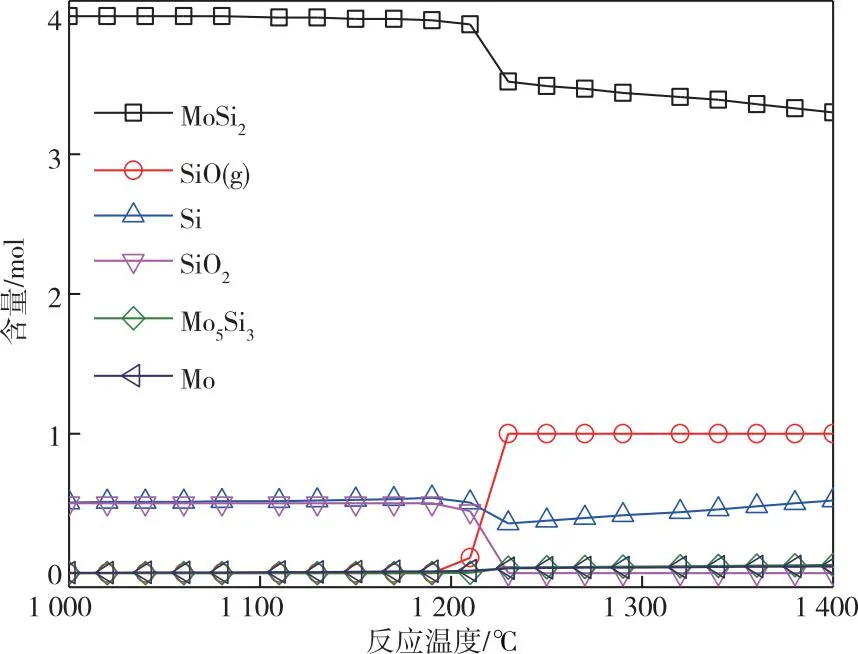
图10 MoSi2与产物SiO反应的热力学平衡产品分布关系图

图11 SiO2与产物SiO反应的热力学平衡产品分布关系图
3 结论
1)10 Pa条件下,在常规选用的坩埚材质中,高纯石墨在低于1 250 ℃时会与反应物中的Si反应,刚玉在低于1 080 ℃时会与SiO2反应生成硅酸铝盐,氮化铝会与产物SiO反应,氮化硅自1 150 ℃时开始分解,碳化硅仅在温度超过1 080 ℃时发生较少量的腐蚀,而氮化硼虽然在低温(<1 170 ℃)会生成Si2N2O和B,但由于氮化硼为凝聚态,且不与物料进一步反应,对坩埚的性能影响不大,而当温度超过1 170 ℃时,氮化硼不与反应物料发生反应。
2)10 Pa条件下,在常规选用的加热元件材质中,高纯石墨棒仅在反应温度低于1 250 ℃时会与SiO2反应而被腐蚀,但由于其材质硬度偏低,其工业适用性有待商榷。硅碳棒和硅钼棒都不会与SiO反应。其中,硅碳棒在温度超过1 080 ℃后仅会受到轻微腐蚀。硅钼棒在温度超过1 290 ℃后会分解成Si和Mo5Si3,但在氧化气氛下预处理后,硅铜棒表面生成的致密SiO2可有效隔绝加热气氛与元件材质的接触。
3)综合考虑材质硬度和成本,SiO生产过程坩埚材质宜选用碳化硅材质,而加热元件宜选用硅钼棒。

