小长山岛3种大型海藻组织碳、氮含量和δ15N值的环境指示意义
赵玥茹,蔡恒江,王选忠,刘龙强,单晓煊,胡思琪
(1.自然资源部大连海洋中心,辽宁 大连 116001; 2.大连海洋大学海洋科技与环境学院, 辽宁 大连 116023)
近年来,由于人类活动的影响导致大量的含氮营养盐尤其是溶解态无机氮(dissolved inorganic nitrogen, DIN)输入到近海,富营养化频发引起生物群落组成和丰度发生改变,严重影响了近海生态系统的结构和功能[1-3]。目前对近海氮营养盐监测主要是通过化学方法测定水体中氮营养盐浓度,该方法不但无法了解氮营养盐的陆、海来源途径,而且当海水中的氮营养盐被海流迅速稀释扩散或被生物大量吸收去除时,监测结果可能误导氮来源的判断[4-5]。此外,海水中氮营养盐浓度并不能揭示出生物对其利用的浓度,故不能准确地评估其对生态系统的影响[5]。已有研究表明,测定样品中δ15N值(15N/14N)是研究氮营养盐来源的一种可靠方法[6-7]。通过生物样本与非生物样本δ15N值的比较,可以长期地记录环境变化情况,成为氮营养盐溯源的优选工具[8]。
20世纪70年代,底栖大型海藻首次被用来监测近海的废水排放[9],此后经过不断地发展,现今已证明大型海藻是指示水生生态系统中人为营养负荷影响的可靠样本[5,10]。大型海藻只吸收海水中生物可利用的氮营养源[4],其组织中存储的氮,受到海水中氮营养盐的短期波动影响较小[11-13]。而且大型海藻在利用氮营养盐的过程中氮分馏作用不明显,其组织的氮稳定同位素比其他生物变化更大,相比海水更加容易测定,可以更好地追溯氮源[14-15]。所以,大型海藻组织的δ15N值已成为研究海洋氮污染的常用工具,并被广泛应用于近海水体中氮源指示和示踪研究,对控制沿海地区氮排放以及缓解近岸富营养化具有重要意义[16-17]。此外,大型海藻组织中的碳、氮含量、C/N比值也可作为评估环境中营养盐生物可利用情况的指标[18]。
大型海藻种类繁多,不同种类的个体对营养盐吸收速率及对环境营养盐的响应形式差异较大,藻体的形态、大小和生活期限也会呈明显的季节性变化[19-20]。所以在利用大型海藻组织的δ15N值指示近海水体氮营养盐的应用中,必须筛选出适合的指示物种。这些物种需要在不同季节均有可采集的足够生物量,具有对水中DIN快速吸收和同化的能力,可以及时准确地反映出水体中氮营养盐的变化[7]。本研究选取小长山岛潮间带四季常见的3种大型海藻,对其组织中的碳、氮含量及其δ15N值、生长环境的环境因子月际变化进行分析,以期为潮间带野生大型海藻氮源指示和示踪研究提供参考。
1 材料与方法
1.1 样品采集
3种大型海藻孔石莼(Ulvapertusa)、角叉菜(Chondrusocellatus)、鼠尾藻(Sargassumthunbergii)分别隶属于绿藻门(Chlorophyta)、红藻门(Rhodophyta)和褐藻门(Phaeophyta),分别于2020年7月至2021年6月于小长山岛南山前岩相潮间带(39°13.8′N,122°40.7′E)逐月采集形态完整、长势适中的整株藻体。每种大型海藻设置3个平行组,每组采集10株藻体。
1.2 样品处理
大型海藻用水冲洗,去除泥沙和附着的细小生物,用吸水纸吸干后,将新鲜样品放入1 mol/L的HCl蒸汽中进行熏蒸,过夜,除去碳酸盐。熏蒸后的样品用蒸馏水洗涤,在烘箱(60 ℃)烘干至恒重。将干样品研磨成细粉末,进行碳(总有机碳)、氮(总氮)含量和稳定同位素分析。
1.3 碳、氮含量和δ15N值的测定
样品在辽宁省高校近岸海洋环境科学与技术重点实验室进行分析测定。称取(1.50±0.50) mg大型海藻细粉末,用锡舟进行包样,每组样品做3个平行。碳、氮含量采用元素分析仪(vario PYRO cube)进行测定;δ15N值利用同位素质谱仪(isoprime 100)测定,以大气中N2的氮同位素比值(15N/14N)为标准的相对值,计算出样品的δ15N值(δ15N的分析误差<±0.2‰),计算公式为:
δ15N样品(‰)={[(15N/14N样品)/
(15N/14N标准)]- 1}×1 000
(1)
式(1)中:15N/14N样品为样品中氮同位素比值,15N/14N标准为标准氮(大气中N2)同位素比值。
1.4 海水营养盐含量分析
大型海藻采集的同时,在海水水深1 m处用塑料罐采集5 L水样,立即运回实验室,用孔径为0.45 μm纤维滤膜(津腾微孔滤膜有限公司)过滤后进行海水营养盐含量分析,同时采集3个平行样。水中NO3-N、NO2-N、NH3-N和PO4-P含量分别采用锌-镉还原法、萘乙二胺分光光度法、次溴酸盐氧化法和磷钼蓝分光光度法,依照《海洋监测规范》[21]测定,DIN含量为NO3-N、NO2-N和NH3-N含量之和。
1.5 数据处理
采用SPSS 23.0进行数据处理和统计分析。使用单因素方差分析(One-Way ANOVA)中的 Turkey HSD(0.05)对样品的差异性进行比较,采用Pearson相关性分析大型海藻碳、氮含量、C/N比值和δ15N值与海水氮、磷营养盐含量的积矩相关系数,显著水平设置为P=0.05。
2 结果与讨论
2.1 大型海藻组织碳、氮含量的变化
分析结果显示3种大型海藻组织中碳含量的变化明显不同(图1)。2020—2021年,3种大型海藻组织年平均碳占比从高到低分别为:角叉菜、孔石莼、鼠尾藻,角叉菜比鼠尾藻年平均碳占比高出了11.53%(P=0.011<0.05)。鼠尾藻组织碳占比年平均为(25.43±2.15)%,变化范围为(22.82±0.48)%~(30.11±0.56)%,在3种大型海藻中变化的跨度最大,达到7.29%;孔石莼组织碳占比年平均为(25.80±1.86)%,变化范围为(23.56±0.68)%~(28.88±0.28)%,在3种大型海藻中变化的跨度最小,达到5.32%。孔石莼组织碳占比在2月时达到最高为(28.88±0.28)%,9月最低为(23.56±0.68)%;角叉菜组织碳占比在8月时达到最高为(30.80±0.48)%,3月最低为(24.43±0.65)%;鼠尾藻组织碳占比在3月时达到最高为(30.11±0.56)%,7月最低为(22.82±0.48)%。
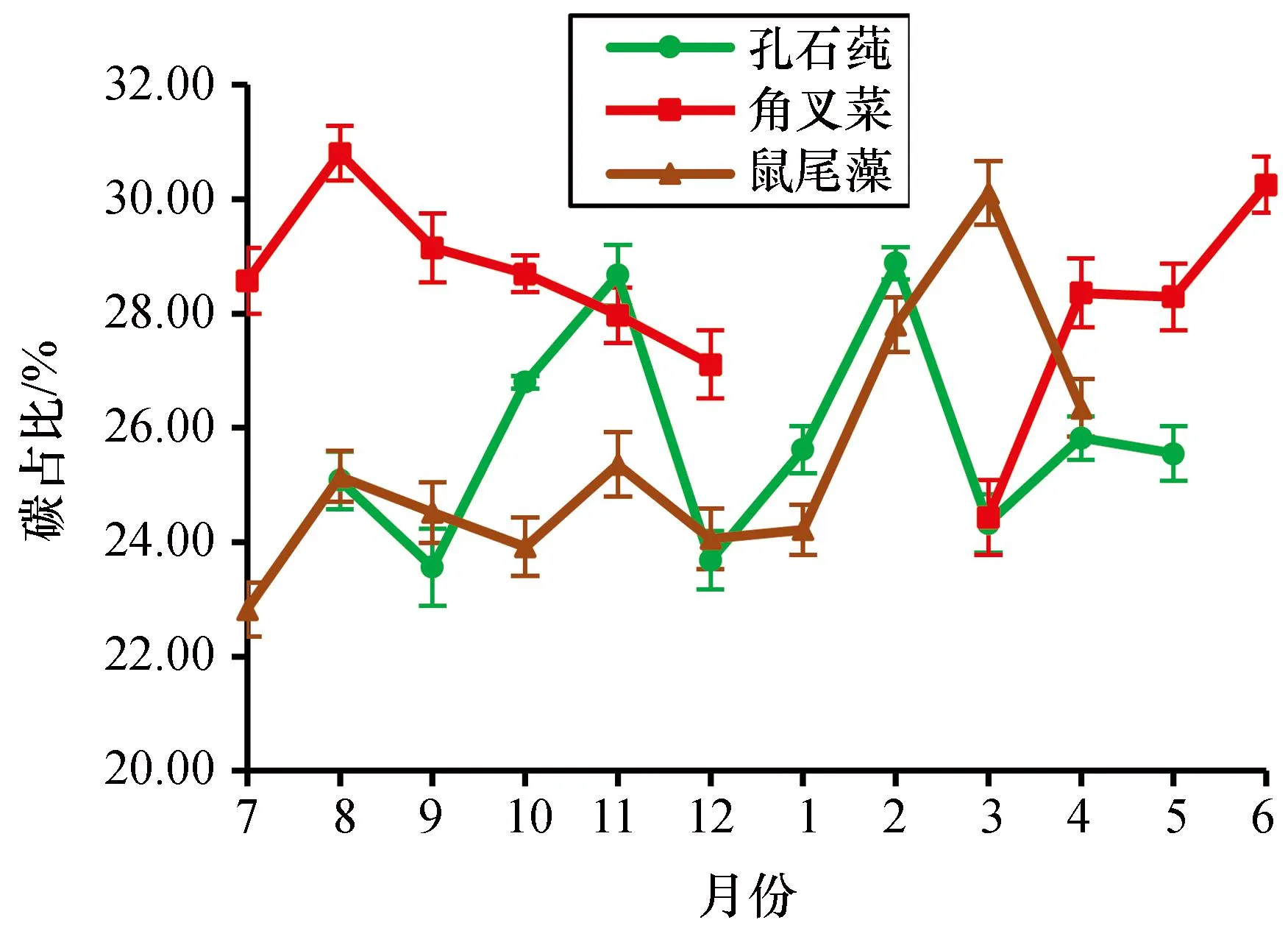
图1 孔石莼、角叉菜和鼠尾藻组织碳占比的变化Fig. 1 Changes in carbon proportions of Ulva pertusa, Chondrus ocellatus and Sargassum thunbergii tissues
从图2可以看出,2020—2021年,3种大型海藻组织年平均氮含量从高到低分别为:孔石莼、角叉菜、鼠尾藻,孔石莼比鼠尾藻年平均氮占比高出了16.74%(P=0.017<0.05)。孔石莼组织氮占比年平均为(3.10±0.33)%,变化范围为(2.63±0.11)%~(3.67±0.13)%,在3种大型海藻中变化的跨度最大,达到1.04%;鼠尾藻组织氮占比年平均为(2.65±0.16)%,变化范围为(2.35±0.20)%~(2.99±0.19)%,在3种大型海藻中变化的跨度最小,达到0.64%。3种大型海藻组织氮含量均在冬季达到了最高,孔石莼和角叉菜组织氮占比在11月达到最高,分别为(3.67±0.13)%和(3.31±0.16)%,鼠尾藻则在12月达到最高,为(2.99±0.19)%;孔石莼组织氮占比在8月最低,为(2.63±0.11)%,角叉菜和鼠尾藻则均在3月最低,分别为(2.43±0.17)%和(2.35±0.20)%。
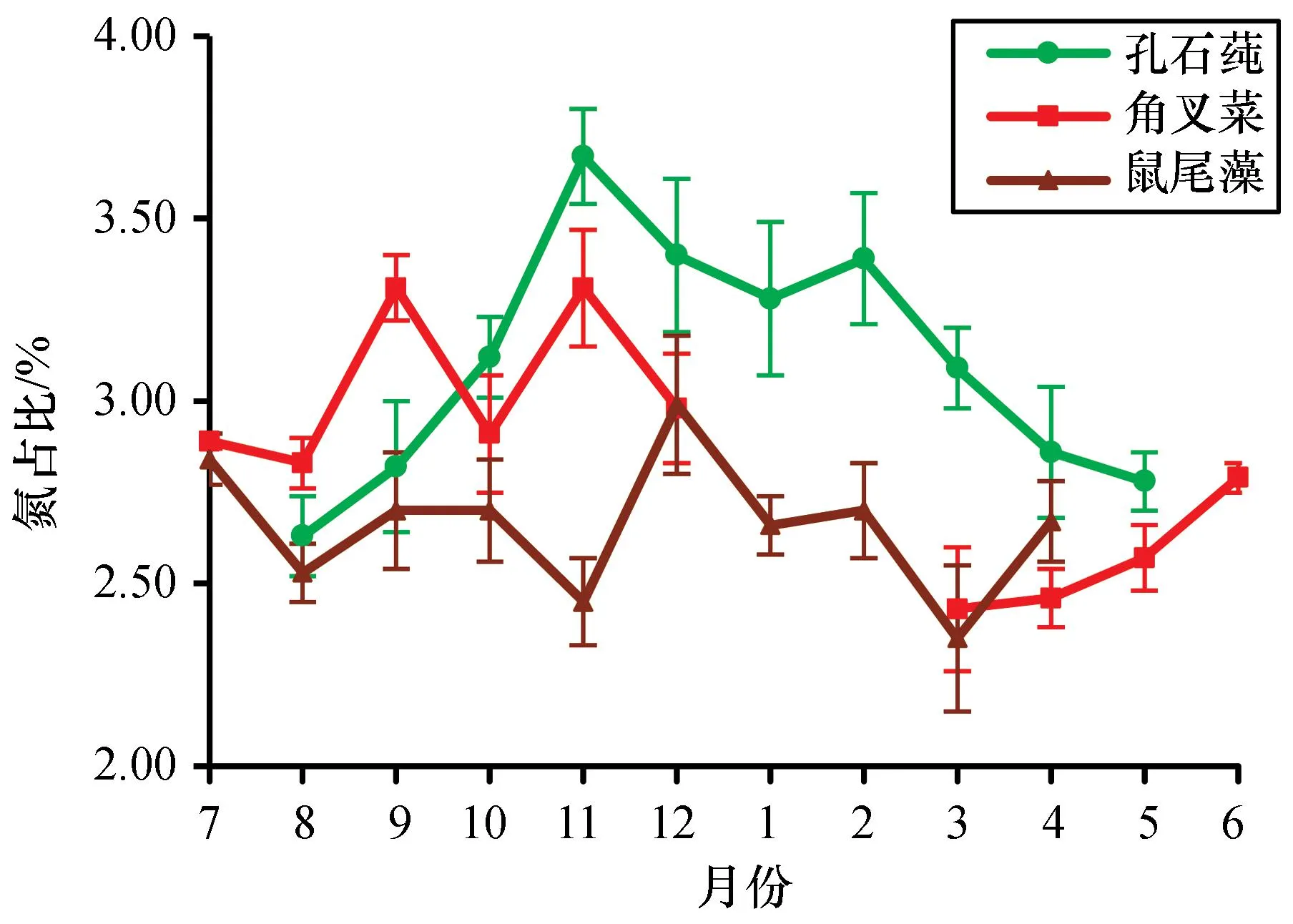
图2 孔石莼、角叉菜和鼠尾藻组织氮占比的变化Fig. 2 Changes in nitrogen proportions of Ulva pertusa, Chondrus ocellatus and Sargassum thunbergii tissues
3种大型海藻组织C/N比值在(6.96±0.33)~(12.81±0.27)之间变动(图3)。2020—2021年,3种大型海藻组织年平均C/N比值从高到低分别为:角叉菜、鼠尾藻、孔石莼。鼠尾藻组织C/N比值平均为9.64±1.39,变化范围为(8.04±0.11)~(12.81±0.27),在3种大型海藻中变化的跨度最大,达到4.77;孔石莼组织C/N比值平均为8.37±0.77,变化范围为(6.96±0.33)~(9.54±0.35),在3种大型海藻中变化的跨度最小,达到2.58。孔石莼组织C/N比值在8月达到最高为9.54±0.35,12月最低为6.96±0.33;角叉菜组织C/N比值在4月达到最高为11.53±0.26,11月最低为8.45±0.30;鼠尾藻组织C/N比值在3月达到最高为12.81±0.27,7月最低为8.04±0.11。
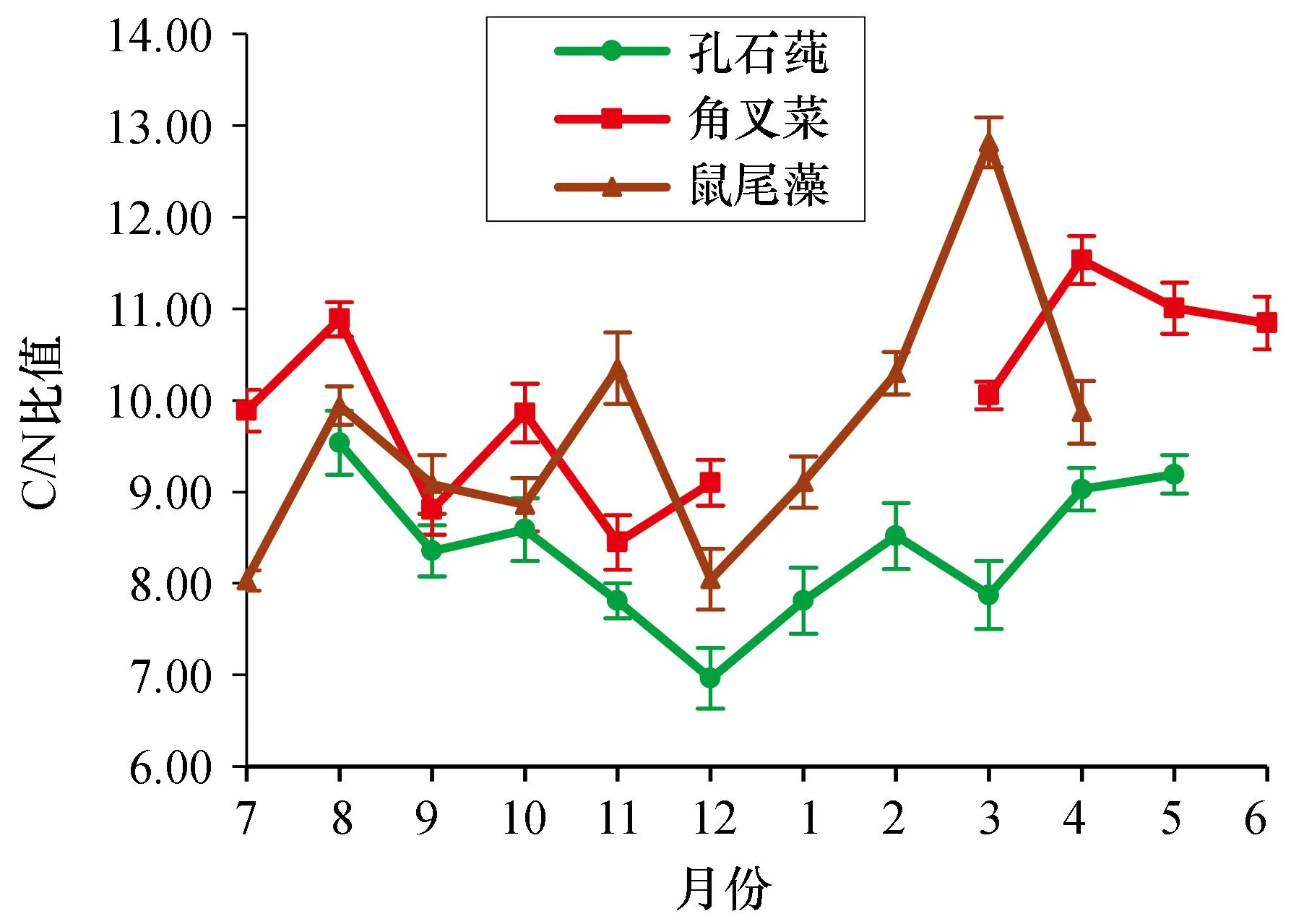
图3 孔石莼、角叉菜和鼠尾藻组织C/N比值的变化Fig. 3 Changes in C/N ratio values of Ulva pertusa, Chondrus ocellatus and Sargassum thunbergii tissues
2.2 大型海藻组织δ15N值的变化
从图4可以看出3种大型海藻组织年平均δ15N值差异性并不明显。孔石莼组织δ15N值年平均为(7.81±0.86)‰,变化范围为(6.49±0.54)‰~(9.27±0.62)‰,在3种大型海藻中变化的跨度最大,达到2.78‰;角叉菜组织δ15N值平均为(8.21±0.70)‰,变化范围为(6.82±0.73)‰~(8.94±0.32)‰,在3种大型海藻中变化的跨度最小,达到2.12‰。孔石莼和角叉菜组织δ15N值在3月达到最高,分别为(9.27±0.62)‰和(8.94±0.32)‰,鼠尾藻则在2月达到最高为(8.84±0.59)‰;孔石莼组织δ15N值在8月最低为(6.49±0.54)‰,角叉菜和鼠尾藻则均在7月最低,分别为(6.82±0.73)‰和(6.28±0.84)‰。
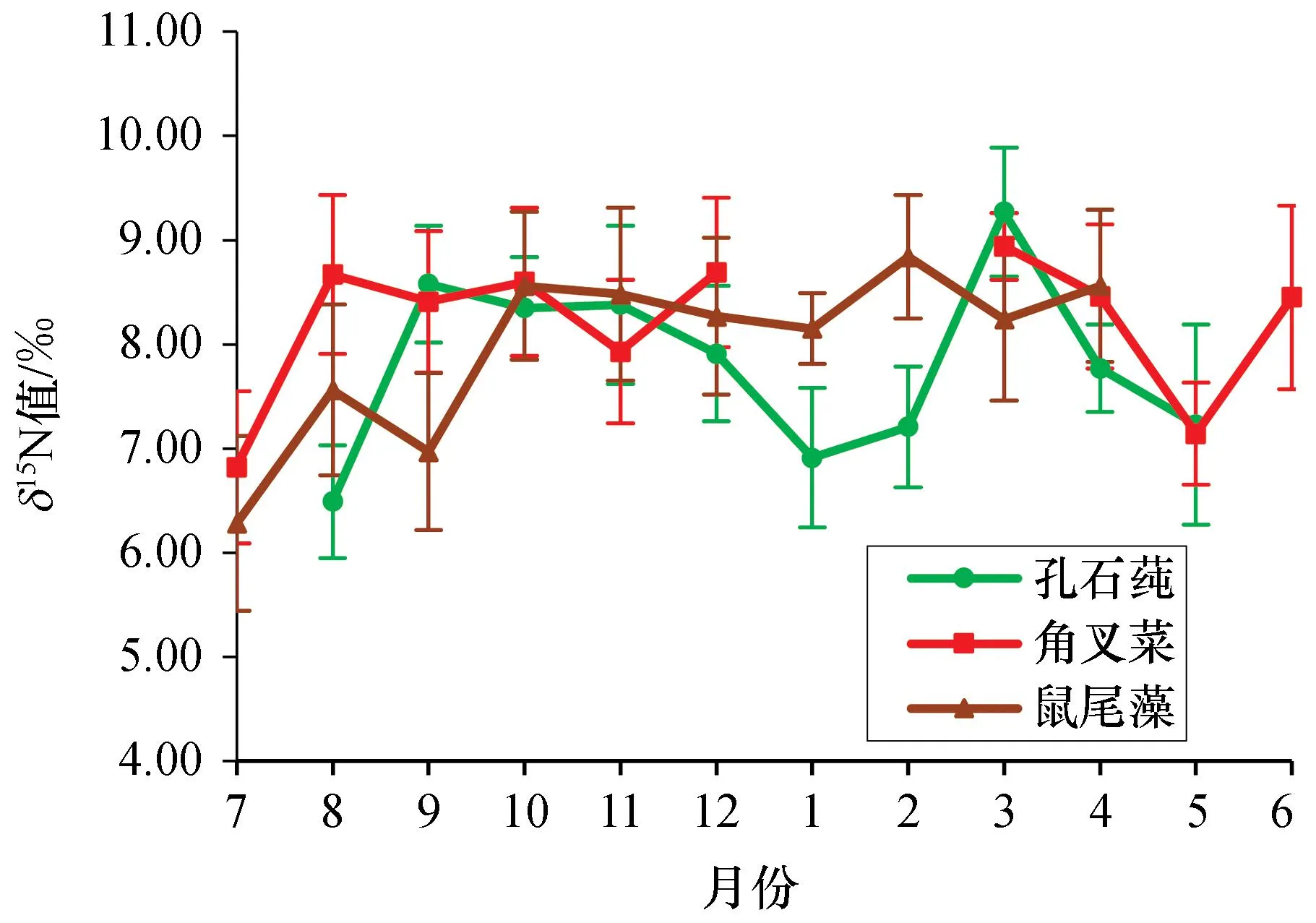
图4 孔石莼、角叉菜和鼠尾藻组织δ15N值的变化Fig. 4 Changes in δ15N values of Ulva pertusa, Chondrus ocellatus and Sargassum thunbergii tissues
2.3 海水中氮、磷营养盐含量变化
从图5可以看出海水中DIN和PO4-P含量的变化。海水中DIN含量的最高值出现在11月,NO3-N、NO2-N和NH3-N含量分别为(0.172±0.003)、(0.012±0.001)mg/L和(0.034±0.002)mg/L;DIN含量的最低值出现在5月,NO3-N、NO2-N和NH3-N含量分别为(0.034±0.002)、(0.012±0.001) mg/L和(0.009±0.001) mg/L。海水中PO4-P含量9月达到最高,为(0.045±0.001) mg/L;4月份达到最低,为(0.008±0.001) mg/L。
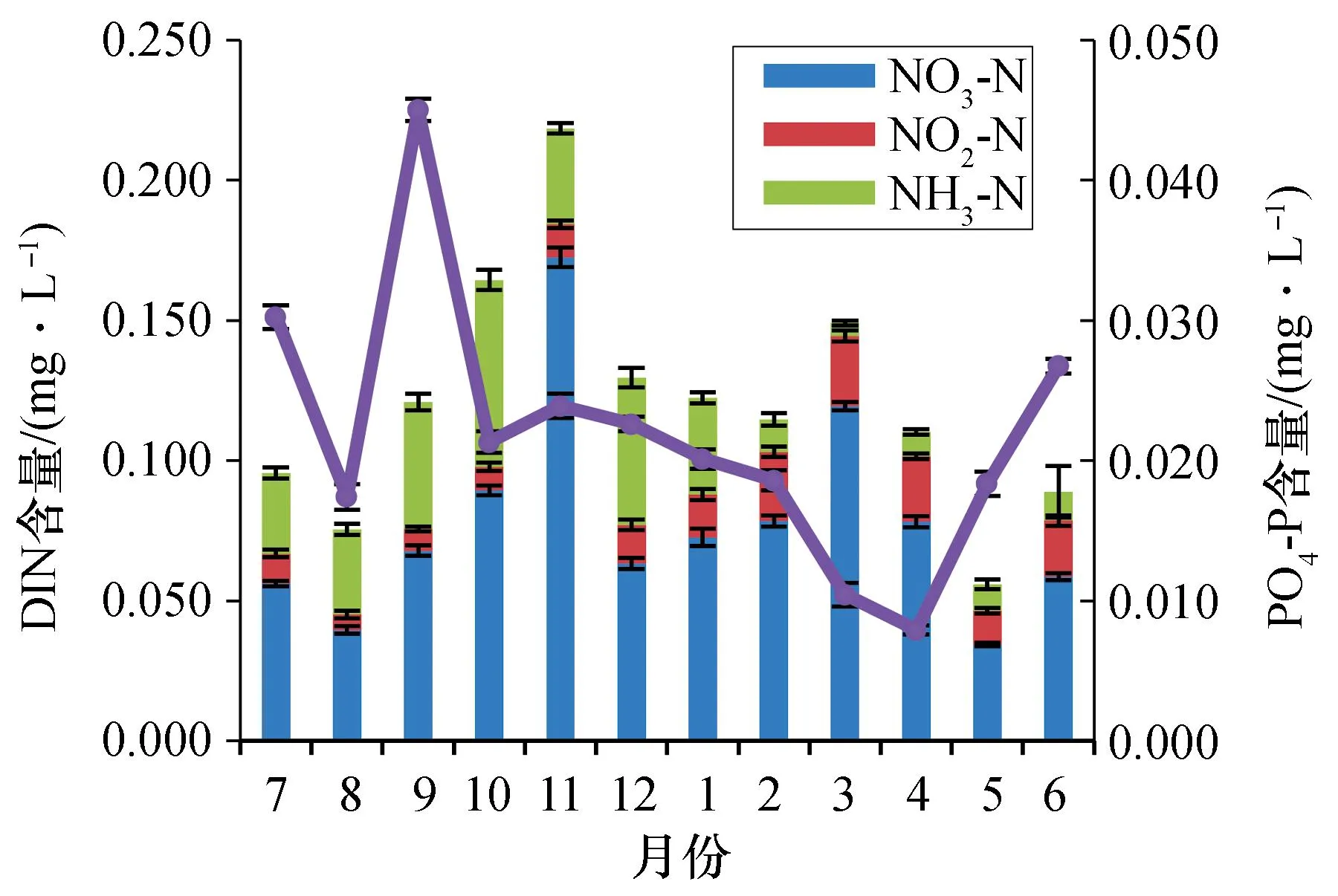
图5 海水中DIN和PO4-P含量的变化Fig. 5 Changes in the DIN and PO4-P contents of seawater
2.4 大型海藻组织碳、氮含量、C/N比值和δ15N值与海水中氮、磷营养盐含量的关系
3种大型海藻组织碳、氮含量、C/N比值和δ15N值与海水中营养盐含量的相关性分析表明,孔石莼组织的氮含量和δ15N值与海水中的NO3-N和DIN含量显著正相关;角叉菜组织的氮含量与海水中的NH3-N含量显著正相关;鼠尾藻组织的碳、氮含量、C/N比值和δ15N值与海水中氮、磷营养盐含量相关性并不显著(表1)。
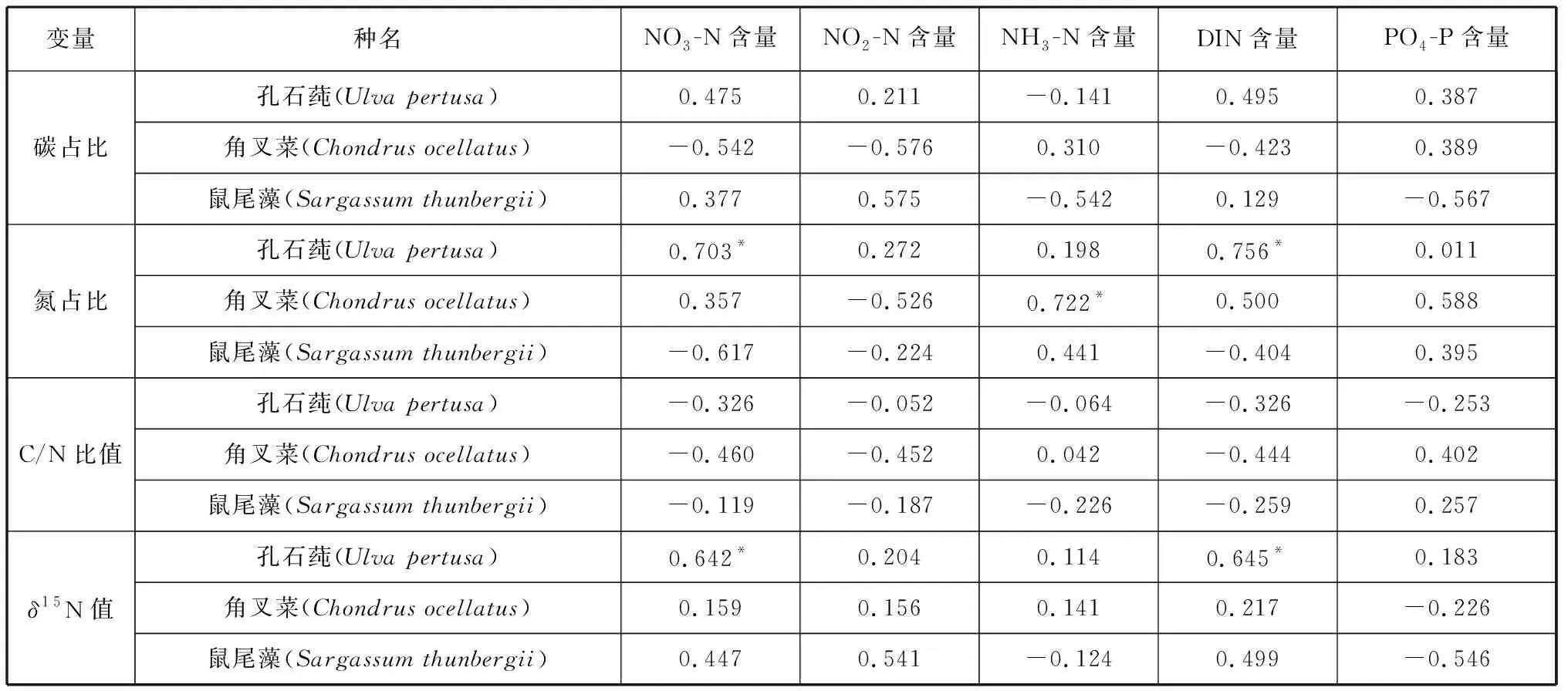
表1 大型海藻组织碳、氮含量、C/N比值和δ15N值与海水中营养盐含量Pearson积矩相关系数Tab. 1 Pearson product-moment correlation coefficients between carbon content, nitrogen content, C/N value, δ15N value of macroalgae tissues and nutrient content of seawater
3 讨论
3.1 大型海藻组织碳、氮含量变化的原因
作为海洋中重要初级生产者之一,大型海藻吸收并储存大量的营养物质,特别是吸收海水中的DIN,所以大型海藻会对海域的富营养化起到缓解和修复的作用[28-29]。前人对烟台潮间带大型海藻组织氮含量进行分析表明其氮占比在1.36%~5.62%之间,并且与水体中的DIN和PO4-P含量变化无关,而是与大型海藻在吸收氮营养盐过程中的生长和储氮机制有关[7]。而本研究发现小长山岛不同种类大型海藻组织的氮含量与海水中营养盐的相关性有所不同,其中孔石莼组织的氮含量与海水中的NO3-N和DIN含量显著相关,角叉菜组织的氮含量与海水中的NH3-N含量显著相关,而鼠尾藻与NO3-N、NO2-N、NH3-N、DIN和PO4-P含量相关性均不显著。大型海藻的营养盐吸收速率因各种物理、化学和生物因素而变化很大。环境中氮的水平会对植物组织的氮含量产生影响,如果环境中的氮营养盐充足,大型海藻会在其组织储存氮[30]。一些生长率较高的大型藻类相对于生长缓慢的大型海藻会需求更多的氮,其组织也会储存更高浓度的氮以支持藻体快速生长过程中氮的消耗[31-32]。不同种类的大型海藻存储氮的来源会有所不同,一些大型海藻对于水中的铵盐吸收速率较高,还有一些海藻更偏好于吸收利用水体中的硝酸盐[33-34]。这可能是造成不同种类大型海藻组织氮含量与海水中不同氮源浓度相关性差异的主要原因。
在自然环境中,海洋底栖大型海藻组织C/N比值的平均值为550/30[35]。海水中的氮营养盐变化直接导致了大型海藻组织氮含量发生改变,C/N比值也会随之发生改变。研究发现,石莼(Ulvasp.)在清洁的海域其组织C/N比值最高可达到30~40,而暴露于养殖废水中这一比值会降到15~20[36],在足够的营养盐环境下这一比值甚至会低于10,达到6.9[37]。本研究发现,3种大型海藻组织C/N比值在(6.96±0.33)~(12.81±0.27)之间变动,其中孔石莼组织C/N比值最低,平均为8.37。可据此推测,小长山岛潮间带海水有充足的可被大型海藻生长利用的营养盐。
3.2 大型海藻组织δ15N值影响因素分析
由于自然界中氮同位素分馏会导致含氮物质δ15N值产生显著差异,因此环境含氮营养盐的不同氮同位素范围在一定程度上反映了不同来源氮的输入,其中大型海藻组织δ15N值通常可以准确地反映陆源氮的输入[38-39]。在同一环境条件下,大型海藻在吸收和利用氮营养盐的过程中发生的同位素分馏导致了其组织δ15N值的差异,可以在0.2‰~50.1‰之间变化[40]。Marconi等通过收集整理1999—2007年发表的分属于4个大洲5个国家潮间带大型海藻组织δ15N值后发现,绿藻门组织δ15N值在-0.1‰~12.40‰之间变化,褐藻门组织δ15N值在-0.75‰~12.40‰之间变化,红藻门组织δ15N值在1.74‰~15.00‰之间变化[41]。本研究发现,小长山岛潮间带绿藻门的孔石莼组织δ15N值在(6.49±0.54)‰~(9.27±0.62)‰范围内变化,褐藻门的鼠尾藻组织δ15N值在(6.28±0.84)‰~(8.84±0.59)‰范围内变化,红藻门的角叉菜组织δ15N值在(6.82±0.73)‰~(8.94±0.32)‰范围内变化,均在Marconi等关于不同种类海藻δ15N值变化范围内[41]。
已有研究发现,大型海藻组织δ15N值不仅能够追踪水产养殖废物氮污染及其他氮的人为来源,而且能够区分自然和人为的氮源[42]。同一种类大型海藻组织δ15N值会发生月际波动,不同种类大型海藻组织的δ15N值也会有所不同,这主要是藻体在吸收利用含氮营养盐的过程中发生同位素分馏所导致的[43]。本试验表明,3种大型海藻组织间δ15N值的变化并无显著的差异,而孔石莼组织δ15N值与海水中的NO3-N和DIN含量显著相关,说明孔石莼组织的δ15N值会受到海水中NO3-N和DIN含量的影响。因此,在小长山岛潮间带,孔石莼适于指示NO3-N和DIN来源。不同氮来源的大型海藻组织的δ15N值会有所不同,源自天然(大气)和合成肥料的硝酸盐δ15N值通常较低,分别在 0‰~4‰ 和-4‰~4‰之间,而生活污水中的δ15N值在5‰~19‰之间,养殖动物粪便中的δ15N值在7‰~26‰之间[44-46]。本研究发现,孔石莼组织δ15N值年平均为(7.81±0.86)‰,在(6.49±0.54)‰~(9.27±0.62)‰范围内变化,所以可以推测小长山岛潮间带海水主要受到生活污水和养殖排放的影响。
4 结论
本研究选取小长山岛潮间带常见的孔石莼、角叉菜和鼠尾藻3种大型海藻,对其组织碳、氮含量及其δ15N值、生长环境的环境因子月际变化进行分析,获得了如下结论:
(1)小长山岛3种大型海藻组织碳占比在(22.82±0.48)%~(30.80±0.48)%之间变化,氮占比在(2.35±0.20)%~(3.67±0.13)%之间变化,C/N比值在(6.96±0.33)~(12.81±0.27)之间变动。孔石莼组织的氮含量与海水中的NO3-N和DIN含量显著相关,角叉菜组织的氮含量与海水中的NH3-N含量显著相关;大型海藻组织碳含量和C/N比值与海水中的碳、氮营养盐含量并无显著的相关性。
(2)3种大型海藻组织δ15N值在(6.28±0.84)‰~(9.27±0.62)‰之间变化。孔石莼组织的δ15N值与海水中的NO3-N和DIN含量显著相关,适于用作NO3-N和DIN来源的指示藻种。
(3)孔石莼C/N比值在(6.96±0.33)~(9.54±0.35)范围内变化,可以推测小长山岛潮间带海水有充足的可被大型海藻生长利用的营养盐;δ15N值在(6.49±0.54)‰~(9.27±0.62)‰范围内变化,推测小长山岛潮间带海水主要受到生活污水和养殖排放的影响。

