高脂饮食与低剂量TCDD联合作用对雌性肥胖易感大鼠肝脏脂质代谢的影响
刘 月 朱 丹 洪煜婧 孙文星 徐广飞*
(1.南通大学附属医院临床营养科,江苏南通 226000;2.南通大学营养与食品卫生学教研室,江苏南通 226000;3.江苏医药职业学院护理学院,江苏盐城 224000)
众所周知,髙脂饮食(high fat diet,HFD)是肥胖发生的重要危险因素,但HFD条件下,并非所有个体均会发生肥胖,Levin等[1]发现,同一种属的大鼠在接受3个月高能量饮食后50%~60%出现肥胖,而40%~50%体质量增长仅与对照组相似或低于对照组,这两种表型的大鼠分别称为肥胖易感(obesity-prone,OP)与肥胖抵抗(obesity-resistant,OR)大鼠。现在已知,OP与OR的产生是遗传与环境(饮食)之间相互作用的结果,OP动物更易表现出肝脏脂质代谢异常[2]。
2,3,7,8-四氯二苯并二噁英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)可造成人和动物多系统和器官的损害,包括皮肤毒性、肝脏毒性、神经毒性、糖脂代谢紊乱以及内分泌紊乱等[3],其中肝脏是TCDD最主要的毒性靶器官[4],暴露于TCDD可以增加脂肪酸转运和游离脂肪酸水平[5],导致实验动物肝脏脂肪变性,进而发展为脂肪性肝炎伴纤维化,其过程与代谢相关脂肪性肝病(metabolic-dysfunction -associated fatty liver disease,MAFLD)的发展阶段相似[6-7]。
尽管有不少研究者分别对TCDD或高脂饮食所致肝脏脂质代谢异常进行过研究,但使用的TCDD剂量较高(一般在8 μg·kg-1·d-1以上),且鲜有高脂与TCDD较长期联合作用对肝脏脂质代谢异常的报道。TCDD对实验动物的肝脏代谢有明显的性别差异,如雄性小鼠肝脏毒性(如转氨酶异常或肝纤维化)较雌性敏感,而雌性大鼠更易出现脂质代谢异常[8]。
为探讨高脂饮食与低剂量TCDD联合作用对雌性OP大鼠肝脏脂质代谢的影响,本研究拟采用2×2析因设计,先以高脂饮食筛选出雌性OP大鼠,再与低剂量TCDD联合作用,观察雌性大鼠肝脏氧化应激及脂质代谢相关指标的变化,实验将有助于分析肥胖易感个体面临高脂饮食及低剂量环境毒素双重作用时是否能增加肝脏脂质代谢异常的发生。
1 材料与方法
1.1 实验动物和分组处理
采用2×2析因设计,研究HFD(脂肪供能45%)与低剂量TCDD(10 ng·kg-1·d-1)联合作用对10周龄OP雌性大鼠(用高脂饮食喂饲6周龄雌性SD大鼠4周,取体质量上1/3作为OP大鼠)肝脏脂质代谢的影响。
96只5周龄无特定病原体(specific pathogen free,SPF)级SD雌性大鼠,体质量120~140 g,购自南通大学实验动物中心[SCXK(苏)2019-0001],动物伦理审查文件编号(S20231204-001),经1周适应性喂养,以高脂饮食(每kg饲料含酪蛋白175 g、玉米淀粉132 g、糊精125 g、蔗糖202 g、豆油30 g、猪油196 g、纤维素62 g、混合矿物质61 g、混合维生素12 g、L-胱氨酸2 g、酒石酸胆碱3 g,饲料能量构成比:蛋白质∶脂肪∶碳水化合物为 15∶45∶40,江苏南通特洛菲实验动物饲料科技有限公司生产)喂养4周,体质量为207.2~291.5 g,按设计要求,取体质量上1/3(246.8~291.5 g)为OP组,共32只,再用随机数字表将筛选出的OP雌性大鼠随机分为4组,每组8只,采用2×2析因设计,4组大鼠接受高脂饮食与TCDD两因素处理,分别为:普通饮食无TCDD处理组(Cont+TCDD 0)、普通饮食低剂量TCDD处理组(Cont+TCDD 10)、高脂饮食无TCDD处理组(HFD+TCDD 0)及高脂饮食低剂量TCDD处理组(HFD+TCDD 10)。各组根据有无TCDD暴露,分别给予10 ng·kg-1·d-1TCDD 及玉米油每周腹腔注射1次,持续13周。每天观察生长情况,记录每周体质量变化。实验结束后采用戊巴比妥钠(40 mg/kg)进行腹腔麻醉后处死大鼠,取其肝脏并称质量,一部分在多聚甲醛中浸泡,一部分置于液氮中-80 ℃冻存。
1.2 肝脏脂肪组织油红O染色
新鲜组织用4%(质量分数)多聚甲醛固定24 h以上。取出组织修切平整,置于15%(质量分数)的蔗糖溶液内,于4 ℃冰箱脱水沉底后转入30%(质量分数)的蔗糖溶液内,再次4 ℃冰箱脱水沉底。将脱好水的组织取出,吸干水分并用OCT包埋剂进行速冻包埋,切片厚度8~10 μm。-20 ℃保存备用。用油红O工作液固定并染色,Harris苏木素复染细胞核。镜下观察染色结果:脂滴呈橘红色至鲜红色,细胞核蓝色。
1.3 肝脏抗氧化指标检测
抗氧化检测试剂盒购自南京建成生物工程研究所,肝组织经匀浆处理后,按试剂盒说明书检测肝组织中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)的活性变化。
1.4 实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction, RT- qPCR)检测
肝脏12种脂质代谢相关基因mRNA表达水平检测包括:乙酰辅酶 A 羧化酶1(acetyl CoA carboxylase1,ACC1)、脂肪酸合酶(fatty acid synthase,FAS)、三酰甘油酰基转移酶1(diacylglycerolacyltransferase1,DGAT1)、单酰甘油脂肪酶(monoacylglycerol,MAGL) 、脂肪组织三酰甘油水解酶(adipose triglyceride lipase,ATGL)、激素敏感脂肪酶(hormone-sensitive lipase,HSL)、乙酰辅酶A氧化酶1 (acyl coenzyme A oxidase 1,ACOX1)、肉碱棕榈酰转移酶1(carnitine palmitoyl transferase 1,CPT1)、微粒体三酰甘油转运蛋白(microsomal triglyceride transfer protein,MTTP)、脂肪酸转运蛋白2(fatty acid transport protein 2,FATP2)、FATP5和脂肪酸转位酶36(cluster of differentiation 36,CD36)。
采用Trizol法从冻存的肝脏组织中提取总RNA。应用反转录试剂盒将RNA反转录为cDNA,使用SYBR Green法进行扩增,β-actin作为内参。Trizol购自上海生工生物工程有限公司,反转录及PCR试剂盒购自日本Takara公司,反应条件:95℃ 5 min,95℃ 20 s,60℃ 30 s,共40个循环。使用2-ΔΔCT公式计算ACC1、ACOX1、ACTβ、ATGL、CD36、DGAT1、FAS、FATP2、FATP5、HSL、MAGL和MTTP的相对表达水平。引物合成由上海生工生物工程有限公司提供,引物序列如表1所示。

表1 引物序列Tab.1 Primer sequence
1.5 统计学方法

2 结果
2.1 HFD与低剂量TCDD联合作用对OP雌性大鼠体质量的影响
图1结果表明:高脂饲料(加或不加TCDD)喂养两组在各时间点体质量均高于普通饲料(加或不加TCDD)喂养两组。从第9周起,高脂组内HFD+TCDD 10体质量均高于HFD+TCDD 0组(P<0.05);普通饲料组内两小组间各时间点差异无统计学意义。

图1 HFD与低剂量TCDD联合作用对OP雌性大鼠体质量的影响Fig.1 Effects of HFD combined with low dose of TCDD on body weight in female OP rats
2.2 HFD与低剂量TCDD联合作用对OP雌性大鼠肝脏脏器系数的影响
大鼠肝脏相对质量即肝脏脏器系数为肝脏全质量(g)/体质量(g)之比值。HFD +TCDD 0组最低,为0.259 4±0.005 6,Cont+TCDD 10组最高,为0.316 5±0.007 7, Cont +TCDD 0组及HFD+TCDD 10组介于前两组之间,分别为0.265 3±0.006 0、0.283 2±0.003 1。两因素方差分析显示,总模型差异有统计学意义(F=6.63,P=0.000 1),两者的联合作用效应也有统计学意义(F=4.35,P=0.011 3)。联合作用效应提示,髙脂饮食与TCDD 10联合作用,能阻滞大鼠肝脏相对质量的增加。
2.3 HFD与低剂量TCDD联合作用对OP雌性大鼠肝脏脂肪蓄积的影响
由图2可见,Cont+TCDD各组基本未见脂肪浸润,HFD+TCDD 0有少量散在红色,但HFD+TCDD 10有较明显增加,方差分析HFD与TCDD的交互学作用P<0.05,表明HFD与TCDD 10联合作用使OP雌性大鼠肝脏出现了最明显的脂肪堆积。
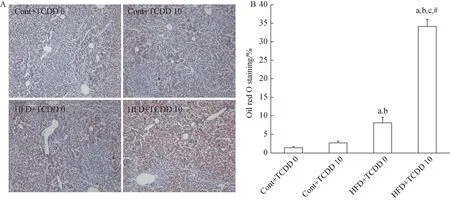
图2 HFD与低剂量TCDD联合作用对OP雌性大鼠肝脏油红O染色的影响Fig.2 Effects of HFD combined with low dose of TCDD on liver oil red O staining in female OP rats
2.4 HFD与低剂量TCDD联合作用对OP雌性大鼠肝脏抗氧化酶活性的影响
由表2、表3可见,髙脂饮食单独作用对肥胖诱导大鼠肝脏SOD和GSH-PX活性影响差异无统计学意义(P>0.05),10 ng·kg-1·d-1TCDD单独作用会导致肥胖诱导大鼠肝脏抗氧化指标SOD(F=4.58,P=0.045)和GSH-PX(F=5.11,P=0.031)酶活性下降;HFD与TCDD两者联合能协同降低肝脏SOD(F=4.31,P=0.039)与GSH-PX(F=5.97,P=0.021)酶活性。

表2 HFD与低剂量TCDD联合作用对OP雌性大鼠肝脏SOD酶活性的影响Tab.2 Effects of HFD combined with low dose of TCDD on SOD enzyme activities in liver of OP rats

表3 HFD与低剂量TCDD联合作用对OP雌性大鼠肝脏GSH-PX 酶活性的影响Tab.3 Effects of HFD combined with low dose of TCDD on GSH-PX enzyme activities in liver of OP rats
2.5 HFD与低剂量TCDD联合作用对OP雌性大鼠脂质代谢相关基因表达的影响
2.5.1 HFD与TCDD联合作用对OP雌性大鼠肝脏脂质合成和三酰甘油水解相关基因表达的影响
与Cont+TCDD 0组相比,Cont+TCDD 10组及HFD+TCDD 10组大鼠肝脏ATGLmRNA表达分别增加1.68和2.02倍,两因素方差分析显示,总模型F=3.69,P=0.037,HFD与低剂量TCDD对ATGL基因表达的影响呈现协同增加作用(F=3.82,P=0.030)。详见表4。

表4 HFD与TCDD联合作用对OP雌性大鼠肝脏脂质代谢相关基因表达的影响Tab.4 Effects of HFD combined with low dose of TCDD on gene expression related to lipid metabolism in liver of OP in rats
除ATGL外,HFD与低剂量TCDD未对本实验选取的大鼠肝脏脂质合成相关基因表达出现联合作用。涉及三酰甘油水解的MAGL的mRNA表达水平,各组间差异亦无统计学意义。
2.5.2 HFD与TCDD联合作用对OP雌性大鼠肝脏脂肪动员和脂肪酸β氧化相关基因表达的影响
与Cont+TCDD 0组相比,Cont+TCDD 10组及HFD+TCDD 10组大鼠肝脏HSL的 mRNA表达分别减少至0.81和0.61倍,两因素方差分析显示,总模型F=4.01,P=0.026,HFD与低剂量TCDD对HSL表达的影响呈现负交互作用(F=3.75,P=0.029),即两者联合作用可抑制大鼠肝脏脂肪酸β氧化。详见表4。
涉及大鼠肝脏脂肪酸 β 氧化的ACOX1及CPT1的mRNA表达水平,各组间差异无统计学意义。
2.5.3 HFD与TCDD联合作用对OP雌性大鼠肝细胞脂质摄取相关基因表达的影响
与Cont+TCDD 0组相比,Cont+TCDD 10组及HFD+TCDD 10组大鼠肝脏CD36 mRNA表达分别增加2.79和3.31倍,两因素方差分析显示,总模型F=5.58,P=0.000,HFD与低剂量TCDD对CD36基因表达的影响呈现协同增加作用(F=7.47,P=0.009)。详见表4。
除CD36外,高脂饮食与低剂量TCDD未对MTTP、FATP2和FATP5等大鼠肝脏脂质转运相关基因表达出现联合作用。
3 讨论
有研究[6]表明,暴露于高剂量TCDD可以增加脂肪酸转运和游离脂肪酸积聚,导致实验动物肝脏脂肪变性。本实验发现单独低剂量TCDD亚慢性(13周)染毒对雌性SD大鼠肝脏脂肪积聚影响不明显,但将HFD与低剂量TCDD联合作用,有促进脂肪在OP雌性大鼠肝脏积聚的联合作用。
暴露于TCDD会显著抑制肝组织内抗氧化酶的活性, Turkez 等[9]使用每天8 μg/kg剂量的TCDD处理大鼠21 d,发现SOD,过氧化氢酶(catalase, CAT)和GSH水平显著下降,并引起了肝脏淋巴细胞浸润,实质变性和脂质积聚。但大多文献报道使用的TCDD剂量均较高,且很少有高脂与低剂量TCDD联合作用对氧化应激指标影响的报道。本研究旨在探讨TCDD与高脂饮食联合作用对大鼠肝脏脂质代谢的影响,所选用的TCDD剂量(10 ng·kg-1·d-1)低于已有报道[10-11]单独研究TCDD肝脏脂质代谢异常的剂量。实验显示, HFD与TCDD(10 ng·kg-1·d-1)联合使用13周,对OP雌性大鼠体质量有协同增加作用,对肝脏SOD及GPX抗氧化酶活性有协同降低作用,该组大鼠肝脏油红染色也表现出最明显的脂肪堆积。本实验使用的低剂量TCDD(10 ng·kg-1·d-1)比较接近环境高污染地区人群TCDD暴露水平,有研究[12]提示我国某些地区人群血清中二噁英类多氯联苯负荷水平较高,对健康的影响亟需重视。本实验结果提示,目前超重肥胖人群如果面临高脂和低剂量有害物质共同影响可能会增加其肝脏脂质代谢异常的发生。
肝脏中脂质摄取、合成与消耗失衡会导致脂质积聚,本实验检测的基因涉及肝脏脂质合成、三酰甘油水解与脂肪动员、脂肪酸β氧化及肝细胞脂肪酸摄取。与肝脏脂质合成有关的基因产物包括ACC1、FAS和DGAT1,其中ACC1和FAS分别是脂肪酸合成限速酶和关键酶,DGAT1是三酰甘油合成最后一步的限速酶;与三酰甘油水解及脂肪动员相关的基因产物包括MAGL和ATGL,其中MAGL负责将三酰甘油分解为游离脂肪酸和甘油,通过游离脂肪酸通路调节脂肪酸代谢网络,ATGL是一种催化三酰甘油第一步水解的重要脂肪酶;与肝脏脂肪酸β氧化和肝细胞脂质摄取相关的基因产物包括:HSL、ACOX1、CPT1、MTTP、FATP2和CD36,其中HSL是催化脂肪酸分解过程的限速酶,ACOX1及CPT1均是脂肪酸 β 氧化的关键酶,MTTP在三酰甘油转运及极低密度脂蛋白组装和分泌中发挥重要作用,FATP5和FATP2均是在肝脏有高表达的脂肪酸转运蛋白家族成员,负责脂肪酸的跨膜转运,CD36是一种脂肪酸转运酶,在促进长链脂肪酸的摄取和细胞内运输中起重要作用。本实验显示,HFD与低剂量TCDD联合作用造成了OP雌性大鼠肝脏脂肪代谢紊乱,尤其是脂肪酸摄取相关基因被诱导(如CD36),脂肪酸β氧化基因被抑制(如HSL)。Lee等[13]发现,TCDD暴露能通过激活芳香族受体诱导CD36基因表达,近年来的研究[14]表明CD36是MAFLD的关键标志物之一,CD36不仅能促进长链脂肪酸摄取,还能增加氧化低密度脂蛋白[13],特异性敲除CD36能减轻TCDD所致肝脂肪变性程度[15]。本研究结果提示CD36基因表达增加可能在HFD与低剂量TCDD联合作用诱导肝脏脂质代谢紊乱中发挥了关键作用,但其机制需要更进一步的研究。
综上,HFD与低剂量(10 ng·kg-1·d-1)TCDD联合作用,可能使OP雌性大鼠体质量及肝脏脂肪出现协同增加,损害肝脏抗氧化酶类SOD和GSH-PX的酶活性;对肝脏脂质代谢相关基因表达的影响表现为:三酰甘油水解酶ATGL和脂肪酸转运酶CD36基因被协同诱导表达,脂肪酸β氧化相关基因HSL的表达被联合抑制,其中CD36基因表达水平的异常增加,可能是HFD与低剂量TCDD联合作用导致OP雌性大鼠肝脏脂质代谢异常的关键原因之一,需进一步增加对其研究。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明刘月: 设计研究方案,进行动物实验,数据分析,论文写作; 朱丹、洪煜婧: 进行动物实验; 孙文星: 动物实验、论文修改; 徐广飞: 提出研究思路,论文总体把关,论文审阅。

