生物化学农药S-烯虫酯防治储粮害虫研究进展
李燕羽, 穆海亮, 胡铁源,, 张洪清, 宋丽雯, 王明亮, 苑江浩
(国家粮食和物资储备局科学研究院1,北京 100037)
(中保粮生物科技(海南)有限公司2,海口 570100)
(甘肃农业大学植物保护学院3,兰州 730070)
为促进我国农业向新型的绿色环保低碳的现代农业的转型升级。国家农药兽药使用减量和产地环境净化行动已实施多年,农药减量的主要措施是使用安全绿色环保的生物农药,助力现代农业发展[1]。生物农药中的生物化学农药作为的一个重要分支,处于起步阶段,发展潜力巨大。
WHO/FAO于1988年定义生物化学农药,一是对靶标害虫没有直接毒杀作用;二是必须是(must be)天然化合物,若是人工合成的,其结构必须(must be)与天然化合物相同。在1988年的定义基础上,2013年修改为应该是(should be)天然化合物;若是人工合成的,其结构应该(should be)与天然化合物相同[2],例如:合成化合物的主成分的分子结构与天然存在的类似物的分子结构相同。中华人民共和国农业部公告第2569号公布了《农药登记资料要求》[3],2017年11月1日起施行。第一次给出我国生物化学农药定义:“2.17生物化学农药,是指同时满足下列两个条件的农药:一是对防治对象没有直接毒性,而只有调节生长、干扰交配或引诱等特殊作用;二是天然化合物,如果是人工合成的,其结构应与天然化合物相同(允许异构体比例的差异)。”主要包括的类别有:化学信息物质、天然植物生长调节剂、天然昆虫生长调节剂和天然植物诱抗剂,以及其他满足生物化学农药定义的物质。
“昆虫生长调节剂”(Insect Growth Regulators,IGR)被用来描述基于昆虫保幼激素(Juvenile Hormone,JH)的杀虫剂[4],后来被扩展到对昆虫有选择性的其他昆虫激素或类似物[5,6]。IGR主要干扰3种生理过程:未成熟昆虫的生长发育;诱导变态;或表皮几丁质的合成[6]。对应3种作用模式的IGR分别为保幼激素类似(Juvenile Hormone Agonists,JHA)、蜕皮激素类似物(Ecdysteroid Agonists)和几丁质合成抑制剂(Chitin Synthesis Inhibitors)[7]。JHA具有较低的脊椎动物毒性[8],因此,它们更具发展潜力。
1 昆虫保幼激素的发现和种类
昆虫的生长发育受JH(一种由靠近大脑的内分泌腺分泌的倍半萜类物质)[9]和蜕皮激素(一种由前胸腺分泌的类固醇,MH)控制[9]。JH能阻止不成熟阶段昆虫发育功能的现象是研究吸血半翅目昆虫Rhodniusprolixus(Stål)时发现的[10]。JH主要有JH 0、JH Ⅰ、JH Ⅱ和JH Ⅲ4种形式(图1),区别在主链上的脂肪族结构。一般情况下,JH0、JH I和JH II存在于鳞翅目昆虫中,而JH III则存在于其他目昆虫中[11]。
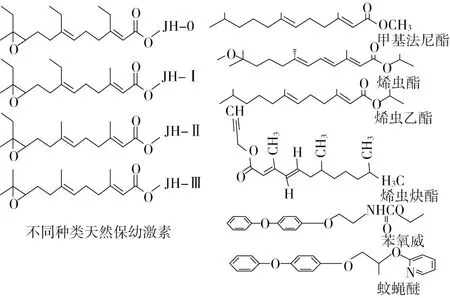
图1 天然保幼激素及其类似物的分子结构
通过对JH进行化学修饰,开发了多种类似物—JHAs。JHA被认为具有与JH相似的作用模式,并具有与JH相似的细胞/核受体[12]。已经开发出的JHAs,与它们的天然对应物JH不同,这些化合物能够抵抗昆虫体内酶的降解[13]。烯虫酯(methoprene)是第一个合成的保幼激素类似物,也是结构上最接近天然JH。随后,科学家们还合成开发了用作杀虫剂的烯虫乙酯(hydroprene)[14]、苯氧威(fenoxycarb)和蚊蝇醚(pyriproxyfen)[6]。烯虫酯、烯虫乙酯和烯虫炔酯(kinoprene)是脂类化合物,在昆虫体内具有化学稳定性和抗降解性。苯氧威和蚊蝇醚是芳香族化合物[13](图1)。
2 作用机理
JH在细胞和分子(基因组)水平发挥作用。在细胞水平,蜕皮过程中蜕皮激素浓度升高时,细胞内存在的JH可阻止幼虫变成蛹。从基因上讲,幼虫蜕皮、化蛹和羽化变态都是通过暂时抑制介入基因组来调节的。在幼虫最后一龄,JH浓度较低,通过增加蜕皮激素滴度来永久性抑制幼虫特异性基因和改变细胞结合力,从而形成蛹。这一作用是不可逆转的,确保不会因为后期JH浓度升高出现蛹态到幼虫态的逆转。但虫体上所有细胞的变化并非同步,使得在外部JH的干扰作用下,产生具有半幼虫和半蛹的昆虫虫态[13]。
另外,JH的主要功能是影响蜕皮激素作用,这些作用包括表皮细胞功能的改变,可影响蜕皮激素在特定阶段已经形成的基因表达,也可调节自身的基因表达。JH和蜕皮甾体都是在细胞水平上起作用的,即在细胞核内同一异二聚体的不同组分结合,也就是说JH可调节蜕皮甾醇的功能。此外,在飞蝗LocustamigratoriaL.中,JH诱导转录因子(蛋白质)与称为JH反应元件的DNA序列结合。JH还可干扰蜕皮激素诱导的基因,即当与一种由蜕皮激素诱导的细胞核受体E75A结合时,JH抑制由JH和蜕皮激素调节的某些基因的激活。在幼虫蜕皮过程中有JH和20-羟基蜕皮激素(20-HE)参与,核受体E75A的合成也参与在这过程中。E75A激活负责幼虫生长的JH诱导基因,但抑制另一组编码负责蛹性状表达的基因。蜕变过程中,JH浓度降低,蜕皮甾体浓度出现一个小峰值。另一组基因BR、E74和E75在没有JH的情况下被20-HE激活,这些激活的基因可激活其他一些有利于蛹发育的基因[10]。在咽侧体合成的JH通过血淋巴结被JH结合蛋白(JHBPs)运输到靶组织[15],到达靶组织后,JH的作用可能通过诱导蛋白激酶C信号通路的细胞表面受体介导[16],或者通过细胞内受体调节基因表达[17,18]。
S-烯虫酯作为一种昆虫保幼激素类似物,对昆虫不产生直接致死作用,而通过破坏或干扰昆虫体内激素平衡,造成昆虫内分泌紊乱,使幼虫不能完成生长变态和性成熟而死亡,如幼虫不能正常蜕皮和蛹不能正常羽化等问题,同时还可使成虫产生不孕现象,进一步降低害虫种群。药剂具有靶标生物特异性和极高保幼激素活性,特别是在有限环境或区域内长期应用时,随着时间的延长,1~2个月后害虫种群数量受到明显的抑制,3~6个月以后种群基本灭绝。因此,S-烯虫酯可称为害虫种群“抑制剂或灭绝剂”,简称“抑灭剂”。普通果蝇D.melanogaster首次鉴定出耐烯虫酯的结构域蛋白helixe-loope-helix(HLH)/Per-Arnt-Sim(PAS),这种被称为烯虫酯耐受蛋白(Met)的bHLH-PAS蛋白同源物,在赤拟谷盗[19]中发现了同源物,JH及其类似物通过其起作用。在赤拟谷盗中,Met与另一种bHLHPAS蛋白——Taiman可以与JH、烯虫酯和其他JHAs结合,作为转录调节因子来驱动抑制变态的基因表达[20]。Met似乎通过调节多种基因发挥其抑制作用,与一种充当JH信号的介体早期JH反应基因的Krüppel同源物(Kr-h1)一起,控制许多昆虫虫种的变态[21]。受Met及其同类影响的基因仍有待确定,但证据表明,Met是调控昆虫发育和蜕皮复杂过程的重要组成部分。
3 生物学效应
自20世纪70年代以来,关于烯虫酯对未成熟昆虫的直接毒性已有大量的实验室研究[22-27],最近研究更多地集中在亚致死效应上,因为这些结果更能说明实际防治效果[28-32]。JHAs最常见的影响是蜕皮期间维持幼虫状态,被认为是“现状”激素[33],产生多龄幼虫,形成生命阶段之间的形态中间体[23],延迟化蛹,最终使幼虫和蛹死亡[26,34]。亚致死效应包括对雄雌虫生殖的影响[35-40]、卵黄形成[39]、胚胎发育[41]、滞育[42]、信息素合成[43]、取食[44]和交配[45]行为。
昆虫发育过程中有一个关键阶段对JH特别敏感,可通过对其调节进行防治[40]。如幼虫蜕皮过程中需要JH的存在[46],JH和蜕皮甾体(MH)的相对浓度决定了蜕皮的类型,如幼虫至幼虫蜕皮或幼虫至蛹蜕皮[9]。通常在全变态昆虫中,在幼虫最后虫龄期间,也就是幼虫化蛹期间,JH量会降低[47],而MH浓度增加[9]。这些模式存在于昆虫变态的内分泌调节过程中,但不同虫种之间有差异[48]。
4 害虫抗性研究
首次使用JHAs时,鉴于昆虫在其多个发育阶段都严重依赖激素调节,所以认为昆虫不会对这些化合物产生抗药性[4]。但研究对其他杀虫剂产生抗药性的昆虫种群时发现,对JH或其类似物也具有抗药性[49,50]。在双翅目[51,52]和鞘翅目昆虫[53,54]中都检测到对烯虫酯的抗性。澳大利亚报告了谷蠹对烯虫酯的抗性,抗性群体主要表现在死亡率和子代种群的应用剂量上,完全抑制子代需要的质量分数为40 mg/kg[55]。不同地理种群的谷蠹对S-烯虫酯的抗性水平不同[55]。此外,蚊蝇醚(pyriproxyfen)的抗药性也有报道[41]。
早期有一些研究关于昆虫种群如何对JHAs产生抗性的观点。研究认为,局部应用JH I时,在角质层部分,药剂从角质层渗透到组织的有延迟[56]。蜕皮过程中虽然角质层脱落,但残留的烯虫酯还会传递到随后的龄期[57],并且能降解其他杀虫剂的酶也可以降解JH[57],因此通过提高多功能氧化酶水平对杀虫剂产生抗药性的昆虫应该也会表现出对JHA产生抗性[58]。然而,目前昆虫对烯虫酯产生抗性的机制尚未得到充分阐明[59]。通过模式昆虫D.melanogaster研究证明,由于JH受体与JHA的亲和力发生了改变,靶标位点变得不敏感[60]。乙酰甲烷磺酸盐诱导突变产生大量突变的Met等位基因,发育出现轻度或极端缺陷,并产生不同程度的JHA抗性。虽然并不是所有的Met突变等位基因都能在自然种群中存活,但从果蝇出现多个耐受Met突变等位基因结果表明,其他物种可能也会出现基因突变,使昆虫对JHA产生抗性。
5 毒理实验
S-烯虫酯对人畜的毒性极低或没有毒性。采用14C示踪S-烯虫酯在环境土壤中和动物体内的完整降解途径,最后的代谢产物为CO2[61]。
5.1 急性毒性
由图2可见,S-烯虫酯对大鼠的经口、经皮、吸入均为LD50>5 000 mg/kg,LD50=34 000 mg/kg剂量是化合物的毒理测试剂量上限,说明S-烯虫酯基本无急性毒性,归类为最低级别,微毒[62]。初期兔子的眼睛刺激和皮肤刺激研究表明,S-烯虫酯局部接触,不会引起眼睛刺激和皮肤刺激。同样,对豚鼠的实验数据显示,皮肤不会对S-烯虫酯产生致敏。
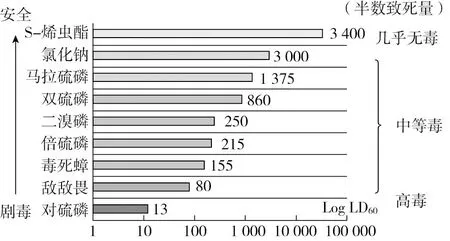
图2 S-烯虫酯与其他杀虫剂和氯化钠的毒性数据比较
5.2 亚急性和慢性毒性
为了更好地评估短期接触的健康风险,对大鼠和狗饲喂实验90 d。每天喂大鼠的剂量分别是0、250、500、1 000 mg/kg或5 000 mg/kg以及每天喂狗的剂量分别是0、250、500 mg/kg或5 000 mg/kg。500 mg/kg剂量下大鼠和狗都无可观察影响水平(No Observed Adverse Effect Level,NOAEL)。另外分别对大鼠和小鼠进行了长期饲喂实验。每天用0、250、1 000 mg/kg或5 000 mg/kg的食物浓度饲养大鼠了2年并没有显示任何不利健康影响,甚至在上限最高剂量与对照组比较也没有差别,无肿瘤发生率被观察到。在最高剂量5 000 mg/kg,系统显示无可观察影响。另一组用每天0、250、1 000 mg/kg或2 500 mg/kg烯虫酯浓度饲喂小鼠18个月,无潜在肿瘤发生率增加被观察到,饲喂组没有发现显著的健康影响。由于有些小鼠在高剂量的喂养中,肝脏有些棕色素存在,因此系统无可观察影响水平对小鼠的实验定在每日250 mg/kg。基于毒理数据,美国环境保护总署(EPA)认为烯虫酯不是一个致癌物质[62]。
5.3 致突变和致畸形
美国环境保护总署(EPA)有烯虫酯对动物发育和生殖影响的完整数据。烯虫酯对兔子和小鼠发育无毒。兔子的NOAEL是2 000 mg/kg,小鼠是600 mg/kg。大鼠三代生殖研究结果表明对生殖影响NOAEL是2 500 mg/kg。如此高的NOAEL,均为最高剂量测试上限,因此可认为无论是孕期或幼儿接触烯虫酯不会有成长发育的不利影响。致突变性检测(Ames)和诱变性实验的结果为阴性,说明S-烯虫酯不是诱变性化合物[62]。
5.4 人体接触途径
5.4.1 取食
从食物接触S-烯虫酯的可能性很小,一般从其处理过的菌类、谷物、或者饲喂后含有微量残留的牛肉、脂肪或者乳品。S-烯虫酯已经使用了近三十年(之前使用消旋烯虫酯),至今鲜有S-烯虫酯引起的食物风险报道[62]。
5.4.2 饮用水
从饮用水接触到S-烯虫酯的可能性很小。水溶液或土壤中,在日照的条件下S-烯虫酯迅速分解/光解,产物是二氧化碳降解物(图3、图4)[61]。因此,可以认为饮用水不是人们接触S-烯虫酯的附加因子。
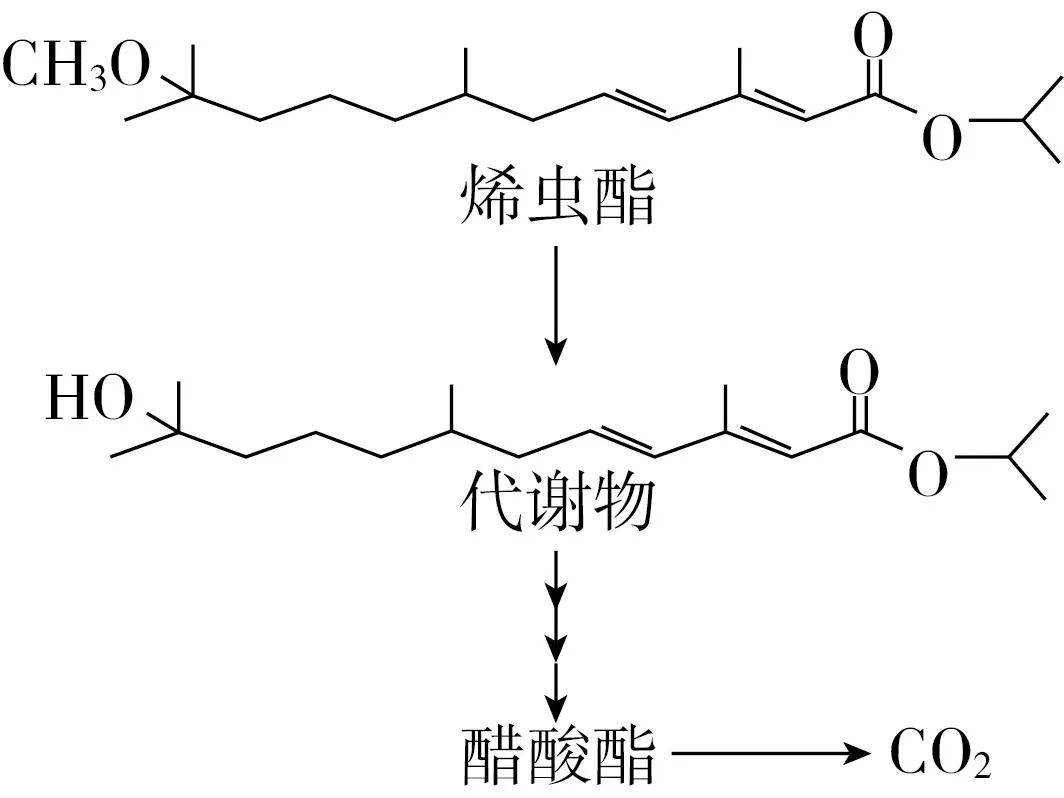
图3 S-烯虫酯在土壤中的降解途径[61]
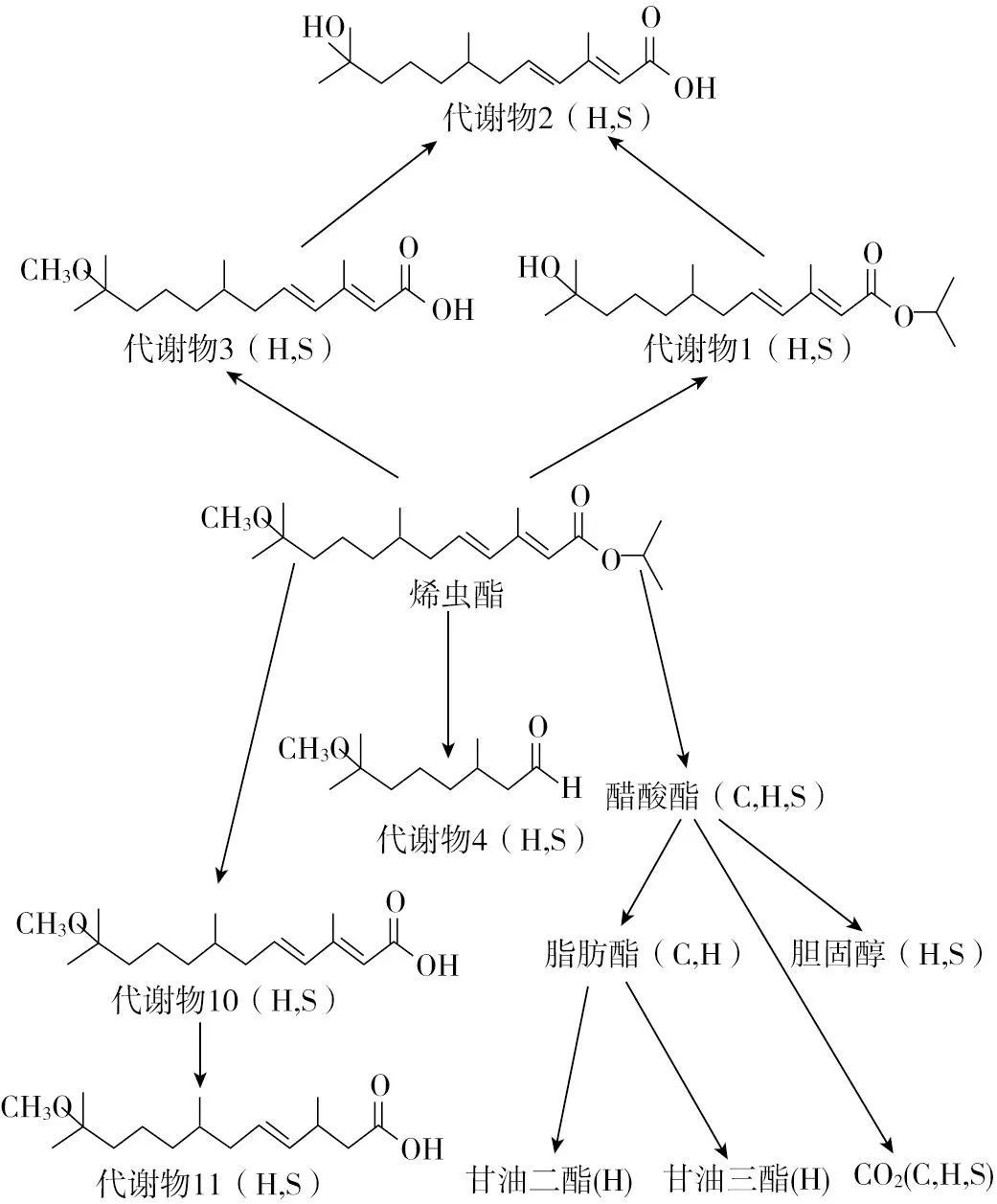
图4 S-烯虫酯在哺乳动物中的代谢途径(C=奶牛,H=母鸡, S=肉用公牛)[61]
5.5 使用过程中
鉴于S-烯虫酯的经皮和吸入毒性归类是微毒级,因此使用混合器、装载机械和播撒器械施药时,经皮和吸入接触可以忽略,即非食物性摄入接触可能性很小。施药者健康风险评估报告表明职业性接触S-烯虫酯的人群风险可接受[63]。
6 残留限量标准
美国联邦法规40CFR180.1033中规定,烯虫酯用于防治食品中害虫幼虫时,残留无限量要求。该法规自2003年起实施,一直处于有效状态[62]。S-烯虫酯2018年在中国首次取得登记,2019年中国首次在食品中规定了烯虫酯的最大残留限量,即烯虫酯在稻谷中残留限量10 mg/kg[64]。
7 烯虫酯的应用
7.1 烯虫酯在国外的应用
烯虫酯自20世纪70年代起开始在美国登记使用,含有R-和S-异构体[65]。2002年,Central Life Sciences重新引入为Diacon®Ⅱ,仅含有S-异构体的烯虫酯,质量浓度为288 mg活性成分[AI]/mL[66]。2011年,该配方被Diacon®IGR取代,其活性成分含量相同[67]。目前应用市场主要为北美、欧洲、大洋洲等区域,用于控制西尼罗疟疾、登革热、乙脑等蚊媒传播流行病,以及抑制储藏物害虫、红火蚁、菇蝇、牛蝇、跳蚤和蟑螂等。在美国,烯虫酯是不具有旋光性的烯虫酯和具有旋光性的S-烯虫酯的统称,它可直接用于谷物,作为谷物保护剂。还可用于工厂、仓库和食品加工厂储存设施等空间防虫杀虫应用。也可以作为宠物食品包装处理[68]。在澳大利亚,烯虫酯被注册为谷物保护剂[69]。烯虫酯于1977年在加拿大注册用于蚊虫控制[70],但尚未在储藏物上注册。在畜牧饲料中添加S-烯虫酯,有效阻止牲畜粪便中吸血角蝇的产生,达到增重、提升牛奶质量和数量,以及牛皮质量(ALTOSID©IGR商品资料)。联合国世界卫生组织(WHO)认定S-烯虫酯是可以在饮用水中投放的消杀剂,以控制登革热、疟疾等媒介传播致死传染疾病的暴发[71]。日本用于环境、公共卫生、畜牧保健、桑蚕增丝等方面。新西兰有十多年的应用经验,从而根治了外来生物南方盐沼蚊。欧盟认为S-烯虫酯是低风险生物灭杀制品,用于莱茵河流域灭蚊。2004年FAO推荐S-烯虫酯为绿色储粮首选防护剂。
当赤拟谷盗成虫预先暴露于烯虫酯时,其耐热性降低。然而,在赤拟谷盗幼虫期尚未检测到这种影响[30]。由于热处理广泛应用于食品工业以及商品的结构处理,将热处理与烯虫酯的效果相结合,可以降低此类处理的总成本。基于烯虫酯的作用机理和生物学效应,早期主要是将烯虫酯与其他杀虫剂联合使用,目的是防治害虫全虫态。当烯虫酯与其他杀虫剂联合使用时,如与硅藻土杀虫剂、甲基毒死蜱[72]、多杀菌素[54]、以及除虫菊酯[29]一起使用时,通常会产生增效作用[65],如烯虫酯与硅藻土联合使用可以提高糙米中谷蠹的死亡率[8,73]。与其他昆虫生长调节剂联合使用时,如与除虫脲结合,可以减少米象和谷蠹的后代数量[74]。在谷物中,烯虫酯对于赤拟谷盗[75]和谷蠹有24个月的防治效果,而对于防治麦蛾[76]、象甲科[77]等隐蔽性害虫还需要添加别的药剂,因为烯虫酯无法穿透粮粒。
7.2 烯虫酯在国内的应用
合成S-烯虫酯所用核心工艺是手性双键转移工艺生产,属生物化学工艺,该工艺所用起始原料约30种,经过八步生物化学合成反应,直接生成光活性物质。而消旋烯虫酯是在合成生产技术水平较低时的产物,S-烯虫酯很难被分离出来。科学家们经过几个世纪的努力和探索,终于在20世纪80年代在不对称合成上有了重大突破。工艺不单是一个简单的提纯工作,而是用生物化学新技术直接生产光活性产品,不涉及任何除去副产物或杂质的提纯,工艺路线温和巧妙。市场上其他的烯虫酯[CAS∶40596-69-8]是R∶S=50∶50的消旋体,无旋光度,活性成分<50%,R为无效体,国际上已淘汰或停止使用。国内已有公司突破了美国对中国的长期技术封锁,合成的构型S的活性物质,具有+5.6°旋光度,活性成分接近100%,是国际上目前广泛应用的杀虫防虫产品。全国农药标准化技术委员会秘书处根据命名原则,及征求专家的意见的基础上,下函同意将(2E,4E,7S)-11-甲氧基-3,7,11-三甲基-2,4-十二碳二烯酸异丙酯的化合物命名为S-烯虫酯,作为其通用名。具有旋光性的光学异构体S-异构体的烯虫酯,称为S-烯虫酯(R∶S=2∶98),与天然昆虫保幼激素JH结构类似(图1),功能相同,活性更高,比烯虫酯的活性高10倍以上,是天然保幼激素的千倍以上。2018年以来,我国先后在江苏、安徽、浙江等9个省中储粮粮库、地方储备粮粮库等开展了实仓试点研究,包括稻谷、玉米、小麦和大豆四大储粮品种,通过对整个储藏周期害虫种群变化监测,发现结合入仓初期的害虫消杀处理,S-烯虫酯能很好控制粮堆害虫种群的作用,整个储藏期处于无虫粮的状态,长期防治效果好,持效期长。同时,为了保证药剂均匀喷施在粮粒上,开发了一系列入仓喷施设备。
7.3 烯虫酯的残效期
烯虫酯稳定性比较好,在20~35 ℃之间持续24周或在65 ℃条件中持续48 h[78]。应用于表面处理时,烯虫酯防治效果随着时间延长而降低,不同材料成分降低速度不同。混凝土是一种典型的粮仓地面,也常用于磨坊、仓库和食品加工厂。许多研究报告表明,与其他表面相比,杀虫剂在混凝土表面上应用效果会降低[78-80]。混凝土表面效果降低的可能原因是其高孔隙率增加了杀虫剂表面渗透,高pH(约10.5)增加了杀虫剂的水解[79]。混凝土表面的粉尘也会进一步稀释烯虫酯的药效[78],其他触杀剂也有类似的情况发现。相比之下,粉末的存在不会降低烯虫酯对上漆木上的应用效果[78]。
8 结论
烯虫酯药效与虫种、虫态、粮食品种、处理表面结构、环境条件等因素有关。最初的实验主要探讨烯虫酯对未成熟昆虫的直接影响,而最近的研究主要集中在亚致死效应影响。与传统神经毒性杀虫剂相比,烯虫酯对脊椎动物无毒是一个明显的优势,它的主要局限性表现在对成虫无杀灭作用,但可以产生降低其繁殖力、生活力、耐热性、产卵效应等亚致死效应。烯虫酯对昆虫许多生理功能的影响,与其他杀虫剂、生物/非生物因子的协同增效效应说明JHAs在控制储粮害虫方面的潜力。而且随着合成生物学以工程化设计理念对生物体系进行改造和优化,建立天然产物生产新模式,可提高合成效率,大大降低成本。因此,研究烯虫酯如何干扰储藏物昆虫的耐热性和种群数量,如何干扰不同的感受系统(器官),以及开发新的害虫防治途径,从而为应用S-烯虫酯等绿色安全的生物和物理技术,防治有害生物危害,减少它们造成的粮食损失,对于国家粮食安全、食品安全、保护环境、绿色高质量发展、建设生态文明和大健康中国等方面有重要意义。

