黑果枸杞不同组织花青苷组分及相对含量研究
陈生蓉,史国民,叶广继,郭佳磊,何涛*
1(省部共建三江源生态与高原农牧业国家重点实验室(青海大学),青海 西宁,810016)2(青海大学 农牧学院,青海 西宁,810016)3(青海省农林科学院,青海 西宁,810016)4(中国科学院西北高原生物研究所,青海 西宁,810001)
黑果枸杞(LyciumruthenicumMurr.)是茄科(Solanaceae)枸杞属(Lycium)植物,主要分布在新疆、宁夏、西藏、甘肃和青海等地[1]。作为中国西北地区代表性沙漠作物,环境适应能力强,能够生长在干旱、高盐碱地区,对生态保护具有重要作用[2-3]。同时,黑果枸杞果中含有丰富的花青苷,具有预防和治疗多种癌症和代谢疾病的作用[4-6],被广泛应用于医药、食品和天然食用色素等领域[7-8]。因此,兼具生态保护和经济价值的黑果枸杞在中国西北地区被大面积种植。研究黑果枸杞花青苷的合成调控机制对培育优良品种和进一步开发其潜在的利用价值至关重要。
目前,黑果枸杞成熟果中鉴定出的花青苷有37种,其花青苷的苷元包含常见的6类花青素。其中,矮牵牛素类花青苷占黑果枸杞中总花青苷含量的95%以上[9-11],主要成分是矮牵牛素-3-反式香豆酸-芸香糖苷-5-葡萄糖[petunidin-3-O-rutinoside(trans-p-coumaroyl)-5-O-glucoside, PRG],其含量占比达到总花青苷含量的80%[12-13]。对黑果枸杞不同发育阶段果中PRG含量变化研究表明,青果中PRG的含量最低,随着果的发育,PRG不断积累含量显著增加,花青素合成相关基因LrAN2在果中的表达与PRG含量呈正相关性[12]。对果中花青苷合成调控网络研究发现LrAN2-like与LrAN1b和LrAN11相互作用形成MBW(MYB-bHLH-WD40)蛋白复合体,调节下游靶基因LrDFR和LrANS启动子调控花青素合成。当果实发育后期花青素积累过高时,MBW复合体会激活LrMYB3和LrETC1抑制子基因实现反馈抑制[14]。花青素合成调控是一个复杂多变的过程,其中还涉及甲基转移酶(methyl transferase, MT)、类黄酮糖基转移酶(UDP-flavonoid glucosyl transferase,UFGT)和酰基转移酶(acyltransferase,BAHD)对合成的花青素进一步修饰,形成更稳定的花青苷[15]。因此,黑果枸杞花青素合成调控机制值得进一步研究和分析。对黑果枸杞花青苷的研究主要集中在果中花青苷的定性定量及花青苷的抗氧化活性[16-18],MBW复合体及结构基因调控花青素合成方面[19-21]。缺乏黑果枸杞生长发育过程中组织花青苷组分及相对含量的变化研究。
本研究以生长于青藏高原地区的野生黑果枸杞为研究对象,采用超高效液相色谱串联四级杆飞行时间质谱(ultra performance liquid chromatography-electrospray ionization-quadrupole time-of-flight mass spectrometry, UPLC-ESI-QTOF/MS)和超高效液相色谱三重四级杆线性离子阱质谱(ultra performance liquid chromatography- quadrupole-Trap-mass spectrometry, UPLC-Q-Trap-MS)多反应监测(multiple reaction monitoring, MRM)模式,研究了黑果枸杞不同生长时期组织中花青苷的组分和相对含量的变化,以期为黑果枸杞花青苷的合成调控和形成机制研究提供基础数据。
1 材料和方法
1.1 材料和试剂
黑果枸杞不同生长时期的组织采自青海省海西蒙古族藏族自治州都兰县荒漠地区,采集的新鲜组织装入液氮冷冻运输。黑果枸杞样本信息如表1所示,黑果枸杞植株和组织照片如图1所示。组织样品冷冻干燥,磨细混匀,储存于-20 ℃冰箱待用。矮牵牛素葡萄糖苷(Petunidin-3-glu)、矮牵牛素(Petunidin)、矢车菊素(Cyanidin)、矢车菊素葡萄糖苷(Cyanidin-3-glu)、天竺葵素(Pelargonidin)、锦葵色素(Malvidin)、飞燕草素(Delphinidin)、飞燕草素葡萄糖苷(Myrtillin)、芍药素(Peonidin)标准品,美国ChromaDex公司;质谱级乙腈和甲醇,美国Fisher公司;质谱级甲酸,上海阿拉丁试剂公司;超纯水,英国ELGA超纯水机自制。

图2 正交试验中花青苷含量变化趋势图
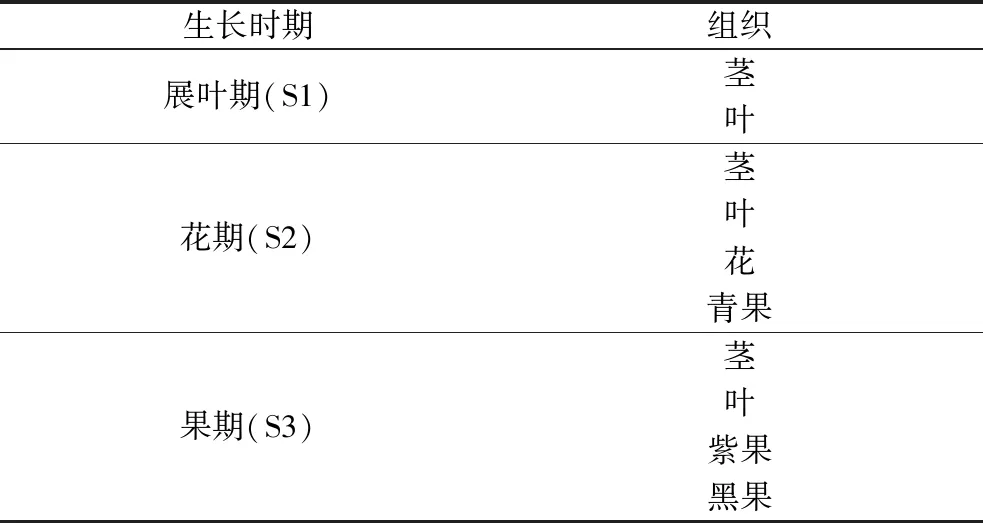
表1 野生黑果枸杞样品信息
1.2 仪器与设备
Agilent 6545超高效液相飞行时间高分辨质谱联用仪、数据处理系统MassHunter工作站、Agilent 1290 Infinity Ⅱ超高效液相色谱仪,美国Agilent公司;AB Sciex QTRAP 5500超高效液相色谱三重四级杆线性离子阱质谱仪、Exion LC AD超高效液相色谱仪,美国AB Sciex公司;ME204E电子分析天平,德国Sartorius公司;KQ-118B超声振荡仪,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 对照品配制
精确称取适量标准品,用甲醇溶解并定容于5 mL容量瓶中,然后用体积分数55%的甲醇水(含体积分数0.5% HCl溶液)稀释至不同质量浓度梯度的标准溶液(1 000、800、600、400、300、200、100、50 ng/mL)。
1.3.2 花青苷提取方法优化
参照杭园园等[22]的方法,准确称取黑果粉末1 g,加入适量不同浓度甲醇溶液,超声提取,并以PRG的提取率为指标进行正交试验(表2),并确定最佳提取方法,用该方法处理黑果枸杞组织,进行后续分析。

表2 正交试验因素水平表
1.3.3 UPLC-ESI-QTOF/MS鉴定黑果枸杞组织花青苷组分
色谱条件:Phenomenex C18色谱柱(100 mm×2.1 mm,3 μm),柱温30 ℃,以体积分数0.1%甲酸水溶液(A)和乙腈(B)为流动相,梯度洗脱:0~2 min,5% B;2~25 min,5%~25% B;25~30 min,25%~50% B;30~35 min,50%~75% B;35~40 min,75%~95% B;40~43 min,95%~5% B。流速0.30 mL/min,进样量2 μL。
质谱条件:离子源为Dual AJS ESI离子源,正离子电离模式;干燥气(N2)温度350 ℃,流量8 mL/min;鞘气温度250 ℃,流量11 mL/min;雾化气压力45 psi;毛细管电压4 000 V;扫描范围:50~1 700m/z;碰撞能量:10.00、20.00、40.00 eV;参比离子:121.050 8与922.009 7;扫描模式:自动MS/MS模式。
利用MassHunter定性分析软件进行数据分析,花青苷定性通过离子碎片、花青素标准品和Metlin数据库比对及查阅文献实现。
1.3.4 UPLC-Q-Trap-MS测定黑果枸杞组织花青苷含量
色谱条件:Agilent ZORBAX Eclipse Plus C18(RRHD,1.8 μm)色谱柱,柱温30 ℃;以体积分数0.1%甲酸水溶液(A)和乙腈(B)为流动相,梯度洗脱:0~2 min,5%~11% B;2~8 min,11%~35% B;8~15 min,35%~95% B;15~18 min,95%~95% B;18~23 min,95%~5% B。流速0.4 mL/min,进样量1 μL。
质谱条件:离子源为ESI源,正离子电离模式;离子源气帘气20 psi;碰撞气Medium;喷雾电压5 500 V;温度450 ℃;离子源气体Gas1:45 psi;离子源气体Gas2:55 psi;扫描类型MRM模式。
1.3.5 方法学验证
采用1.3.1节中已制备的不同浓度梯度的对照品溶液和1.3.4节色谱-质谱条件,进样分析,记录9种花青素的峰面积,并以质量浓度为横坐标,以峰面积为纵坐标,拟合9种花青素的线性方程;随后按1.3.2节已优化方法制备茎、叶、花和果4个组织混合样品6份用于验证仪器精密度和重复性。
2 结果与分析
2.1 花青苷提取方法优化
采用超声时间、液固比和甲醇浓度3个因素考察花青苷的提取方法。超声时间大于20 min时提取液中花青苷含量趋于平衡,但随着甲醇浓度和液固比的增加,提取液中花青苷含量下降。因此,影响黑果枸杞花青苷浓度值的主次因素为:液固比>甲醇浓度>超声时间。确定花青苷最佳提取方法为:超声时间20 min,甲醇浓度65%,液固比10∶1(mL∶g)。
2.2 黑果枸杞组织中花青苷组分鉴定
利用UPLC-ESI-QTOF/MS测定了黑果枸杞组织在正离子模式下的总离子流图(total ion chromatography, TIC)。通过自动MS/MS方式查找化合物,在查找的所有化合物中根据分子离子产生的碎片离子特征,对比文献和Metlin数据库在黑果枸杞茎、叶、花、青果、紫果和黑果中共鉴定出19种花青苷,有10种矮牵牛素花青苷、5种飞燕草素花青苷、2种锦葵色素花青苷、1种矢车菊素花青苷、1种芍药素花青苷,它们的保留时间、分子离子和碎片离子、定性名称如表3所示。其中90%的花青素以葡糖糖苷、芸香糖苷、咖啡酸和香豆酸酰化形式存在,只有矮牵牛素和飞燕草素能检测到苷元。

表3 黑果枸杞组织中花青苷的组分
根据表3列出的花青苷分子离子,在黑果枸杞组织总离子流图中提取了花青苷离子色谱图(extracted ion chromatograms,EIC)。通过比较S1、S2、S3生长时期茎、叶的提取离子色谱图发现,不同生长时期茎、叶中的花青苷组分没有发生变化。S2时期茎、叶的离子色谱图如图3-a和3-b所示,茎和叶分别有6种花青苷,其中的差异花青苷是petunidin-3-O-glucoside(maloyl)-5-O-glucoside(757.219 2)和矮牵牛素葡萄糖苷(479.120 0)。花(图3-c)中检测到10种花青苷组分,果中的花青苷组分随果的成熟从青果(图3-d)中的8种增加到黑果(图3-f)的13种。茎、叶、花、青果、紫果和黑果中主要花青苷有5种,茎、叶、花、青果中主要是飞燕草素-3-O-对香豆酸-葡萄糖苷(delphinidin-3-O-(p-coumaroyl)-glucoside)(611.162 5)、petunidin-3-O-glucoside(maloyl)-5-O-glucoside(757.219 2)、cyanidin-3-O-rutinoside(595.167 6)和petunidin-3-O-(p-coumaroyl)-glucoside(625.178 2),紫果中PRG(933.266 5)开始合成,黑果中PRG(933.266 5)占主导。

a、b、c-S2生长时期茎、叶、花的色谱图;d、e、f-青果(S2)、紫果(S3)、黑果(S3)的色谱图
不同生长时期黑果枸杞组织中花青苷的组分存在组织特异性。茎、叶、花、果在各个生长期内共有的花青苷是飞燕草素-3-O-对香豆酸-葡萄糖苷(611.162 5)、cyanidin3-O-rutinoside(595.167 6)和petunidin-3-O-(p-coumaroyl)-glucoside(625.178 2)。peonidin-3-glucoside(463.123 5)和malvidin-3-glucoside(493.134 2)仅在花中特有。delphinidin-3-O-rutinoside-5-O-glucoside(773.215 6)、petunidin-3-O-rutinoside(glucosyl-trans-p-coumaroyl)-5-O-glucosid(1 095.319 8)、petundin-3-O-glucoside-5-O-glucoside(641.172 4)、petunidin-3-O-rutinoside(feruloyl)-5-O-glucoside(963.276 4)、malvidin-3-O-rutinoside(p-coumaroyl)-5-O-glucoside(947.281 2)、petunidin-3-caffeoylrutinoside-5-glucoside(949.261 3)仅在黑果中特有。这种组织特异性可能与花青苷合成路径中结构基因和转录因子的表达调控有关,对结构基因和转录因子表达分析有待进一步研究。对茎、叶、花和青果中的主要花青苷飞燕草素-3-O-对香豆酸-葡萄糖苷(611.162 5)与黑果中的主要花青苷PRG(933.266 5)的结构对比,后者是delphinidin B环上的3′位羟基进一步被MT甲基化变成了甲氧基,同时,UFGT将一分子芸香糖连接在C环3号位上,生成更大分子质量的花青苷[8]。
S2时期叶和青果中有6种花青苷相同,只有矮牵牛素(317.065 3)和PRG(933.266 5)不同。因此,叶和青果之间的花青苷可能存在转移的过程。青果和紫果很明显的差异是紫果中未检测到delphinidin(303.049 7)和矮牵牛素(317.065 3),而紫果中生成了PRG(933.266 5),它是花青苷组分随着果的成熟进一步糖基化、甲基化和酰化的产物。糖基化、甲基化和酰化能够提高花青苷的稳定性。另外,花青苷飞燕草素-3-O-对香豆酸-葡萄糖苷(611.162 5)的抗氧化能力强于PRG(933.266 5)[25],作为茎、叶、青果和紫果中主要的花青苷可能是植物生长发育过程中需要抵御外界的非生物胁迫,而在果成熟时生成了更稳定但抗氧化能力稍弱的花青苷。
2.3 黑果枸杞组织花青苷含量差异分析
通过UPLC-Q-Trap-MS中的MRM,在正离子模式下对9种花青素标准品进行扫描,确定Q1和Q3,并优化了锥孔电压和碰撞能量如表4所示。

表4 九种花青素标准品的质谱参数
表5显示了9种花青素标准品的线性方程及其特征,从相关系数的取值可以看出在整个线性范围50~1 000 ng/mL内方程呈线性关系。重复性的相对标准偏差(relative standard deviation, RSD)值平均为3.88,精密度平均为2.79,表明重复性和精密度良好。

表5 九种花青素标品的线性方程和相关系数
图4-a为不同生长时期组织中5种花青苷的总含量(以峰面积表示),结果显示S1、S2和S3时期茎、叶、花中花青苷的总含量都较高,S2时期叶和花中花青苷的总含量跟黑果中的相当,茎中的花青苷总含量相比于S2时期的叶、花和黑果较低,但比青果和紫果总含量高。叶中的花青苷总含量先增加后减少,茎中的花青苷总含量在不同时期基本保持稳定,但果中的花青苷总含量随着果的成熟显著增加。茎、叶、花、青果、紫果和黑果都含有丰富的花青苷,说明黑果枸杞茎、叶和花也有较高的食用和药用价值。同时,对植物而言,组织中的花青苷起到了抵御强紫外线照射引起的分子氧化作用。
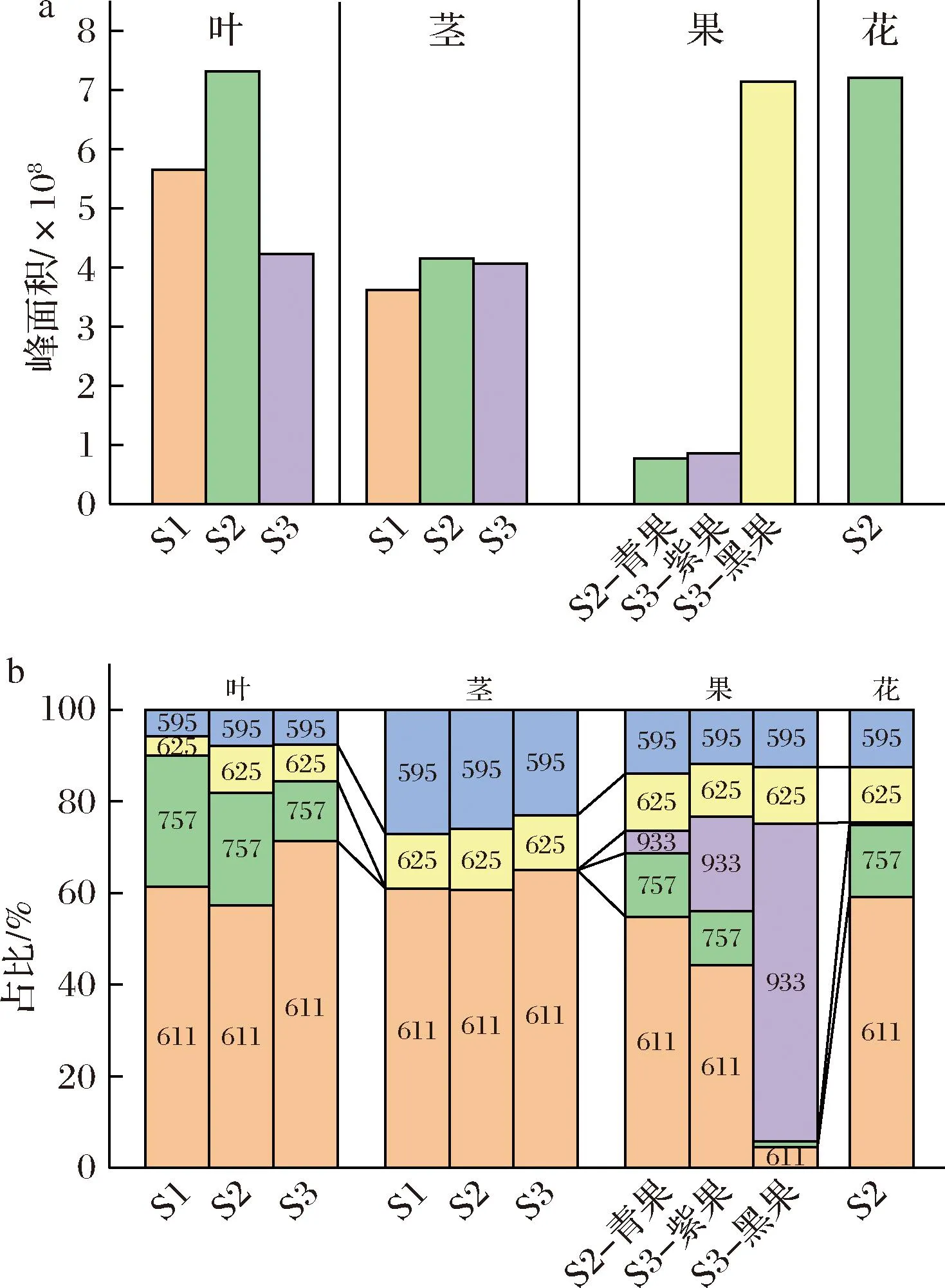
a-花青苷总含量;b-花青苷含量占比
图4-b为不同生长时期黑果枸杞茎、叶、花、青果和紫果中含量较高的5种花青苷的含量占比。茎、叶和花中的主要花青苷是飞燕草素-3-O-对香豆酸-葡萄糖苷(611.162 5),其在不同生长时期的茎、叶和花中的含量占比都接近60%。除了茎之外,其他组织中均含有petunidin-3-O-glucoside(maloyl)-5-O-glucoside(757.219 2),并且它是叶、花和青果中的次要花青苷(含量可达14%~29%)。在茎的3个生长时期,cyanidin-3-O-rutinoside(595.167 6)含量占比最高达到27%,是茎的次要花青苷。虽然青果和紫果之间花青苷的占比差异较小,但它们与黑果相比差异明显,青果和紫果中的主要花青苷是飞燕草素-3-O-对香豆酸-葡萄糖苷(611.162 5),而黑果中主要的花青苷是PRG(933.266 5)。对比青果、紫果和黑果,飞燕草素-3-O-对香豆酸-葡萄糖苷(611.162 5)的含量占比从55%减少到5%,PRG(933.266 5)含量占比从5%增加到69%,这可能是随着果的成熟,花青苷组分的生物合成(甲基化、糖基化和酰化)、再生和从其他组织转移的协同效应,形成了更加稳定的PRG(933.266 5)花青苷,上述2种花青苷可能在植物生长过程发挥着不同的作用[4]。
3 结论
研究野生黑果枸杞展叶期(S1)、花期(S2)、果期(S3)的茎、叶、花、果4种组织中花青苷组分和相对含量的动态变化,发现黑果枸杞组织在不同生长时期内花青苷组分存在组织差异性,含量差异较大。茎、叶、花和果中共检测到19种花青苷,花和黑果中的花青苷组分最为丰富,花中检测到10种花青苷,黑果中检测到13种。在19种花青苷中含量较高的有5种,在茎、叶、青果和紫果中主要是飞燕草素-3-O-对香豆酸-葡萄糖苷(611.162 5)、petunidin-3-O-glucoside(maloyl)-5-O-glucoside(757.219 2)、cyanidin-3-O-rutinoside(595.167 6)、petunidin-3-O-(p-coumaroyl)-glucoside(625.178 2),黑果中主要是PRG(933.266 5)。S1、S2和S3生长时期组织中花青苷的总含量都较高,S2时期的叶和花中花青苷的总含量跟黑果中的相当。叶中的花青苷总含量先增加后减少,茎中的花青苷总含量在不同时期基本保持稳定,但果中的花青苷总含量随着果的成熟显著增加。说明黑果枸杞茎、叶和花也有较高的食用和药用价值。同时,研究黑果枸杞不同生长时期组织中花青苷的组分和相对含量的变化,为黑果枸杞花青苷的合成调控和形成机制研究提供基础数据。
——徐州市青果小作家基地简介