乳腺浸润性癌中EZH2定量表达和M2型巨噬细胞相关性及与临床病理特征的关系
方会娟, 徐小艳, 徐宪伟, 姜 黄
(河南中医药大学 第五临床医学院(郑州人民医院)病理科, 河南 郑州 450000)
0 引言
在过去20年中,我国乳腺癌的发病率和死亡率呈快速上升趋势,虽然手术、放化疗、免疫治疗和联合治疗等手段大大提高了乳腺癌患者的生活质量,但对于总生存率仍无明显改善,乳腺癌依然严重威胁着女性群体的健康,侵袭和转移是乳腺癌患者病情复发和死亡的主要原因。研究表明,在包括乳腺癌在内的多种恶性肿瘤细胞中存在 EZH2(enhancer of zeste homolog 2)基因的突变及异常表达,与癌症的侵袭、转移及不良预后密切相关[1]。肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)是肿瘤微环境极为重要的成分,在肿瘤微环境中巨噬细胞可以被极化成两种不同的亚型[2]:经典活化的M1型巨噬细胞和替代活化的M2型巨噬细胞,TAMs主要为M2型巨噬细胞,乳腺癌的不良预后与TAMs 的浸润密切相关[3]。CD163 是公认的M2型巨噬细胞表面标志物之一。乳腺浸润性癌中EZH2定量表达特点如何,其与CD163 是否存在相关性,这些都尚未见文献报道。为了解乳腺浸润性癌中EZH2和CD163与多个临床病理因素的关系及二者之间的相关性,本研究采用免疫组织化学方法检测67例乳腺浸润性癌及相应的癌旁组织中EZH2蛋白的表达情况,采用定量测试方法,测试EZH2蛋白的阳性单位(Positive Unit,PU),计数高倍视野CD163的个数,分析EZH2蛋白定量表达和CD163数目与乳腺浸润性癌的临床病理特征的关系及二者的相关性,旨在观察EZH2和CD163是否参与乳腺浸润性癌的侵袭和转移过程,以拓展和丰富人们对乳腺癌发生和发展机制的认识。
1 材料与方法
1.1 病例资料
收集河南中医药大学人民医院病理科2015年1月至2017年12月期间的手术切除的活检标本,其中包括乳腺浸润性癌67例和相应的67例癌旁组织。67例乳腺浸润性癌标准如下:①患者均为女性;②术前均未接受放化疗或中医治疗;③经过乳腺保乳或者乳腺根治性切除术。收集患者相关临床资料,按照2019年WHO乳腺癌组织病理分级分类法,即核分裂象、腺管形成和细胞异型性对其进行分级。所有标本均经10%的中性福尔马林固定,石蜡包埋,并经河南中医药大学人民医院病理科诊断确诊。
1.2 主要试剂
EZH2一抗兔抗人单克隆抗体公司购自福州迈新公司、CD163一抗兔抗人单克隆抗体、二抗及二氨基联苯胺(DAB)均为河南赛诺特生物技术有限公司。
1.3 免疫组织化学染色
(1)3~4 μm石蜡切片、烤片、脱蜡及水化;
(2)抗原修复,EZH2采用EDTA修复,CD163采用柠檬酸修复;
(3)一抗37℃孵育1.5~2 h;
(4)二抗室温孵育20~30 min;
(5)DAB显色3~5 min;
(6)脱水、透明及中性树胶封片。
EZH2阳性对照采用已知EZH2阳性的乳腺癌组织和PBS代替一抗分别作为阳性和空白对照,CD163阳性对照采用扁桃体和和PBS代替一抗分别作为阳性和空白对照。
1.4 EZH2免疫组化定量测试
根据空白对照、乳腺癌组织自身阴性对照、阳性对照的显色情况,在确保无假阴性和假阳性的前提下,以EZH2细胞核染成棕褐色为阳性。用ImagePro Plus图像分析软件,测试其阳性单位值(Positive Unit,PU)[4]。方法如下:在40倍物镜下,从每例切片中取10个着色最强的视野输入计算机,使其转换成灰色照片,将照片导入ImagePro Plus图像分析软件。测试每个阳性细胞的灰度Gα,同时在相应的10个视野中测试背景灰度Gβ并取其平均值。本研究中测试软件设定的Gmax为256,按下列公式计算每个阳性细胞的阳性单位(Positive Unit)PU值[4]。
1.5 CD163计数判读
在低倍镜下选取视野中巨噬细胞最密集的5个区域,在高倍镜下(400 ×)计数,取5个视野总和的平均值进行统计。
1.6 统计学方法
用SPSS 22.0软件进行统计学分析。两个独立样本均数间比较采用t检验。多样本均数之间采用方差分析进行比较。若方差齐,组间多重比较采用LSD检验,若方差不齐,组间多重比较采用Dunnett’S T3检验。相关分析采用Spearman分析法。P<0.05表示差异具有统计学意义。
2 结果
2.1 EZH2和CD163蛋白在乳腺癌旁组织和浸润性癌中表达情况
EZH2阳性表达部位定位于乳腺癌细胞核,在乳腺间质的纤维细胞中未见表达,在乳腺癌癌旁组织中有少量弱表达。EZH2蛋白PU值在乳腺癌组织(14.81±5.62)中显著高于其在癌旁组织(3.88±1.33)中的表达,差异具有统计学意义(P=0.000)。如图1和表1所示。
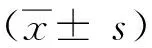
表1 EZH2和CD163蛋白在乳腺癌旁组织和浸润性癌中表达情况
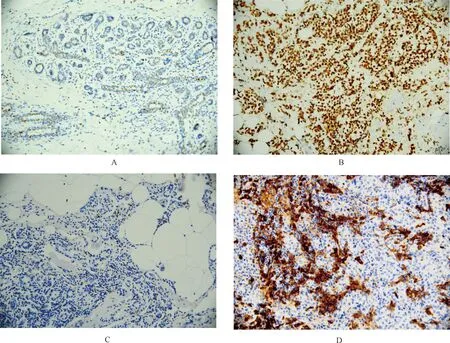
图1 EZH2和CD163蛋白在乳腺癌旁组织和浸润性癌中的表达A:EZH2在癌旁组织中的表达;B:EZH2在乳腺癌组织中的表达;C:CD163在癌旁组织中的表达;D:CD163在乳腺癌组织中的表达。免疫组织化学法(200倍,视野直径约1.1 mm)
CD163阳性表达部位主要定位于乳腺癌癌巢周围组织间隙的组织细胞内,染色呈棕黄色颗粒,呈小巢状分布,也有散在分布于乳腺癌癌巢组织内。CD163计数在乳腺癌组织(148.10±55.62)中显著高于其在癌旁组织(7.34±3.57),差异具有统计学意义(P=0.000)(如图1、图2和表1所示)。

图2 组织细胞在乳腺癌中的分布A:大部分组织细胞位于癌巢周围呈片状分布(200倍镜,视野直径约1.1 mm);B:少量组织细胞散在分布于癌巢内(400倍镜,视野直径约0.55 mm)
2.2 EZH2和CD163与乳腺浸润性癌临床病理特征的关系
乳腺浸润性癌中,EZH2与肿瘤直径大小相关,其蛋白PU值在肿瘤直径≤2 cm、2~5 cm和>5 cm中表达依次升高,分别为12.11±4.18、18.24±4.80、19.14±5.41,差异总体有统计学意义(P=0.000),但其在2~5 cm和>5 cm组中,差异不具有统计学意义(P>0.05);EZH2与乳腺癌WHO分级有关,其在WHOI级、II级、III级中的PU值表达依次升高,分别为11.16±6.66、13.59±4.28、18.75±5.47,差异具有统计学意义(P=0.000);EZH2在淋巴结有转移组别(19.35±4.52)中高于无淋巴结转移组别(10.66±2.38),差异有统计学意义(P=0.000);EZH2在TNMⅢ-Ⅳ期(16.68±5.92)表达高于Ⅰ-Ⅱ期(11.86±3.57),差异有统计学意义(P=0.000);EZH2在ER阳性组中(11.68±3.83)低于ER阴性组(16.34±5.76),差异有统计学意义(P=0.000);EZH2在PR阳性组中(12.51±4.57)低于ER阴性组(16.09±5.79),差异有统计学意义(P=0.000);EZH2与患者的年龄、肿瘤的部位和Her-2是否扩增均无关(P>0.05)。见表2。
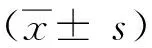
表2 EZH2和CD163 与乳腺癌临床病理特征的关系
CD163计数与肿瘤直径大小相关,其数目在肿瘤直径≤2 cm、2~5 cm和>5 cm中表达依次增多,分别为121.38±41.54、181.80±47.31、191.18±53.20,差异总体有统计学意义(P=0.000),但其在2~5 cm和>5 cm组中,差异不具有统计学意义(P>0.05);CD163计数与乳腺癌WHO分级有关,其在WHO I级、II级、III级中的计数依次升高,分别为110.56±67.04、136.66±42.30、186.75±53.57,差异具有统计学意义(P=0.000);CD163计数在淋巴结有转移组别(192.78±45.13)中高于无淋巴结转移组别(107.26±23.50),差异有统计学意义P=0.000);CD163计数在TNMⅢ-Ⅳ期(166.15±59.10)高于Ⅰ-Ⅱ期(117.50±36.86),差异有统计学意义(P=0.000);CD163计数在ER阳性组中(125.50±44.63)低于ER阴性组(163.07±57.40),差异有统计学意义(P=0.000);CD163计数在PR阳性组中(125.50±44.63)低于ER阴性组(160.72±57.58),差异有统计学意义(P=0.000);CD163计数与患者的年龄、肿瘤的部位和Her-2是否扩增均无关(P>0.05)。见表2。
2.3 乳腺浸润性癌中EZH2和CD163表达的相关性
Spearman相关性分析显示:67例乳腺浸润性导管癌中,EZH2和CD163蛋白表达呈显著正相关(RS=0.990,P=0.000),即EZH2蛋白表达量越高,CD163数目相应的越多。
3 讨论
EZH2在多种恶性肿瘤细胞中表达异常,这些异常导致了抑癌基因的沉默,与肿瘤的侵袭转移及不良预后有密切关系。已有的研究表明,其在胶质瘤、前列腺癌和卵巢癌等肿瘤中的表达与肿瘤的发生和发展密切相关[5-7],其高表达提示肿瘤的不良预后。赵昕辉等[8]利用整合生物信息学手段分析结果表明,EZH2在乳腺癌组织中的mRNA及蛋白表达量显著高于正常乳腺组织,EZH2的表达水平与年龄、分期及分子分型密切相关,乳腺癌患者EZH2表达水平高的总生存期、无病生存期、无远处转移生存期及后进展生存期均明显低于EZH2低表达患者。Zhang L等[9]研究表明,EZH2通过整合素β1-FAK激活参与TGFβ信号传导促进乳腺癌症骨转移。本研究采用免疫组织化学方法结合图像定量测试分析表明EZH2蛋白在乳腺浸润性癌中阳性强度高于癌旁组织,其在乳腺浸润性癌的WHO Ⅲ级、淋巴结有转移及TNM分期Ⅲ-Ⅳ表达量较高,EZH2蛋白定量表达与激素受体相关,在ER、PR阴性这表达较高,提示该蛋白在乳腺癌侵袭和进展的过程中发挥了重要的作用。EZH2蛋白定量研究结果与以往文献定性结果基本相似。本研究结果还发现,EZH2蛋白定量表达与乳腺癌的肿瘤直径有关,其在肿瘤直径≤2 cm、2~5 cm和>5 cm中表达依次升高,差异总体具有统计学意义,但是其在2~5 cm和>5 cm中表达基本相似,分析原因可能跟样本含量有关。本研究结果显示,EZH2蛋白定量表达与患者年龄无关,与以往文献报道[8]不同。其原因为:①免疫组化判读方法不一致,本研究采用了定量判读的方法;②年龄分组的界限不一致;③样本量不一致。本研究结果提示,EZH2的表达可能与乳腺癌的进展和不良预后相关。
M2型巨噬细胞参与Th2型免疫反应,抑制抗肿瘤免疫,对肿瘤细胞杀伤活性降低。研究表明,M2型巨噬细胞在多种肿瘤中可促进肿瘤的浸润和转移,在头颈部鳞癌中研究发现M2型巨噬细胞高表达组织与肿瘤多灶性、浸润深度及发病次数呈显著正相关[10]。Tu D等[11]研究表明,M2巨噬细胞孵育的乳腺癌细胞中miR-1587过表达,促进了癌细胞增殖和迁移。宫颈癌中CD163阳性的M2型巨噬细胞浸润与治疗反应和疾病无进展生存期有关[12]。此外,M2型巨噬细胞可促进肿瘤血管的形成,与肿瘤浸润和转移相关。Zhao X等[13]采用Meta分析发现,在4541例乳腺癌患者中,M2型巨噬细胞高密度者浸润性乳腺癌患者生存率较低。本研究中通过分析M2巨噬细胞与临床病理特征的关系,发现CD163阳性数目在乳腺癌组织中的表达显著高于癌旁组织,其表达与肿瘤直径、WHO分级、TNM分期、PR阴性及淋巴结转移有关,这提示乳腺癌组织中M2巨噬细胞浸润的数量越多,乳腺癌患者肿瘤直径较大、WHO分级较高、TNM分期较晚,肿瘤越容易发生侵袭和转移,免疫组化检测乳腺癌组织中M2巨噬细胞的数量能够反映乳腺癌的发生和发展。
本研究中,Spearman相关性分析结果表明,浸润性乳腺癌组织中EZH2蛋白定量与 CD163阳性巨噬细胞个数呈显著正相关,推测乳腺癌中EZH2表达与肿瘤微环境中CD163阳性的巨噬细胞可能存在协同作用,促进乳腺癌的发生、发展和不良预后。
4 结论
综上所述,EZH2和CD163在乳腺癌中高表达,与乳腺癌的侵袭转移有关,二者表达呈正相关,乳腺癌中EZH2表达与肿瘤微环境中CD163 阳性的巨噬细胞可能存在协同作用促进乳腺癌的发生、发展,对乳腺癌中EZH2和CD163表达规律及相关性研究,能够为乳腺癌靶向治疗提供一定理论依据,其具体机制有待于后续开展更深入的研究。

