Omega-3多不饱和脂肪酸对运动性骨骼肌损伤修复的促进作用及相关机制研究进展
杨思梦,贺 庆,石丽君,吴 迎,*
(1.北京体育大学运动人体科学学院,北京 100084;2.艾兰得健康控股有限公司,上海 200120)
运动性骨骼肌损伤(exercise-induced muscle damage,EIMD)是由机体从事不习惯、长时间或高强度运动所引起[1],主要表现为肌原纤维的破坏、继发性炎症反应和氧化应激。EIMD对个体的影响因运动类型(耐力、抗阻和高强度间歇)、强度和持续时间而异,常伴有肌肉功能的暂时降低、延迟性肌肉酸痛(delayed onset of muscle soreness,DOMS)、运动范围(range of motion,ROM)减少和恢复受阻[2-3]。因EIMD已被证明会阻碍运动员训练和竞技赛事的运动表现[4],对于专业和业余运动员来说,从剧烈运动中恢复到最佳状态至关重要。由于目前没有有效的治疗方法改善与EIMD相关的体征和症状,营养补充策略逐渐引起国内外学者的关注[3]。运动后96 h急性恢复期被认为是优化运动表现的关键[5],而营养策略可促进EIMD恢复进程,更是优化运动表现的重要手段。
长链Omega-3(ω-3)多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是参与机体许多生理过程的营养素[6],在人体新陈代谢中起关键作用[7];此外,ω-3 PUFAs是细胞膜的重要结构成分,在维持膜功能包括稳定性、流动性、渗透性和信号转导等方面起主要作用[8]。在流行病学中,ω-3 PUFAs已被证实具有降低帕金森病、阿尔茨海默病[9]、早产相关风险[10],改善认知[11],抗抑郁等作用[12]。由于其抗炎、抗氧化和促肌肉合成的特性[13],常被作为运动营养补剂,在促进EIMD的恢复方面受到广泛关注[14]。研究发现,补充ω-3 PUFAs,特别是二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)有利于加速EIMD的恢复进程[15-19]。了解ω-3 PUFAs在促EIMD恢复方面的作用机制,包括骨骼肌细胞膜外肌卫星细胞的肌源性修复机制、骨骼肌细胞质膜的修复机制以及与细胞器密切相关的抗炎、抗氧化修复机制有利于开发新的补充策略,确定最优的与运动项目相结合的促EIMD恢复补充方案。
1 Omega-3多不饱和脂肪酸与EIMD修复
ω-3 PUFAs是一种长链多不饱和酸,包括α-亚麻酸(α-linolenic acid,ALA)、硬脂酸、EPA、二十二碳五烯酸(docosapentaenoic acid,DPA)和DHA。人体不能合成ω-3系列脂肪酸,必须从食物中摄取获得。EPA和DHA可由ALA转换,但人体内由ALA转化为EPA的比例仅为8%~12%,转化为DHA的比例更是低于1%[20],故膳食补充EPA和DHA十分重要。海洋生物是ω-3 PUFAs(EPA和DHA)补充剂的主要来源,主要包括以乙酯或酰基甘油为浓缩形式的鱼油,以三酰基甘油和磷脂为浓缩形式的磷虾油,以及新型可再生来源的藻类、真菌和微生物油类[7]。植物种子是ω-3 PUFAs(ALA)补充剂的良好来源,主要包括亚麻籽油、奇亚籽油和油菜籽油,是人体内合成长链PUFAs的前体[21]。
一系列实验研究证实ω-3 PUFAs可促进EIMD的恢复,包括肌肉功能、DOMS、骨骼肌微损伤、氧化应激和炎症反应。最近研究证实,富含ω-3 PUFAs的鱼油可促EIMD恢复:4 周鱼油(EPA 600 mg/d、DHA 260 mg/d)补充可提高无训练经历成年男性血清EPA水平,降低肘部屈肌离心运动后即刻关节ROM的减少、运动后48 h血清肌酸激酶(creatine kinuase,CK)水平[19];4 周鱼油(EPA 2 145 mg/d、DHA 858 mg/d)补充可降低健康成年男性一次性下坡跑运动(60 min,65% O2max(最大摄氧量强度),-10°)后即刻血清白细胞介素(interleukin,IL)-6水平和24 h血清CK、DOMS水平,提高24 h下肢最大自主收缩(maximal voluntary contraction,MVC)峰值功率[16];其他较长鱼油补充周期(包括30、42、49、56 d)均可不同程度改善大强度运动后骨骼肌肌肉功能(包括肌力、ROM、僵硬程度等),缓解骨骼肌微损伤、氧化应激和炎症水平[15,17,22-24]。急性和短期鱼油补充周期也被认为可促进EIMD恢复进程:Jakeman等[25]发现,成年男性进行100 次深蹲跳跃后即刻摄入1 g鱼油/10 kgmb(其中1 g鱼油含有750 mg EPA,50 mg DHA),可提高运动后深蹲跳跃和反向跳跃运动表现;Jouris等[26]发现,7 d鱼油(1 000 mg/d)补充可降低健康男女肘部屈肌离心运动后48 h肌肉酸痛程度;Tinsley等[18]同样发现,7 d鱼油(6 g/d)补充降低了成年女性肘部和下肢抗阻运动后48 h静态和功能性肌肉酸痛;此外,Edward等[27]发现,9 d DHA(3 000 mg/d)补充降低了年轻女性肘部屈肌离心运动后48 h肌肉酸痛和僵硬程度,并抑制了关节ROM的减少。
富含ω-3 PUFAs的磷虾油补剂同样可促EIMD恢复:Skarpańska-Stejnborn等[23]发现,6 周磷虾油(1 g/d)补充可降低赛艇运动员大强度运动后24 h硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)水平;da Boit等[28]发现,6 周磷虾油(2 g/d)补充可提高年轻运动员力竭运动后NK细胞活性,并减少运动3 h后血浆外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中IL-2的产生。这些结果均表明,ω-3 PUFAs补充可以缓解EIMD,促进运动后骨骼肌功能的恢复,改善大强度/抗阻运动引起的氧化应激和炎症反应(表1)。
2 Omega-3多不饱和脂肪酸促EIMD修复机制
2.1 Omega-3多不饱和脂肪酸与肌卫星细胞
当肌肉受伤时,骨骼肌会激活复杂的反应,使受损组织自修复[40]。肌卫星细胞是骨骼肌特异性干细胞,在骨骼肌自修复中起主要作用[41]。肌卫星细胞激活后,进入细胞周期,可在肌生成的过程中分化为成肌细胞,并与受损的肌纤维融合,促进修复。肌卫星细胞的增殖和分化易受到周围环境的影响,其中调节肌生成的转录因子肌源性调节因子(myogenic regulatory factors,MRF)决定了肌卫星细胞是否处于静止、激活、承诺或分化状态。肌卫星细胞的增殖和分化可通过营养物质来调节[42],由于ω-3 PUFAs具有调节基因表达、线粒体生物发生和炎症的能力,被认为可调节骨骼肌肌源性再生[43],促进骨骼肌损伤修复。
研究发现,内源性产生ω-3 PUFAs的ω-3脂肪酸脱氢酶fat-1基因-小鼠在注射心脏毒素(cardiotoxin,CTX)诱导骨骼肌损伤后,与野生型小鼠相比,fat-1小鼠在注射CTX第3天的炎症反应程度和细胞凋亡率降低,肌源性分化的标志物Pax7和成肌分化蛋白(myogenic differentiation,MyoD)的表达增加,这说明内源性ω-3 PUFA具有促进CTX诱导的骨骼肌损伤自修复的能力。EPA、DHA也被证实参与肌卫星细胞肌源性激活[44],静止的肌卫星细胞以Pax7的表达为特征,而以EPA和/或DHA培养C2C12成肌细胞24 h或48 h,可观察到Pax7表达降低和肌细胞生成素(myogenin,MyoG)表达增加[45],这说明EPA+DHA诱导了肌卫星细胞从静止到激活的转变;将C2C12成肌细胞分化3~6 d后,用EPA和/或DHA处理肌管24 h或48 h,观察肌管的终末成熟和融合情况,可观察到在EPA+DHA培养的细胞中,MRF4、MyoG和MyoDmRNA的表达下调。Zhang Jing等[46]同样发现用EPA+DHA处理后,MyoG的成肌细胞增殖和基因/蛋白质表达在48 h和72 h均降低。这些结果均表明EPA和/或DHA可通过调节肌卫星细胞基因表达,促进肌细胞增殖和分化。
ω-3 PUFAs还通过调节线粒体生物发生,促进肌源性分化。线粒体的生物发生受转录因子过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferatoractivated receptor γ coactivator-1α,PGC-1α)的调控[47],该转录因子能够共同激活并增强核呼吸因子1(nuclear respiratory factor 1,NRF1)和线粒体转录因子A(transcription factor A,TFAM)的表达[48],从而刺激线粒体DNA(mitochondrial DNA,mtDNA)转录和复制。骨骼肌损伤后,肌卫星细胞的耗氧率和糖酵解率会增加[49],用50 μmol/L EPA+DHA处理肌管24 h,可观察到PGC-1α、NRF1和TFAMmRNA的表达增加,mtDNA/核DNA增加[50],这提示EPA+DHA可改善肌生成过程线粒体的生物发生。Løvsletten等[51]从健康人的肌肉中分离出肌卫星细胞,并诱导其分化形成多核肌管,用100 μmol/L EPA处理24 h后同样发现,线粒体耗氧率、质子泄漏均增加,这表明EPA在生肌过程中改善了线粒体的功能。然而,EPA+DHA培养成肌细胞3 d,TFAM和PGC1 mRNA的表达降低,mtDNA/核DNA的比率和线粒体耗氧率降低[45],这说明线粒体生物发生减少;同样,用50 μmol/L的EPA处理成肌细胞18 h,线粒体耗氧率、质子泄漏和ATP的产生降低[52]。这表明在成肌细胞分化过程中高水平的EPA+DHA与调节线粒体生物发生的基因表达之间存在负相关,线粒体功能和生物发生受到抑制。ω-3 PUFAs在肌分化中对线粒体生物发生的抑制作用在肌源性分化中所扮演的角色还需要进一步研究探讨。
ω-3 PUFAs可通过抑制炎症途径的激活,从而促进肌源性分化。研究发现,抑制TNF-α可通过抑制p53丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的活性,使骨骼肌分化标志物如MyoD和转录因子MyoG的表达下调[53]。Chen等[54]将C2C12肌管与750 μmol/L棕榈酸、50 μmol/L EPA+DHA共处理16 h,发现EPA+DHA可抑制棕榈酸诱导的TNF-α、IL-6mRNA表达。同样,双酚A和DHA处理C2C12还可通过降低核因子-κB抑制蛋白(inhibitor of NF-κB,IκBα)、核因子-κB(nuclear factor-κB,NF-κB)核蛋白结合活性和NF-κB转录活性,从而抑制棕榈酸诱导的NF-κB激活。
在生理条件下,涉及骨骼肌肌源性修复过程的调节分子之间存在复杂的相互作用,大多数研究报道了ω-3 PUFAs在激活肌卫星细胞、促进损伤修复方面的有益作用,但其补充剂量和周期(急性/短期高剂量和长期低剂量)对骨骼肌肌源性增殖分化的影响还需要进一步研究探索。
2.2 Omega-3多不饱和脂肪酸与骨骼肌质膜
质膜是细胞在细胞质和细胞外界空间之间形成的物理屏障,可通过一系列自修复维持细胞的稳态。大强度运动产生的机械刺激和运动后的氧化应激、炎症反应会破坏骨骼肌质膜完整性、通透性和流动性,使其“自修复”能力下降。骨骼肌质膜的损伤会导致骨骼肌细胞CK渗出,胞外离子、氧化剂进入,甚至会引起细胞死亡,是EIMD主要诱因。
ω-3 PUFAs补充可缓解大强度运动导致的骨骼肌质膜损伤,促进质膜修复(图1)。Mickleborough等[17]发现,26 dω-3 PUFAs(1.2 g/d)补充可降低健康男性下坡跑运动后2、24 h血液中肌红蛋白浓度;Tartibian等[22]发现,30 dω-3 PUFAs(1.8 g/d)补充降低了青年男性一次性大强度离心运动后24、48、72 h血清CK水平。在动物实验中同样发现,8 周ω-3 PUFAs补充减少了大鼠抗阻运动后骨骼肌肌肉水肿和中性粒细胞浸润[55]。EPA和DHA是质膜的重要组成成分,膳食ω-3 PUFAs(EPA和DHA)被认为可以通过掺入骨骼肌质膜维持其完整性[56-57];构成质膜的卵磷脂和鞘磷脂中含有大量不饱和键的烯烃结构,对氧自由基非常敏感,而DHA和EPA的掺入还可通过增加细胞膜内的不饱和键,使其不易被氧化[58],从而维持膜的稳定性。另一方面,研究发现,ω-3 PUFAs(磷虾油)补充可增加小鼠力竭运动后骨骼肌质膜不饱和脂肪酸成分(C22:5、C22:6(DHA)、C24:5),改善骨骼肌质膜流动性,促进力竭运动后骨骼肌质膜的修复[56]。此外,质膜还是信号反应的重要场所(包括细胞信号传导、基因表达和生物活性代谢物合成等),ω-3 PUFAs的掺入能否通过影响膜修复相关蛋白的信号转导,促进运动后骨骼肌质膜修复,还需要进一步研究证实。
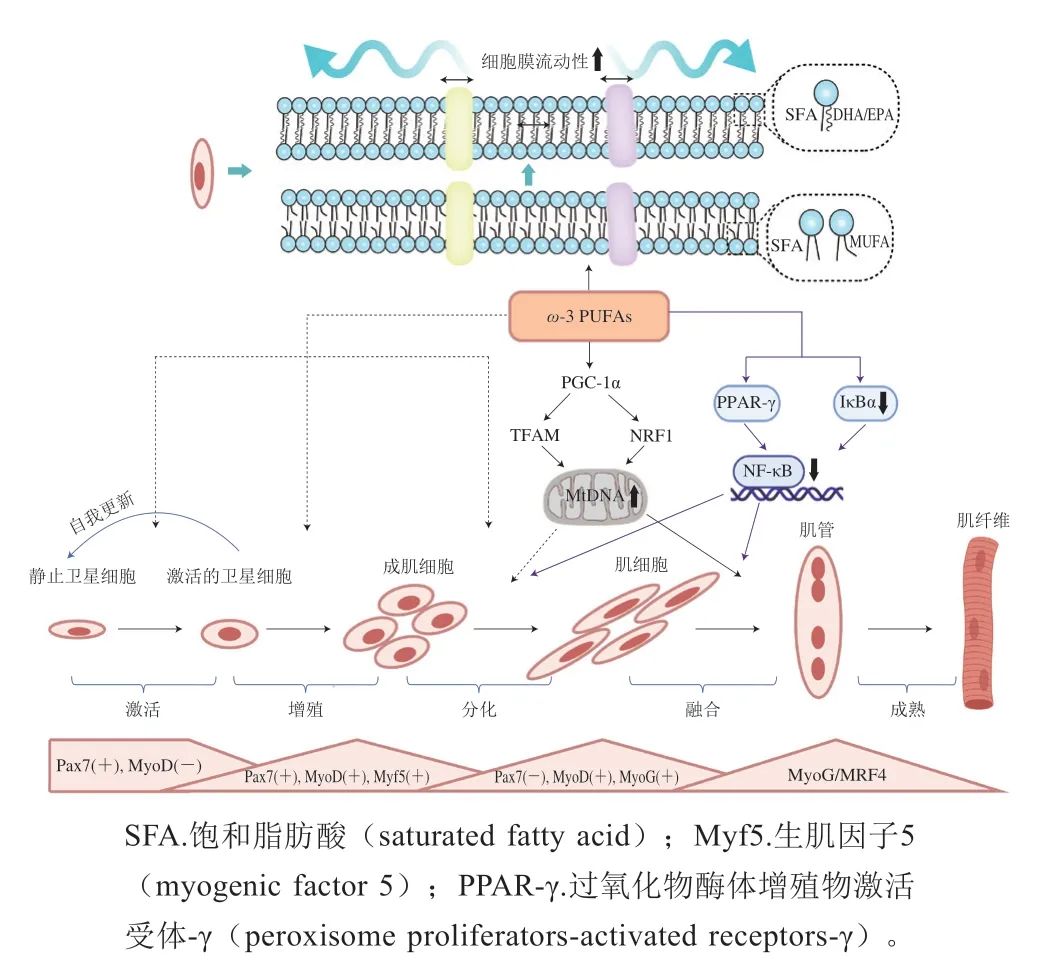
图1 ω-3 PUFAs在肌源性再生和质膜修复中所起的作用Fig. 1 Role of ω-3 PUFAs in myogenic regeneration and plasma membrane repair
值得关注的是,McGlory等[59]的研究表明,ω-3 PUFAs至少需要2 周补充期才能观察到其掺入骨骼肌细胞,需要大于4 周的补充期才能最大限度地增加骨骼肌对ω-3 PUFAs的吸收。但该研究检测的是骨骼肌中ω-3 PUFAs含量,而非骨骼肌细胞膜中ω-3 PUFAs含量。由于ω-3 PUFAs在骨骼肌质膜损伤修复中的重要作用,ω-3 PUFAs是否会先掺入骨骼肌细胞膜,使膜成分发生改变,进而促进骨骼肌质膜损伤恢复,还需要进一步研究证实,这可能是高剂量急性/短期ω-3 PUFAs补充促进骨骼肌损伤恢复的重要原因。此外,研究证实血液水平中高ω-3 PUFAs水平可防止青年男性离心运动后MVC和关节灵活度的下降[60],因此,短期/急性ω-3 PUFAs补充可能并不仅作用于骨骼肌,还具有全身效应。
2.3 Omega-3多不饱和脂肪酸与抗炎能力
EIMD第二阶段是运动后的炎症反应和氧化应激,肌肉功能暂时丧失和肌肉酸痛增加,由于第二阶段会导致机体良好的适应(包括肌肉重塑和骨骼肌性能的改善),也被称为恢复阶段[61]。然而,运动后过量的免疫抑制和氧化应激会导致细胞蛋白质、脂类和DNA的损伤[62],使骨骼肌恢复受阻。运动后机体的抗炎、抗氧化能力适度提高是促EIMD恢复的重要因素[63]。
ω-3 PUFAs可提高机体运动后抗炎能力,促进EIMD恢复(图2)。Gray等[64]发现,6 周鱼油(3 g/d)补充可增加青年男性一次大强度耐力运动后3 h PBMC IL-2和NK细胞活性;da Boit等[28]同样发现,6 周磷虾油(2 g/d)补充提高了健康男女力竭运动后3 h PBMC IL-2和NK细胞活性。PUFAs是免疫细胞膜的基本成分,白细胞膜中主要多不饱和脂肪酸成分是ω-6 PUFAs花生四烯酸(arochidonic acid,AA)[65]。ω-3 PUFAs的补充以时间和剂量依赖性的方式增加细胞膜中EPA和DHA含量[66],其与ω-6 PUFAs竞争并取代膜磷脂中的AA,减少促炎类二十烷酸包括PGE2的产生[67]。NK细胞活性在一次大强度运动后立即增加,由于PGE2的抑制NK细胞活性作用,其在运动后2 h迅速降低至低于基本水平[68-69]。细胞膜中ω-3 PUFAs含量的增加导致PGE2的减少,从而减轻了大强度运动对NK细胞功能的抑制作用;此外,ω-3 PUFAs提高运动后PBMC IL-2水平,可能也是NK细胞活性增加的另一个重要原因:IL-2激活NK细胞达到靶细胞的主要机制(诱导一氧化氮合酶产生),使NK细胞活性增加[70]。
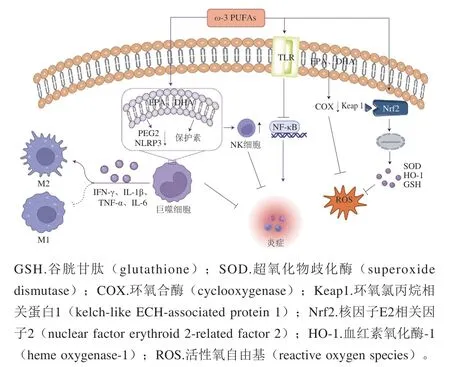
图2 ω-3 PUFAs与抗炎、抗氧化能力Fig. 2 Anti-inflammatory and antioxidant properties of ω-3 PUFAs
ω-3 PUFAs还可调节运动后抗炎和免疫抑制细胞因子网络,使机体Th1/Th2比率降低。巨噬细胞是骨骼肌损伤后24~48 h内主要存在的白细胞[71],也是炎性细胞因子的主要来源。巨噬细胞对组织的进一步浸润会激活一些炎症通路,例如末端激酶、MAPK和NF-κB通路,从M2极化状态(参与Th2免疫反应并抗炎)转换为M1极化状态(参与Th1免疫反应并促炎)[72]。急性大强度运动会使机体免疫功能发生变化,Th1细胞因子产生增多[73],导致Th1/Th2平衡向Th1表型转变[74]。其中Th1细胞主要分泌促炎因子IFN-γ、IL-1β、TNF-α、IL-6等,Th2细胞分泌抗炎因子IL-4、IL-5、IL-10等。Andrade等[34]发现,6 周鱼油(1.8 g/d,其中含有EPA 950 mg、DHA 500 mg)补充可提升优秀游泳运动员高强度训练后血浆EPA、DHA水平,降低血浆AA水平、外周PBMC IFN-γ和TNF-α、PGE2水平;Delfan等[31]同样发现,4 周ω-3 PUFAs(3.6 g/d)补充减少了优秀男性桨手大强度运动后48 h TNF-α、IL-1β、IFN-γ产生,增加了IL-6、IL-10产生。研究发现,PGE2可以抑制Th1细胞因子的产生,并刺激Th2细胞因子的产生[75]。此外,ω-3 PUFAs还可通过抑制TLR的激活,上调EPA/DHA衍生效力较低的替代炎症介质E系列和D系列细胞保护素[76]和抗炎解毒酶的表达[77];减少IκBα的磷酸化抑制NF-κB信号通路,抑制炎症因子的产生[78];调节氧化低密度脂蛋白受体1、纤溶酶原激活物抑制物1、血栓素A2受体、血管细胞黏附分子-1、单核细胞趋化蛋白-1和细胞间黏附分子1的表达,调节炎症反应[79];抑制巨噬细胞中NLRP3炎症小体等[80],多方面共同调节运动后抗炎和免疫抑制细胞因子网络,使机体Th1/Th2比率降低。
2.4 Omega-3多不饱和脂肪酸与抗氧化能力
ω-3 PUFAs可提高机体运动后抗氧化能力,促EIMD恢复(图2)。Gray等[33]对健康男性进行6 周鱼油(3 g/d)补充,随后受试者进行200 次离心膝关节收缩,评估机体运动后不同时间点氧化和抗氧化水平,结果发现,与对照组相比,鱼油组受试者运动后48、72 h TBARS水平、H2O2刺激的DNA损伤较低;Skarpańska-Stejnborn等[81]同样发现,6 周磷虾油(1 g/d)补充减少了皮划艇运动员大强度运动后24 h TBARS水平。Buonocore等[82]对运动员和久坐受试者进行为期8 周ω-3 PUFAs(4 g/d)补充,检测补充前后氧化损伤的标志物——丙二醛(malonic dialdehyde,MDA)、蛋白质羰基、8-羟基-2’-脱氧鸟苷和抗氧化能力标志物GSH、SOD、过氧化氢酶(catalase,CAT)水平,发现运动员在ω-3 PUFAs补充8 周后肌酐水平显著增加,运动员的MDA水平比久坐不动的受试者更显著地下降,这说明ω-3 PUFAs可根据状态(运动员或久坐不动的受试者)具有不同的效果,影响运动导致的氧化应激,使氧化应激标志物MDA水平显著降低。细胞实验也表明,利用EPA处理C2C12细胞24 h,SOD和CAT表达增加[83]。EPA/DHA可充当自由基清除剂[84],降低机体氧化应激水平;另一个机制涉及PGE2的产生减少,PGE2的合成与脂质过氧化之间存在联系,负责产生PGE2的COX也可以产生ROS[85],而ω-3 PUFAs导致AA和COX介导的AA代谢减少使PGE2产生减少,从而使ROS的产生减少;ω-3 PUFAs还可通过上调Keap1/Nrf2减少内质网应激和线粒体ROS的产生,活化的Nrf2还可促进SOD、HO-1和GSH等抗氧化基因的转录[86],从而减少自由基的过量产生。
3 结 语
综上,本文根据ω-3 PUFAs对EIMD的作用特点,由表及里、逐层深入地梳理了ω-3 PUFAs促EIMD修复的可能机制,包括激活肌卫星细胞的肌源性修复,增强骨骼肌细胞质膜修复,提升抗炎、抗氧化作用:1)通过调节基因表达、线粒体生物发生、炎症途径促进骨骼肌肌源性再生和自修复;2)通过改变细胞膜磷脂成分调节骨骼肌细胞物理特性如流动性等,从而促进骨骼肌质膜损伤修复;3)通过影响巨噬细胞极化状态,从而促进EIMD免疫抑制恢复;4)通过表面或细胞内脂肪酸的“受体”或“感受器”直接影响骨骼肌抗氧化能力,从而提高细胞恢复能力。
但目前相关研究仍存在很多问题,还需要进一步研究探讨:1)各研究之间使用的ω-3 PUFAs补充剂的剂量和持续时间存在明显差异,停止补充ω-3 PUFAs后骨骼肌和血液中ω-3 PUFAs浓度恢复到基线水平的持续时间目前尚不清楚;2)ω-3 PUFAs用于减轻炎症、促EIMD恢复及最大限度地将DHA、EPA掺入骨骼肌细胞和骨骼肌细胞膜的最佳剂量仍然未知,因此无法确定最优化的补充方案;3)各研究使用的安慰剂主要包括玉米油、橄榄油、椰子油、豆油、红花油等,这些油可能含有大量ω-6 PUFAs,故作为安慰剂时,这些油可能实际上会改变ω-3 PUFAs与ω-6 PUFAs的比例,目前最合适作为安慰剂的似乎是不含ω-3 PUFAs与ω-6 PUFAs的椰子油,然而,椰子油中短链饱和脂肪酸可能会影响新陈代谢进而影响实验结果[87],因此尚未确定用于所有研究测试最合适的安慰剂;4)相关研究中ω-3 PUFAs补充剂的EPA与DHA比例并不相同,还应考虑到EPA和DHA各自活性特性独立发挥的作用;5)应考虑到不同种类ω-3 PUFAs补充剂各自的优势性,如磷虾油由于虾青素和磷脂成分,在生物利用度和抗氧化方面具有优势;贻贝油则由于含有多酚成分,在抗炎、抗氧化方面具有优势;6)应考虑到不同运动方式的补充剂量、周期和种类,如马拉松、赛艇等长时间耐力运动项目运动后氧化应激和炎症反应较强烈,因此更长的补充周期和更具抗氧化优势的ω-3 PUFAs补剂更适宜;而爆发力项目运动员则需要维持运动后的肌肉功能,短时大剂量ω-3 PUFAs补充更适宜。

